Introducción
La encapsulación es un proceso para atrapar agentes activos dentro de un material portador y es una herramienta útil para mejorar la liberación de moléculas bioactivas y células vivas en alimentos, ya que puede proporcionar barreras entre los materiales bioactivos sensibles y el medio ambiente, así como permitir la diferenciación de sabor y aroma, enmascarar malos sabores u olores, evitar la evaporación y degradación de compuestos volátiles que proporcionan aroma, prevenir reacciones con otros componentes en productos alimentarios como el oxígeno o el agua, estabilizar ingredientes alimentarios en productos finales y durante el procesado o aumentar su biodisponibilidad y para inmovilización de células o enzimas en aplicaciones de procesamiento de alimentos, como procesos de fermentación y metabolitos, industrias farmacéuticas (Gouin, 2004; Nedovic y col., 2011; Peanparkdee y col., 2016).
Los materiales utilizados para el diseño de la capa protectora de encapsulados deben ser de calidad alimentaria, biodegradable y capaz de formar una barrera entre la fase interna y su entorno. Entre todos los materiales, los más utilizados para la encapsulación en aplicaciones alimentarias son las proteínas, lípidos y polisacáridos; dentro de los polisacáridos más utilizados destacan exudados y extractos vegetales, como la pectina, y extractos marinos, como alginatos (Nedovic y col., 2011). Los alginatos son uno de los polímeros más utilizados en la microencapsulación, estos compuestos son extraídos primariamente de tres especies de algas marrones y son una familia de polisacáridos lineales no ramificados, conteniendo cantidades variables de ácido (1,4') β-D-manurónico (M) y de ácido α-L-gulurónico (G). Está compuesto por secuencias de residuos M (bloques M) y G (bloques G) intercalados con secuencias MG (Bloques MG). La composición y extensión de las secuencias y el peso molecular determinan las propiedades físicas de los alginatos (Lupo y col., 2012).
Las perlas de alginato se han usado ampliamente en microencapsulación porque son extremadamente fáciles de preparar a escala de laboratorio, el proceso es muy ligero, puede ser realizado en ambientes estériles y prácticamente cualquier ingrediente puede ser encapsulado, ya sea hidrófobo o hidrófilo, sensible a la temperatura, un delgado líquido, un aceite viscoso, un sólido, etc. (Gouin, 2004). Dada su biocompatiblidad, biodegradabilidad y propiedades de no toxicidad e inmunogénicas lo han hecho ser evaluado como un biomaterial para la regeneración tisular ósea (Venkatesan y col., 2015), atrapamiento celular terapéutico o inmovilización celular, propiedades inmunogénicas del alginato, modificador de la red de polímeros de mucina, modificadores de la mucosidad en fibrosis quística (Draget y Taylor, 2011) y la posibilidad de atrapar diferentes tipos de células a través de ingeniería celular y producir biomoléculas terapéuticas ha dado lugar a numerosas aplicaciones novedosas (Orive y col., 2015).
Un método de encapsulamiento es la gelificación iónica también conocida como gelificación externa o ionotrópica, que se desarrolló inicialmente para la inmovilización de células y el alginato es utilizado principalmente como componente de la membrana y se utiliza la combinación de calcio y bario (iones divalentes) para dar pie a la gelificación. La aplicación más atractiva del alginato es la gelificación inducida por calcio, resultando en interacciones específicas y fuertes entre los iones de calcio y residuos de guluronatos presentes en el alginato. El tamaño de las partículas no puede ser bien controlado y las partículas tienden a coagularse en grandes masas antes de adquirir la consistencia apropiada, obteniendo partículas de tamaño, entre 400 μm y 1 mm (Krasaekoopt y col., 2003; Agulhon y col., 2014; Sandoval y col., 2016), sin embargo, no ha sido utilizada la pectina como agente encapsulante.
Los polisacáridos pécticos o pectinas tienen una estructura química extremadamente diversa, pero comparten algunas características comunes, particularmente la presencia de ácido galacturónico y generalmente son tres tipos de polisacáridos reconocidos como: homogalacturonanos (HG), ramnogalacturonano-I (RG I) y ramnogalacturonano-II (RG II) (Willats y col., 2006). Las pectinas constituyen alrededor del 35 % (p/p) de las paredes celulares primarias de las dicotiledóneas y monocotiledóneas no gramíneas (Willats y col., 2006; Mohnen, 2008) y presentan propiedades espesantes, estabilizantes y gelificantes, además de brindar estabilidad y viscosidad, por su función emulsificante en combinación con aceites comestibles da lugar a la producción de aceites esenciales empleados en la producción de sabores. Los recubrimientos de pectina son utilizados debido a sus propiedades mecánicas de adherencia y flexibilidad en la superficie (García y col., 2004). Este polisacárido está atrayendo una mayor atención por los efectos de salud prometedores que ha mostrado, tales como la disminución de los niveles de colesterol, disminución de la glucemia y actividad anticancerígena (Liu y col., 2016).
Por otro lado, las especies de cítricos son fuente ricas de vitamina C, folato, fibra dietética y minerales además de muchos fitoquímicos, incluyendo flavonoides, aminoácidos, triterpenos, ácidos fenólicos y carotenoides (Li-Ying y col., 2008). Entre los productos de frutas, destaca el jugo de naranja, como una fuente de flavanonas en la dieta, principalmente hesperidina y narirutina. La naranja es uno de los frutos más populares y consumidos en México por sus cualidades refrescantes y su sabor característico ácido o dulce dependiendo de la variedad. México se consolidó como el quinto productor mundial de naranja, con un volumen promedio de 4.2 millones de T, las cuáles se comercializaron tanto en el mercado como en destinos internacionales. Las principales entidades productoras de este cítrico son Veracruz, quien aporta el 44.5 % del volumen nacional; Tamaulipas 14.6 %, y San Luis Potosí 8.8 % de acuerdo a la Secretaría de Agricultura y Desarrollo Rural (SAGARPA, 2015).
La naranja normalmente se consume como fruto fresco, sus subproductos se utilizan en la elaboración de jarabes, jugos, refrescos, postres, helados y pasteles. La oferta que la agroindustria mexicana procesadora de jugos cítricos actualmente es de prácticamente 90 000 T de jugo concentrado de naranja. Considerando únicamente a la agroindustria ubicada en la zona citrícola que circunda al golfo de México (Veracruz, Nuevo León, Tamaulipas, San Luis Potosí y Tabasco) y parte de la Península de Yucatán (Licona, 2009). El jugo concentrado de naranja es el de mayor importancia en el mundo, tanto por el volumen que se produce como por el número de mercados que lo consumen, los principales centros de consumo de jugo de naranja se ubican en Europa y Norteamérica (Licona, 2009). Sin embargo, una de las principales desventajas del jugo de naranja natural, es su vida útil corta por su alto contenido de azúcares, que si no se almacena bajo condiciones adecuadas de temperatura comienza a degradarse y presentarse sabores indeseables.
El objetivo del presente trabajo fue evaluar la estabilidad de las cápsulas del jugo de naranja, utilizando como método de encapsulación la gelificación iónica, y usando pectina y alginato de sodio como agentes encapsulantes bajo dos condiciones de almacenamiento, a temperatura ambiente (26 °C) y refrigeración (4 °C).
Materiales y métodos
Materiales
Las naranjas dulces (Citrus sinensis L. Osbeck) variedad Valencia fueron obtenidas de mercados de Ciudad Victoria, Tamaulipas, las cuales fueron lavadas y desinfectadas, previamente a la extracción del jugo. La pectina de alto metoxilo (PAM) y alginato de sodio (AS) se obtuvieron de un proveedor nacional (Quial comerciales, S.A. Tepic, México).
Métodos
Gelificación iónica
Para la elaboración de las cápsulas utilizando gelificación iónica, se utilizó el jugo de naranja recién extraído y filtrado, a 5 °Brix y a 15 °Brix (este se tomó como referencia a la concentración del jugo natural que se determinó durante su caracterización).
Para la obtención de cápsulas mediante gelificación iónica se utilizó un diseño factorial como se muestra en la Tabla 1, en el cual se disolvieron diferentes concentraciones de pectina de alto metoxilo (1.5 %, 2 % y 2.5 % p/v), se modificó el pH (2.5, 3.5 y 4.5) y se ajustó el jugo a dos concentraciones de sólidos solubles totales (SST) a 5 °Brix y 15 °Brix con ácido cítrico y sacarosa; manteniendo constante la concentración de alginato de sodio al 0.5 % (p/v) el cual fue previamente disuelto en el jugo, por otra parte se elaboró una disolución de lactato de calcio (Quial, México) al 3 % (p/v).
Una vez obtenidas ambas soluciones (alginato de sodio y lactato de calcio), se procedió a verter gotas de la solución de alginato, pectina y jugo, por medio de una piseta, sobre la solución de lactato de calcio. Las cápsulas formadas se enjuagaron con agua destilada, se separaron y almacenaron en recipientes de polipropileno de 10 mL con tapa y estériles, bajo dos condiciones de almacenamiento, temperatura ambiente (26 °C) a una HR 6 % y refrigeración (4 °C) a una HR de 85 %; ambas condiciones (temperatura y humedad relativa) medidas mediante un termohigrómetro análogo A600FC, durante 12 d, realizando la medición de los siguientes parámetros cada 3 d.
Caracterización del zumo de naranja encapsulado con gelificación iónica
Peso
Las cápsulas se colocaron en conjunto con su recipiente en la balanza analítica (VELABTM, VE-210, Velab Co, USA), una vez obtenido este peso se procedió a obtener el peso real de las cápsulas mediante diferencia con el peso inicial. Para ello, se tomaban 5 cápsulas que se pesaban cada 3 d, y de esta manera se determinaba la pérdida de peso.
Atributos de color
El análisis de color de las cápsulas obtenidas se realizó con un colorímetro MiniScan EZ 45/0
LAV (MSEZ1342) (Reston, VA, USA), Hunter Associates Laboratory HunterLab,
determinando los atributos Luminosidad (L*),
Saturación o Cromaticidad (C*), Tono
(H*) utilizando las Ecuaciones (1) y (2), además de la determinación del
cambio de color (
Diámetro
Se determinó el diámetro promedio de las cápsulas utilizando una cinta métrica flexible (Lufkin), midiendo el diámetro de 5 cápsulas de cada tratamiento.
Morfología macroscópica
Se colocaron 5 cápsulas sobre una caja Petri, con fondo blanco y buena iluminación, mediante observación se determinó su morfología de manera visual, además de observar los cambios y alteraciones que sucedieron durante los 12 d de evaluación.
pH
El pH del jugo encapsulado que se obtuvo cada 3 d mediante la ruptura de las cápsulas, se midió con un potenciómetro (Thermo Scientific, Orion Star A1210, Waltham, MA, USA) y un electrodo (Hanna instruments) previamente calibrado con solución reguladora de pH 4, 7 y 10 (JT Baker®, Modelos 5657-01, 5656-01, 5655-01, Edo. de México, México).
Densidad
Se utilizó un método indirecto considerando que las cápsulas son de formas irregulares entre sí, se tomó una muestra de 5 esferas y se pesaron en una balanza analítica (VELABTM, VE-210, Velab Co, USA) para obtener su masa. El volumen final se obtuvo al sumergir en una probeta con 1 mL de agua destilada (volumen inicial), la cual fue medida con una pipeta serológica, la densidad de las cápsulas se calculó dividiendo la masa entre la diferencia del volumen final y el volumen inicial.
Análisis estadístico
Se utilizó el programa de Excel (Microsoft Office 2010) para la determinación de las medidas de tendencia central y realización de gráficas, y el software Statistica 7.0 (StatSoft Inc., Tulsa, OK, USA) para establecer diferencias entre tratamientos, empleando el método de pruebas de rangos múltiples de Diferencias Mínimas Significativas (LSD, por sus siglas en inglés: Least Significant Difference) y las diferencias fueron consideradas significativas cuando P ≤ 0.05.
Resultados y discusión
Parámetros fisicoquímicos del zumo de naranja en capsulado con gelificación iónica
En la Figura 1, se muestran los resultados de las pérdidas de peso de las cápsulas obtenidas mediante gelificación iónica a 5 ºBrix y 15 ºBrix durante los 12 d de almacenamiento a temperatura ambiente (26 ºC) y refrigeración (4 ºC), en la cual se aprecia que la pérdida de peso fue mayor en las cápsulas a 15 ºBrix, independientemente de las condiciones de almacenamiento. No se muestran los resultados a 15 ºBrix, a pH de 2.5, porque bajo ninguna concentración de pectina evaluada a este pH, y esta concentración de SST, se formaron cápsulas estables.

En las cápsulas obtenidas con jugos con diferentes concentraciones de SST, la pérdida de peso más notable fue al día 12, observándose la mayor pérdida de peso (34 %) en las cápsulas de 15 ºBrix, 1.5 % pectina y pH 4.5 tanto a 26 ºC como 4 ºC. También se presentó el mismo porcentaje de pérdida de peso en las cápsulas de 15 ºBrix 2.5 % de pectina, a 26 ºC. Este comportamiento podría deberse a que quizá la pared del agente encapsulante sea tan delgada que provoque la salida del jugo encapsulado por sinéresis. El agua liberada es evaporada de la superficie de la cápsula por las corrientes de aire generadas en el interior del refrigerador, con la consecuente pérdida de peso. Cabe mencionar que hay interacciones en los hidrocoloides utilizados y el agua, lo que influye en la evaporación o pérdida de la misma en las cápsulas, que está determinada por parámetros moleculares de las macromoléculas, propiedades del material a encapsular y morfología de las partículas, además de condiciones externas, como temperatura, humedad y pH, tal como lo menciona Einhorn-Stoll (2018).
En las cápsulas almacenadas a 4 ºC, a concentración de 2.0 % y 2.5 % (p/v) no se observaron diferencias significativas (P ≤ 0.05) en la pérdida de peso (21 % a 25 %), independientemente del pH evaluado.
Las cápsulas con concentración de 5 ºBrix, presentaron una disminución porcentual de peso menos notoria, oscilando de 5 % a 12 %, a 26 ºC, independientemente de la concentración de pectina y pH evaluados. La mayor pérdida (12 %) se obtuvo a pH 3.5. Las pérdidas fueron más evidentes a 4 ºC, oscilando de 7 % a 14 % en las diferentes concentraciones de pectina.
El factor que más influyó en la pérdida de peso fue la concentración de SST, puesto que las cápsulas en condición de almacenamiento a temperatura ambiente y refrigeración con 15 ºBrix presentaron un porcentaje de pérdida de peso mayor. Es de resaltar, que la mayor pérdida de peso con esta concentración de SST ocurrió entre el día 0 al 3, para ambas condiciones de almacenamiento. Debido a que una cápsula está conformada por una membrana semipermeable, de forma esférica, paredes delgadas y fuertes, estas se encargan de proteger el centro sólido/líquido, el agua del interior en combinación con los sólidos disueltos en ella. Esa permeabilidad pudo haber influido en la modificación de este parámetro durante el almacenamiento, ya que el proceso de encapsulamiento coadyuva a que los compuestos bioactivos presentes en el producto alimenticio encapsulado resistan ciertas condiciones durante el procesamiento y empacado, y proteja de degradación o transformación física, química o enzimática, con la consecuente pérdida de bioactividad (Dias y col., 2015).
El tamaño de las cápsulas de jugo de naranja, almacenadas a temperatura ambiente (26 ºC) y refrigeración (4 ºC) a 5 ºBrix se muestra en la Figura 2. El diámetro osciló de 0.42 mm a 0.66 mm a 26 ºC, a las diferentes concentraciones de pectina, siendo los tamaños mayores los obtenidos con pH de 4.5, mientras que a los otros pH (2.5 y 3.5) no se observaron diferencias significativas en el día 1; y a 4 ºC, los tamaños de las cápsulas oscilaron de 0.41 mm a 0.58 mm, con las diferentes concentraciones de pectina. Este atributo no varió en las muestras con 1.5 % de pectina. Las cápsulas obtenidas a 2.0 % y 2.5 % de pectina presentaron los tamaños menores.
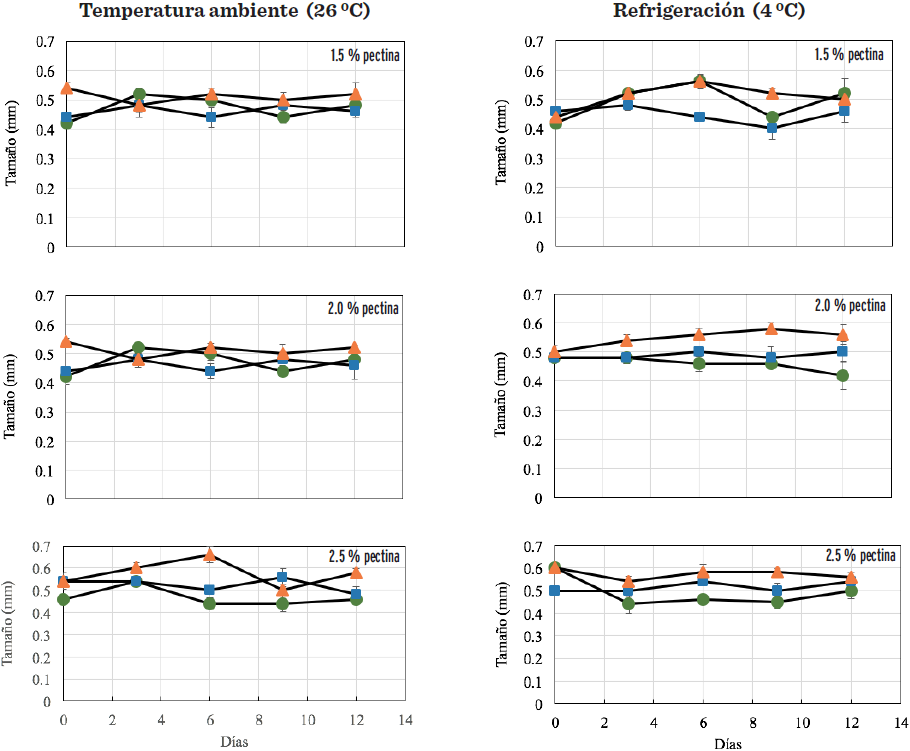
Las cápsulas obtenidas a 15 ºBrix (Figura 3) variaron de 0.40 mm a 0.61 mm, almacenadas a 26 ºC. El tamaño de la cápsula almacenada a 4 ºC osciló de 0.46 mm a 0.68 mm en las diferentes concentraciones de pectina y pH evaluados, observándose los tamaños mayores a 2.5 % (p/v) de pectina y pH 4.5, mientras que a concentraciones de 1.5 % y 2.0 % (p/v) de pectina, las cápsulas de mayor tamaño fueron con un pH de 3.5.
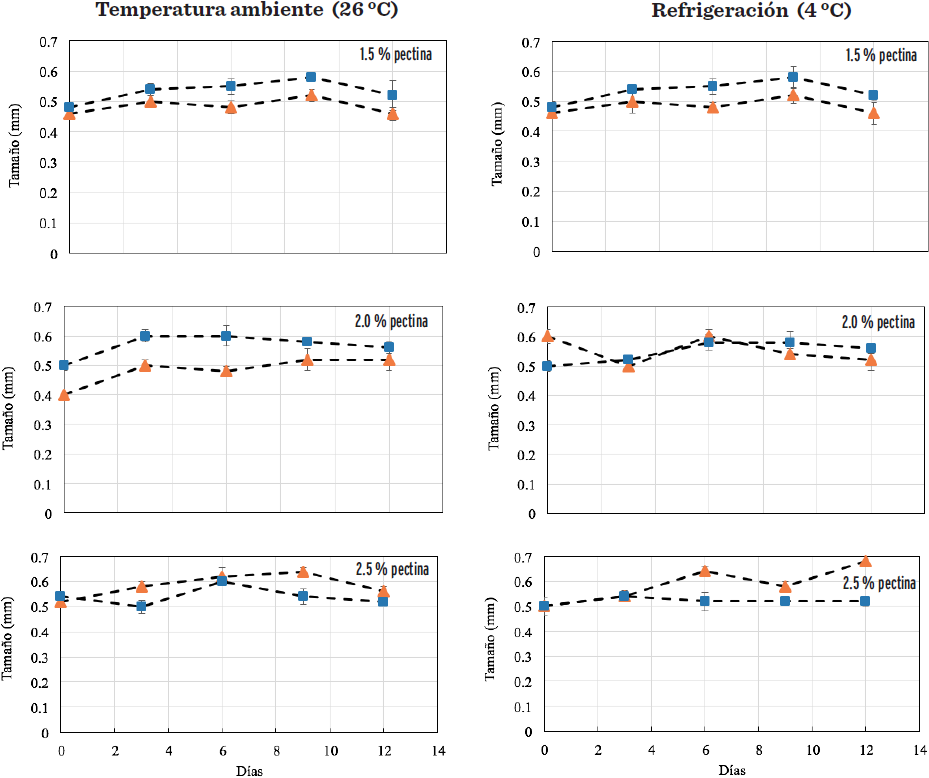
De acuerdo a Parra (2010), el tamaño de las cápsulas elaboradas con alginatos no puede ser del todo controlado, pero normalmente oscila de 400 µm y a 1 mm, para su fácil deglución, una vez que las cápsulas son sometidas a un secado posterior. En este estudio, las cápsulas no fueron sometidas a un proceso de secado posterior, es por ello su tamaño es mayor. De acuerdo a Krasaekoopt y col. (2003), el tamaño de las esferas es de 2 mm a 5 mm y la forma de las cápsulas de alginato de sodio está determinado por el diámetro de la aguja usada y la distancia de la caída libre de la solución. Además, esta morfología podría ser debido a las interacciones de la pectina y el alginato en geles mixtos, que se han descrito como una asociación heterogénea de los bloques poli-G de alginato y éster metílico de las regiones de pectina de baja carga, empaquetadas en perlas rígidas (Voo y col., 2011).
En la Tabla 2 se muestran los valores de la densidad de las cápsulas de jugo de naranja. En la cápsula almacenada a 26 ºC la densidad inicial más baja (0.88 g/mL) y más alta (2.30 g/mL) fue observada a 5 ºBrix, pH 4.5 y concentraciones de pectina de 2 % y 1.5 % (p/v), respectivamente, mientras que las densidades finales a esta misma concentración de SST osciló de 0.63 g/mL a 1.04 g/mL. A 15 ºBrix, la densidad inicial obtuvo valores entre 1.11 g/mL y 2.03 g/mL. A concentración de 2 % (p/v) de pectina, pH 3.5 % se obtuvo la mayor densidad inicial. Las densidades más bajas se obtuvieron a 2.5 % (p/v) de pectina con los pH evaluados. La densidad inicial varió de 0.72 g/mL a 1.51 g/mL. Los cambios de densidad pueden ser debido a que la pectina, muestra una menor sensibilidad a agentes químicos, en este caso, al pH del jugo, además de una mayor resistencia mecánica en comparación con alginato (Naqash y col., 2017). Es posible que se haya presentado un efecto sinérgico, al hacer la combinación de ambos agentes encapsulantes que influyeron en la densidad de las cápsulas.
Tabla 2 Densidad de las cápsulas de jugo de naranja obtenidas mediante gelificación iónica, almacenadas durante 12 d a temperatura ambiente (26 °C) y refrigeración (4 °C).
Table 2 Density of the orange juice capsules obtained by ionic gelation, stored for 12 d at room (26 °C) and refrigeration (4 °C) temperature.
| Almacenamiento en temperatura ambiente (T = 2G °C, HR = G %) | ||||
|---|---|---|---|---|
| SST | Pectina (%) | pH | Inicial | Final |
| 5 °Brix | 1.5 | 2.5 | 1.88 ± 0.03 | 0.63 ± 0.02 |
| 3.5 | 1.10 ± 0.01 | 0.84 ± 0.06 | ||
| 4.5 | 2.30 ± 0.01 | 0.88 ± 0.01 | ||
| 2 | 2.5 | 1.38 ± 0.04 | 0.74 ± 0.01 | |
| 3.5 | 1.11 ± 0.02 | 1.04 ± 0.04 | ||
| 4.5 | 0.88 ± 0.01 | 0.76 ± 0.05 | ||
| 2.5 | 2.5. | 1.28 ± 0.03 | 1.01 ± 0.02 | |
| 3.5 | 1.09 ± 0.05 | 0.84 ± 0.07 | ||
| 4.5 | 1.12 ± 0.02 | 0.90 ± 0.01 | ||
| 15 °Brix | 1.5 | 2.5 | - | - |
| 3.5 | 2.03 ± 0.06 | 1.03 ± 0.03 | ||
| 4.5 | 2.04 ± 0.02 | 0.74 ± 0.01 | ||
| 2 | 2.5 | - | - | |
| 3.5 | 2.42 ± 0.01 | 1.21 ± 0.06 | ||
| 4.5 | 1.47 ± 0.05 | 1.11 ± 0.02 | ||
| 2.5 | 2.5. | - | - | |
| 3.5 | 1.40 ± 0.02 | 0.82 ± 0.01 | ||
| 4.5 | 1.59 ± 0.04 | 0.89 ± 0.06 | ||
| Almacenamiento en refrigeración (T = 4 °C, HR = 85 %) | ||||
| 5 °Brix | 1.5 | 2.5 | 1.18 ± 0.01 | 0.77 ± 0.01 |
| 3.5 | 0.96 ± 0.04 | 0.73 ± 0.03 | ||
| 4.5 | 0.78 ± 0.03 | 0.96 ± 0.05 | ||
| 2 | 2.5 | 1.51 ± 0.03 | 1.31 ± 0.08 | |
| 3.5 | 1.22 ± 0.02 | 1.07 ± 0.06 | ||
| 4.5 | 1.39 ± 0.01 | 1.21 ± 0.04 | ||
| 2.5 | 2.5. | 0.72 ± 0.06 | 0.74 ± 0.01 | |
| 3.5 | 1.10 ± 0.03 | 0.87 ± 0.01 | ||
| 4.5 | 1.35 ± 0.04 | 1.23 ± 0.04 | ||
| 15 °Brix | 1.5 | 2.5 | - | - |
| 3.5 | 2.97 ± 0.08 | 0.82 ± 0.01 | ||
| 4.5 | 2.61 ± 0.06 | 0.88 ± 0.04 | ||
| 2 | 2.5 | - | - | |
| 3.5 | 1.49 ± 0.06 | 0.84 ± 0.02 | ||
| 4.5 | 1.65 ± 0.04 | 0.89 ± 0.05 | ||
| 2.5 | 2.5. | - | - | |
| 3.5 | 1.46 ± 0.03 | 0.93 ± 0.05 | ||
| 4.5 | 1.61 ± 0.01 | 1.00 ± 0.02 | ||
Las cápsulas formadas fueron demasiado débiles para poder realizar las pruebas.
A 15 ºBrix, las cápsulas mostraron densidades más altas, cuyos valores oscilaron entre 1.46 g/mL y 2.97 g/mL. La densidad más alta se obtuvo a concentración de 1.5 % (p/v) de pectina. De acuerdo a Rivera (2013), la densidad de las esferas de alginato sufre cierta influencia debido a la concentración en que se han elaborado y el tiempo de gelificación, sin embargo, las cápsulas obtenidas mediante este método de encapsulamiento mostraron una apariencia y homogeneidad en su tamaño y forma, a pesar de los cambios de densidad que sufrieron durante su almacenamiento.
El comportamiento de los cambios que tuvo el pH de las cápsulas de naranja a 5 ºBrix y 15 ºBrix, en las cápsulas almacenadas a 26 ºC y 4 ºC, se muestra en la Figura 4. El pH inicial 3.5 y 4.5 tendió a disminuir en las muestras almacenadas a temperatura ambiente, alcanzando valores de 2 a 2.5 a los 12 d, en tanto que el pH 2.5 permaneció estable. En temperatura de refrigeración el pH 3.5 y 4.5, presentó una disminución general para el día 6, con un incremento al día 12, en las muestras con 2.5 % y 3.5 % de pectina. En algunas cápsulas se observó cierta sinéresis que pudo haber sido causada por estas modificaciones de pH, ya que al inicio existió degradación de las cápsulas, que se pudo apreciar de manera visual al momento de realizar las determinaciones, pero no una desintegración total, a excepción del pH de 1.5, donde su formación fue más lenta y más débil. Esta inestabilidad del pH pudo haber afectado la estabilidad de las cápsulas, de acuerdo a lo reportado por Einhorn-Stoll y col. (2015), ya que ocurren enlaces de hidrógeno en los grupos carboxilo no disociados y no cargados a pH bajos, que favorecen fuertes interacciones en las macromoléculas de la pectina de las cápsulas. En contraste, los grupos carboxilo disociados a pH más altos están cargados negativamente y causa repulsión electrostática de las macromoléculas, lo que determina finalmente la estabilidad o inestabilidad de las cápsulas a los diferentes pH evaluados.
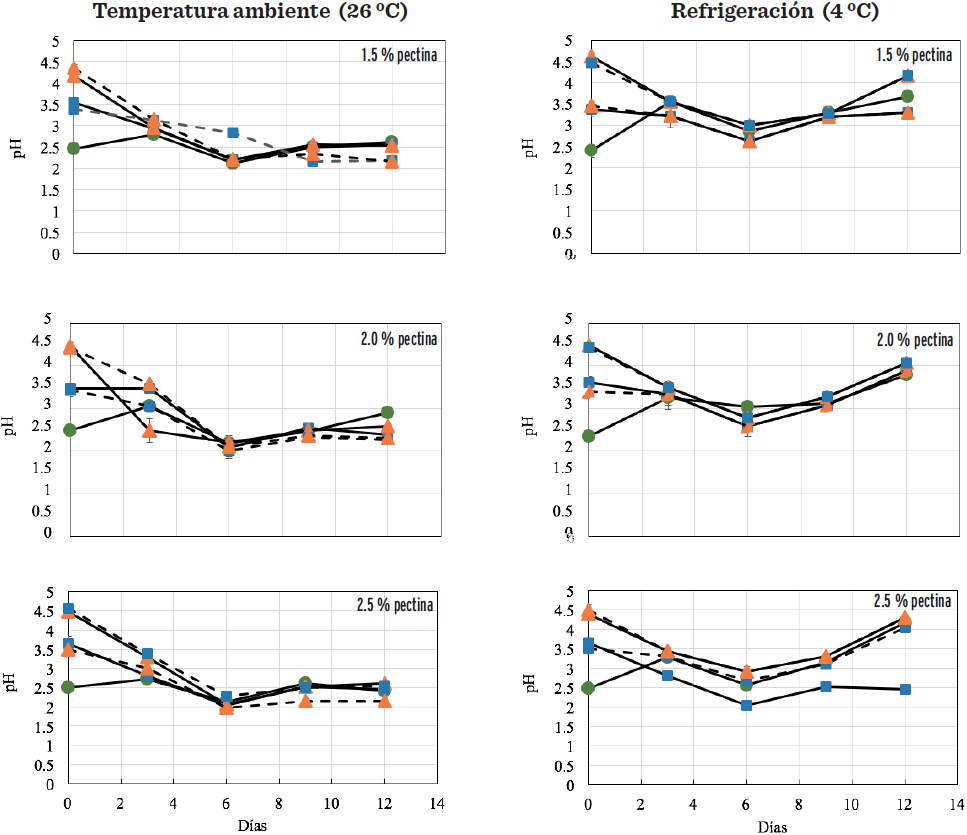
De acuerdo a Pérez y col. (2012), el pH en tratamientos de gelificación iónica debe ser igual o menor a 3.3, para mantener cápsulas estables y de mayor grado de gelificación. Estos cambios de pH, después del almacenamiento, se deben quizá por la oxidación que sufre el ácido ascórbico a ácido dehidroascórbico, así como el incremento de ácidos orgánicos, que pudieron influir en la reducción de estos valores, lo que provocó que incrementara el pH al día 12 de almacenamiento. Las características de los geles de alginato-calcio pueden ser influenciadas por muchos factores, tales como pH, agente secuestrante, dureza del agua, adición de hidrocoloides y la cantidad de agua, y el pH fue uno de los factores que más influencia tuvo sobre la estabilidad de las cápsulas en este estudio, tal como lo observó King (1983), quien determinó que el pH tiene un efecto significativo sobre la formación de geles de alginato, cuyo rango de pH donde se obtuvieron los mejores cápsulas es de 2.8 a 4.0.
En la Tabla 3 se muestran las medias de los atributos de color, de las cápsulas obtenidas por gelificación iónica, al día 0 y al día 12. Los valores de L* al día 0 en las muestras a 5 ºBrix, oscilaron de 35.95 a 39.30 a 26 ºC, y de 35.60 a 39.71 a 4 ºC. No se observaron diferencias con respecto a la concentración de pectina y pH inicial, pero se observó una ligera reducción al día 12 a 26 ºC (31.93 a 39.41) y a 4 ºC (35.16 a 39.77), lo cual podría atribuirse a la pérdida parcial de agua, que ocasionó ese ligero descenso. En las cápsulas a 15 ºBrix, la luminosidad inicial fue más homogénea en todos los tratamientos evaluados al día 0 a 26 ºC (35.87 a 38.14) y a 4 ºC (37.59 a 39.45). Este incremento se debe tal vez a la mayor concentración de sólidos presentes en el jugo, ya que aún al día 12 ocurrió una menor pérdida de pigmentos, debido a que a baja temperatura la degradación es menor.
Tabla 3 Atributos de color de las cápsulas de jugo de naranja almacenadas a temperatura ambiente (26 °C) y en refrigeración (4 °C), obtenidas mediante gelificación iónica.
Table 3 Color attributes of orange juice capsules stored at room temperature (26 °C) and refrigeration (4 °C) temperature, obtained by ionic gelation.
| SST | Pectina (%) | pH inicial | L * 0 | C * 0 | H * 0 | L * 12 | C * 12 | H * 12 | (E |
|---|---|---|---|---|---|---|---|---|---|
| Almacenamiento a temperatura ambiente (26 °C, HR = 6 %) | |||||||||
| 5 °Brix | 1.5 | 2.5 | 39.30 | 19.94 | 82.65 | 37.72 | 24.17 | 79.97 | 4.63 |
| 3.5 | 38.56 | 19.07 | 82.86 | 36.71 | 25.38 | 79.60 | 6.69 | ||
| 4.5 | 37.59 | 17.61 | 84.36 | 35.92 | 25.77 | 79.31 | 8.54 | ||
| 2 | 2.5 | 36.43 | 19.17 | 81.48 | 33.75 | 24.61 | 81.73 | 6.06 | |
| 3.5 | 39.29 | 24.95 | 81.68 | 34.73 | 33.69 | 80.69 | 9.87 | ||
| 4.5 | 35.95 | 35.86 | 82.82 | 39.41 | 19.43 | 82.64 | 16.79 | ||
| 2.5 | 2.5 | 38.63 | 27.75 | 82.00 | 37.63 | 14.87 | 82.04 | 13.03 | |
| 3.5 | 36.98 | 33.93 | 82.53 | 35.82 | 24.30 | 79.69 | 9.80 | ||
| 4.5 | 38.83 | 24.85 | 80.99 | 31.93 | 39.99 | 80.20 | 16.65 | ||
| 15 °Brix | 1.5 | 2.5 | - | - | - | - | - | - | - |
| 3.5 | 37.05 | 34.95 | 84.80 | 31.51 | 39.28 | 80.34 | 7.59 | ||
| 4.5 | 37.40 | 34.16 | 82.92 | 38.90 | 29.87 | 82.44 | 4.55 | ||
| 2 | 2.5 | - | - | - | - | - | - | - | |
| 3.5 | 37.26 | 18.91 | 80.01 | 35.23 | 28.62 | 81.58 | 9.94 | ||
| 4.5 | 35.87 | 40.63 | 83.65 | 32.02 | 30.53 | 77.53 | 11.44 | ||
| 2.5 | 2.5 | - | - | - | - | - | - | - | |
| 3.5 | 38.14 | 40.37 | 83.93 | 31.76 | 40.57 | 79.82 | 7.01 | ||
| 4.5 | 37.35 | 28.35 | 81.28 | 38.01 | 27.85 | 80.91 | 0.85 | ||
| Almacenamiento en refrigeración (T = 4 °C, HR = 85 %) | |||||||||
| 5 °Brix | 1.5 | 2.5 | 39.71 | 20.36 | 80.90 | 39.51 | 20.22 | 79.54 | 0.54 |
| 3.5 | 37.56 | 21.83 | 82.21 | 36.80 | 19.25 | 79.34 | 2.88 | ||
| 4.5 | 35.60 | 24.90 | 83.50 | 39.69 | 17.49 | 78.42 | 8.67 | ||
| 2 | 2.5 | 36.70 | 23.60 | 84.12 | 38.51 | 22.58 | 79.90 | 2.69 | |
| 3.5 | 38.44 | 25.65 | 82.65 | 39.66 | 21.93 | 80.00 | 4.06 | ||
| 4.5 | 38.50 | 27.85 | 82.86 | 37.40 | 30.71 | 81.37 | 3.16 | ||
| 2.5 | 2.5 | 38.77 | 28.93 | 81.33 | 38.67 | 27.68 | 79.19 | 1.64 | |
| 3.5 | 38.32 | 23.91 | 81.56 | 35.16 | 21.30 | 80.08 | 4.14 | ||
| 4.5 | 37.72 | 27.59 | 83.57 | 39.77 | 23.38 | 80.25 | 4.91 | ||
| 15 °Brix | 1.5 | 2.5 | - | - | - | - | - | - | - |
| 3.5 | 38.66 | 28.07 | 81.89 | 38.41 | 22.57 | 80.07 | 5.57 | ||
| 4.5 | 39.45 | 26.41 | 81.92 | 37.66 | 28.63 | 80.79 | 2.90 | ||
| 2 | 2.5 | - | - | - | - | - | - | - | |
| 3.5 | 37.62 | 30.98 | 84.11 | 33.68 | 33.40 | 78.01 | 5.75 | ||
| 4.5 | 37.59 | 32.60 | 82.56 | 38.62 | 24.84 | 78.58 | 8.08 | ||
| 2.5 | 2.5 | - | - | - | - | - | - | - | |
| 3.5 | 38.74 | 37.05 | 83.16 | 38.32 | 26.50 | 80.68 | 10.65 | ||
| 4.5 | 39.34 | 27.73 | 83.06 | 37.39 | 21.82 | 80.13 | 6.35 | ||
Las cápsulas formadas fueron demasiado débiles para poder realizar las pruebas.
La saturación de color o cromaticidad (C*) se mantuvo en un rango de 17.61 a 35.86 al día 0 con 5 ºBrix a 26 ºC, y de 20.36 a 28.93 a 4 ºC. No se observó una tendencia clara en este atributo de color después de 12 d de almacenamiento. A 15 ºBrix, los valores de C*, de las cápsulas almacenadas a 26 ºC, fueron similares (18.91 a 40.63) porque el mayor contenido de sólidos presentes en el jugo se debió a un incremento en los azúcares disueltos. Con respecto a las cápsulas almacenadas a 4 ºC, los valores de cromaticidad al día 0 oscilaron entre 26.41 a 37.05. A los 12 d de almacenamiento se observó una reducción general de este atributo (21.82 a 33.40), alcanzando valores hasta 17.49 al día 12, a 5 ºBrix con pectina al 1.5 % (p/v) y pH 4.5. Los materiales de pared de las microcápsulas protegen los componentes encapsulados contra efectos ambientales (oxígeno, luz, humedad, entre otros) lo que mejora su estabilidad, (Garg y col., 2006), lo cual se pudo apreciar en el presente estudio, ya que la pectina y el alginato contribuyeron a la estabilidad, de los pigmentos responsables del atributo de color.
Los valores de tonalidad (H*) de las cápsulas almacenadas a 26 ºC fueron de 80.99 a 84.36 y de 80.01 a 84.80 a 5 ºBrix y 15 ºBrix, respectivamente. Estos valores se redujeron ligeramente al día 12. Este mismo comportamiento fue observado también en todas las cápsulas almacenadas en refrigeración, en todos los tratamientos. Al parecer, el pH y la concentración de pectina no tuvieron influencia sobre este parámetro, observándose como resultado cápsulas de color amarillo de tonalidad uniforme. En el estudio realizado por Pérez y col. (2012), indicaron que la modificación en la estabilidad de color, en esferas realizadas con bebida comercial a base de jugo de cítricos (naranja, mandarina y limón), no es significativa, ya que los valores de L* y H* van en aumento con el transcurso de los días, lo que da como resultado una estabilidad visual. Estos resultados muestran similitud con los tratamientos aquí descritos, ya que se pudo apreciar que la temperatura de almacenamiento y la humedad relativa en sinergia tuvieron influencia en los cambios de color y la concentración de los agentes gelificantes utilizados.
El almacenamiento influyó en la estabilidad de las cápsulas, ya que a pesar de que los materiales de pared (pectina y alginato de sodio) forman geles estables al calor, un tratamiento térmico prolongado, a bajo o alto pH desestabiliza los geles, debido a una tasa de reacción incrementada de procesos de depolimerización, tales como la hidrólisis catalizadas por protón y las reacciones de β-eliminación, como lo reportó Smidsrod y Draget (1997), observándose los valores más altos de DE a pH 4.5 a 5 ºBrix almacenadas a 26 ºC, y los valores más bajos a bajas temperaturas, lo que ocurrió quizá debido a la capacidad de las pectinas de formar geles, la cual está influenciada por el grado de metoxilación y el patrón de los grupos carboxilo libres que determinan las propiedades funcionales, en adición a factores ambientales tales como los iones presentes (calcio principalmente), pH (grado de disociación de los grupos carboxilo y las concentraciones de azúcares (Kastner y col., 2019). De acuerdo a lo anterior, utilizando el método de gelificación iónica se obtuvieron cápsulas estables (Figura 5). Las que mostraron una mayor estabilidad durante los 12 d de evaluación fueron las obtenidas a una concentración de pectina del 2 % (p/v), pH 2.5 y a 5 ºBrix, almacenadas a 4 ºC, lo cual pudo ser debido a los factores mencionados anteriormente.

Cabe mencionar que las formas macroscópicas observadas más frecuente fueron las siguientes: esféricas, ovoides, irregulares y amorfas. La concentración de pectina, pH y condición de almacenamiento no tuvieron gran influencia en los cambios físicos de las cápsulas, siendo la morfología más común la esférica. La concentración inicial de SST fue la variable que más influyó en que se presentaran morfologías diferentes a las esféricas. Los tratamientos que obtuvieron los mejores resultados morfológicos fueron los de menor concentración de SST (5 ºBrix), puesto que obtuvieron un 45.56 % de forma esférica y solo un 6.67 % para cápsulas amorfas; a pesar de ello, es necesario estandarizar las condiciones aplicadas en la gelificación iónica para incrementar la predominancia de la morfología esférica, y por tanto, tener un mayor control sobre las propiedades de las cápsulas. Por otra parte, las cápsulas con mayor concentración de SST (15 ºBrix) presentaron formas irregulares y amorfas en la mayoría de sus tratamientos, observándose además durante los 12 d, cierta degradación de las cápsulas y esta sinéresis fue más frecuente en las cápsulas amorfas. Las cápsulas elaboradas a partir de alginato tienden a presentar paredes más rígidas y de mayor porosidad, tal como lo explican Burey y col. (2008), ya que los alginatos forman un complejo insoluble con el calcio, lo que da pie a la formación de una pared semirrígida constituida por enlaces químicos. En esta pared los iones calcio se sitúan como puentes entre los grupo carboxilo del alginato, dando lugar a cápsulas de geles estables al tiempo y resistentes a la temperatura.
Las cápsulas que registraron una menor pérdida de peso, almacenadas a 4 ºC, debieron presentar una pared mejor estructurada, probablemente más gruesa y estable a los 12 d de evaluación, independiente de sus concentraciones de SST, pectina, pH y condición de almacenamiento. Dias y col. (2015) mencionaron que en una técnica de encapsulación, los materiales, proceso de producción, morfología final y aplicación son los factores más importantes para ser considerados en sistemas de liberación de compuestos bioactivos, para que estos puedan ejercer las funciones biológicas, por lo que mejoran su estabilidad, aplicando técnicas como la gelificación iónica es una alternativa viable.
Conclusiones
El uso de tecnologías de encapsulación es adecuado para obtener productos más estables y que permitan conservar las propiedades fisicoquímicas de los zumos, ya que utilizando el método de gelificación iónica se pudieron obtener encapsulados de jugo de naranja con 5 ºBrix, con parámetros de calidad aceptables, utilizando alginato de sodio 0.5 % (p/v) y pectina 2 % (p/v) como agentes encapsulantes, pH 2.5 y almacenados a 4 ºC. Por tanto, el uso de tecnologías de encapsulación como gelificación iónica permitieron preservar las características fisicoquímicas del jugo de naranja producido en Tamaulipas, que es el segundo estado citrícola más importante a nivel nacional, lo que contribuirá a mejorar la comercialización de este producto regional, ofreciendo alternativas que ayuden a la diversificación de su uso y/o agregarse a otros productos alimenticios.











 nueva página del texto (beta)
nueva página del texto (beta)



