Introducción
Los bancos sumergidos se desarrollan desde el fondo del mar, pero no alcanzan a llegar a la superficie, probablemente porque no mantuvieron su ritmo de crecimiento para compensar la tasa de ascenso del nivel del mar durante la trasgresión holocénica o bien porque no llegaron a ese nivel, cuando la tasa de ascenso se redujo (Neumann y Macintyre, 1985; Abbey y Webster, 2011). Recientemente se ha reconocido su importancia ecológica porque son un hábitat disponible para los organismos marinos y pueden contribuir de manera significativa a la producción de larvas (Thomas y col., 2015). Además conectan las comunidades arrecifales y sirven como áreas de reserva de germoplasma (Ortiz-Lozano y col., 2013; Thomas y col., 2015; Salas-Monreal y col., 2018).
En las costas de Veracruz se tienen documentados más de 30 bancos sumergidos (Gobierno del Estado de Veracruz, 2008; Ortiz-Lozano y col., 2013; Cortés-Useche y col., 2015; González-Gándara, 2015; Ortiz-Lozano y col., 2018). Uno de ellos es el arrecife Palo Seco, ubicado en el sur del estado, muy cerca de la desembocadura del río Coatzacoalcos, lo cual le confiere una alta turbidez debido a las descargas fluviales (Salas-Pérez y col., 2015), que reducen la calidad del agua tanto para la comunidad de corales escleractinios (Loya, 1976) como para la de peces (Wenger y col., 2015a). Esto es, porque los corales se desarrollan mejor en aguas transparentes, oligotróficas (Zlatarsky y Martínez-Estalella, 2018), y se vinculan estrechamente con la comunidad de peces (Ricart y col., 2016).
La estructura de las comunidades de peces se ha relacionado con la profundidad (Hernández-Landa y col., 2014), la cobertura coralina (Jones y Sims, 1998), la complejidad del ambiente (Aguilar-Medrano y Arias-González, 2018) y la turbidez (Wenger y col., 2015a; 2015b), entre otros. Los ensambles de peces asociados a los arrecifes de coral veracruzanos, en general, se conocen bien, tanto en el Sistema Arrecifal Veracruzano (SAV) (Del-Moral-Flores y col., 2013 y Robertson y col., 2019) como en el Sistema Arrecifal Lobos-Tuxpan (SALT) (González-Gándara y col., 2012; 2013). Sin embargo, se sabe muy poco de la ictiofauna ligada a los bancos sumergidos de Veracruz, ya que únicamente existen 3 trabajos publicados, que aportan información sobre los componentes ictiológicos de los arrecifes: Blake, Pantepec y Oro Verde, ubicados en el norte del estado (Cortés-Useche y col., 2015; González-Gándara, 2015), y el registro de Neopomacentrus cyanomos procedente del Indo Pacífico, en Palo Seco, Veracruz (González-Gándara y De-la-Cruz-Francisco, 2014).
El conocimiento de la estructura de las comunidades de peces ligadas a los arrecifes veracruzanos, es necesario para documentar la conectividad ecológica planteada por Ortiz-Lozano y col. (2013), que es soportada parcialmente por los patrones de corrientes del sur-oeste del golfo de México (Salas-Monreal y col., 2018). Por otra parte, la Comisión Nacional de Áreas Naturales Protegidas (CONANP) propuso el Área de Protección de Flora y Fauna Arrecifes de los Tuxtlas, en el sur de Veracruz (CONANP, 2018), pero no incluyó al arrecife Palo Seco.
El objetivo del presente trabajo fue determinar la estructura de la comunidad de peces en el arrecife Palo Seco, Veracruz, y su relación con los grupos morfofuncionales que caracterizan el sustrato, para enfatizar su importancia ecológica y documentar su incorporación a la propuesta de áreas naturales protegidas.
Materiales y métodos
Palo Seco se ubica a los 18°10’30” N y 94°31’30” W, a 1 920 m de la costa de Coatzacoalcos, Veracruz, y cubre un área aproximada de 0.12 km2 (Figura 1). Presenta una profundidad que oscila de 11.6 m a 22 m, su estructura arrecifal contiene varios parches con baja cobertura coralina representada por Pseudodiploria sp, Montastraea sp, Siderastrea sp, Agaricia sp y Oculina sp. Las pendientes rocosas contienen numerosas colonias de esponjas e hidroides (González-Gándara y col., 2015). Esta formación es bañada por el río Coatzacoalcos cuyo gasto en época de lluvias es de 661.44 m3/s, y su temperatura promedio es de 25.39 °C (Salas-Pérez y col., 2015).
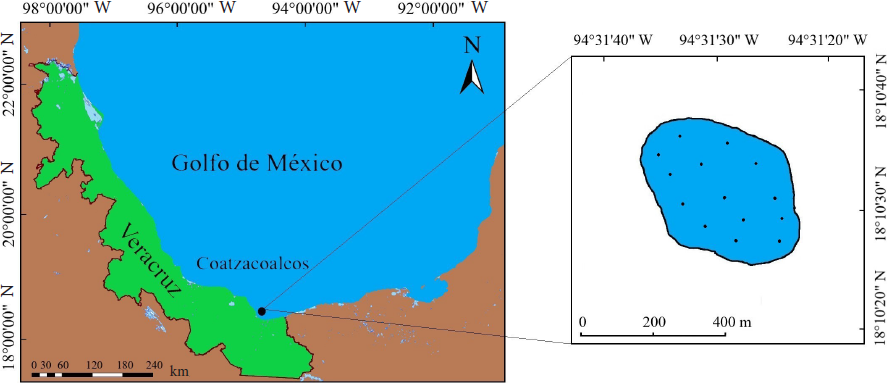
Se llevaron a cabo 117 censos visuales en total, 63 usando la técnica de buzo errante con una duración de 30 min efectuados en junio y agosto de 2013, para las evaluaciones cualitativas, y 54 transectos en banda (25 m x 2 m), distribuidos sistemáticamente en 14 sitios en el arrecife (Figura 1), para los muestreos cuantitativos efectuados en junio de 2016. Los puntos de muestreo se seleccionaron de forma tal, que estuviesen distribuidos en toda el área del arrecife y permitieran un muestreo entre 11.6 m y 22.0 m de profundidad. Ambos muestreos se hicieron con equipo de buceo autónomo SCUBA. La identificación de los peces fue realizada in situ a partir de los rasgos morfológicos y los patrones de coloración que distinguen a los peces arrecifales. Cuando esto no fue posible, se llevaron a cabo recolectas; los peces mayores a 10 cm de longitud total se capturaron con hawaianas, y los peces menores a 10 cm de longitud total fueron rociados con una solución de aceite de clavo (10 % aceite de clavo y 70 % etanol) para adormecerlos, y luego se atraparon con redes de mano. Los organismos se transportaron al laboratorio para su identificación, utilizando las obras de Böhlke y Chaplin (1993) y McEachran y Fechhelm (1998; 2005). La nomenclatura fue revisada usando el catálogo de peces (Fricke y col., 2018). La lista fue ordenada de acuerdo con Nelson y col. (2016), para las categorías supragenéricas; los géneros y especies se ordenaron alfabéticamente. La suficiencia del muestreo fue determinada utilizando los estimadores no paramétricos: Chao 2, Jack 1, Jack 2 y Bootstrap, con el programa EstimateS versión 9.0 (Colwell, 2013), considerando el número total de censos (117).
La estimación de la abundancia ictiológica se realizó sobre los 54 transectos en banda (25 m x 2 m), utilizando la escala propuesta por Harmelin-Vivien y col. (1985): 1, 2, 3 a 5; 6 a 10; 11 a 30, 31 a 50, 51 a 100, 101 a 200, 201 a 500 y > 500. Las tallas fueron estimadas considerando intervalos de 10 cm (1 cm a 10 cm; 11 cm a 20 cm; 21 cm a 30 cm, 31 cm a 40 cm, 41 cm a 50 cm; 51 cm a 60 cm, 61 cm a 70 cm, 71 cm a 80 cm, entre otros), posteriormente, se calculó la talla media. Para validar las estimaciones de talla efectuadas por el buzo, se realizó una prueba t-pareada, siguiendo la propuesta de English y col. (1997), usando el programa PAST versión 3.25 (Hammer y col., 2001). A partir de los datos de abundancia y de talla promedio de cada especie, se evaluó la biomasa mediante la función exponencial P = a Lb, donde, P = peso total (g) L = longitud total (cm); a y b = constantes de la relación peso-longitud. Los valores de estas constantes se obtuvieron a partir de la base de datos electrónica Fishbase (Froese y Pauly, 2019) y la publicación de: Claro y García-Arteaga (1994). Las especies de peces, registradas durante la evaluación cuantitativa se agruparon con base en su nivel trófico, siguiendo la propuesta de Randall (1967), que considera los siguientes grupos: carnívoros generalistas, consumidores de invertebrados con concha, consumidores de invertebrados sésiles, ectoparasitívoros, herbívoros, omnívoros, piscívoros y zooplanctívoros, para valorar su aporte a la abundancia total.
Los componentes bentónicos fueron determinados usando los siguientes grupos morfofuncionales: algas césped, algas costrosas, cianobacterias, corales, esponjas, macroalgas, arena, materia orgánica y roca, definidos a partir de 1 470 fotografías tomadas sobre los transectos de 25 m x 2 m con una cámara Canon, Power Shot G16 de 16 megapíxeles (Tokio, Japón). Las imágenes fueron analizadas con el programa Coral Point Count (Kohler y Gill, 2006), usando 25 puntos al azar por imagen. Para el análisis de correspondencia canónica (ACC), se utilizó la matriz de cobertura de los grupos morfofuncionales y la profundidad, previa transformación a Box Cox, contra la matriz de las especies de peces más abundantes (transformadas a raíz cuarta) y la matriz de los gremios tróficos de peces, utilizando el programa PAST versión 3.25 (Hammer y col., 2001).
Resultados
La fauna ictiológica del arrecife Palo Seco estuvo constituida por 109 especies pertenecientes a 67 géneros y 36 familias. Pomacentridae, Scaridae y Lutjanidae fueron las familias con mayor riqueza, con 9 especies cada una (Tabla 1). Además, se registró la presencia de 2 especies invasoras: Pterois volitans y N. cyanomos, así como 3 especies endémicas de Veracruz (Elacatinus jarocho, Hypoplectrus atlahua e Hypoplectrus castroaguirrei) y 1 del golfo de México (Halichoeres burekae). Los estimadores no paramétricos explicaron en promedio, el 83.2 % de la riqueza, y potencialmente se pueden registrar hasta 131 especies (Tabla 2).
Tabla 1 Lista sistemática de los peces del arrecife Palo Seco, Veracruz, México. Las especies consideradas en los muestreos cuantitativos fueron señaladas con la letra c.
Table 1 Checklist of the fish at Palo Seco Reef, Veracruz, Mexico. The species considered on quantitative sampling were marked with c letter.
| Urotrygonidae | Urobatis jamaicensis (Cuvier, 1816) c |
| Aetobatidae | Aetobatus narinari (Euphrasen, 1790) |
| Megalopidae | Megalops atlanticus (Valenciennes, 1847) c |
| Muraenidae |
Gymnothorax miliaris (Kaup, 1856) Gymnothorax moringa (Cuvier, 1829) c |
| Synodontidae | Synodus intermedius (Spix y Agassiz, 1829) c |
| Holocentridae |
Holocentrus adscensionis (Osbeck, 1765) Myripristis jacobus (Cuvier, 1829) c |
| Gobiidae |
Coryphopterus glaucofraenum (Gill, 1863) Coryphopterus hyalinus (Böhlke y Robins, 1962) c Elacatinus jarocho (Taylor y Akins, 2007)** c Elacatinus oceanops (Jordan, 1904) c Ptereleotris calliura (Jordan y Gilbert, 1882) |
| Pomacentridae |
Abudefduf saxatilis (Linnaeus, 1758) c Chromis cyanea (Poey,1860) c Chromis multilineata (Guichenot, 1853) c Chromis scotti (Emery, 1968) c Microspathodon chrysurus (Cuvier, 1830) c Neopomacentrus cyanomos (Bleeker, 1856)* c Stegastes adustus (Troschel, 1865) c Stegastes partitus (Poey, 1868) c Stegastes xanthurus (Poey, 1860) c |
| Blenniidae |
Ophioblennius macclurei (Silvester, 1915) c Parablennius marmoreus (Poey, 1876) Scartella cristata (Linnaeus, 1758) |
| Labrisomidae |
Labrisomus nuchipinnis (Quoy y Gaimard, 1824) Malacoctenus triangulatus (Springer, 1959) c |
| Carangidae |
Caranx bartholomaei (Cuvier, 1833) Caranx crysos (Mitchill, 1815) c Caranx hippos (Linnaeus, 1766) Caranx latus (Agassiz, 1831) c Caranx ruber (Bloch, 1793) Decapterus macarellus (Cuvier, 1833) c |
| Sphyraenidae |
Sphyraena barracuda (Walbaum, 1792) c Sphyraena guachancho (Cuvier, 1829) c |
| Aulostomidae | Aulostomus maculatus (Valenciennes, 1837) |
| Scombridae |
Auxis thazard thazard (Lacepède, 1800) Scomberomorus cavalla (Cuvier, 1829) Scomberomorus maculatus (Mitchill, 1815) |
| Labridae |
Bodianus rufus (Linnaeus, 1758) c Clepticusparrae (Bloch y Schneider, 1801) c Halichoeres bivittatus (Bloch, 1791) c Halichoeres burekae (Weaver y Rocha, 2007)*** c Halichoeres maculipinna (Müller y Troschel, 1848) c Halichoeres radiatus (Linnaeus, 1758) c Thalassoma bifasciatum (Bloch, 1791) c |
| Scaridae |
Nicholsina usta (Valenciennes, 1840) c Scarus iseri (Bloch, 1789) c Scarus taeniopterus (Lesson, 1829) c Scarus vetula (Bloch y Schneider, 1801) Sparisoma aurofrenatum (Valenciennes, 1840) c Sparisoma chrysopterum (Bloch y Schneider, 1801) Sparisoma radians (Valenciennes, 1840) Sparisoma rubripinne (Valenciennes, 1840) Sparisoma viride (Bonnaterre, 1788) |
| Gerreidae | Gerres cinereus (Walbaum, 1792) c |
| Mullidae | Pseudupeneus maculatus (Bloch, 1793) c |
| Pempheridae | Pempheris schomburgkii (Müller y Troschel, 1848) c |
| Kyphosidae | Kyphosus incisor (Cuvier, 1831) c |
| Ephinephelidae |
Cephalopholis cruentata (Lacepède, 1802) c Epinephelus adscensionis (Osbeck, 1765) c Mycteroperca bonaci (Poey, 1860) c |
| Serranidae |
Hypoplectrus
atlahua Tavera y Acero, 2013** c Hypoplectrus castroaguirrei (Del-Moral-Flores, Tello-Musi y Martínez-Pérez, 2011)** c Hypoplectrus floridae (Victor, 2013) c Hypoplectrus puella (Cuvier, 1828) c Rypticus subbifrenatus (Gill, 1861) Serranus subligarius (Cope, 1870) c |
| Priacanthidae | Priacanthus arenatus (Cuvier, 1829) c |
| Chaetodontidae |
Chaetodon capistratus (Linnaeus, 1758) Chaetodon ocellatus (Bloch, 1787) c Chaetodon sedentarius (Poey, 1860) c Prognathodes aculeatus (Poey, 1860) |
| Pomacanthidae |
Holacanthus bermudensis (Goode, 1876) Holacanthus tricolor (Bloch, 1795) Pomacanthus paru (Bloch, 1787) c |
| Haemulidae |
Anisotremus virginicus (Linnaeus, 1758) c Anisotremus surinamensis (Bloch, 1791) c Haemulon aurolineatum (Cuvier, 1830) c Haemulon carbonarium (Poey, 1860) c Haemulon flavolineatum (Desmarest, 1823) c Haemulon macrostomum (Günther, 1859) c Haemulon plumierii (Lacepède, 1801) c Haemulon vittatum (Poey, 1860) |
| Lutjanidae |
Lutjanus analis (Cuvier, 1828) Lutjanus apodus (Walbaum, 1792) Lutjanus cyanopterus (Cuvier, 1828) c Lutjanus griseus (Linnaeus, 1758) c Lutjanus jocu (Bloch y Schneider, 1801) c Lutjanus mahogoni (Cuvier, 1828) c Lutjanus synagris (Linnaeus, 1758) Ocyurus chrysurus (Bloch, 1791) c Rhomboplites aurorubens (Cuvier, 1929) c |
| Scorpaenidae |
Pterois volitans (Linnaeus, 1758)* Scorpaena plumieri (Bloch, 1789) c |
| Ephippidae | Chaetodipterus faber (Broussonet, 1782) c |
| Scianidae |
Equetus lanceolatus (Linnaeus, 1758) Odontoscion dentex (Cuvier, 1830) c Pareques acuminatus (Bloch y Schneider, 1801) Pareques umbrosus (Jordan y Eigenmann, 1889) |
| Acanthuridae | Acanthurus chirurgus (Bloch, 1787) c |
| Sparidae | Archosargusprobatocephalus (Walbaum, 1792) c |
| Balistidae | Balistes capriscus (Gmelin, 1789) |
| Monacanthidae |
Aluterus scriptus (Osbeck, 1765) c Cantherhines pullus (Ranzani, 1842) c |
| Tetraodontidae |
Canthigaster rostrata (Bloch, 1786) c Sphoeroides spengleri (Bloch, 1785) c |
| Diodontidae |
Diodon hystrix (Linnaeus, 1758) c Diodon holocanthus (Linnaeus, 1758) c |
*Especies invasoras; **especies endémicas de Veracruz; ***especie endémica del golfo de México.
Se contabilizaron un total de 26 192 individuos, por lo que, la abundancia promedio de peces por censo fue de 485 ± 148 ind, y entre las especies más abundantes destacan aquellas de talla menor a 10 cm, como: H. burekae, Coryphopterus hyalinus y los juveniles de Haemulon aurolineatum que representaron más del 70 % del total (Tabla 3). La prueba t para la estimación de tallas, no mostró diferencias significativas (t = 0.21, P = 0.832). Se estimó una biomasa total de 10 194.05 g durante la investigación, por tanto, el promedio de la biomasa ictiológica fue de 188.77 ± 169.22 g/m2 por censo. Las especies con mayor biomasa fueron: Sphyraena barracuda, Anisotremus virginicus y Megalops atlanticus, representando un poco más del 30 % (Tabla 4).
Tabla 3 Diez especies de peces más abundantes en el arrecife Palo Seco, Veracruz, México en función de su abundancia relativa.
Table 3 The ten most abundant fish species at Palo Seco Reef, Veracruz, Mexico according to the ir relative abundance.
| Especie | Abundancia (%) |
|---|---|
| Halichoeres burekae | 34.67 |
| Coryphopterus hyalinus | 22.76 |
| Haemulon aurolineatum (juveniles) | 14.01 |
| Stegastes xanthurus | 5.22 |
| Stegastes adustus | 4.54 |
| Neopomacentrus cyanomos | 3.38 |
| Chromis scotti | 2.84 |
| Chromis multilineata | 1.80 |
| Odontoscion dentex | 1.58 |
| Canthigaster rostrata | 1.06 |
| Otras especies | 8.14 |
| Total | 100 |
Tabla 4 Diez especies de peces más importantes en el arrecife Palo Seco, Veracruz, México en función de su biomasa relativa.
Table 4 The ten most important fish species at Palo Seco Reef, Veracruz, Mexico according to their relative biomass.
| Especie | Biomasa (%) |
|---|---|
| Sphyraena barracuda | 12.90 |
| Anisotremus virginicus | 9.79 |
| Megalops atlanticus | 8.49 |
| Halichoeres burekae | 5.00 |
| Archosargus probatocephalus | 4.56 |
| Pomacanthus paru | 4.42 |
| Coryphopterus hyalinus | 3.89 |
| Caranx chrysos | 3.60 |
| Odontoscion dentex | 3.08 |
| Epinephelus adscensionis | 2.97 |
Los peces que se alimentan de zooplancton (e. g. H. burekae, C. hyalinus y juveniles de H. aurolineatum) constituyeron el gremio dominante en el arrecife Palo Seco, representando el 83.35 % del total de la abundancia, seguido de los omnívoros (10.84 %) y carnívoros generalistas (1.58 %). Al considerar la biomasa, los zooplanctívoros aportaron el 18.79 %, y los piscívoros (e. g. M. atlanticus) junto con los carnívoros generalistas (e. g. Lutjanus jocu) aportaron el 57.11 % al total, debido a que sus tallas, en general, fueron mayores a 20 cm. La proporción de herbívoros en el arrecife Palo Seco fue notablemente reducida tanto en abundancia total (1.24 %) como en biomasa total (1.75 %) (Tabla 5), especialmente por la escasa abundancia de herbívoros errantes (escáridos, acantúridos y kifósidos), que representaron el 0.18 % de la abundancia total de herbívoros y el 1.21 % de la biomasa total de este gremio (Tabla 6).
Tabla 5 Abundancia y biomasa relativa de los gremios tróficos de peces en el arrecife Palo Seco, Veracruz, México. En negritas se ubican los grupos con mayor abundancia y biomasa.
Table 5 Relative abundance and biomass of the fish trophic guilds at Palo Seco Reef, Veracruz, Mexico. The groups with the greatest abundance and biomass are marked in bold.
| Grupo trófico | Especies consideradas en cada grupo | Abundancia total |
Abundancia % | Biomasa total (g) |
Biomasa % |
|---|---|---|---|---|---|
| Carnívoros generalistas |
A. virginicus, C. cruentata, E. adscensionis, H. aurolineatum, H. flavolineatum, H. maculipinna, H. atlahua, H. castroaguirrei, H. floridae, H. puella, L. griseus, L. jocu, L. mahogoni, O. chrysurus, P. maculatus, R. aurorubens, S. plumieri, S. subligarius, S. spengleri y U. jamaicensis. | 414 | 1.58 | 2 877.00 | 28.22 |
| Ectoparasitívoros | E. oceanops, juveniles de A. virginicus y B. rufus | 121 | 0.46 | 6.77 | 0.07 |
| Consumidores de invertebrados con concha |
A. surinamensis, A. probatocephalus, B. rufus, D. hystrix, D. holocanthus, G. cinereus, H. carbonarium, H. macrostomum, H. plumierii, H. bivittatus y H. radiatus. | 273 | 1.04 | 1 090.39 | 10.70 |
| Consumidores de invertebrados sésiles | A. saxatilis, C. sedentarius, H. bermudensis, C. faber, C. ocellatus y P. paru. | 290 | 1.11 | 912.53 | 8.95 |
| Omnívoros | A. scriptus, C. pullus, C. rostrata, S. adustus y S. xanthurus. | 2 839 | 10.84 | 268.53 | 2.63 |
| Herbívoros | A. chirurgus, K. incisor, M. triangulatus, M. chrysurus, N. usta, O. macclurei, S. iseri, S. taeniopterus y S. aurofrenatum. | 325 | 1.24 | 178.84 | 1.75 |
| Piscívoros | C. crysos, C. latus, L. cyanopterus, S. intermedius, G. moringa, M. atlanticus, M. bonaci, S. barracuda y S. guachancho. | 98 | 0.37 | 2 944.93 | 28.89 |
| Zooplanctívoros | C. cyanea, C. multilineata, C. scotti, C. parrae, C. hyalinus, E. jarocho, D. macarellus, juveniles de H. aurolineatum, H. burekae, M. jacobus, N. cyanomos, O. dentex, P. schomburgki, P. arenatus, S. partitus y T. bifasciatum. | 21 832 | 83.35 | 1 915.06 | 18.79 |
| Total | 26 192 | 100 | 10 194.05 | 100 |
Entre los GMF que caracterizan al sustrato del arrecife Palo Seco destacaron: algas césped, esponjas, roca, corales y cianobacterias (Tabla 7). En el análisis de ACC, el eje 1 mostró una relación con la proporción de esponjas y de arena. En cambio, en el eje 2 se detectó un gradiente de la profundidad y las algas césped, que se relacionan negativamente con la cobertura coralina, de algas costrosas y roca (Figura 2b). Los eigenvalores fueron relativamente bajos (Tabla 8), pero se puede detectar una tendencia en la distribución de las especies de peces en función de la profundidad y la cobertura coralina principalmente. De esta forma, en las áreas someras con mayor cobertura coralina, fueron más frecuentes: Microspathodon chrysurus, Abudefduf saxatilis, Elacatinus jarocho, Hypoplectrus puella y Ophioblennius macclurei, entre otros, mientras que en las zonas profundas con mayor cobertura de algas césped, fueron comunes: Serranus subligarius, Chaetodon ocellatus y Pomacanthus paru (Figura 2a, 2b). Los primeros dos ejes del ACC del GMF y abundancia de peces explicaron el 51.86 % de la variación (Tabla 8).
.
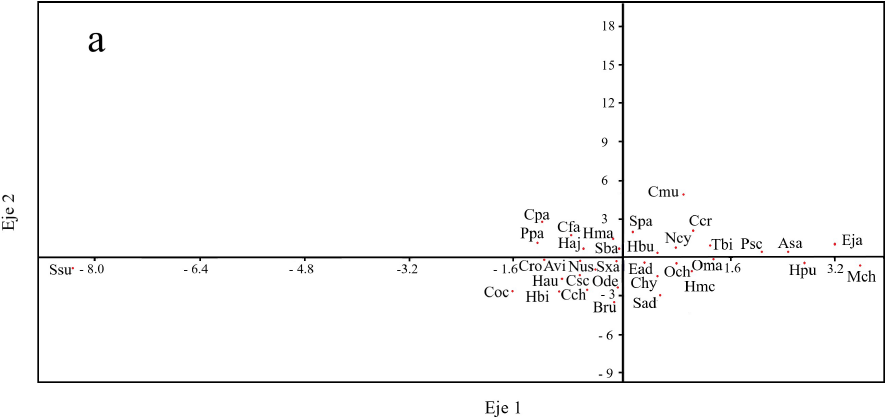
Dma= D. macarellus, Ppa= P. paru, Cpa= C. parrae, Cfa= C. faber, Hma= H. macrostomum , Sba= S. barracuda, Haj= juveniles de Haemulon, Cmu= C. multilineata, Spa= S. partitus, Hbu= H. burekae, Ncy= N. cyanomos, Ccr= C. cruentata, Tbi= T. bifasciatum, Psc= P. schomburgkii, Asa= A. saxatilis, Eja= E. jarocho, Ssu= S. subligarius, Coc= C. ocellatus, Hbi= H. bivittatus, Cch= C. chrysos, Hau= H. aurolineatum, Csc= C. scotti, , Bru= B. rufus, Ode= O. dentex, Cro= C. rostrata, Avi= A. virginicus, Nus= N. usta, Sxa= S. xanthurus, Ead= E. adscensionis, Sad= S. adustus, Och= O. chrysurus, Chy= C. hyalinus, Oma= O. macclurei, Hmc= H. maculipinna, Hpu= H. puella, Mch= M. chrysurus.
Figura 2a Biplot que muestra la distribución las especies ictiofaunísticas más abundantes en el arrecife Palo Seco, Veracruz.
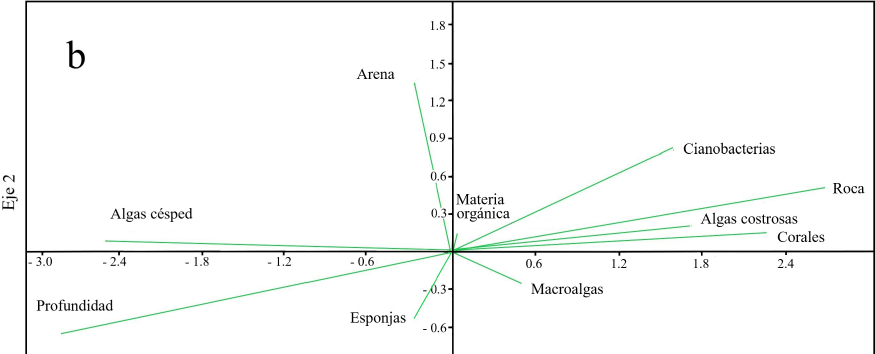
Tabla 8 Eigenvalores y proporción que explican los dos primeros ejes del análisis de correspondencia canónica (ACC), al relacionar los grupos morfofuncionales con la abundancia y con los gremios tróficos de peces en el arrecife Palo Seco, Veracruz, México.
Table 8 Eigenvalues and percentage explained by the two first axis of canonical correspondence analyses (CCA) that related morpho functional groups with abundance and with trophic guilds of fishes at Palo Seco Reef, Veracruz, Mexico.
| ACC: GMF y abundancia de peces | ACC: GMF y gremios tróficos | |||||
|---|---|---|---|---|---|---|
| Eje | Eigenvalores | P | % | Eigenvalores | P | % |
| 1 | 0.135 7 | 0.024 | 30.83 | 0.005 | 0.977 | 48.75 |
| 2 | 0.052 64 | 0.037 | 21.03 | 0.003 | 0.962 | 22.62 |
La relación de los GMF con los gremios tróficos de peces de acuerdo al ACC, no muestra tendencias claras, sin embargo, se observó que los herbívoros se ligan a la presencia de roca y cianobacterias, y los consumidores de invertebrados (con concha y sésiles), se asociaron a las áreas de arena y de mayor cobertura de macroalgas, algas costrosas y algas césped, las cuales visitan para buscar alimento (Figura 3). Los primeros dos ejes del ACC del GMF y gremios tróficos explicaron el 71.37 % de la variación (Tabla 8).
Discusión
La riqueza y abundancia ictiológica en formaciones arrecifales se ha relacionado positivamente con la cobertura coralina (Jones y Sims, 1998; Wilson y col., 2006; Hernández-Landa y col., 2014; Ricart y col., 2016) y la complejidad de las colonias de coral (Álvarez-Filip y col., 2011), entre otros. Sin embargo, en este estudio, los valores de la cobertura de corales (6.48 %), así como la complejidad en el arrecife Palo Seco (0.29) fueron bajos, y por tanto no coincide con la generalización señalada. La riqueza ictiológica observada en Palo Seco es ligeramente menor a la registrada en otros bancos sumergidos de Veracruz, como el Blake (126 especies) (Cortes-Useche y col., 2015; González-Gándara, 2015), y mayor a la observada en los arrecifes: Pantepec y Oro Verde (42 especies) (Cortés-Useche y col. 2015). Las diferencias con los 2 últimos, probablemente se relacionen con el esfuerzo de muestreo. Las estimaciones de la riqueza ictiológica potencial efectuadas con los modelos no paramétricos son adecuadas, dado que explican más del 80 % (Tabla 2), 24 especies correspondieron a observaciones únicas y 11 fueron avistadas en 2 ocasiones. Entre los componentes ictiológicos del arrecife Palo Seco destacan, 3 especies endémicas de Veracruz (E. jarocho, H. atlahua e H. castroaguirrei) y una del golfo de México (H. burekae), así como N. cyanomos (González-Gándara y De-la-Cruz-Francisco, 2014) y P. volitans, originarias del Indo Pacífico.
Las especies de peces más abundantes en Palo Seco coinciden con aquellas registradas por González-Gándara y González-Sansón (1997), para el arrecife Tuxpan, y Pérez-España y col. (2015) para el SAV. Entre las 10 especies más abundantes en Palo Seco, destaca N. cyanomos, lo cual sugiere el establecimiento definitivo de esta especie en la región, hecho que puede influir en la estructura comunitaria, aunque esta aseveración requiere de estudios poblacionales detallados. Uno de los grupos de peces más abundantes corresponde a los territoriales (e. g. Stegastes adustus y Stegastes xanthurus, posiblemente por su capacidad para controlar los niveles de sedimentación en sus territorios, ya que al remover las partículas aseguran el crecimiento de las algas que prefieren (Ceccarelli y col., 2005 y Dromard y col., 2018). La ausencia de Stegastes planifrons en el área estudiada, parece relacionarse con la escasez de refugios, especialmente porque esta damisela se le ha asociado a colonias de los géneros Orbicella o Acropora (Tolimieri, 1998; González-Gándara y Arias-González, 2004, Dromard y col., 2018), los cuales prácticamente no existen en el sistema Palo Seco.
La talla de los peces es determinante en el aporte de las especies a la biomasa en los sistemas arrecifales. La presencia de peces de gran talla (mayor a 20 cm) en el arrecife Palo Seco particularmente de piscívoros (e. g. S. barracuda y M. atlanticus) y carnívoros generalistas (e. g. A. virginicus), incrementó su contribución a la biomasa. Uno de los grupos que menos aportó a la biomasa fue el de los herbívoros, lo cual es atribuido a las condiciones de turbidez que limitan la visión e influye en sus valores de abundancia (Cheal y col., 2013).
El arrecife Palo Seco se caracteriza por una notable turbidez que resulta de su cercanía a la costa (Ajemian y col., 2015), y particularmente del volumen de descarga del río Coatzacoalcos, cuyo promedio anual es de 561.9 m3/s (Salas-Pérez y col., 2015). La turbidez influye en la riqueza y abundancia de peces (Utne-Palm, 2002; Wenger y col., 2015b), especialmente de los herbívoros errantes, debido a que, la concentración de sedimentos suspendidos limita la transparencia del agua (Cheal y col., 2013). Por eso, la abundancia de acantúridos, escáridos y kifósidos en el arrecife Palo Seco, fue muy baja (0.18 %) y contrasta con las observaciones de González-Gándara y González-Sansón (1997) y Pérez-España y col. (2015), efectuadas en arrecifes del norte y centro de Veracruz, donde la turbidez es menor y varias especies de herbívoros errantes son abundantes (e. g. Scarus iseri).
Por otra parte, los ambientes turbios favorecen a los peces planctívoros, porque la turbidez les permite visualizar mejor a la presa (Utne-Palm, 2002). En general, las especies de peces más abundantes (H. burekae, C. hyalinus y juveniles de H. aurolineatum) en Palo Seco fueron zooplanctívoras, lo cual se atribuye a la gran concentración de nutrientes procedentes del río Coatzacoalcos. Por su parte, los carnívoros generalistas (Haemulidae, Lutjanidae) que consumen bentos móvil, como: anélidos, crustáceos y pequeños peces (Randall, 1967) representaron el 1.58 % de la abundancia total. Esta baja proporción sugiere una relación con la estructura de las colonias coralinas, cuya forma aplanada en Palo Seco, reduce la disponibilidad de refugios que requieren los peces, especialmente los piscívoros residentes y los carnívoros genera listas.
El ACC no dejó evidencias claras de la relación de la comunidad de peces y los GMF en el arrecife Palo Seco, dado que los eigenvalores son bajos, y los primeros dos ejes explican únicamente el 51.86 % de la variación. Sin embargo se nota, que algunas especies territoriales, como M. chrysurus y O. macclurei se ligan a las zonas someras, donde la roca, algas costrosas, corales y cianobacterias fueron más abundantes, y otras (e. g. S. subligarius y C. ocellatus) se asociaron a las zonas profundas, con menor cobertura coralina y alta proporción de algas césped. La cobertura coralina (6.48 %) del arrecife Palo Seco, sugiere una limitada penetración de luz, debido a los sedimentos suspendidos (observación personal) y a la profundidad (Wenger y col., 2015b) pero al parecer, no es determinante en la riqueza y abundancia de peces en Palo Seco.
El ACC entre GMF y gremios tróficos provee una limitada descripción de la interrelación, y la mayor parte de las variables ambientales se ligan al eje 1, que refleja la relación de los herbívoros con la presencia de roca y cianobacterias, a pesar de que este grupo trófico fue escaso, posiblemente debido a la disminución de la penetración de luz, característica de los sistemas con alta turbidez (Cheal y col., 2013; Fabricius y col., 2014). Por su parte, los peces que se alimentan de invertebrados con concha y de invertebrados sésiles, se ubicaron en las zonas de arena donde hurgan en el sedimento o bien en las zonas de mayor proporción de vegetación (macroalgas, algas césped), donde se localizan anélidos, moluscos y crustáceos, que utilizan como alimento (Randall, 1967). Los peces piscívoros no muestran relación clara con el ambiente, porque la mayor parte de ellos son transeúntes de la columna de agua (M. atlanticus y S. barracuda), y sugiere una mayor adaptación de estos a las condiciones de turbidez para detectar a sus presas (Huber y Rylander, 1992).
Conclusiones
El parecido general de los ensambles ictiológicos del arrecife Palo Seco con otros sistemas arrecifales veracruzanos sugiere la existencia de una conectividad temporal. Las diferencias puntuales resaltan de las condiciones ambientales locales definidas por la profundidad y los grupos morfofuncionales del sustrato. La riqueza y abundancia de los ensambles de peces en los bancos sumergidos, representan una oportunidad para generar áreas de reserva ecológica, por lo que, el arrecife Palo Seco debe ser incluido en la propuesta de Área de Protección de Flora y Fauna Arrecifes de Los Tuxtlas, especialmente porque representa una buena parte de la riqueza biológica característica de los arrecifes veracruzanos e incluye especies endémicas.











 nueva página del texto (beta)
nueva página del texto (beta)




