INTRODUCCIÓN
Los biopolímeros más comúnmente utilizados, en la preparación de películas y recubrimientos comestibles, son polisacáridos (almidón, pectina, celulosa, alginato y carragenano), proteínas (gelatina, caseína, gluten de trigo y zeína) y lípidos (ácido esteárico, ceras y grasas, ésteres de ácidos grasos), los cuales, pueden emplearse individualmente o en combinación (Bravin y col., 2004; Chiumarelli y Hubinger, 2014; Oleyaei y col., 2016), o incluso con diferentes aditivos plastificantes, como el glicerol o el sorbitol, que dan la flexibilidad adecuada a la película, disminuyendo su fragilidad y mejorando las propiedades mecánicas de los hidrocoloides, debido a su naturaleza hidrofílica (Chiralt y col., 2016). Las películas y los recubrimientos comestibles, basados en polisacáridos, son actualmente una alternativa para el empacado de alimentos, por su biodegradabilidad y bajo costo de producción, sin embargo, su naturaleza higroscópica y su inestabilidad física son limitantes importantes (Sorrentino y col., 2007; Rafieian y col., 2014).
Las principales propiedades funcionales de los materiales hidrofílicos dependen de su contenido de agua (Slavutsky y Bertuchi, 2012; 2015). El estudio de las propiedades de barrera al vapor de agua genera información sobre la interacción entre las películas comestibles y la humedad durante el procesamiento y el almacenamiento (Bertuzzi y col., 2007; Chinma y col., 2015). Para mejorar las propiedades de los bioplásticos, incluida la permeabilidad al vapor de agua y las propiedades mecánicas, se han desarrollado diversos métodos para reforzar los biopolímeros, mediante la incorporación de nanopartículas o la fabricación de materiales nanoestructurados, derivados de estos biopolímeros, sin interferir con la biodegradabilidad y biocompatibilidad de dichos compuestos (Avella y col., 2005). Por lo tanto, la aplicación de la nanotecnología en la industria alimentaria, específicamente en el envasado de productos alimenticios, es un área prometedora de innovación y desarrollo de nuevos productos (Silvestre y col., 2011; Oleyaei y col., 2016). Los nanomateriales tienen superficies de contacto más grandes, lo que favorece las interacciones con la matriz del polímero (Bradley y col., 2011). El comportamiento del agua en espacios a nanoescala difiere del agua a nivel macroscópico (Pascual y col., 2014; Youssef, 2016).
El objetivo del presente trabajo fue desarrollar una película comestible, utilizando almidón nanoestructurado, que pueda ser utilizado como empaque resistente a la humedad y que extienda la vida útil de los alimentos, con los beneficios ambientales adicionales.
MATERIALES Y MÉTODOS
Materiales
Se compraron 10 kg de maíz blanco (Zea maysL.) en el mercado local de la ciudad de Xalapa, Veracruz, México. El nitrógeno líquido se obtuvo de GENEXA S.A. de C.V. (Xalapa, Veracruz, México).
Métodos
Extracción y aislamiento de almidón. Primero se lavó el maíz; después, se extrajo el almidón por molienda húmeda (Ji y col., 2004). La suspensión blanca obtenida se dejó reposar en refrigeración durante 12 h y se decantó para separar la fase sólida (almidón) de la líquida. El almidón aislado se secó en una estufa (Novatech®, Mod.EI35-AIA, Tlaquepaque, Jalisco, México) con recirculación de aire a una temperatura de 45 °C durante 48 h. Posteriormente, se molió el almidón con un mortero marca Isolab (Isolab Laborgerate GmbH, Wertheim, Alemania), y se tamizó con malla 80 U.S. (0.177 mm) para lograr un tamaño de partícula uniforme, similar a los almidones comerciales. Se separó parte del almidón obtenido y para almacenarlo se envasó al vacío utilizando un sistema Food Viver Mod V2240 (Oster® Boca Raton, Florida, EU).
Nanoestructuración del almidón
El almidón aislado se modificó físicamente a escala nanométrica, para ello, se empleó un proceso criogénico reportado previamente por Acosta y col. (2016)). Se congeló el almidón con nitrógeno líquido. Después, se utilizó un liofilizador (Labconco®Mod FreeZone 2.5, Kansas City, MO, EU) a 0.1 mBar y - 50 ºC durante 2 d. El almidón de maíz nanoestructurado obtenido también fue envasado al vacío hasta su uso.
Formulación de las películas comestibles
Se elaboraron 9 formulaciones diferentes con almidón nativo (películas sin nanoestructurar: PSN) y almidón nanoestructurado (películas nanoestructuradas: PN) (Tabla 1), 3 %, 4 % y 5 % de almidón se disolvieron en 75 mL de agua; se agitaron durante 10 min (25 ± 1 °C) y posteriormente se calentaron a 85 °C durante 20 min mediante una parrilla de calentamiento (Scientific Scorpion®, Mod. A50020, México DF, México). Después, se añadieron 6 %, 10 % y 12 % de glicerol para cada porcentaje de almidón, agitando las diferentes suspensiones durante 10 min y aforando a un volumen de 100 mL cada una. Finalmente, se tomaron 13 mL de cada suspensión y se vertieron en placas de polietileno (8.1 cm φ), para su posterior secado a 45 °C en una estufa de temperatura controlada (Novatech®, Mod. EI35-AIA, Tlaquepaque, Jalisco, México).
Humedad de la película
El método utilizado para determinar la cantidad de agua presente en las películas se basó en gravimetría indirecta por desecación. El peso seco inicial se obtuvo después de colocar, al vacío, muestras de película, en desecadores con pentóxido de fósforo, durante 3 semanas, hasta obtener peso constante (Bertuzzi y col., 2007). La humedad fue calculada por diferencia de pesos.
Espesor de la película
El espesor fue medido con un micrómetro digital (Mitutoyo®, Mod. 293-721, Wilmington, NC, USA). El espesor de cada película en µm, fue calculado como el promedio de 10 mediciones tomadas en diferentes puntos de estas.
Solubilidad de la película en agua
Las películas se colocaron en 50 mL de agua destilada y se mantuvieron bajo agitación constante durante 2 h a temperatura ambiente (25 ± 1 °C) usando una parrilla (Scientific Scorpion®, Mod. A50020, México D.F., México). Los restos no solubilizados se separaron mediante una centrífuga (Hettich®, Mod. Mikro 220R, Tuttlingen Freiburg, Alemania) a 3 000 rpm durante 10 min, y se secaron. El peso seco final se calculó por diferencia, con respecto al peso seco inicial, determinados por gravimetría, a peso constante, en desecadores con pentóxido de fósforo.
Cinética de adsorción de vapor de agua
La cinética de adsorción de vapor de agua se realizó a 25 °C para PN y PSN, con 3 % de almidón, a los diferentes porcentajes de glicerol 6 %, 10 % y 12 %. Las muestras de cada película se almacenaron en desecador con pentóxido de fósforo (P2O5) por una semana. Posteriormente, las muestras secas de las diferentes películas se colocaron a 100 % de humedad relativa (HR) dentro de celdas de vidrio selladas, y los cambios de peso se determinaron cada 10 min en una balanza analítica (ADAM®, Mod. PW124, MK Buckinghamshire, England) hasta que no se observaron cambios, en tres medidas consecutivas (Acosta y col., 2016).
Análisis de los mecanismos de transferencia de vapor de agua
La ecuación 1 se empleó para analizar los mecanismos de transferencia de vapor de agua:
Donde: Mt es humedad al tiempo t.
M∞ es la humedad en el equilibrio, k es una constante que incorpora las características del sistema de red macromolecular y la penetración.
t es tiempo, n es un exponente difusional (Peppas y Sinclair, 1983; Brannon-Peppas y Peppas, 1989).
Cálculo de coeficientes de difusión Las curvas de adsorción de vapor de agua se ajustaron, según la ecuación 2 de difusión de Fick (Crank, 1975) y se calcularon los coeficientes de vapor de agua en la película:
Donde: Mt es la humedad al tiempo t.
M∞ es la humedad en el equilibrio.
t es el tiempo, l0 es el espesor promedio de la película.
Dw es el coeficiente de difusión
Determinación de la permeabilidad al vapor de agua
Se colocaron muestras circulares de películas durante 7 d en recipientes con 53.6 %, 76.5 % y 84.6 % HR a 25 ºC. Los cambios en las celdas de permeación fueron registrados diariamente por diferencia de peso, mediante una balanza analítica (ADAM®, Mod. PW124, MK Buckinghamshire, Inglaterra). La velocidad en la transmisión del vapor de agua (VTVA) fue calculada usando la pendiente de la regresión lineal de pérdida de peso contra el tiempo (ASTM, E96, 2000). La permeabilidad al vapor de agua (PVAm) fue calculada de acuerdo con la ecuación 3:
Donde:
VTVA es la velocidad de transmisión del vapor de agua en la película.
L es el espesor de la película.
pw1 es la presión parcial de vapor de agua dentro del recipiente.
pw2 es la presión parcial de la solución saturada de sal dentro de la celda de permeación.
Los valores ajustados de la permeabilidad al vapor de agua (PVAc) (Gennadios y col., 1994) fueron obtenidos de acuerdo con la siguiente ecuación:
Donde:
VTVA es la velocidad de transmisión del vapor de agua en la película.
L es el espesor de la película.
ΔPr es la diferencia de la presión parcial real del vapor de agua en ambos lados de la película. El porcentaje de error fue calculado por diferencia con PVAc.
Microscopia electrónica de barrido (MEB)
La microestructura, morfología superficial, distribución del plastificante y el grosor de la película fueron analizados con un microscopio electrónico de barrido de emisión de campo de alto vacío (JEOL JSM-7600F, Massachusetts, USA). Las muestras fueron cortadas en cuadrados de 0.5 cm x 0.5 cm, y colocadas por separado en portamuestras, de manera horizontal y vertical, para su observación morfológica a diversas amplificaciones, considerando 1.5 kV, WD = 8.4 mm y barra = 100µ.
Espectroscopia óptica
Se utilizó la espectroscopia infrarroja por transformada de Fourier (FTIR, por sus siglas en inglés: Fourier Transform Infrared) para obtener los espectros de las películas nativas y nanoestructuradas, en el intervalo espectral de 400 cm a 4 000 cm.
Diseño experimental
Para establecer la mejor formulación, tanto en el tratamiento control (PSN) y el tratamiento nanoestructurado (PN), se utilizó un diseño factorial 32, teniendo dos factores: concentración de almidón y concentración de glicerol; ambos con tres niveles cada uno, 3 %, 4 % y 5 %; y 6 %, 10 % y 12 %, respectivamente. Los experimentos fueron llevados a cabo por triplicado, para un total de 54 muestras.
Análisis estadístico
El efecto de la concentración del almidón y del plastificante en la matriz estructural de las PN y PSN fue determinado mediante análisis de varianza factorial (ANOVA) (P ≤ 0.05) para las variables de respuesta espesor y solubilidad. La comparación de medias se llevó a cabo mediante la prueba de Tukey. Se utilizó el paquete estadístico Minitab 16 para realizar el análisis de los datos.
RESULTADOS Y DISCUSIÓN
Fragilidad y flexibilidad de la película
Las películas con 3 % de almidón nanoestructurado (PN) (Figura 1a) fueron más translúcidas, con mejor flexibilidad y menos frágiles, que las películas con 3 % de almidón sin nanoestructurar (PSN) (Figura 1b), ambas contenían 6 % de glicerol, además de que las PN se desprendieron fácilmente de las placas donde se formaron. Películas formuladas por Chiumrelli y col. (2010), utilizando almidón de yuca como material base, también fueron translúcidas, así como las elaboradas con nanocristales de almidón de maíz y proteína de amaranto por Condés y col. (2015). Aún cuando no se realizaron fuerzas de tensión, mediante equipos especiales, Chiumarelli y Hubinger (2012) determinaron que el uso de glicerol mejora la flexibilidad de las películas, a diferencia de otros plastificantes, como la cera de carnauba y el ácido esteárico, lo que evita a su vez que las películas se vuelvan quebradizas.

Humedad de la película
La humedad en base seca para PN fue de 11.46 % y para PSN 21.8 %. Con estos resultados, y en términos de “agua libre”, es decir, agua que se libera con facilidad por evaporación o secado; PSN presenta un porcentaje mayor en comparación con PN. Ambas películas fueron formuladas y obtenidas con las mismas condiciones, modificando únicamente el tipo de almidón utilizado; por lo tanto, tendría que haber presentado el mismo porcentaje de humedad. El uso del almidón nanoestructurado en las películas podría inducir a una distribución más homogénea de las moléculas de agua, así como de una menor movilidad de las mismas. Acosta y col. (2016), reportaron que los materiales nanoestructurados incrementan la firmeza, la energía de superficie y las fuerzas capilares de una matriz sólida.
Espesor de la película
El espesor de las PN fue estadísticamente diferente al de las PSN (P≤0.05) (Figura 2), mientras las PN tuvieron espesores entre 40 µm y 45 µm, todos los espesores de las PSN rebasaron las 50µm. La concentración de almidón, presente en las diferentes películas, también afectó el espesor de las mismas (P≤0.05), cuando la concentración del almidón aumentó, el espesor también. Estos resultados coinciden con las características de otros nanomateriales, los cuales forman superficies delgadas, como de papel (Cao, 2004). La concentración del plastificante no afectó este parámetro (P > 0.05). Gutiérrez y col. (2015) y Slavutsky y Bertuzzi (2014), formularon películas con almidones modificados de yuca y cush-cush y nanocristales de bagazo de caña; obtuvieron espesores mayores: 120µm±20µm
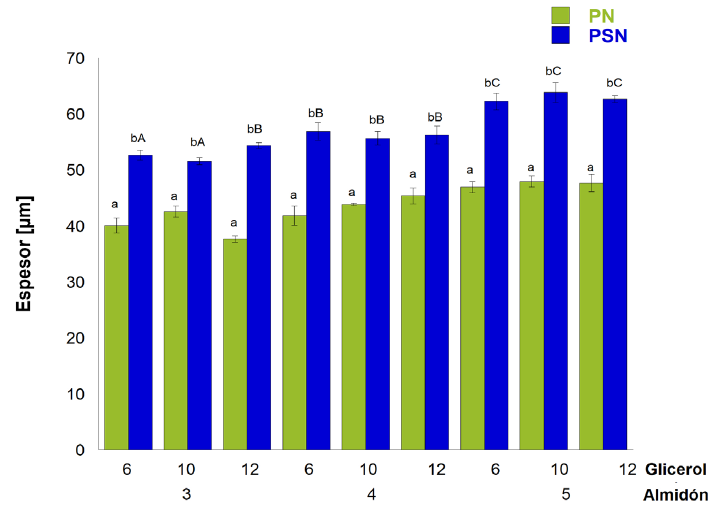
Figura 2 Espesor de películas con almidón nanoestructurado (PN) y sin nanoestructurar (PSN). Los datos son expresados como media ± desviación estándar. ABLetras diferentes mayúsculas indican diferencias entre los porcentajes de almidón.
Figure 2 Thickness of nanostructured films (NF) and non-nanostructured films (NNF). The dates are expressed as mean ± standard deviation. abDifferent lower-case letters show significant differences between NF and NNF. ABDifferent capital letters show differences between the percentages of cornstarch.
El espesor es una característica muy importante de las películas, debido a que afecta las propiedades de barrera, tales como la permeabilidad al vapor de agua (PVA), además de la permeabilidad de otros gases.
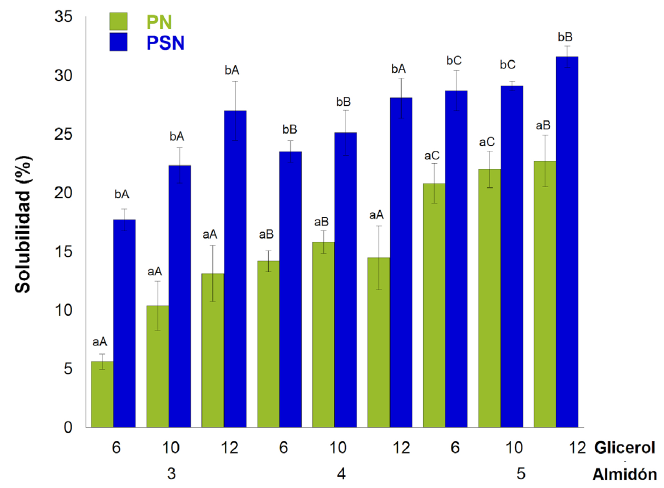
Solubilidad en agua
El porcentaje de solubilidad de las películas en agua (Figura 3) a 25 ºC, bajo condiciones dinámicas, fue estadísticamente significativo (P ≤ 0.05). Las PSN presentaron porcentajes más altos de solubilidad que las PN (P ≤ 0.05). Al llevar a cabo el análisis de medias, se determinó que las películas nanoestructuradas con 3 % de almidón, a los diferentes porcentajes de glicerol, eran significativamente mejores que las demás, por lo que esto se tomócomo referencia para llevar a cabo las siguientes determinaciones. El almidón de PSN fue más fácil de solubilizar que el de las PN; por lo que esta última película sería más resistente a condiciones extremas de humedad. Es importante medir la solubilidad en agua, ya que esto permite determinar la resistencia que tienen las películas al estar expuestas a humedades altas (Bertuzzi y col., 2007).
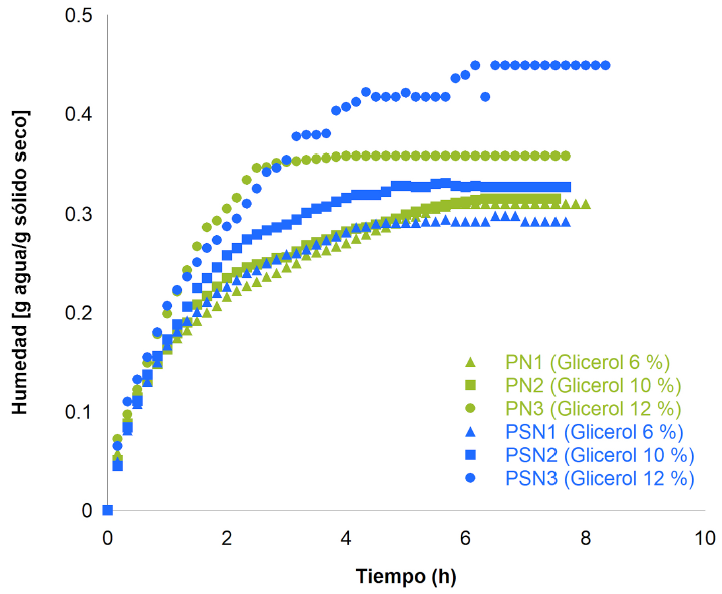
Cinética de adsorción de vapor de agua
Para PN hubo tendencias prácticamente iguales con los dos primeros porcentajes de glicerol, no así para la de 12 % (v/w) (Figura 4), ya que hubo un incremento importante en la adsorción del vapor de agua desde la primera hora. Por el contrario, en las PSN se observó un aumento en la adsorción de agua, misma que conforme entra a la red estructural genera un incremento en el movimiento de las cadenas del biopolímero, induciendo cambios en el hinchamiento de la estructura, la formación de microcavidades y la reorganización de la estructura, así como de los segmentos de la misma. También se observó que, al aumentar la concentración de glicerol, se incrementó la adsorción de la película, volviéndola más higroscópica; principalmente, por la naturaleza del glicerol y la porosidad del almidón. Esta propiedad condiciona el comportamiento de algunos materiales, facilitando principalmente su disolución. Esto coincide con los resultados encontrados en la solubilidad de las películas, ya que las PSN fueron más higroscópicas.
Análisis de los mecanismos de la transferencia de vapor de agua
La difusión es un proceso de transporte de masa, resultante de movimientos moleculares aleatorios. En polímeros amorfos, se considera un parámetro importante, porque pequeñas moléculas, como el agua, pueden penetrar la matriz estructural del material polimérico, y en consecuencia, introducir cambios o transiciones físicas en el material. En polímeros gomosos, la difusión del penetrante es generalmente Fickiana, y en polímeros vítreos, la difusión de la molécula penetrante es mucho más compleja (Piringer y Baner, 2008). En este trabajo, como se puede observar (Figura 5), se presenta la relación con ln (Mt/M∞) contra ln (t) de acuerdo a una ecuación semiempírica (Brannon-Peppas y Peppas, 1989), donde hubo un área de difusión anómala, determinada para grados de hidratación inferiores a 0.216 g de agua/g en seco para PN, con valores entre 0.5 y 1.0, posteriormente, la hidratación aumentó hacia un mecanismo de difusión Fickiano, con un valor de n = 0.5, causando una transición en el material, volviéndolo suave y plástico. Las PSN tuvieron un área más amplia de difusión anómala, a estados bajo hidratación de 0.286 g de agua/g en base seca. Por arriba de este estado de hidratación, se observó un mecanismo de difusión Fickiano (n = 0.5). Las desviaciones del comportamiento de Fick se atribuyen a la velocidad a la que la estructura del biopolímero se reorganizó, debido a la entrada de moléculas de agua. En el caso de esta investigación, los principales reordenamientos estructurales se observaron a humedades bajas, cuando las moléculas de vapor de agua comenzaron a penetrar en la matriz estructural de las películas.
Cálculos de los coeficientes de difusión
En PN, los valores calculados para los coeficientes de difusión fueron significativamente diferentes a los obtenidos para PSN (P ≤ 0.05) (Tabla 2), estas probablemente presentaron zonas de difusión con difusividad menor, pero cuando la concentración del glicerol aumentó (6 %, 10 % y 12 %), el coeficiente también aumentó (P ≤ 0.05). Las zonas de difusión Fickianas para las PN fueron más estrechas (Figura 5), en cambio los coeficientes de difusión fueron más altos, con respecto a las PSN, debido a su afinidad por el agua y a la adsorción “desordenada” de las PSN. El comportamiento observado en estas películas fue el esperado, debido a las propiedades hidrofílicas (Figura 4), donde la PSN 3 (con almidón nativo) tuvo una mayor adsorción de agua, aún cuando la formulación tenía el contenido de glicerol más alto; respecto a las PN, la adsorción fue muy parecida para PN1 y PN2, a pesar de la concentración de glicerol aumentó del 6 % al 10 %. Con base en los resultados anteriores, se eligió la primer formulación de las PN como la mejor, ya que tuvo el menor espesor y porcentaje de solubilidad en agua, así como un coeficiente de difusión bajo, estos dos últimos parámetros son las propiedades más críticas de un material de embalaje.
Permeabilidad al vapor de agua (PVA)
Los polisacáridos y proteínas son conocidos por su capacidad de formación de películas y pueden actuar como transportadores efectivos de gases (O2 y CO2) o barreras, exhibiendo alta PVA (Bertuzzi y col., 2007). Este es el caso de polisacáridos como el almidón, que debido a su naturaleza hidrofílica, cuando interactúa con el agua, sus propiedades mecánicas y de barrera se ven afectadas. Las interacciones generalmente tienen un efecto plastificante, que causa un aumento en la permeabilidad. Los valores de PVA y VTVA de las películas PN y PSN (Tabla 3), se utilizaron para obtener la permeabilidad al vapor de agua medida y corregida (PVAm y PVAc), ya que algunos autores han considerado el efecto que tiene la resistencia del aire en la difusión del vapor de agua, a través de películas o revestimientos con matrices hidrofílicas, especialmente cuando se usan sistemas estáticos (Gennadios y col., 1994). Los resultados obtenidos mostraron diferentes valores de PVAm para ambas películas, estos cambios presentados en la permeabilidad se debieron a la adsorción y desorción de las películas generadas por el gradiente de presión en la celda de permeación y la aw a la cual fue equilibrada la película. En cuanto a PVAc no se observó una tendencia, este comportamiento se presentó probablemente por diferencias en el espesor de las películas, relacionado con la adsorción del agua. La PVA es una combinación de solubilidad en agua en la película y la difusividad de las moléculas de agua en la matriz de almidón, ambos coeficientes fenomenológicos dependen de la concentración de humedad en la matriz del polímero. En el presente trabajo, la matriz de almidón fue plastificada cada vez más por las moléculas de agua adsorbidas, lo que resultó en una PVA mayor (Cheviron y col., 2015).
Tabla 3 Permeabilidad al vapor de agua (PVA) y velocidad de transmisión de vapor de agua (VTVA) de las PN y PSN formuladas con 3% de almidón y 6% y 10% de glicerol.
Table 3 Water vapor permeability (WVP) and water vapor transmission rate (WVTR) of NF and NNF formulated with 3 % of starch and 6 % and 10 % of glycerol.
| awext-awint | Δaw | VTVA (g/día m2) | PVAm (g/ms Pa) | PVAc (g/ms Pa) | Error (%) |
|---|---|---|---|---|---|
| PN | |||||
| 0.536 a 1.000 | 0.464 | 519.78 | 1.624 E-10 | 8.8692 E-10 | 81.7 |
| 0.765 a 1.000 | 0.235 | 424.41 | 1.624 E-10 | 8.4148 E-10 | 68.9 |
| 0.846 a 1.000 | 0.154 | 197.01 | 1.855 E-10 | 2.5727 E-09 | 92.8 |
| PSN | |||||
| 0.536 a 1.000 | 0.464 | 556.01 | 2.252 E-10 | 5.831 E-10 | 61.4 |
| 0.765 a 1.000 | 0.235 | 271.22 | 2.169 E-10 | 1.341 E-09 | 83.8 |
| 0.846 a 1.000 | 0.154 | 248.62 | 3.033 E-10 | 1.712 E-09 | 82.3 |
awext = Actividad de agua exterior; awint = actividad de agua interior; Δaw = gradiente de actividad de agua; PVAm= Medida de la permeabilidad al vapor de agua; PVAc= Permeabilidad al vapor de agua corregida.
Microscopia electrónica de barrido
Se observaron superficies homogéneas en los cortes horizontales de las micrografías de las PN con 3 % de almidón y 6 % de glicerol (Figura 6a), no así en las de PSN, con 3 % de almidón y 6 % de glicerol, las cuales, presentaron micropartículas de material plastificante, mediante los cortes verticales (Figura 6b); se determinó el espesor de las películas observando que los promedios fueron 39.7 ± 0.7 µm y 51.4 ± 2.1 µm, respectivamente, los cuales coincidieron con los presentados en la Figura 2. También se puede observar en esta figura, que el espesor en las PSN no fue homogéneo.
Espectroscopia óptica
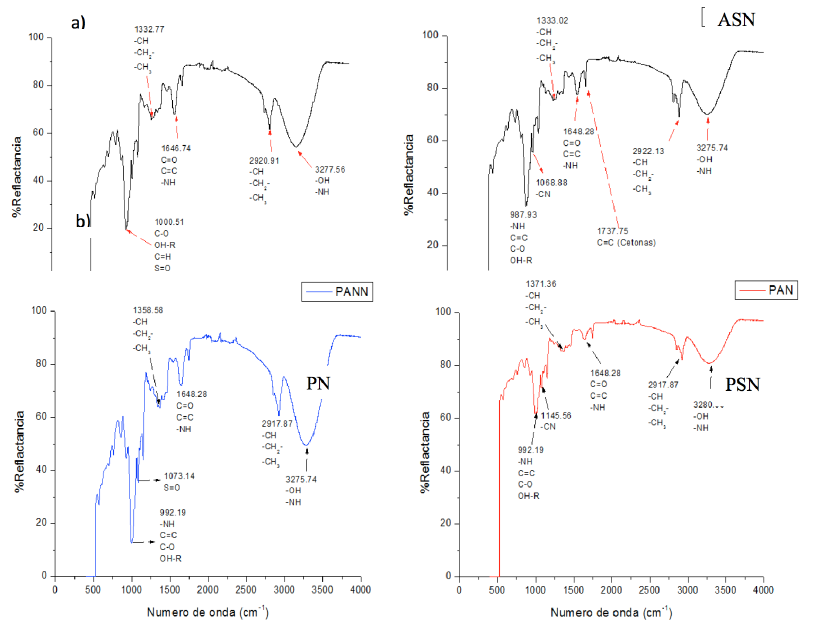
Al realizar la nanoestructuración, no se afectó la composición química del almidón por el proceso criogénico, ambos almidones presentaron los mismos grupos funcionales (Figura 7a). En cuanto a las películas (Figura 7b), se observaron cambios en la intensidad de las bandas; por ejemplo, el punto 3 275 cm, característico de los grupos hidroxilos (OH-), se puede ver que el valor de reflactancia fue mayor para la PSN que para PN, por lo que se podría relacionar una mayor presencia de agua en la PSN, para una misma unidad de volumen en la PN, toda vez que, las bandas vibracionales cambian dependiendo de la concentración. Este supuesto se basa en las características de nanoestructuras y nanomateriales, ya que poseen una gran fracción de átomos de superficie por unidad de volumen (Cao, 2004).
CONCLUSIONES
El tipo de almidón fue el factor con mayor influencia significativa, para el espesor y solubilidad en agua. Las películas formuladas con nanoestructurado presentaron menor grosor y menor solubilidad. La concentración de glicerol afectó la velocidad de difusión del vapor de agua en las películas, sin embargo, tal afectación fue más visible en las películas de almidón sin nanoestructurar, que en las nanoestructuradas. La permeabilidad al vapor de agua dependió de la humedad relativa del medio, así como de las características de la película, esta variable aumentó a medida que aumentó la humedad relativa del ambiente. La menor permeabilidad de las PN y PSN se obtuvo bajo condiciones de prueba de humedades relativas de 76.5 % a 100 % y 53.6 % a 100 %, respectivamente. El proceso criogénico de nanoestructuración para la matriz de la película utilizado en este estudio, posiblemente creó nanocavidades con mayor contenido de humedad; lo cual pudo ser evidenciado al presentar una mayor absorción del espectro infrarrojo.











 nueva página del texto (beta)
nueva página del texto (beta)