INTRODUCCIÓN
Los protocolos de sincronización del estro, en la oveja, se han basado principalmente en imitar la fase lútea del ciclo estral, a través de dispositivos o esponjas impregnadas con progestágenos, tales como acetato de medroxiprogesterona (MAP, por sus siglas en inglés: Medroxiprogesterone acetate), acetato de melengestrol (MGA, por sus siglas en inglés: Melengestrol acetate) y acetato de fluorogestona (FGA, por sus siglas en inglés: fluorogestone acetate) (Abecia y col., 2012); no obstante, existe una tendencia a reducir el empleo de progestágenos, debido a los riesgos de contaminar el medio ambiente y los tejidos que se encuentran en contacto con residuos propios de los progestágenos utilizados, además de antibióticos usados para evitar vaginitis en la oveja (Manes y col., 2016), implicando un cambio en el método tradicional del control de la reproducción en los pequeños rumiantes (Delgadillo y Martin, 2015). En respuesta a lo anterior, algunos investigadores han disminuido el tiempo de exposición de los progestágenos, obteniendo protocolos de sincronización de corta duración, con resultados aceptables en la inducción y la sincronización de estros en ovejas durante las temporada reproductiva y no reproductiva (Fleisch y col., 2012; Martinez y col., 2015). Sin embargo, existe la tendencia de usar solamente prostaglandinas F2α(PGF2α), porque son rápidamente metabolizadas en pulmón y, por lo tanto, no se acumulan en los tejidos (Abecia y col., 2012), además de tener ventajas prácticas, como fácil aplicación, costo reducido y menor contaminación, comparada con dispositivos intravaginales impregnados con progestágenos (Fierro y col., 2013). Cabe mencionar que las PGF2α, al ser utilizadas de manera individual, en una sola dosis, no proveen una sincronía aceptable de estro en las ovejas (Fierro y col., 2017), por lo que una alternativa para mejorar el nivel de sincronía de estro y fertilidad, provista por PGF2αes, asociarla al uso de la hormona liberadora de gonadotropina (GnRH, por sus siglas en inglés: Gonadotropin-releasing hormone), aplicándola al inicio del tratamiento para eliminar folículos grandes por ovulación o atresia, e induciendo la emergencia de una nueva onda folicular en los siguientes 3 d o 4 d después de su administración. Se ha documentado que GnRH puede ser empleada para controlar la función folicular y lútea, así como incrementar la precisión del estro y sincronización de la ovulación en ovejas durante la época reproductiva (Hashem y col., 2015). La asociación de GnRH y PGF2αse ha evaluado como alternativa a tratamientos basados con progestágenos, obteniéndose resultados prometedores de fertilidad en la época reproductiva (Rekik y col., 2016), pero no en la época no reproductiva (Almadaly y col., 2016), observándose para este último, que el protocolo de sincronización con dos aplicaciones de PGF2α, a intervalo de 9 días, y la administración de gonadotropina coriónica equina en la segunda aplicación de PGF2α, logró mejorar la tasa de preñez (100 %) pero la respuesta a estro fue baja (30 %).
La GnRH es utilizada para inducir la ovulación o bien la luteinización de un folículo (Rekik y col., 2016), sin embargo, si se aplica en un programa de sincronización antes de la inserción de progestágenos, puede influir en el reclutamiento de folículos, iniciando una nueva oleada folicular e indirectamente influir en la función del cuerpo lúteo (Karaca y col., 2009), lo cual podría a su vez contribuir en la fertilidad. Investigaciones recientes en ovejas (Bartlewski y col., 2017) y vacasBos indicus(Simões y col., 2018), registraron que la aplicación exógena de progesterona durante la fase lútea del ciclo estral, incrementó la tasa de crecimiento de los folículos antrales grandes, y redujo el número y porcentaje de folículos ovulatorios emergentes en la penúltima oleada del ciclo estral estudiado, aunque también disminuyó la tasa de ovulación. Resulta interesante que incrementara la tasa de crecimiento de algunos folículos, lo cual, puede contribuir a que al momento de la ovulación se tenga un folículo lo suficientemente grande para generar un subsecuente cuerpo lúteo, que pueda producir concentraciones altas de progesterona, lo que puede ser benéfico para mejorar la fertilidad en ovejas.
El objetivo del presente trabajo fue evaluar, durante la época reproductiva, el efecto de administrar una dosis de GnRH a la mitad del intervalo de aplicación de dos dosis de PGF2αsobre el pico pre-ovulatorio de hormona luteinizante (LH), las concentraciones progesterona post-estro, la tasa de preñez, la fertilidad y la prolificidad en ovejas de pelo, además de comparar la eficiencia reproductiva de ovejas sincronizadas con PGF2α+ GnRH versus progestágeno + PGF2α.
MATERIALES Y MÉTODOS
Localización del área de estudio
El experimento se realizó en una granja de ovinos ubicada en el municipio de Autlán de Navarro, Jalisco, México (19º48’ N, 104º24’ W y 1 013 msnm), donde el clima es templado seco, con lluvias en verano (García, 2004). El estudio se llevó a cabo durante la época reproductiva (septiembre a octubre). Todos los animales fueron manejados con base en los lineamientos indicados en las siguientes Normas Oficiales Mexicanas: NOM-062-ZOO-1999 (especificaciones técnicas para la producción, cuidado y uso de los animales de laboratorio) y NOM-051-ZOO-1995 (especificaciones del trato humanitario en la movilización de animales).
Animales experimentales y tratamientos
Se utilizaron 30 ovejas hembras adultas multíparas (cruzas de las razas Katahdin y Pelibuey), con un peso promedio de 45 ± 3.1 kg, una condición corporal de 3.2 ± 0.5 unidades (escala 1 a 5) (Russel y col., 1969) y 60 d a 90 d postparto, considerándose aptas para los protocolos de sincronización (Ungerfeld y SanchezDavila, 2012). Las ovejas se encontraban separadas de los machos, sin embargo, se realizó la confirmación de que estuvieran en una condición fisiológica de “no gestantes”, a través de ultrasonografía de tiempo real, usando un equipo de ultrasonido (Medison®, modelo Sonovet 2000, Seúl, Korea) equipado con el transductor lineal rectal de 7.5 MHz (Medison®, modelo Sonovet 2000, Seúl, Korea). Las ovejas fueron asignadas al azar a uno de tres tratamientos (n = 10), después de haber sido presincronizadas con PGF2α(cloprostenol sódico, Celosil®, MSD, salud animal, New Jersey, USA) (Figura 1).
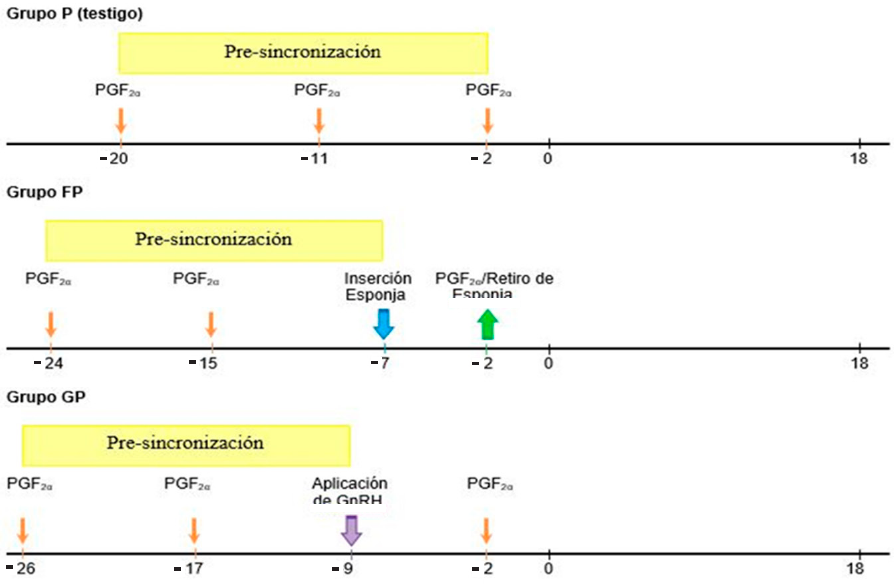
Grupo P (Testigo): Las ovejas de este grupo recibieron la primera dosis de 125 μg de cloprostenol sódico en el día - 20, (día 0, presentación del estro), la segunda dosis se aplicó el día -11, correspondiendo estas dos aplicaciones al periodo de pre-sincronización, la última aplicación de cloplostenol sódico se realizó en el día - 2.
Grupo FP: Las ovejas de este grupo recibieron la primera dosis de 125 μg de cloplostenol en el día - 24, y la segunda el día - 15, correspondiente al periodo de pre-sincronización, en el día - 7, cada oveja fue tratada con una esponja intravaginal impregnada de 20 mg de acetato de fluorgestona (FGA; Chronogest® CR; MSD Salud Animal, New Jersey, Estados Unidos) por un periodo de 5 d (- 7 d al - 2 d), y al término, se aplicó una dosis de 125 μg de cloprostenol sódico por vía IM.
Grupo GP: La ovejas de este grupo recibieron la primera dosis de 125 μg cloprostenol sódico el día - 26, y una segunda aplicación el día - 17, comprendiendo estas dos aplicaciones el periodo de pre-sincronización, en el día - 9 las ovejas fueron inyectadas, vía IM, con 50 μg de gonadorelina, un análogo sintético de GnRH (Fertagyl®; MSD salud animal, New Jersey, Estados Unidos); y en el día - 2 se administraron 125 μg de cloprostenol sódico por vía IM.
Alojamiento y alimentación
Las ovejas estuvieron en condiciones de estabulación con un espacio de 1.0 m2 por animal, techo de lámina de 10 m x 8 m y un espacio abierto de 10 m x 20 m con paredes de malla, alimentadas con 1.0 kg/d de alimento comercial por oveja, conteniendo 90 % de materia seca (DM, por sus siglas en inglés: dry matter), 2.40 Mcal/kg de energía metabolizable y 16 % de proteína cruda, más rastrojo de maízad libitum; el alimento se ofreció en dos comederos de metal de 80 cm de ancho y 4 m de largo, con acceso libre al agua en bebedero de cemento de 60 cm de ancho, 2 m de largo y 40 cm de hondo.
Observación de la presentación y duración del estro
El comportamiento del estro de las ovejas fue monitoreado a partir de las 24 h después de la aplicación de la última dosis de PGF2α, correspondiente al programa de sincronización del estro. Las observaciones fueron realizadas por 30 min, a intervalos de 4 h durante 4 d. Se utilizó un macho con mandil (para evitar la preñez) para detectar las ovejas en estro. Las ovejas detectadas en estro fueron servidas por el semental, repitiéndose la monta 12 h después (Molina-Mendoza y col., 2005). Se trabajó con 6 machos adultos de una edad de 4 ± 0.2 años, de la raza pelibuey, a los cuales, se les realizaron pruebas para determinar su viabilidad espermática. Los resultados fueron: volumen 1.0 ± 0.2 mL, motilidad 85.0 ± 5.0 %, concentración espermática 1.7 ± 0.1x 109 /mL y espermatozoides vivos 60.0 ± 4.0 %. Se asignaron dos sementales, de forma aleatoria, por grupo de oveja, para realizar un sistema de monta controlada, la cual consistió en que cada semental montara dos veces a cada oveja. Las ovejas servidas fueron llevadas a otro corral.
Diagnóstico de gestación
El diagnóstico de gestación se realizó 45 d después del servicio, utilizando un equipo de ultrasonido (Sonovet, 2000).
Toma de muestras sanguíneas
Se colectaron muestras sanguíneas mediante venopunción de la vena yugular, obteniéndose 5.0 mL de sangre para determinar concentraciones de progesterona (P4) y LH. Para determinar las concentraciones de P4, se colectaron muestras sanguíneas cada 3 d, a partir del día 1 al día 18 del ciclo estral. Para las concentraciones de LH se colectaron muestras cada 4 h, desde las 24 h hasta las 96 h, después de terminados los tratamientos. Posteriormente, las muestras sanguíneas fueron centrifugadas a 1 500 xg durante 15 min, el suero fue separado por decantación para ser congelado y almacenado a - 20 °C hasta su análisis.
Al finalizar este periodo de muestreo, todas las ovejas fueron suplementadas durante 15 d con minerales Superbayphos® Bayer (10 mg por oveja) y además, se aplicó vitamina K, dosis única de 1.5 mg/kg de peso vivo.
Análisis hormonales
La concentración de P4 se determinó por el método inmunoenzimático, con un kit comercial (Inmunometrics UK Ltd. 280 Munster Roard, London SW6 6BQ). La sensibilidad del análisis fue de 0.12 ng/mL, con coeficientes de variación intra e inter ensayo de 8.3 % y 10.7 %, respectivamente. Las concentraciones de LH fueron determinadas por radioinmuno análisis (Niswender y col., 1969). La sensibilidad de la prueba fue de 0.7 ng/mL y el coeficiente de variación intra ensayo fue de 7.0 % e inter ensayo de 13.3 %.
Variables de respuesta
- Porcentaje de presentación de estro: se determinó como el resultado de dividir el número de hembras que presentaron estro entre ovejas que recibieron tratamiento, multiplicadas entre 100.
-Inicio del estro: se estableció como la resultante de las horas transcurridas desde el momento de la última aplicación de croplostenol, hasta el momento que la oveja manifiesta estro.
-Duración del estro: se determinó como el resultado de la diferencia entre el inicio y fin del estro.
-Inicio y duración del pulso pre-ovulatorio de LH: el inicio de la elevación de LH se definió como el tiempo en el cual, las concentraciones de LH fueron mayores a 2 desviaciones estándar con respecto a la secreción promedio basal, y permanecieron así, mínimo 4 h. El fin de la elevación fue definida como el tiempo en el cual las concentraciones de LH regresaron a su concentración basal (Van-Cleeff y col., 1998).
-Amplitud del pulso pre-ovulatorio de LH: fue establecido como el punto más alto del pico, menos la concentración nadir precedente del Pico (Mattioli y col., 1986).
-Porcentaje de preñez: se determinó como resultado de dividir el número de ovejas que quedaron preñadas entre el número de ovejas que presentaron estro, multiplicando el cociente por 100.
-Porcentaje de pariciones: se definió como resultado de dividir el número de ovejas que parieron entre el número de ovejas que estaban preñadas, multiplicando el cociente por 100.
-Prolificidad: se determinó como resultado de dividir el número de corderos vivos entre el número de ovejas que parieron.
Análisis estadístico
Se utilizó un diseño completamente al azar, donde la unidad experimental fue cada oveja. Los resultados de presentación del estro, gestación y parto fueron analizados mediante la prueba exacta de Fisher, a través del sistema de análisis estadístico (SAS) con el PROC FREQ (SAS, 2008). Mediante el análisis de varianza de los datos de inicio, duración del estro e inicio, amplitud y duración de LH y prolificidad, se obtuvieron valores promedio ± error estándar de la media (EEM), con el programa SAS, usando el PROC GLM (SAS, 2008). Para determinar las diferencias entre las medias de los tratamientos (P ≤ 0.05) se realizó la prueba de comparación de medias de Tukey. Para las concentraciones de P4, se elaboró un análisis de mediciones repetidas en el tiempo, con el software SAS, empleando el PROC MIXED para un diseño completamente al azar (Littell y col., 1998), teniendo como factor fijo al tratamiento, y factor aleatorio a la oveja y al tiempo. La estructura de covarianza fue obtenida de acuerdo a la metodología establecida por Wang y Goonewardene (2004), utilizando una arreglo de covarianza auto regresiva de primer orden AR (1).
RESULTADOS
Porcentaje de presentación, inicio y duración del estro
El 100 % de las ovejas del grupo FP presentaron estro, pero los grupos P y GP, presentaron una diferencia de 20 % y 10 %, respectivamente con respecto al grupo FP (Tabla 1). El aplicar los diferentes programas de sincronización de estros a mitad de la fase lútea no registró diferencia (P > 0.05) para la variable duración del estro, donde la duración para los tres grupos estuvo en el rango de 31.55 h a 36.50 h.
Tabla 1. Presentación, inicio y duración del estro, porcentaje de gestación y partos, para los diferentes tratamientos.
Table 1. Presentation, onset and duration of estrus, percentage of gestation and lambing for the different treatments.
| Tratamientos* | Presentación de estro (%) | Inicio de estro (h) | Duración de estro (h) | Gestación (%) | Partos (%) | Prolificidad** |
|---|---|---|---|---|---|---|
| P | 80 (8/10) | 40.00 ± 2.92a | 36.50 ± 3.94a | 87 (7/8) | 71 (5/7) | 1.66 ± 0.21a |
| FP | 100 (10/10) | 55.20 ± 4.80b | 31.55 ± 1.04a | 90 (9/10) | 78 (7/9) | 2.12 ± 0.12a |
| GP | 90 (9/10) | 43.55 ± 1.23a | 34.22 ± 1.89a | 89 (8/9) | 100 (8/8) | 1.88 ± 0.35a |
abLiterales distintas en una misma columna indican diferencia (P < 0.05).
*Grupo P (grupo testigo), aplicación de PGF2α; Grupo FP, 20 mg de FGA por 5 d y Grupo GP, 50 μg de GnRH y 7 d después 125 μg de cloprostenol.
**Promedio de corderos nacidos por oveja parida.
Descripción del pulso pre-ovulatorio en las variables de inicio, amplitud y duración del pico
Las ovejas de los tres grupos presentaron al menos un pulso pre-ovulatorio durante un periodo de 120 h, después de la última aplicación de PGF2α(Figura 2), registrando los valores individuales más altos en un rango de 48 ng/mL a 70 ng/mL, en los diferentes grupos. No se observó efecto alguno (P > 0.05) entre los grupos de tratamiento sobre el inicio, amplitud y duración del pulso pre-ovulatorio, donde los promedios para amplitud y duración fueron muy cercanos entre los diferentes grupos (Tabla 2).
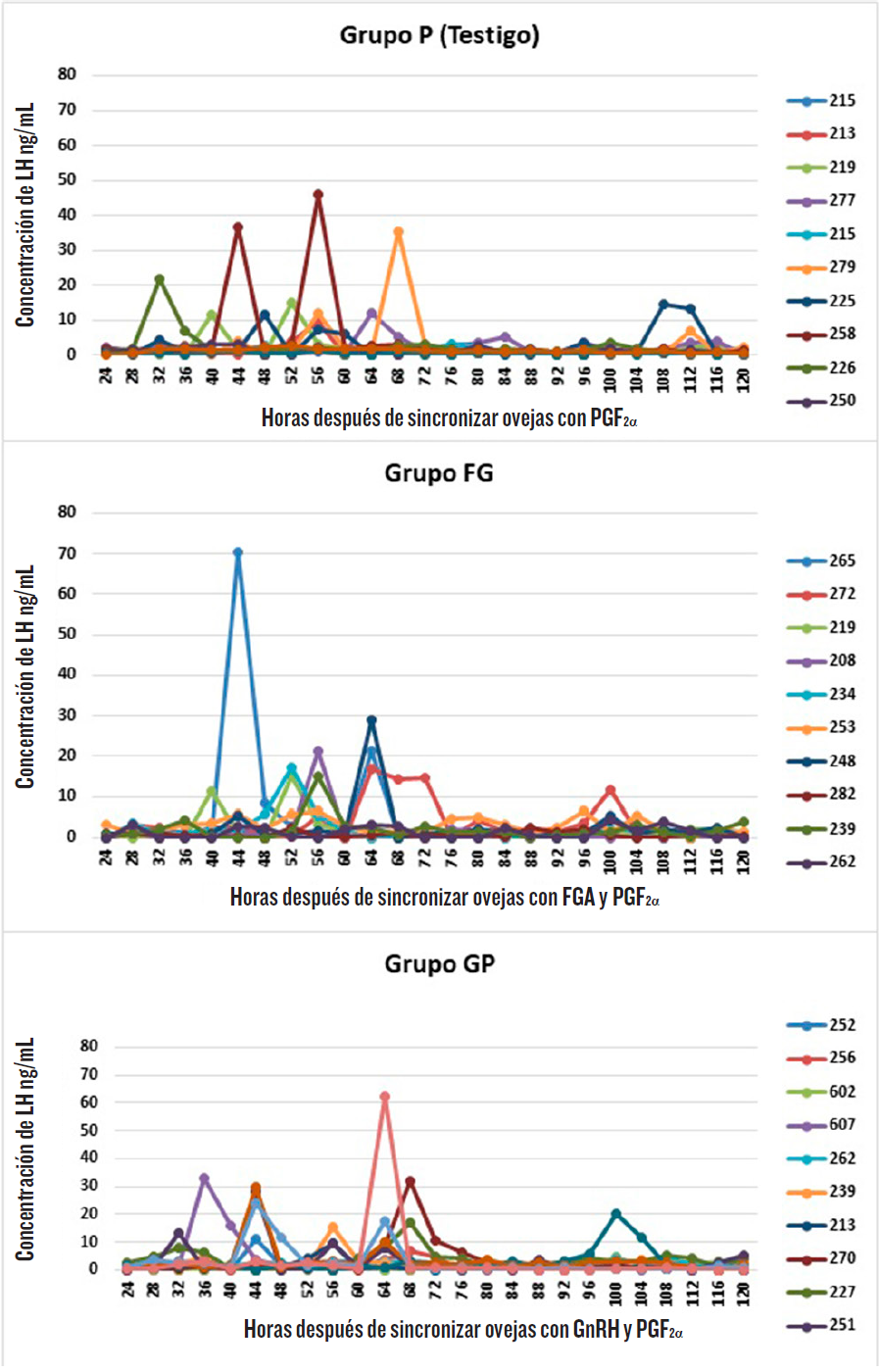
Tabla 2. Inicio, amplitud y duración de la elevación de LH (medias ± error estándar) en los grupos de ovejas.
Table 2. Onset, amplitude and duration of surge LH (means ± standard error) in ewes groups.
| Evento | Tratamientos* | ||
|---|---|---|---|
| P | FP | GP | |
| Inicio de la elevación de LH (h) | 55 ± 3 | 54 ± 2 | 66 ± 15 |
| Amplitud del pico de LH (ng/mL) | 26 ± 8 | 25 ± 6 | 27 ± 6 |
| Duración del pico de LH (h) | 5 ± 1 | 4 ± 0.6 | 5 ± 1 |
*Grupo P (grupo testigo), aplicación de PFG2α; Grupo FP, 20 mg de FGA por 5 d; Grupo GP, 50 μg de GnRH al inicio del programa y 7 d después 125 μg de Cloprostenol.
Concentración de progesterona posterior al estro
Las concentraciones de P4 no variaron (P > 0.05) entre tratamientos durante los primeros 5 d de post-finalizados los protocolos (Figura 3); no obstante, después de 8 d de finalizados los tratamientos, se detectó una diferencia significativa (P ≤ 0.05) en las concentraciones séricas promedio de P4entre tratamientos, siendo esta más alta para el grupo GP en relación a los grupos P y FP. Se mantuvo dicha diferencia entre grupos al día 18 de finalizados los tratamientos, observándose esta diferencia en un rango de 4 ng/mL a 8 ng/mL, para este periodo.
Gestación, parto y prolificidad
El porcentaje de gestación fue muy parecido entre los diferentes protocolos de sincronización de estro. En tanto que, el porcentaje de partos varió del 71 % al 100 % (Tabla 1). Las ovejas del grupo GP lograron mantener la gestación hasta el momento del parto. La prolificidad no fue afectada (P > 0.05) por los tratamientos.
DISCUSIÓN
Los resultados de presentación del estro se esperaban, ya que esta variable se encuentra relacionada con la concentración de P4al momento de la elevación de estradiol, GnRH y gonadotropinas, pero no con la concentración sérica de P4durante la fase lútea (Swelum y col., 2018). La duración del estro se ha reportado que se encuentra influida por el tiempo que dure los niveles altos de estradiol, y los niveles de estradiol registrados durante el estro dependen de la cantidad y el tamaño de los folículos dominantes (Martinez-Ros y col., 2018). También la cantidad de P4durante la fase lútea, previa al estro, juega un rol importante en los niveles de estradiol que puedan presentarse en el estro subsecuente (Skinner y col., 2000). Sin embargo, en el presente estudio no se encontraron efectos de los tratamientos sobre la duración del estro (Tabla 1), lo cual sugiere que las variaciones en las concentraciones de P4, en el ciclo previo, y la actividad folicular fueron similares entre tratamientos.
Si bien, la duración del estro no fue afectada por los tratamientos, el inicio de estro fue más rápido en el grupo P (testigo), que solo utilizó PGF2α, comparado con el grupo FP, donde se usó FGA+ PGF2α (Tabla 1). Esta diferencia puede ser explicada por el lento metabolismo de los progestágenos, en comparación a la progesterona natural (Swelum y col., 2015), y la efectiva acción de la PGF2αsobre un cuerpo lúteo maduro, con una gran cantidad de receptores (Fierro y col., 2017). Por su parte, la aplicación de GnRH días antes de administrar PGF2α, no mostró ninguna alteración en el tiempo de aparición del estro. Esto puede ser debido a que el GnRH se aplicó a la mitad de la fase lútea, que es cuando el cuerpo lúteo alcanza concentraciones altas de progesterona, evitando con ello que la GnRH tenga efecto completo sobre la secreción de gonadotropinas, sin alcanzar a luteinizar u ovular un folículo dominante (Titi y col., 2010).
El pulso pre-ovulatorio de LH, en sus variables de inicio, amplitud y duración, no se afectó por comenzar los diferentes tratamientos a mitad de la fase lútea (Tabla 2). Skinner y col. (2000) observaron que una mayor concentración y duración de P4, durante la fase lútea, retrasa el inicio del pulso pre-ovulatorio de LH, durante un periodo de muestreo de 40 h, después de retiradas las esponjas, siendo este efecto dependiente de la dosis. Para el presente experimento, el inicio de la elevación del pulso pre-ovulatorio de LH no fue diferente entre tratamientos (Tabla 2), por lo que es posible que la concentración de P4, durante la fase lútea, no difiriera lo suficiente para causar un efecto en esta variable, lo que explicaría la ausencia de diferencias entre ellos. En relación con la amplitud y duración, los resultados de este trabajo coinciden con los de Skinner y col. (2000), quienes demostraron que diferentes concentraciones de P4, en la fase lútea anterior al estro, no afecta la amplitud y duración del pulso pre-ovulatorio de LH.
La diferencia de concentraciones de progesterona posteriores al estro, siendo mayores para el grupo GP, en comparación a los grupos P y FP (Figura 3), podría deberse al grado de madurez del folículo pre-ovulatorio, al momento de la aplicación de PGF2α, y con ello un mayor grado de hipertrofia o luteinización en las células de la granulosa que rodean al antrum folicular después de la ovulación (Sangha y col., 2002). En este sentido, la aplicación de GnRH a la mitad de la fase lútea, puede provocar un aumento en el crecimiento y desarrollo de las células foliculares, propiciando que en la subsecuente ovulación y formación del nuevo cuerpo lúteo haya un aumento en la concentración de P4, después del estro sincronizado, como consecuencia de un mayor número y desarrollo de células luteales.
Es reconocido el papel que tiene la LH, en la luteinización de las células de la granulosa y vascularidad sanguínea, transporte de oxígeno, nutrientes y hormonas, así como varios factores (Sangha y col., 2002), lo que podría influir en su posterior producción de P4. Sin embargo, en este experimento no existieron diferencias en la amplitud o duración del pulso preovulatorio, que pueda sostener esta idea (Tabla 2).
Se podría esperar que las altas concentraciones de P4, después del estro, como las observadas para el grupo GP, influyeran en una mayor tasa de gestación en comparación a los grupos P y FP, pero en este trabajo no existió diferencia entre tratamientos para dicha variable, resultado similar a lo reportado por Miranda y col. (2018). Al parecer, en el presente estudio, los diferentes protocolos de sincronización de estros fueron capaces de generar cuerpos lúteos con la suficiente producción de P4, para permitir la implantación y desarrollo embrionario, lo que puede atribuirse al momento en el que se iniciaron los protocolos de sincronización de estro que, en este caso, fue a mitad de la fase lútea, cuando las concentraciones de P4son altas, lo que permite el desarrollo de un folículo adecuado para su ovulación y subsecuente formación del cuerpo lúteo (Johnson y col., 1996).
En lo que respecta al parto, no existió diferencia entre grupos (Tabla 2), sin embargo, en el grupo GP ninguna oveja perdió su gestación, lo cual podría estar influenciado por las altas concentraciones de P4registradas para este grupo, coincidiendo con lo reportado por deBrun y col. (2016), quienes observaron que, las ovejas que tuvieron más altas concentraciones de P4mantuvieron su gestación hasta el parto, sugiriendo que el medio endocrino entre los d 7 a 18, condiciona el desarrollo del producto, guiando a la pérdida de la preñez después del d 18.
En este estudio, la variable de prolificidad no fue afectada, lo cual es un resultado esperado, debido a que no se utilizó algún fármaco que estimulara el crecimiento de varios folículos, tales como gonadotropina coriónica equina u hormona folículo estimulante de origen porcino (Hasani y col., 2018; Kraisoon y col., 2018)
CONCLUSIONES
Los protocolos de P, FP y GP, iniciados durante la mitad de la fase lútea, fueron efectivos en sincronizar el estro en ovejas de pelo durante la época reproductiva, así como en una fertilidad aceptable con monta natural, considerando que, bajo las condiciones del presente estudio, los protocolos P y GP pueden ser una alternativa al uso de progestágenos. Por lo tanto, se recomienda usar protocolos basados en la aplicación de PGF2α, debido a su facilidad de aplicación y aceptable fertilidad.











 nueva página del texto (beta)
nueva página del texto (beta)




