INTRODUCCION
Los cereales han representado un alimento nutritivo básico en la dieta de la humanidad a través de su historia, y recientemente, los avances científicos han demostrado bondades adicionales en la promoción de la buena salud, asociadas al consumo de estos alimentos (Birkett y Cho, 2013; Jones y col., 2015). En concordancia, la producción de los dos cereales de mayor consumo en México, el maíz y el trigo, se incrementó en un 2.7 % y 9.3 %, respectivamente, del año 2013 al 2014 (FAO, 2017).
Estudios en humanos, han reportado que la ingestión de fibra dietética reduce el riesgo a padecer enfermedades crónicas y degenerativas (Asp y col., 1993), las cuales en 2015, generaron la muerte de 40 millones de personas (WHO, 2017). Dichas enfermedades se han incrementado debido a que la población se ha sometido a un ritmo de vida caracterizado por altos niveles de estrés, consumo de alimentos de bajo valor nutrimental (Patel y Goyal, 2012) y un estilo de vida más sedentario (Kirchengast, 2014).
Muchos de los efectos benéficos se han adjudicado a los polisacáridos de la pared celular vegetal, tales como los arabinoxilanos (AX), así como para algunos de sus derivados como los arabinoxilo-oligosacáridos (AXOS) (Swennen y col., 2006). Desde 2003, se ha acrecentado el interés por estos polisacáridos, ya que se ha demostrado que pueden ser considerados como prebióticos (Femia y col., 2010), por lo que podrían reducir la incidencia de enfermedades como la neoplasia, la obesidad crónica, desórdenes gastrointestinales, diabetes, enfermedades coronarias, enfermedades degenerativas y cáncer (Patel y Goyal, 2012).
El objetivo de este trabajo fue describir el uso potencial de los arabinoxilanos (AX) y los arabinoxilo-oligosacáridos (AXOS) como prebióticos, y el efecto de su consumo en la promoción de la buena salud, al estimular selectivamente el crecimiento y actividad de bacterias benéficas.
Origen y estructura química de los AX y los AXOS
Los AX son polisacáridos que están presentes en los granos de los cereales, localizándose en el endospermo, la aleurona, la cutícula y el pericarpio, denominándose a estos tres últimos en forma genérica como salvado (Izydorczyk y Billiaderis, 2007). Estos polisacáridos están conformados por una cadena lineal de miles de unidades de xilosa, unidas mediante enlaces β(1-4) y ramificaciones con sustituyentes de arabinosa a través de enlaces en O-2 y/o O-3 (Fincher y Stone, 1974) (Figura 1a). Al número de unidades presentes en las cadenas del polisacárido se le conoce como grado de polimerización (GP), mientras que la relación entre la arabinosa y la xilosa se expresa como grado de sustitución (GS). Otros sustituyentes de menor frecuencia son el ácido glucurónico, la galactosa y los grupos acetilo (Saulnier y col., 2007). Asimismo, algunos sustituyentes de arabinosa tienen residuos esterificados de ácido ferúlico en posición O-5 (Smith y Hartley, 1983). Los AX pueden ser solubles en agua (WEAX, por sus siglas en inglés: water extractable arabinoxilanos) e insolubles en agua (WUAX, por sus siglas en inglés: water unextractable arabinoxilanos) (Izydorczyk y Billiaderis, 2007).
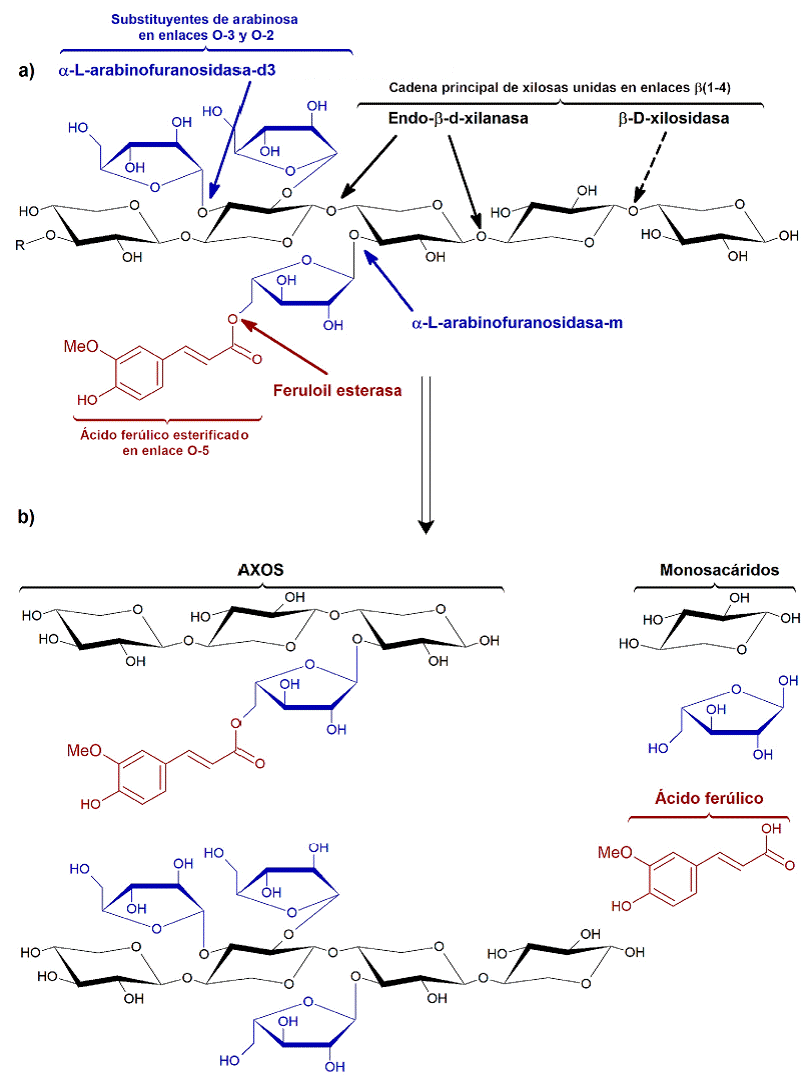
Figura 1 Estructura química básica de arabinoxilanos ferulados. a) Enzimas hidrolíticas de arabinoxilanos ferulados y sus sitios de acción. R = cadena lineal de xilosas. b) Posibles productos de la hidrolisis enzimática de los arabinoxilanos ferulados. Por ejemplo, los arabinoxilo-oli-gosacáridos (AXOS) presentan diferente grado de polimerización (GP) y grado de sustitución (GS); un GP-GS de 3.0-0.33 y 4.0-0.75 para los AXOS superior e inferior, respectivamente.
Figure 1 Basic chemical structure of ferulated arabinoxylans. a) Ferulated arabinoxylans with their hydrolytic enzymes and attack sites. R = xylose backbone. b) Possible products of the enzymatic hydrolysis of ferulated arabinoxylans. For example, arabinoxylan-oli-gosaccharides (AXOS) with different degree of polymerization (DP) and degree of substitution (DS); a DP-DS of 3.0-0.33 and 4.0-0.75 for top and bottom AXOS, respectively.
Los AXOS son cadenas cortas de unidades de xilosa sustituidas con unidades de arabinosa, las cuales pueden estar esterificadas a ácido ferúlico, que se producen por degradación de los AX (Figuras 1a, 1b). La hidrólisis de los AX y los AXOS puede llevarse a cabo durante el procesamiento de los cereales, para transformarlos en productos alimenticios, debido a la presencia de enzimas endógenas que los degradan. Los AX y AXOS que permanecen en los alimentos pueden ser hidrolizados en el colon de los animales y humanos, por efecto de la microbiota endógena o natural, que produce enzimas como endo-β-D-xilanasa, β-D-xilosidasa, a-L-arabinofuranosida-d3, a-L-arabinofuranosida-m y feruloil esterasa. La endo-β-D-xilanasa rompe de manera aleatoria los enlaces glucosídicos interiores de la cadena lineal de unidades de xilosa y la β-D-xilosidasa corta el enlace glucosídico de la unidad terminal de xilosa (Figura 1a). Por su parte, las a-L-arabinofuranosidasas hidrolizan los enlaces de ramificación entre las unidades de xilosa y arabinosa. En contraste, las feruloil esterasas cortan los enlaces entre las unidades de arabinosa y ácido ferúlico. El resultado de la actividad enzimática en conjunto produce la disminución del peso molecular (PM) de los AX, produciendo AXOS y xilo-oligosacáridos, y finalmente monosacáridos (Figura 1b) (Grootaerty col., 2007).
Existen procesos de purificación de AX y AXOS, a partir de fuentes con alto contenido de AX, para que puedan ser utilizados como ingredientes alimenticios, con el fin de modificar alguna característica o incrementar el nivel de fibra. Estos procesos combinan dos pasos: el primero es la solubilización en agua o solubilización inducida por hidrólisis alcalina; y el segundo, por una hidrólisis que puede ser enzimática o por condiciones de alta temperatura y presión (Broekaert y col., 2011).
Las características estructurales que definen a los AXOS son el GP, GS y el contenido de ácido ferúlico. El ácido glucurónico, también se ha detectado como componente minoritario del oligosacárido. Los valores del GP y del GS de los AXOS reportados varían de 3 a 67 y de 0.09 a 0.58, respectivamente (Sanchez y col., 2009; Femia y col., 2010).
AX y AXOS en productos de harina
El hecho de que los AX y AXOS sean parte de los mayores componentes en los subproductos del procesamiento de los granos de cereales (fibra o salvado de maíz, salvado de trigo, fibra de arroz, entre otros) o residuos agrícolas (rastrojo de maíz, paja de trigo, bagazo de caña de azúcar, entre otros), ha permitido que estos polisacáridos tengan una aplicación potencial en la industria alimenticia, con el fin de obtener productos con valor agregado (Yadav y Hicks, 2018). En específico, los AX han sido estudiados de manera extensiva por el papel que desempeñan en el proceso de panificación y su efecto en el producto final. El uso de WEAX ofrece beneficios tecnológicos en la panificación, como el incrementar la consistencia y prevenir la coalescencia de la masa, por lo que aumentan el volumen del pan y mejoran la textura de la miga (Izydorczyk y Biliaderis, 2007). Por el contrario, los WUAX desestabilizan la estructura de la masa, disminuyen el volumen del pan y producen una miga más dura y gruesa (Courtin y Delcour, 2002). Sin embargo, estos efectos negativos se pueden disminuir o eliminar, al agregar enzimas endo-β-D-xilanasas, las cuales convierten los WUAX a WEAX de alto PM, mejorando la consistencia de la masa, la estabilización de la fermentación, el volumen del pan y la estructura y suavidad de la miga (Rouau y col., 1994; Courtin y Delcour, 2002). La enzima xilanasa permitió obtener pan de centeno con una mejor calidad (volumen, dureza y densidad) respecto al control. Estos atributos se realzaron cuando en la fórmula de la masa, también se agregó salvado de centeno (Döring y col., 2017a) o la enzima transglutaminasa, que generó proteínas insolubles, al reticular gluteninas de alto peso molecular (Grossman y col., 2016; Döring y col., 2017b). En pan de trigo, el uso de una mezcla enzimática (0.25 %; xilanasa, amilasa y celulasa) y la substitución del 20 % de harina de trigo por AX de salvado prefermentados, generaron AX más solubles en la masa, permitiendo una mayor distribución de agua y en consecuencia un pan, con una calidad superior al pan elaborado con 100 % harina de trigo suave (Messia y col., 2016).
La evaluación de productos de panadería enriquecidos con AX, ha puesto de manifiesto el reto de crear alimentos que converjan en valor nutrimental y atractivo para el consumidor. Por ejemplo, Lu y col. (2000), evaluaron pan adicionado con un 7 % y 14 % de fibra (principalmente conformada por AX), observando que la palatabilidad del producto es igual a la de pan con un 50 % de trigo entero. A su vez, Koegelenberg y Chimphango (2017), observaron que una dosis del 0.8 % de AX de salvado de trigo desplazó al 2.5 % de la harina, sin afectar los atributos físicos de pan, excepto el color, manteniendo así el peso del pan, altura y volumen. En cambio, en pan libre de gluten, se requirió adicionar 6 % de AX de fibra de maíz para obtener un volumen específico más alto y una textura de miga más suave (Ayala-Soto y col., 2017).
Saeed y col. (2015), elaboraron panes con AX de diferentes variedades de trigo y proporciones (0.5 % y 1.0 %). La inclusión de los AX, al pan, proporcionó una mejor consistencia, fracturabilidad y gomosidad, sin embargo, dichos atributos disminuyeron durante su almacenamiento (6 d a 25 °C). En cambio, en otro estudio, la adición de AX de salvado de centeno en masa y almacenada durante 60 d a - 18 °C, permitió obtener pan, con características de textura y volumen de miga superiores al pan sin AX adicionados (Wang y col., 2016). Este resultado se explicó en términos de una menor cristalización del agua, debido a la absorción que ejercen los AX, manteniendo la viabilidad y actividad de las levaduras. El empleo de WUAX al 4 % en la preparación de pan frito chino (youtiao), permitió obtener un producto de bajo contenido en grasa y mejor valor nutrimental, al incrementar la humedad y la firmeza del producto, así como disminuir el volumen específico y el contenido total de aceite (37 %) (Li y col., 2017).
Por otra parte, Marconi y col. (2000), sustituyeron en un 50 % la sémola de trigo duro por fibra rica en AX de cebada, para elaborar spaghetti. Aunque el spaghetti rico en AX fue más oscuro que el spaghetti de trigo duro, presentó buenas características de cocción respecto a la adhesividad, la firmeza y la materia total liberada en el agua de lavado. Por otro lado, Dexter y col. (2005), al sustituir el 20 % de sémola de trigo duro, por harina de cebada sin cáscara (alto contenido de AX y β-glucanos), observaron que el color del spaghetti era aceptable y la firmeza similar al spaghetti preparado con 100 % de sémola. En esta misma línea, Izydorczyk y col. (2005), encontraron que el spaghetti enriquecido con fibra rica en AX, ofrece al consumidor un menor tiempo de cocción, aceptable calidad de cocción y un aumento y diversificación del valor nutrimental.
Recientemente, se describió que la adición de AX de salvado de trigo (2 %) a la masa para preparar fideo chino, contribuyó a mejorar las características de cocción (absorción de agua y tiempo de cocción), textura (dureza, adhesividad, elasticidad, cohesividad, gomosidad y masticabilidad), fuerza al quiebre, flexibilidad y valor nutrimental de los fideos cocinados (Fan y col., 2016). Actualmente, el interés de incorporar los AX y los AXOS, a los alimentos a base de harina, va más allá de mejorar únicamente las características del producto: se busca obtener un producto capaz de otorgar un beneficio a la salud.
AX y AXOS como prebióticos
La tendencia actual de consumo responde cada vez más, a la demanda de productos denominados “sanos” o “naturales”, con el fin de disminuir el riesgo de padecer enfermedades crónico-degenerativas. Entre los productos que satisfacen esta demanda se encuentran los alimentos enriquecidos con prebióticos. Los prebióticos son ingredientes alimenticios no digeribles, que tienen efectos benéficos en el hospedero, debido a la estimulación selectiva del crecimiento o actividad de una o un número limitado de bacterias en el colon, teniendo como consecuencia una mejora en la salud del huésped (Gibson y Roberfroid, 1995).
Diversos estudios in vitro sobre AX y sus derivados, afirmaron que pueden ser fermentados por la microbiota intestinal y estimular selectivamente el crecimiento y la actividad de bacterias intestinales benéficas. Por ejemplo, Hopkins y col. (2003), fermentaron AX y AX entrecruzados, extraídos de endospermo de trigo en condiciones anaerobias y pH controlado. Los medios de cultivo se inocularon con microbiota intestinal de niños. Estos autores encontraron que la fermentación de AX y AX entrecruzados es lenta y se asocia con un incremento en la formación de ácidos grasos de cadena corta y un aumento significativo en la cuenta total de anaerobios, en especial de Bacteroides fragilis (Veillon y Zuber, 1898; Castellani y Chalmers, 1919). La fermentación lenta de los AX también fue reportada por Kaur y col. (2011), quienes sometieron a los AX, al igual que otras fibras, a una fermentación en suspensión fecal humana. Las fermentaciones de los AX y β-glucanos de cadena larga fueron lentas en una primera etapa, durante la cual se produjeron concentraciones similares de ácidos grasos de cadena corta y bajos niveles de gases.
La estructura química de los AX puede influir en la fermentación y el crecimiento selectivo o en la actividad de bacterias intestinales benéficas. Un claro ejemplo de lo anterior es lo registrado por Hughes y col. (2007), quienes fermentaron AX de trigo de diferente PM, utilizando heces fecales humanas. Si bien, todas las fracciones de AX mostraron impacto bifidogénico comparables en la microflora, es de destacar que los AX de menor PM (66 kDa) fueron particularmente selectivos para Lactobacillus y Eubacterium. Entre tanto, la fermentación de todos los AX mostró un aumento en la producción total de ácidos grasos de cadena corta, con una proporción especialmente alta de ácido butírico. La selectividad de Bifidobacterium y Lactobacillus por AX incrementó cuando el PM de los AX disminuyó.
Por otra parte, Reis y col. (2014), fermentaron AX de diferente estructura (GP y GS) en medios con microbiota de adultos sanos. En ambos fermentados, se evidenció la estimulación de la población bacteriana benéfica (en especial Bifidobacterium) y la producción de ácido grasos de cadena corta. Sin embargo, los AX con mayor GP y menor GS presentaron la mayor proliferación de bacterias benéficas, pero con una menor producción de ácidos grasos de cadena corta. De igual manera, Ding y col. (2015), al estudiar la fermentación de AX de Psyllium y de mucilago de linaza en medios con microbiota de cerdo, observaron que los perfiles de ácidos grasos de cadenas cortas fueron diferentes durante y al término del estudio.
En otro estudio, donde se fermentaron WUAX de trigo en un sistema de cultivo mixto, se documentó un mayor índice prebiótico de estos polisacáridos, cuando fueron tratados previamente con enzimas endo-β-D-xilanasas y feruloil esterasas (Vardakou y col., 2008). Lo anterior puede estar relacionado con la complejidad estructural de los WUAX, siendo necesario que la microbiota exprese una mayor cantidad de enzimas para poder degradarlos. Igualmente, la fermentación de WEAX en medios con contenido cecal de pollos de engorda, mostró que la aplicación de enzimas hidrolíticas induce una mayor producción de acetato y butirato (Yacoubi y col., 2016).
Los resultados in vitro antes descritos han sido corroborados por estudios in vivo.Lopez y col. (1999), alimentaron ratas con pan de un alto contenido en WEAX y encontraron que los niveles de ácidos grasos de cadena corta en el ciego (primera porción del intestino grueso) se incrementaron, en especial el ácido propiónico. Un resultado similar reportaron Van-den-Abbeele y col. (2011), quienes inocularon ratones con microbiota fecal humana y observaron el efecto de la ingesta de AX de cadena larga. En dicho estudio, la microbiota de los ratones, fue enriquecida con microorganismos de los filos Verrucomicrobia (Hedlund y col., 1997), Firmicutes (Gibbons y Murray, 1978) y Bacteroidetes (Krieg y col., 2010), además de contener diferentes especies de Bifidibacterium como B. bifidum (Tissier, 1900; Orla-Jensen, 1924), B. adolecentis y B. longum (Reuter, 1963). Los resultados demostraron que el suministro de AX de cadena larga estimuló principalmente el crecimiento de B. longum e incrementó los niveles de ácidos grasos de cadena corta, induciendo principalmente la producción de propionato. El propionato puede ser absorbido por el intestino, entrar al torrente sanguíneo y llegar al hígado por la vena porta, donde se le ha asociado con la reducción de la síntesis del colesterol y mejora de la sensibilidad a la insulina (Vanden-Abbeele y col., 2011).
Por su parte, Neyrinck y col. (2011), evaluaron en ratones la habilidad de los WEAX (10 % p/p) para modular la microbiota del intestino y el metabolismo de lípidos después de una dieta con alto contenido de grasa. El tratamiento con WEAX restauró el número de bacterias que habían disminuido a causa de la dieta, entre ellas Bacteroides (Castellani y Chalmers, 1919), Prevotella (Shah y Collins, 1990) y Roseburia (Stanton y Savage, 1983). Además, el tratamiento con WEAX incrementó fuertemente el contenido de bifidobacterias cecales, en particular Bifidobacterium animalis lactis (Meile y col., 1997). Estos autores sugirieron que los WEAX empleados pueden promover un impacto positivo en la salud a través de la modulación de la microbiota intestinal.
Al igual que las investigaciones sobre los AX, la fermentación de AXOS y su relación con la producción de ácidos grasos de cadena corta y estimulación selectiva, han demostrado el potencial de dichos oligosacáridos como prebióticos. Los estudios in vitro se han efectuado en simuladores del ecosistema microbiano del intestino humano (SHIME, por sus siglas en inglés: Simulator of the Human Intestinal Microbial Ecosystem), que se componen de recipientes que simulan el estómago y el duodeno, el yeyuno y el íleon, el colon ascendente, el colon transverso y el colon descendente (Grootaert y col., 2009; Sanchez y col., 2009; ProDigest, 2016). Los análisis in vivo se han realizado tanto en ratas como en humanos (Grasten y col., 2003; Cloetens y col., 2008; Van-Craeyveld y col., 2008).
Grootaert y col. (2009), analizaron el potencial prebiótico de los AXOS en el SHIME. Durante el suplemento con AXOS, encontraron un incremento en los niveles de lactato y propionato en el colon ascendente y transverso, respectivamente. Si bien, el suplemento de los AXOS no presentó efectos significativos en la composición de la microbiota, sí afectó primordialmente el metabolismo microbiano, al “encender” la degradación enzimática de los AXOS (arabinofuranosidasas, endo-β-D-xilanasas y β-D-xilosidasas). De acuerdo con los anteriores resultados, los autores concluyeron que los AXOS tiene un alto potencial para desplazar parte de la fermentación hacia las partes distales del colon.
Por su parte, Sanchez y col. (2009), utilizaron el SHIME para evaluar el impacto del GP y del GS de los AXOS (3-0.09; 3-0.25; 8-0.23; 15-0.26; 29-0.30), en el balance de la fermentación de proteínas y carbohidratos, así como la composición de la microbiota en el intestino grueso, y encontraron que en los experimentos de fermentación, los AXOS con bajo GP (3 y 8) fueron primordialmente fermentados en el colon proximal; en cambio, parte de los AXOS con alto GP (15 y 29) alcanzaron el colon distal. La suplementación prolongada de AXOS con alto GP disminuyó los niveles de fenol y p-cresol, los cuales son derivados de la fermentación microbiana de proteínas. Estos compuestos se asocian al riesgo de alteraciones en el colon. Conjuntamente, se incrementó la concentración de ácidos grasos de cadena corta en todos los compartimentos representativos del colon. Además, aumentó significativamente la cantidad de microorganismos promotores de buena salud como Lactobacillus, así como Bacteroides-Prevotella y Clostridium coccoides (Kaneuchi y col., 1976)-Eubacterium rectale (Prévot, 1938), por lo que concluyeron que, la suplementación de los AXOS podría influir en la microbiota, para modular una respuesta positiva en la salud del hospedero.
Por otro lado, Grasten y col. (2003), estudiaron en humanos el efecto de la ingesta de pan enriquecido con AXOS y su relación con la actividad metabólica de la microbiota fecal. Debido al consumo de pan enriquecido con AXOS, los sujetos de estudio presentaron un aumento en los niveles de ácidos grasos de cadena corta en heces, en donde el butirato mantuvo una mayor proporción molar con respecto a acetato y propionato. Los niveles de ácidos grasos en heces solo reflejan un parte de la producción de estos ácidos, porque se absorben rápidamente en el colon ascendente. Sin embargo, una alta concentración de ácidos grasos de cadena corta en heces, especialmente butirato, indica que la concentración de estos ácidos en el colon descendente, el sitio de mayor incidencia de tumores, también fue alta (Topping y Clifton, 2001). El butirato se relaciona con la mejora de la función de la barrera de la mucosa e induce la apoptosis de células tumorales a diferencia de acetato y propionato. Empero, acetato y propionato estimulan la biosíntesis de colesterol (Fernández y col., 2016).
Por su parte, Cloetens y col. (2008), caracterizaron la influencia de los AXOS en la movilidad gastrointestinal y el metabolismo bacteriano en humanos sanos. Para ello, suministraron a voluntarios una dieta cuyo contenido de AXOS aumentó gradualmente. Al final del periodo, el aumento de la cantidad de AXOS en la dieta no influyó en el vaciado gástrico y el tiempo de tránsito intestinal, pero sí en la estimulación del crecimiento bacteriano y la actividad metabólica.
En animales, específicamente en ratas, la administración de una dieta a base de pan rico en AXOS, con diferentes grados de polimerización y sustitución, mostró que los AXOS con bajo GP promovieron un incremento en la producción de acetato y butirato en el colon y un aumento rápido en la concentración de la población bacteriana de Bifidobacterium en el ciego. Sin embargo, no se disminuyó la concentración de ácidos grasos de cadena corta ramificados, los cuales son considerados como marcadores de la degradación de proteínas realizada por la microbiota intestinal. En contraste, la suministración de AXOS con alto GP suprimió la concentración de ácidos grasos de cadena corta ramificados, por lo que se evitó la degradación de proteínas, pero no aumentó la concentración de butirato ni estimuló el desarrollo del grupo Bifidobacterium. A su vez, la ingestión de AXOS con GP similar pero diferente GS, afectó de igual forma las características intestinales, sugiriendo que la influencia se debe principalmente al GP y no al GS.
Los AXOS con GP de 5 y GS de 0.27 presentaron los mejores efectos benéficos en el intestino. Al comparase los efectos de estos AXOS con respecto a la administración de inulina y fructo-oligosacáridos, se obtuvieron efectos bifidogénicos similares y una mayor producción de butirato (Van-Craeyveld y col., 2008), cuyo efecto anti-tumoral se mencionó anteriormente. Esto permite colocar a los AXOS como compuestos que benefician a la salud tanto como los prebióticos inulina y fructo-oligosacáridos.
Otros efectos benéficos de los AX y los AXOS en la salud
Antiobesogénico
De acuerdo a Neyrinck y col. (2011), la incorporación de AX, en la dieta de ratas que consumían alimentos altos en grasa, disminuyó en los animales los problemas relacionados a cambios en la microflora intestinal y la obesidad (la acumulación de colesterol hepático, reducción del tamaño de adipocitos y peso corporal). Estos resultados fueron similares al cambiar el suministro de AX por AXOS (Neyrinck y col., 2012), por lo que concluyeron que tanto AX como sus derivados (AXOS) presetan propiedades relacionadas a la prevención de la obesidad y los desórdenes derivados de dicho padecimiento.
Harding y col. (2014), documentaron en háms-ter, que el consumo de salvado de trigo (rico en AX) como parte de una dieta inductora de obesidad e hipercolesterolemia, disminuyó la masa grasa (7 %) y aumentó la masa magra corporal (8 %). Sin embargo, no encontraron diferencias respecto a los niveles de colesterol plasmático y de triglicéridos. Caso contrario, Tong y col. (2014), observaron en hámsters hipercolesterolemicos, que el consumo de una dieta con AX de salvado de trigo disminuyó el colesterol total del plasma y el colesterol-LDL al promover la excreción de lípidos en heces, vía de la regulación de la actividad de la 3-hidroxi-3-metil-glutaril-CoA reductasa (HMGCR) y colesterol 7-a-mono-oxigenasa (CYP7A1). La síntesis y excreción de colesterol en el hígado está regulada por la HMGCR y CYP7A1, respectivamente (Sato y col., 2003).
Así mismo, Adam y col. (2001), observaron en ratones, que una ingesta rica en AX puede modificar el metabolismo de lípidos, ya que dicha dieta estimuló la disminución del colesterol plasmático y triglicéridos en un 27 % y 40 %, respectivamente. Estos resultados son similares a los registrados por Lopez y col. (1999), quienes describieron que una dieta semipura de WEAX permitió la disminución del 20 % y 25 % en el nivel del colesterol plasmático y de triglicéridos, respectivamente, así como la disminución de la acumulación de colesterol en el hígado de ratas. Sarma y col. (2018), demostraron en ratones albinos, el beneficio que tiene la ingesta de AX de mijo, durante una dieta con alto contenido de grasa. En dicho trabajo, la suplementación de 0.5 g AX/kg en peso y 1.0 g AX/kg en peso por 10 semanas, promovió la disminución del peso corporal y ganancia en peso, aunado a la reducción del perfil de lípidos en el suero, la disminución de la inflamación y acumulación de lípidos en el hígado y la modulación benéfica de la expresión de genes del tejido hepático y adiposo blanco. Sin embargo, en humanos sanos con sobrepeso y obesidad, la suplementación de AX durante 6 semanas, no mostró efectos significativos en las concentraciones colesterol total, colesterol LDL, colesterol HDL y triglicéridos (Salden y col., 2018). Los autores explicaron estos resultados, en el hecho de que los participantes tenían valores normales desde el comienzo del estudio. Además, no se controló la dieta y actividad física de los participantes, por lo que estos factores serían considerados en investigaciones futuras.
Regulador de la glucosa
Hartvigsen y col. (2013), reportaron que en ratas propensas a desarrollar diabetes tipo 2, la ingesta de pan suplementado con WEAX derivó en una disminución de los niveles de glucosa en ayunas y de insulina plasmática. Además, se observó en el tejido adiposo sobrerregulación en la expresión de genes involucrados en la cascada de señalización de insulina y metabolismo de glucosa y lípidos. Por lo anterior, los autores concluyeron que el consumo de pan de trigo suplementado con WEAX retarda el desarrollo de diabetes tipo 2 en ratas. En este tipo de roedores, también se estudió la influencia del consumo de WUAX y WUAX etrecruzados (rehidratados o no), en el nivel de glucosa postprandial en sangre (Vogel y col., 2012). Estos autores observaron que a diferencia de WUAX, los WUAX entrecruzados disminuyeron significativamente el nivel de glucosa en sangre. La posible explicación para dicho efecto la describen a partir de la alta viscosidad en el bolo alimenticio, lo que probablemente disminuyó la difusión de la glucosa hacia la superficie de absorción. Además, Sarma y col. (2018) observaron en ratones, que la inclusión de AX en una dieta alta en grasa, promovió la tolerancia a la glucosa, así como la disminución de las altas concentraciones de lipopolisacáridos, de insulina y de leptina en el suero. Altos niveles de estos compuestos es indicativo de una resistencia a la insulina inducida por la endotoxemia metabólica que puede conducir a la diabetes tipo 2 (Singh y col., 2015).
Por su parte, Christensen y col. (2013), trabajaron con cerdos la relación entre el consumo de pan enriquecido con WEAX y la respuesta inmediata de glucosa e insulina en sangre. Los resultados mostraron que ambas respuestas disminuyeron. La disminución inmediata de glucosa se justificó en similitud a lo descrito anteriormente, mientras que la reducción de la secreción de insulina como consecuencia del bajo nivel del flujo de glucosa.
En humanos, se ha registrado el efecto positivo del consumo de AX (Sandberg y col., 2017) o AXOS (Boll y col., 2016) sobre la tolerancia a la glucosa. De hecho, la Autoridad Europea de Seguridad Alimentaria (Europen Food Safety Authority) ha reconocido los efectos benéficos de los AX sobre la respuesta a la glucosa post-prandial, y la Unión Europea ha autorizado la declaratoria de que “al consumo de AX, como parte de una comida, se le atribuye la reducción del aumento de glucosa en sangre después de esa comida” (Kellow y Walker, 2018). Para ello, se revisaron 18 ensayos de investigación, de los cuales, cuatro fueron en adultos sanos, tres en personas con trastornos metabólicos y uno en personas con diabetes tipo 2.
Antioxidante
La capacidad antioxidante de los AX y AXOS está relacionada con el contenido de ácido ferúlico presente (Van-den-Ende y col., 2011). Por ejemplo, Malunga y Beta (2015), observaron que la capacidad antioxidante de distintas fracciones de WEAX de trigo (aleurona y salvado rojo y blanco) está asociada al contenido de ácido ferúlico y fenoles totales, donde el ácido ferúlico representa del 85 % al 95 %. En tanto, Ayala-Soto y col. (2014), analizaron la relación entre la composición de azúcares, el perfil de ácidos hidroxicinámicos, fenoles totales y la capacidad antioxidante de AX de diferentes fibras de maíz. Estos autores encontraron que la capacidad antioxidante de los AX está relacionada principalmente a la concentración de trímeros de ácido ferúlico, seguido de ácido cumárico y fenoles totales.
La capacidad antioxidante también puede estar influida por la complejidad estructural de la molécula y la asociación que tiene con otros componentes. Yadav y col. (2017), estudiaron la capacidad antioxidante de diferentes materiales vegetativos compuestos de AX y celulosa. Los valores más altos se detectaron en salvado de maíz y trigo, los cuales presentaron la mayor proporción de AX: los autores asociaron estos resultados a la estructura altamente ramificada de sus componentes. Por su parte, Adam y col. (2002), demostraron en ratas, que después de la administración de una dieta a base de cereal (rica en AX), se excretó en la orina un 95 % menos de ácido ferúlico que el registrado después de una dieta enriquecida con ácido ferúlico. Por ello, concluyeron que el efecto antioxidante de los AX ferulados presentes en las harinas o cereales que se ingieren está limitado por la baja biodisponibilidad del ácido ferúlico en el organismo, como consecuencia del entrecruzamiento existente con otras hemicelulosas y ligninas.
Asimismo, Nordlund y col. (2012), cuantificaron la formación de metabolitos fenólicos producidos por fermentación microbiana de salvado y aleurona (alto contenido de AX), en condiciones que simulan el colon, observando que la formación del metabolito ácido fenilpropiónico hidroxilado dependió del contenido de ácido ferúlico, del tamaño de partícula y de la proporción de AX insolubles presentes en las muestras. Malunga y col. (2017), estudiaron el efecto protector de los WEAX (diferente tipos y concentraciones) sobre la hidroperoxidación de lípidos bajo condiciones gástricas simuladas, encontrando que, la formación de los hidroperóxidos de lípidos permanecía ligeramente menor hasta una reducción del 30 %, dependiendo del tipo y concentración de WEAX en el ensayo.
Respecto al efecto antioxidante de AXOS, Veenashri y Muralikrishna (2011), analizaron el perfil de ácidos fenólicos y la capacidad antioxidante de AXOS derivados de diferentes cereales, encontrando que el poder reductor depende principalmente de la concentración de ácido ferúlico y su relación sinérgica y aditiva con otros compuestos fenólicos. En un estudio in vivo, Maki y col. (2012), midieron la concentración de ácido ferúlico presente en plasma sanguíneo de adultos mayores de 50 años, después de ingerir cereal enriquecido con AXOS. Se relacionó el incremento de AXOS en el cereal ingerido, con un aumento en la concentración de ácido ferúlico plasmático. Sin embargo, la medición antioxidante del plasma no fue significativamente superior al testigo. Los autores explicaron dicho resultado en función de los bajos niveles de ácido ferúlico, comparado con otros compuestos antioxidantes presentes en el plasma, como ácido úrico, ácido ascórbico y a-tocoferol. En contraste, Ou y col. (2007), mediante pruebas en ratas con diabetes inducida, confirmaron la alta capacidad antioxidante de los AXOS, al observar que los AXOS pueden reducir la peroxidación de lípidos en suero, hígado y testículos. Este resultado concuerda con los ensayos in vitro realizados por Katapodis y col. (2003), quienes observaron que los AXOS inhiben fuertemente la oxidación de la lipoproteína humana de baja densidad.
Posiblemente, la diferencia en la actividad antioxidante entre los AX y los AXOS podría explicarse en términos del GP y GS de sus estructuras, así como del entrecruzamiento de las cadenas, ya que una mayor complejidad en la estructura no permitiría la exposición del ácido ferúlico a los compuestos oxidantes.
Anticancerígeno
Los estudios in vivo han situado a los AX y los AXOS como posibles agentes anti-cancerígenos. Entre ellos se encuentran los datos obtenidos por Cao y col. (2011), quienes observaron que la administración oral de AX, a ratones inducidos con tumores tipo S180, inhibió significativamente el crecimiento de dichos tumores. Por su parte, Femia y col. (2010), elaboraron un ensayo en cual alimentaron ratas con una dieta rica en AXOS y las trataron con un agente carcinogénico, inductor de dos tipos de lesiones en el colon. El consumo de este oligosacárido, por un periodo de 30 d, causó la reducción significativa de dichas lesiones, corroborando que la ingesta de AXOS puede tener un efecto benéfico en la disminución de riesgo de cáncer.
La fermentación de proteínas no es un proceso benéfico en el colon, ya que se producen compuestos como el p-cresol, fenol y amonio que se consideran promotores de cáncer. El consumo de AX y AXOS promovió la protección intestinal de cerdos alimentados con una dieta rica en proteína (Belobrajdic y col., 2012; Zhang y col., 2015; Williams y col., 2016), al disminuir la concentración de dichas sustancias en heces.
Sugawara y col. (1990), encontraron que la suplementación de extracto de pericarpio de maíz, a voluntarios sanos, promovió la disminución de la actividad de la enzima β-glucuronidasa y del contenido de amonio en heces. Muchos compuestos se conjugan con el ácido glucurónico en el hígado y son excretados vía bilis al tracto gastrointestinal (Rowland y Mallet, 1986). En estado glucuronidado, estos compuestos son inactivos, se absorben poco en el intestino y se excretan en las heces. Sin embargo, la enzima β-glucuronidasa presente en el intestino, remueve la fracción glucurónida de estos conjugados produciendo metabolitos que pueden ser reabsorbidos en el intestino. Estos metabolitos son altamente tóxicos y se consideran promotores de cáncer, por lo que la actividad de β-glucuronidasa se considera como un biomarcador de riesgo de cáncer (Wallace y col., 2015). El amonio al ser considerado un carcinógeno potencial, se desea que se excrete por vía fecal en vez de la vía urinaria, lo que significaría que la absorción del tóxico se realizó a través de la mucosa del colon (Broekaert y col., 2011). Este cambio en la vía de excreción de amonio fue observado por Cloetens y col. (2008), quienes suministraron a voluntarios sanos, pan enriquecido con AXOS. Para estudiar la influencia de los AXOS en el metabolismo de amonio se utilizó ureido-[15N, 15N’]-lactosa; dicho biomarcador es convertido a amonio-15N en el colon. El consumo de AXOS redujo significativamente la secreción urinaria de amonio-15N con un correspondiente incremento de amonio-15N en las heces. Este cambio se explicó considerando que los AXOS estimulan la fermentación bacteriana de carbohidratos en el colon, aumentado así la ingesta y la asimilación del nitrógeno en estas bacterias.
Además, en otro estudio donde se suministró a humanos sanos pan enriquecido con AXOS, se observó que disminuyó la producción de ácidos orgánicos asociados a la fermentación de proteínas, como el isobutirato, isovalerato, valerato y caproato (Walton y col., 2012). También se ha demostrado que la estructura de los AX y AXOS influye en la fermentación de proteínas. Damen y col. (2011), hicieron un estudio donde alimentaron a ratas con dietas que incluía WEAX, WUAX y AXOS en forma individual o combinada. En general, los niveles de isobutirato e isovalerato disminuyeron tanto en el ciego como en colon en aquellas ratas que consumieron dieta con WEAX, AXOS, WEAX+AXOS y WUAX+WEAX+AXOS. La reducción más fuerte se observó en ratas que consumieron dieta con WEAX, mientras que en las que consumieron dietas con WUAX y WUAX+AXOS no se presentó efecto positivo.
Inmunomodulador
Samuelsen y col. (2011), realizaron ensayos in vitro para determinar la actividad biológica de los AX sobre la habilidad de modular la actividad de NF-kB en monocitos, así como la proliferación de dos líneas celulares del epitelio intestinal (células Caco-2 y HT-29) y sus respectivas secreciones de citosinas tipo IL-8 (interleucina 8). Los resultados mostraron que los AX no presentaron efecto significativo en la proliferación y la secreción de IL-8 de dichas líneas celulares, ni tampoco en la actividad de NF-kB, por lo que no encontraron actividad inmunomodulatoria de los AX.
En otro estudio, se evaluó el efecto inmunomodulador de los AX sobre macrófagos humanos en una línea celular de monocitos (U937), midiendo los niveles de óxido nítrico (Zhang y col., 2016). El óxido nítrico es un mediador en la inflamación y defensas del hospedero mediante diferentes mecanismos de acción. Como resultado, las células U937, tratadas con AX, incrementaron la producción de óxido nítrico con respecto al control: los valores de producción dependieron de la concentración y PM de los AX utilizados. Por lo que se sugirió que los AX pueden aumentar la respuesta innata inmune en ausencia de infección o enfermedad.
Los estudios in vivo han mostrado resultados alentadores respecto a la influencia de los AX en el sistema inmune. Por ejemplo, tanto en ratones sanos, como en ratones infectados con células tumorales, se demostró que la administración intragástrica de WEAX, de cáscara de maíz, induce la reducción de alergias y aumenta la producción de interferóngama y citocinas tipo IL-2, así como la activación de células NK (Natural Killer) (Ogawa y col., 2005). En semejanza con lo anterior, la administración oral de AX a ratones con tumores tipo S180 estimuló la actividad fagocítica de macrófagos y de células NK, la producción de citocinas tipo IL-2 y la proliferación de linfocitos (Cao y col., 2011). En un modelo murino con inducción de tumores NB1691, la terapia con células NK estimuladas con AX (incubación en medio que incluía AX de salvado de arroz), provocó el incremento de la actividad de las células NK e inhibió el progreso de dichos tumores (Pérez-Martínez y col., 2015).
Además, Zhou y col. (2010), demostraron que la actividad inmunoreguladora de AX varía de acuerdo a su estructura. Para lograrlo, administraron oralmente diferentes AX a ratones albinos (BALB/c). El primer AX (AX1) no contenía ácido ferúlico, su contenido de proteína fue de 4 %, con un PM de 351 kDa y un GS de 0.83, mientras que el segundo (AX2), contenía 43 mg ácido ferúlico/100 g AX, un 9 % de proteína, un PM de 32 kDa y un GS de 0.56. Estos autores reportaron que el consumo de ambos polisacáridos ejerció una potente estimulación en la respuesta inmune, mejorando la proliferación de linfocitos. Sin embargo, la mayor fagocitosis de macrófagos se registró en ratones tratados con AX2.
También se reportó que la estructura de AXOS influye en la respuesta del sistema inmune de aves de corral inoculadas oralmente con Salmonella enteritidis (Gartner, 1888; Castellani y Chalmers, 1919). Dichas aves se alimentaron con AXOS de distinto GP durante 37 d. Durante los primeros 11 d, después de la inoculación, se observó que todas las aves tratadas con AXOS inhibieron la colonización de S. enteritidis en el bazo, aunque el mayor porcentaje de inhibición se dio en AX con alto GP (Eeckhaut y col., 2008).
Broekaert y col. (2011), sugirieron que el efecto de los prebióticos en la modulación de la microbiota intestinal no es prueba por sí misma de los efectos benéficos, excepto cuando dicha modulación involucra la disminución de bacterias patógenas y sus efectos dañinos. Sin embargo, esta sugerencia no considera que los prebióticos puedan actuar estimulando selectivamente la actividad de algunos organismos produciendo sustancias benéficas que impactan los procesos del cuerpo, como son el tránsito intestinal, las funciones inmunitarias, el metabolismo de lípidos, el metabolismo energético y la inhibición del desarrollo de tumores, entre otros. En ese sentido, los resultados obtenidos, en los estudios sobre la ingesta de los AX y los AXOS, han puesto de manifiesto la congruencia de ser considerados como promotores de la buena salud, ya que se les ha asociado como posibles agentes reductores de colesterol (Adam y col., 2001), antioxidantes (Ou y col., 2007), antitumorales y benefactores del sistema inmune (Cao y col., 2011) (Tabla 1).
Tabla 1 Estudios in vivo de los efectos benéficos de los arabinoxilanos y arabinoxilo-oligosacáridos en la salud.
Table 1 In vivo studies of the beneficial effect of ferulated arabinoxylans and arabinoxylansoligosaccharides in health.
| Compuestos | Fuente | Especie | Efecto | Referencia |
|---|---|---|---|---|
| Antiobesogénico | ||||
| AX AXOS |
Maíz Trigo Mijo |
Ratas Ratones Hámsters |
Disminución del colesterol plasmático y triglicéridos. Reducción del colesterol hepático, del tamaño de adipocitos y del peso corporal. Decremento del peso corporal y ganancia de peso, reducción del perfil de lípidos en suero, disminución de la acumulación de lípidos en hígado, modulación de la expresión de genes del tejido hepático y adiposo Descenso del colesterol LDL y HDL. |
Lopez y col. (1999) Neyrinck y col. (2011) Neyrinck y col. (2012) Tong y col. (2014) Sarma y col. (2018) |
| Regulador de glucosa | ||||
| AX AXOS |
Trigo Maíz Centeno Mijo |
Ratas Cerdos Humanos sanos Ratones |
Decremento de los niveles de glucosa e insulina en sangre. Incremento de la tolerancia a la glucosa, prevención de endotoxemia metabólica inductora de resistencia a la insulina. |
Hartvigsen y col. (2013) Christensen y col.(2013) Vogel y col. (2012) Sarma y col. (2018) Sandberg y col. (2017) Boll y col. (2016) |
| Antioxidante | ||||
| AX AXOS |
Trigo | Ratas Humanos |
Reducción de la peroxidación de lípidos en suero, hígado y testículos. Incremento de la concentración de ácido ferúlico plasmático. Capacidad antioxi dante del plasma. |
Adam y col. (2002) Ou y col. (2007) Maki y col. (2012) |
| Anticancerígeno | ||||
| AX AXOS |
Trigo Maíz Centeno |
Ratones Ratas Cerdos Humanos |
Inhibición de crecimiento tumoral. Disminución de los metabolitos derivados de la degradación de proteínas. Disminución de lesiones en el colon. Reducción de la actividad de la enzima b-glucuronidasa. |
Femia y col. (2010) Cao y col. (2011) Belobrajdic y col. (2012) Damen y col. (2011) Sugawara y col. (1990) Cloetens y col. (2008) Walton y col. (2012) |
| Inmunomodulador | ||||
| AX | Maíz Trigo Arroz |
Ratones Aves de engorda |
Reducción de alergias. Incremento de la producción de interfe rón-gama y citosina IL-2. Aumento en la actividad de macrófagos, células NK y proliferación de linfocitos. Estimulación de células NK. Inhibición de S. enteritidis en el bazo. |
Ogawa y col. (2005) Cao y col. (2011) Zhou y col. (2010) Eeckhaut y col. (2008) Pérez-Martínez y col. (2015) |
CONCLUSIONES
Los arabinoxilanos y arabinoxilo-oligosacáridos han demostrado estimular el crecimiento y actividad de bacterias benéficas, así como generar respuestas biológicas asociadas a la buena salud del hospedero, por su efecto antiobesogénico, regulador de la glucosa, antioxidante, anticancerígeno e inmunomodulador. Los AX y los AXOS al ser obtenidos de subproductos del procesamiento de los granos de cereales, aportarían un efecto benéfico adicional a la dieta. Es importante destacar que los AX y los AXOS pueden contener en su estructura ácido ferúlico, lo cual les proporciona actividad antioxidante, siendo hasta donde la literatura reporta, el único prebiótico con esta propiedad. Se requiere investigación adicional enfocada a estudiar la relación entre la estructura química de los AX y los AXOS (grado de sustitución, contenido de ácido ferúlico, peso molecular, distribución de arabinosa y ácido ferúlico en la cadena de xilosa) y el efecto prebiótico y promotor de la buena salud de estos compuestos. Es posible que en un futuro cercano, la generación de nuevo conocimiento sobre los AX y los AXOS siente las bases para su aplicación como prebiótico en la industria alimentaria, biomédica o farmacéutica, entre otras, lo cual permitiría además dar valor agregado a los cereales o subproductos de cereales, de los cuales pueden ser extraídos estos componentes.











 nova página do texto(beta)
nova página do texto(beta)



