INTRODUCCIÓN
Los cereales son la fuente de energía y nutrientes más importante en la alimentación humana y animal (Serna-Saldivar, 2010; Koehler y Wieser, 2013), distinguiéndose entre ellos el trigo, del cual se obtiene harina como producto principal; salvado y germen como subproductos (Dexter y Sarkar, 2004). La harina se utiliza para la elaboración de una gran variedad de alimentos, destacando los productos de la panificación. Por otro lado, el salvado se destina en su mayor parte a la alimentación animal (Heuzé y col., 2013) y tradicionalmente ha recibido menor atención en lo que respecta a sus propiedades nutrimentales, fitoquímicas y funcionales, por lo que su utilización para consumo humano se ha basado en aplicaciones específicas, apreciándose principalmente por su alto contenido de fibra insoluble (Prückler y col., 2014).
En la actualidad, se encuentran documentadas una serie de propiedades del salvado que son benéficas para la salud humana, gracias a sus componentes, entre los que se incluyen la fibra dietaria, proteínas, minerales, vitaminas del complejo B, vitamina E, compuestos fenólicos, luteina, antocianinas, tocotrienoles y ácido fítico (Nogata y Nagamine, 2009; Shewry 2009; Fardet, 2010; Brewer y col., 2014; de-Mora 2015; Onipe y col., 2015; Kawaguchi y col., 2017). Estos compuestos nutricionales y bioactivos son importantes en la prevención de enfermedades degenerativas (Javed y col., 2012; Rosa-Sibakov y col., 2015), por lo que el consumo del salvado ha tendido a incrementarse en los últimos lo años (Javed y col., 2012; Prückler y col., 2014).
De entre los componentes del salvado de trigo, sus proteínas han sido las menos estudiadas, a pesar de tener mayor calidad que las de la harina de este cereal, debido a un mejor balance de aminoácidos (Stevenson y col., 2012). Esto es de destacarse, ante la demanda permanente por diversas fuentes de proteína barata, no solo por su importancia en la nutrición sino también por su potencial uso como ingredientes funcionales en la industria de los alimentos (Idris y col., 2003). Sin embargo, la extracción eficiente de las proteínas del salvado se encuentra restringida por factores anatómicos propios del grano, por lo que el proceso global podría ser económicamente inviable en términos de las aplicaciones tradicionales.
El objetivo del presente trabajo fue dar a conocer las propiedades y usos potenciales de las proteínas del salvado de trigo.
Composición y usos del salvado de trigo.
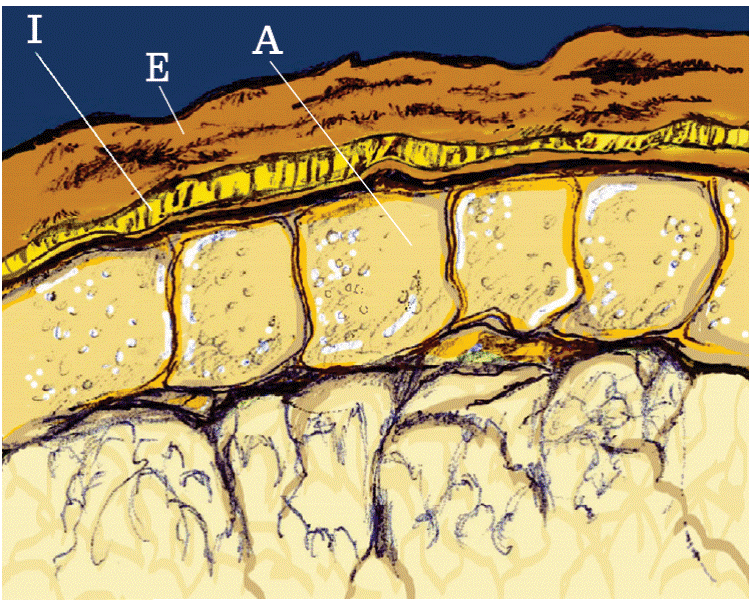
El trigo (Triticum aestivum L.) ha sido cultivado desde inicios de la civilización (Javed y col., 2012) y actualmente es el tercer cereal con mayor producción a nivel mundial, con un volumen anual de alrededor de 729 millones de T (FAOSTAT, 2016). El grano de trigo se compone de varios tejidos, los cuales se esquematizan en la Figura 1. El germen o embrión, es el órgano reproductivo y de almacenamiento y representa entre 2 % y 3 % del peso del grano. El endospermo, principal fuente de energía durante la germinación, es la parte anatómica más abundante (81 % a 84 % del peso del grano). El pericapio (salvado) está constituido por un conjunto de capas que protegen al grano y comprende entre 14 % y 16 % del peso de este último (Corke, 2004).
El endospermo es extraído mediante molienda para la obtención de harina y semolina, que son utilizadas en las industrias de panificación, galletería y pastas, mientras que el germen y el pericarpio se recuperan como subproductos (Nandini y Salimath, 2001; Dexter y Sarkar, 2004; Stevenson y col., 2012). Solamente un 10 % del salvado producido se destina a la alimentación humana, principalmente como fuente de fibra en pan, galletas, cereales y otros (Hossain y col., 2013; Prückler y col., 2014); el resto se dirige a la alimentación animal (Javed y col., 2012; Heuzé y col., 2013; Reisinger y col., 2014). De acuerdo con los datos de producción mundial de trigo y el porcentaje de este cereal que se destina a la molienda para consumo humano (CANIMOLT, 2014; FAO STAT, 2016), se estima que la cantidad de salvado obtenida anualmente es de alrededor de 74 millones de T, lo cual es interesante desde la óptica del valor agregado.
El término salvado es coloquial, pues anatómicamente se conoce como pericarpio (Balandrán-Quintana y col., 2015) y consiste de tres secciones identificadas como pericarpio exterior, pericarpio interior y capa aleurona, respectivamente (Figura 2). El pericarpio exterior rodea a la semilla y está morfológicamente compuesto por tres capas de células muertas (epidermis, hipodermis y capa interna). El pericarpio interior se constituye de células tubulares y células cruzadas, así como por la testa o cubierta de la semilla, la cual contiene los pigmentos que dan el color característico al grano. La capa aleurona es una monocapa de células vegetativas que rodea y cubre enteramente al germen y al endospermo. La aleurona pertenece al endospermo, pero se considera la capa más interna del salvado, debido a que permanece adherida a este después de la molienda (Corke, 2004).
La composición química del salvado de trigo es compleja. En la Tabla 1 se presentan los componentes más representativos, entre los que destacan la fibra dietaria total, principalmente fibra insoluble lignificada (Rosenfelder y col., 2013), las proteínas y, en menor proporción, lípidos y cenizas. Así mismo, se observa un nivel relativamente alto de ácido fítico, que constituye la reserva de fósforo del grano y el cual es considerado un factor anti nutricional, ya que puede interferir con la absorción de minerales como Fe, Mg, Zn y Ca (Stevenson y col., 2012; Prückler y col., 2014; Reisinger y col., 2014). Entre los compuestos fenólicos, el ácido ferúlico es importante y se encuentra esterificando algunos residuos de arabinosa de los arabinoxilanos, los cuales son polisacáridos que representan mayormente a la fibra dietaria en el salvado de trigo (Morales-Ortega y col., 2013).
Table 1 Chemical composition of wheat bran.
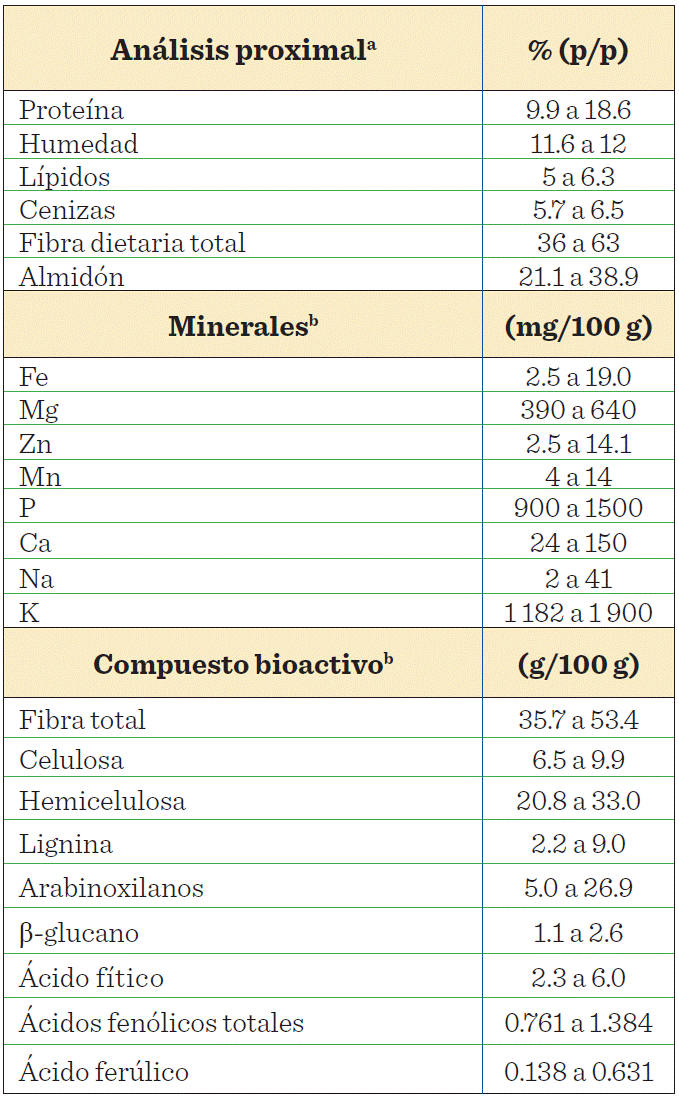
Modificado a partir de: bFardet (2010); aCurti y col. (2013).
Entre los usos no convencionales propuestos para el salvado de trigo está su potencial como sustrato para la producción de hongos соmestibles (Locci y col., 2008) y como fuente de azúcares fermentables para procesos biotecnológicos, por ejemplo la producción de bioetanol (Favaro y col., 2013). También se ha estudiado su capacidad para la remoción de metales pesados (Kanwal y col., 2013) y su factibilidad como componente en el diseño de empaques biodegradables (Fama y col., 2010). Sobre usos alternativos de las proteínas de salvado de trigo se ha investigado muy poco.
Proteínas de salvado de trigo
Dependiendo del cultivar, el salvado de trigo contiene entre 9.9 % y 18.6 % en peso de proteínas (Shewry y col., 2009; Apprich y col., 2014; Reisinger y col., 2014), las cuales se distribuyen en tres grandes capas (Figura 2). El contenído de proteínas del pericarpio exterior es de 0.4 mg/g, la capa intermedia contiene 3.6 mg/g y la capa aleurona 156 mg/g, lo cual representa el 0.25 %, 2.25 % y 975 % del total de las proteínas encontradas en el salvado, respectivamente. Es decir, la aleurona contiene la gran mayoría de las proteínas del salvado (Jerkovic y col., 2010), las cuales representan además un 20 % del total de las proteínas del grano del trigo, de ahí la importancia de su estudio.
En el grano en desarrollo, las proteínas de salvado desempeñan funciones metabólicas; mientras que en el grano maduro, constituyen una reserva de nitrógeno y también están involucradas en la defensa contra estreses bióticos y abióticos. Debido a su composición en aminoácidos, estas proteínas son de mayor valor biológico que las del endospermo, y su digestibilidad es cercana a la de la caseína; esta última considerada como proteína de referencia (Woerman y Satterlee, 1974). De acuerdo con los datos de producción anual mundial de trigo y el porcentaje destinado a la molienda, se calcula que aproximadamente 12 millones de T de proteínas de buena calidad podrían estar siendo subutilizadas (CANIMOLT, 2014; FAO STAT, 2016).
De acuerdo con su solubilidad, las proteínas de los cereales se han clasificado tradicionalmente como albúminas, globulinas, prolaminas y glutelinas (Koehler y Wieser, 2013). Las albúminas son solubles en agua; las globulinas en soluciones diluidas de NaCl; las gliadinas (prolaminas de salvado de trigo) en alcohol al 70 % y las glutelinas en soluciones acidas y básicas diluidas (Goesaert y col., 2005; Šrámková y col., 2009; Koehler у Wieser, 2013). Dicha solubilidad hace posible extraer las proteínas secuencialmente. Jones y Gersdorff (1923), extrajeron las proteínas de salvado de trigo en esta forma por vez primera, encontrando un 16.6 % de albúminas, 13.6 % de globulinas y 31 % de prolaminas. En otro estudio, se reportó 23.5 % de albúminas, 15.5 % de globulinas, 18.5 % de prolaminas у 25.5 % de glutelinas (Idris y col., 2003). Las diferencias entre autores pueden deberse al método de preparación del salvado, previo a la extracción.
Las proteínas de los cereales también se pueden clasificar como de reserva y como biologicamente activas (enzimas) (Fabian y Ju, 2011). Las proteínas de salvado de trigo, esencialmente albúminas y globulinas, despliegan ambas funciones (Jerkovic y col., 2010; Meziani y col., 2012; Koehler y Wieser, 2013), aunque probablemente también desempeñan algún papel estructural (Rhodes y Stone, 2002). Las proteínas de las capas externa e intermedia son básicamente enzimas que actúan contra el estrés oxidativo y contra patógenos que sobreviven a la deshidratación, enzimas hidrolíticas necesarías para la germinación, así como inhibidores de otras enzimas (Jerkovic y col., 2010; Koehler y Wieser, 2013). Las proteínas de la capa aleurona están constituidas en un 58 % por globulinas, aproximadamente, cuya función principal es la de reserva para su uso durante la germinación; el restante 42 % tiene actividad enzimática (Jerkovic y col., 2010; Meziani y col., 2012).
En las capas externas del salvado de trigo se han identificado las enzimas oxalato oxidasa y de transferencia de lípidos, así como lipoxigenasa; en la fracción interna están reportadas la oxalato oxidasa, inhibidor de xilanasa I, quitinasa, endoquitinasa, α-amilasa y taumatina, mientras que las proteínas de la capa aleurona están constituidas por globulinas, proteínas de almacenamiento de la superfamilia cupina y la globulina 7S de trigo (Jerkovic y col., 2010). Por otro lado, en el extracto acuoso de la capa exterior se ha observado la presencia de proteínas de defensa, como la polifenol oxidasa, peroxidasa y oxalato oxidasa (Jerkovic y col., 2010). En otro estudio se identificaron 142 proteínas en la aleurona de trigo, de las cuales, el 57 % son proteínas de reserva, 16.2 % están involucradas en el metabolismo de carbohidratos y 17.6 % en la defensa contra el estrés (Meziani y col., 2012).
Las proteínas de salvado de trigo son de alta calidad nutricional, ya que presentan una composición balanceada y rica en aminoácidos esenciales como lisina (Lys), triptófano (Trp) y metionina (Met), los cuales son deficientes o limitantes en la harina de trigo (Shewry y col., 2009). Las proteínas de salvado tienen un contenido de Lys que es casi el doble del encontrado en la harina (Cornell, 2003; Shewry y col., 2009) y representa el 4.5 % del total de los aminoácidos del salvado (Corke, 2004); además, contienen arginina (Arg), alanina (Ala), ácido aspártico (Asp), glicina (Gly) y, en menor proporción, ácido glutámico (Glu), prolina (Pro) y fenilalanina (Phe), así como aminoácidos azufrados, como la cisteína (Cys) (Apprich y col., 2014; De-Brier y col., 2015). En la Tabla 2 se muestra la composición de aminoácidos del grano de trigo y de las principales fracciones de la molienda, destacándose el contenido de 5 aminoácidos esenciales (histidina, lisina, treonina, valina y triptófano), el cual es mayor en el sa!vado que en la harina (Shewry y col., 2009).
Tabla 2 Contenido de aminoácidos del grano de trigo entero y de las fracciones de la molienda (g/100 g de proteína).
Table 2 Aminoacid content of the whole wheat grain and millling fractions (g/100 protein).
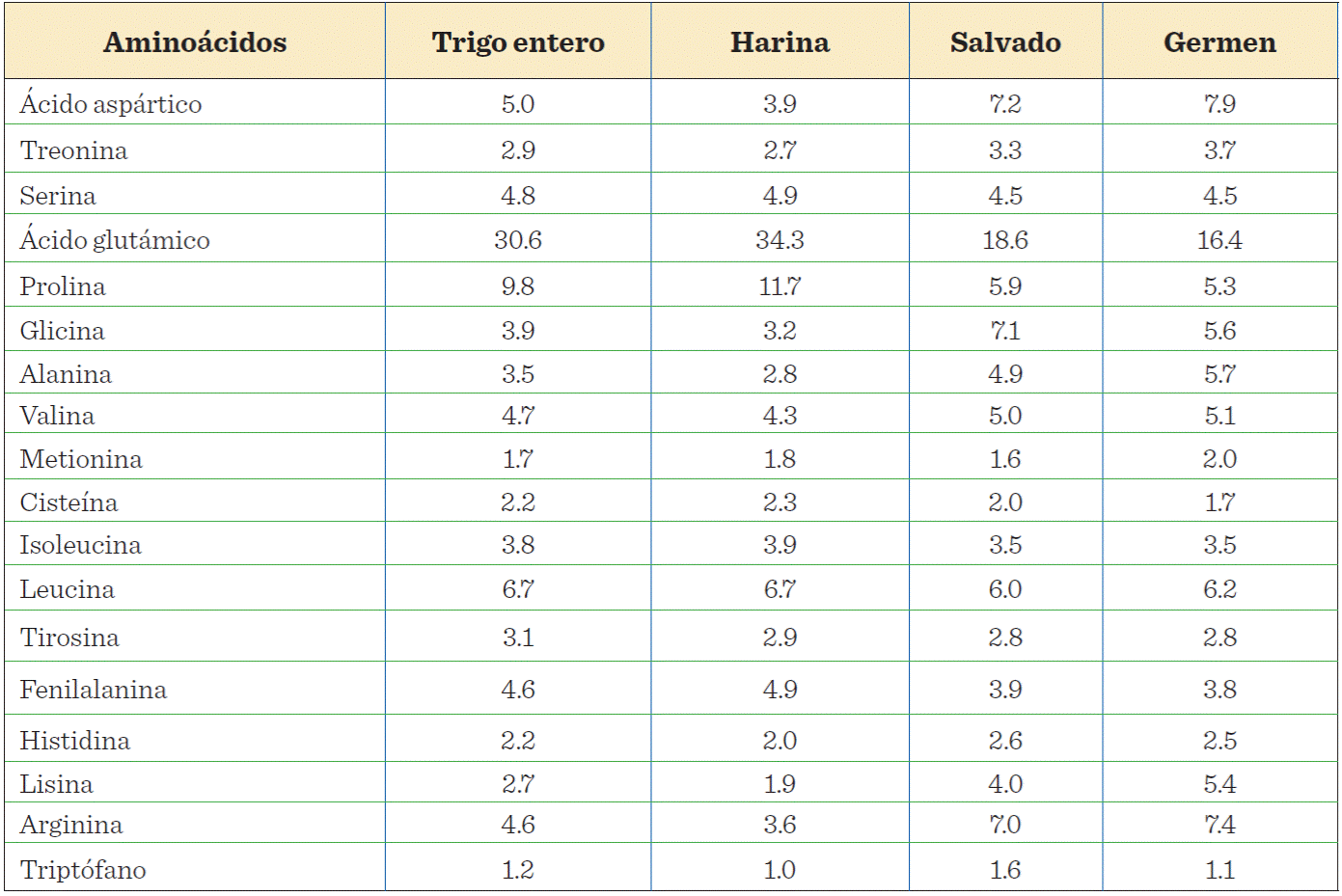
Modificado a partir de Shewry y col. (2009).
La razón de eficiencia proteica (PER, por sus siglas en inglés: Protein Efficiency Ratio) es otro factor que contribuye al valor biológico y nutricional de las proteínas extraídas del salvado de trigo. La PER de un concentrado de proteínas de salvado de trigo es de 2.07 (Woerman y Satterlee, 1974), ligeramente menor al de la caseína (2.50), pero mucho mayor que el de trigo entero (1.07) o la harina (0.59), mientras que la digestibilidad es de 89.9 %, en comparación con un 92.8 % para la caseína.
Extracción de las proteínas de salvado de trigo
La obtención de concentrados o aislados proteicos del salvado de trigo representa un gran desafío. Estas proteínas son difíciles de extraer, pues la mayor parte de ellas son globulinas que se encuentran en las células de la capa aleurona, cuya pared celular compuesta por polisacáridos dificulta su accesibilidad (Shewry y col., 2009; Meziani y col., 2012). Además, muchas de las proteínas de la capa aleurona tienden a asociarse a carbohidratos comо los arabinoxilanos (Rhodes y Stone, 2002), y a formar complejos con el ácido fítico (Martínez y col., 2002). En lo que respecta a las proteínas solubles en agua, es decir las albúminas, a pesar de que esta fracción se extracta facilmente a temperatura ambiente, las sales minerales presentes en los tejidos son coextraídas, requiriendo de varias etapas de purificación, así como precipitación repetitiva, ultra centrifugación y/o diálisis (Chaquilla-Quilca y col., 2016). Aún con estas limitantes, se han obtenido diferentes concentrados y aislados proteicos a partir del salvado de trigo, principalmente mediante extracción húmeda alcalina, en cuyo proceso influyen factores como el pH, tiempo, temperatura y tamaño de partícula. El tema de la extracción de proteínas de salvado de trigo ha sido revisado en mayor detalle por Balandrán-Quintana y col. (2015) y Balandrán-Quintana (2018). En el presente trabajo solo se describen brevemente los aspectos más relevantes.
Los primeros intentos por extraer y aprovechar las proteínas de salvado de trigo datan de las décadas de 1960 y 1970. Fellers y col. (1966), reportaron la extracción mediante lavado con álcali a pH 10.5, encontrando una influencia del tamaño de partícula sobre el rendimiento de extracción: a menor tamaño de partícula mayor rendimiento. Saunders y col. (1975), también utilizaron la extracción húmeda alcalina y obtuvieron un concentrado con 65 % de proteína, con rendimientos en el intervalo 15 % a 25 %. En otro estudio se optimizó el proceso de extracción mediante el uso de las enzimas celulasa, hemicelulasa y pectinasa, posterior al tratamiento alcalino a pH 8.5, lográndose rendimientos de hasta 38.5 % (Waszczynskyj y col., 1981). Por otro lado, Roberts y col. (1985), observaron condiciones óptimas de extracción a temperatura ambiente, pH 6.5, 16 h y un tamaño fino de partícula; también emplearon la enzima celulasa para degradar la fibra e incrementar el rendimiento, el cual no se vio favorecido.
La mayoría de los concentrados de proteína de salvado de trigo obtenidos mediante extracción alcalina han sido utilizados en el enriquecimiento de productos de panificación y galleteria (Haque y col., 2002; Prückler y col., 2014). La extracción alcalina constituye un factor restrictivo, debido a que se puede dañar la calidad nutricional y alterar las propiedades funcionales de las proteínas, por lo cual es deseable el uso de métodos menos agresivos. Se ha encontrado que la fermentación o el uso de cócteles de carbohidrasas no afecta la solubilidad de las proteínas de salvado de trigo, sin embargo, mediante la activación de proteasas endógenas o bien, mediante el uso de proteasas exógenas, dicha solubilidad se puede aumentar hasta en un 10 %; aunque este procedimiento no tiene gran efecto sobre las proteínas de la aleurona (Arte y col., 2015; 2016). También se ha recurrido al uso de métodos físicos, entre los cuales la explosión de vapor ha resultado ser el más pro metedor, ya que se ha reportado una solubilidad de proteínas casi cinco veces superior a la obtenida en los controles (Zhao y col, 2015).
Propiedades funcionales de las proteínas de salvado de trigo
El uso de proteínas vegetales como ingredientes en sistemas alimenticios se basa en sus propiedades funcionales, i.e., solubilidad en agua, capacidad de emulsificación, capacidad de formar espuma, capacidad de absorción de agua y aceite y gelificación (Fabian y Ju, 2011; Воlontrade y col., 2016). La solubilidad es uno de los atributos más importantes de las proteínas, ya que influye directamente en el resto de las propiedades funcionales.
Muy poco se ha investigado sobre las propiedades funcionales de las proteínas del salvado de trigo. Se ha determinado que la digestibilidad, el perfil de aminoácidos y la capacidad de absorción de grasa de las proteínas contenidas en una mezcla de salvado de trigo grueso y fino, germen y harina (lo que en el argot molinero se conoce como "millrun"), las hace factibles de utilización como enriquecedores de harina, para la elaboración de pan (Saunders y col., 1976). Sin embargo, el metodo de obtención es complejo y laborioso, además de que no se utilizó solo salvado. En un estudio realizado con salvado de trigo se extrajeron las proteínas totales mediante extracción alcalina y precipitación ácida con calor, seguido de diálisis y liofilizado, y se determinaron algunas de sus propiedades funcionales (Idris y col., 2003). Las solubilidades mínima y máxima de nitrógeno se obtuvieron a pH de 5.5 y 11.5, respectivamente. La capacidad de emulsificación y estabilidad de la emulsión, así como la capacidad de formar espuma y estabilidad de la misma, se vieron muy afectadas por el pH y la concentración de sales. Dichas capacidades fueron mayores a pH alcalino y bajas concentraciones de sal. La concentración mínima para la gelificación de proteínas de salvado de trigo disueltas en NaCl 1.0 M fue de 16 %.
De dichos estudios, se observa que, para la extracción y aprovechamiento de las propiedades funcionales de las proteínas totales de salvado, es necesaria la extracción mediante métodos complejos y pH alcalino, por lo que prevalece el problema de la agresividad química, además de que se pone en duda la rentabilidad del proceso.
Posibilidades de innovación para las proteínas de salvado de trigo
La constante necesidad por innovaciones tecnológicas podría ser una plataforma para dar valor agregado a las proteínas de salvado de trigo. Se ha reportado el potencial que tienen los hidrolizados de proteínas de salvado de trigo como inhibidores de oscurecimiento enzimático, logrando reducciones de hasta 40 % en la actividad de polifenol oxidasa de manzana (Campas-Ríos y col., 2012) y de 24 % en la de tirosinasa de champiñón (Ortíz-Estrada y col., 2012).
Otro enfoque, es la formación de nanopartículas proteicas para el transporte y entrega de compuestos bioactivos y fármacos, tal y como se ha reportado para otros sistemas proteicos. Se han fabricado nanopartículas a partir de proteínas, como la gelatina, proteínas de soya y albúminas (Lohcharoenkal y col., 2014). La ventaja de las albúminas es que son biocompatibies y biodegradables (Elzoghby y col., 2012; Yedomon y col., 2013; Lohcharoenkal y col., 2014). Además, tienen un alto potencial para su uso como soporte en la liberación controlada de fármacos (in vitro e in vivo) (Patil, 2003; Wongsasulak y col., 2010).
Las albúminas más utilizadas para la fabricación de nanорarticulas son las de suero һumano y de bovinos. También se han realizado estudios con proteínas de soya y de semillas de girasol (Nesterenko y col., 2013), así como con α-lactoalbúmina del suero de leche, para la obtención de nanoestructuras, como nanotubos y nanodiscos (Graveland-Bikker y col., 2004; Balandrán-Quintana y col., 2013). Tales nanopartículas pueden tener una diversidad de aplicaciones en las industrias de alimentos y farmacéutica. Respecto al salvado de trigo, hay reportes sobre la formación de nanotubos y nanopartículas esféricas a partir de extractos acuosos ricos en albúminas (Chaquilla-Quilca y col., 2016; Luna-Valdez y col., 2017), sin embargo, aún hace falta estudiar sus posibles aplicaciones.
El desarrollo de matrices para biomineralización artificial es otra perspectiva innovadora. La biomineralización in vivo consiste en la formación de cristales minerales mediante la deposición de iones precursores sobre una matriz orgánica, constituida por proteínas y polisacáridos, dando lugar a estructuras macroscópicas con propiedades mecánicas únicas, por ejemplo, la cascara de huevo, los dientes, los huesos, los caparazones de los artrópodos, las conchas de los moluscos y los corales (Veis y Dorvee, 2013; Addadi y col., 2016).
La biomineralización artificial se estudia induciendo la mineralización sobre geles de proteína y/o polisacáridos de alta pureza (Asenath-Smith y col., 2012; Rauner y col., 2014). Es un tema de vanguardia, ya que se podrían producir estructuras con capacidad para la regeneración de tejido óseo, implantes dentales o una variedad de materiales con diferentes aplicaciones industriales (Chabanon y col., 2016). Los extractos acuosos del salvado de trigo, que tienen cantidades altas de proteína, carbohidratos y iones fosfato, podrían servir como matrices para inducir la biomineralización de diferentes polimorfos de fosfato de calcio. Esta es una línea de investigación reciente sobre la que se está trabajando y de la que ya se hicieron los primeros reportes preliminares (Luna-Valdez y col., 2016); se considera que tiene un gran potencial.
En perspectiva, aunque se podría ver económicamente inviable la extracción tradicional alcalina de las proteínas de salvado de trigo, debido a la matriz de polisacáridos que las protege (factores anatómicos del grano), bajo un esquema de aprovechamiento integral del salvado de trigo, podría aprovecharse la fracción de proteínas solubles en agua, debido a su facilidad de extracción. Entre las alternativas innovadoras para el uso de estas proteínas está la producción de péptidos bioactivos, la prevención del oscurecimiento enzimático y la posibilidad de su uso en nanotecnología para la fabricación de nanopartículas o bien como matrices para procesos de biomineralización artificial (Balandrán-Quintana y col., 2015).
CONCLUSIONES
Las tecnologías emergentes en la industria alimentaría, como la nanotecnologia y la biomineralización artificial, representan alternativas viables para el aprovechamiento de las más de 12 millones de toneladas de proteínas de salvado que se considera se desperdician actualmente a nivel mundial. Sin embargo, es necesario optimizar los procesos de extracción para incrementar su rentabilidad y preservar o mejorar sus propiedades funcionales.











 nova página do texto(beta)
nova página do texto(beta)