INTRODUCCIÓN
La violencia sexual consiste en la realización de todo acto sexual sin consentimiento ni deseo por parte de la víctima e implica utilización de fuerza física o intimidación (OMS, 2013). Tiene un impacto profundo en la salud física y mental de las víctimas y se encuentra asociada tanto a lesiones físicas como a un aumento del riesgo de padecer una serie de problemas de salud sexual y reproductiva, con consecuencias inmediatas y a largo plazo (Arroyo-Sánchez, 2016).
Este delito constituye un problema global, tanto en términos geográficos, como en el hecho de que no distingue entre edad y sexo (Cortés-Arboleda y col., 2011). En América Latina es uno de los problemas más graves de salud pública por su asociación con enfermedades venéreas, embarazos no deseados y problemas psicológicos (Fernández-Moreno, 2015). Anualmente se reportan 87 589 violaciones en América Latina y el Caribe, lo que representa aproximadamente 240 denuncias diarias con una tasa regional de 16.4 por cada 100 000 habitantes, según datos reportados en 2011 a la Oficina de las Naciones Unidas contra la Droga y el Delito (UNODC, por sus siglas en inglés: United Nations Office on Drugs and Crime), por la mayoría de los países, con excepción de Nicaragua (2010), Guatemala y Perú (2009), Argentina (2008), Ecuador (2006) y Suriname (2004) (Fleitas, 2014). Al respecto, el Observatorio de Criminalidad del Ministerio Público del Perú (Ministerio Público Fiscalía de la Nación, 2014) reportó que se recibieron 17 763 denuncias por el delito contra la libertad sexual en todo el país, correspondiendo a la ciudad de Lima una tasa de 37.96 por cada 100 000 habitantes. Además se señala que el 75 % de las víctimas fueron menores de edad y que el 34 % fueron ultrajadas sexualmente (Aguilar-Cabrera, 2013; Sánchez, 2015).
En Estados Unidos se publicaron estudios que demuestran índices significativamente más altos de agresión sexual en el ejército, en comparación con reportes civiles, exacerbando la gravedad de este problema (Stander y Thomsen, 2016). Por otro lado, en México, Andrade-Rubio (2016), reportó una asociación, ya sea como causa o consecuencia, entre la violación sexual y la migración de las mujeres dedicadas al trabajo agrario en Tamaulipas.
Los movimientos feministas no solo han contribuido a visibilizar la discriminación y violencia contra las mujeres, sino a impulsar un proceso de reivindicación que procura la equidad de género y la construcción de políticas públicas coherentes con sus necesidades reales. En este marco, las víctimas conscientes de sus derechos, asumen los hechos de violencia sexual no como una valoración social a esconder, sino que realizan las denuncias pertinentes para procurar la detención del culpable (Afanador-Contreras y Caballero-Badilla, 2012). A menudo, las víctimas que deciden reportar un delito sexual buscan ayuda a través de la policía, desde donde son remitidas a un centro de salud para realizar una valoración médica, o incluso las víctimas acuden de manera directa a los servicios de salud (Arroyo-Sánchez, 2016). Estos delitos se caracterizan por la ausencia de testigos, y el laboratorio adquiere importancia en la valoración, siendo el semen el indicio más importante en este tipo de hechos (Espín-Falcón y col., 2008). El estudio del fluido seminal en química forense está relacionado con el derecho penal e involucra delitos de índole sexual, frecuentes en medicina legal (Támara, 2013).
En medicina legal es esencial rastrear la evidencia y tomar muestras del material biológico para documentar el presunto contacto sexual o físico, así como corroborar la historia de la víctima y el presunto agresor, para recabar información que resulte útil en la resolución del proceso legal. Dentro de la evidencia que se debe tomar tempranamente está la ropa íntima de la víctima, muestras de la cavidad oral en casos donde se haya referido sexo oral como parte de la agresión, muestras de las manos y uñas, así como muestras de piel (Arroyo-Sánchez, 2016).
La valoración médico legal proporciona evidencia de la agresión tendiente a facilitar la identificación, enjuiciamiento, condena y castigo de los ofensores. A pesar de lo importante que es obtener esta evidencia, debe alcanzarse un balance entre la adquisición de las muestras y la atención de las demás necesidades de la víctima, en tanto que una conducta insensible o forzosa, al realizar el examen forense, podría convertirse en "una segunda violación" (Dickens, 2015).
En los delitos sexuales, la valoración médico forense se realiza bajo un protocolo estandarizado. La toma de las muestras, con el consentimiento informado de la víctima, debe tener en cuenta las características y circunstancias en que ocurrieron los hechos y el tiempo transcurrido. En todo momento se debe garantizar la cadena de custodia y quedar documentada. Aún cuando el indicio más categórico es el semen, el no hallazgo del mismo no implica la ausencia de acceso carnal, solo la falta de eyaculación del autor; de la misma manera, la presencia del indicio, o sea del semen, no indica presencia del delito, sino solo la realización del acto, cobrando importancia la intervención y el análisis del laboratorio forense (Vega-Vega y col., 2014).
El semen está compuesto mayoritariamente por la secreción de las glándulas sexuales anexas y un pequeño porcentaje: 2%a3% por espermatozoides (López-García y col., 2012).
El 46 % al 80 % del fluido seminal es aportado por las vesículas seminales, 13 % a 33 % es secretado por la glándula prostática, aproximadamente 5 % proviene de los testículos y el epidídimo, y 2 % a 5 % de la secreción de las glándulas uretrales y bulbouretrales. En cuanto a la composición química del semen, contiene mayoritariamente ácido cítrico, aminoácidos libres, fructosa, fibrinógeno, enzimas, fosfatidilcolina, carnitina, prostaglandinas, potasio y cinc (Carma, 2010).
El elemento fundamental en la identificación del fluido seminal es el hallazgo del espermatozoide, compuesto por cabeza, segmento intercalar o intermedio y cola o flagelo. La cabeza presenta forma ovalada vista de frente y piriforme de perfil; mide de 4 μm a 5 μm de longitud y 2.5 μm a 3.5 μm de ancho. Contiene el núcleo haploide con cromatina compacta altamente resistente a la digestión, el acrosoma en la parte anterior y un par de centríolos detrás del núcleo (distal y proximal). El acrosoma es una estructura tipo capuchón, contiene enzimas hidrolíticas como hialuronidasa, acrosina, fosfatasa ácida y neuraminidasa, que facilitan la penetración del espermatozoide a la zona pelúcida del ovocito (WHO, 2010). El segmento intercalar es una región cilíndrica estrecha, de 5 μm de longitud, que une la cabeza con la cola o flagelo, y contiene la carga mitocondrial que provee la energía necesaria (ATP) para la movilidad del espermatozoide (WHO, 2010). La cola o flagelo es una estructura importante para la movilidad del espermatozoide. Tiene una longitud de 40 μm a 50 μm, desenrollada y uniforme. En la parte central del flagelo y en toda su extensión se encuentra el axonema o filamento axial, que es un sistema microtubular formado por un par central rodeado de nueve pares de microtúbulos periféricos y permite el desplazamiento con movimiento ondular de la gameta masculina (WHO, 2010).
Entre los componentes químicos del plasma seminal, el cinc secretado por la glándula prostática, se encuentra en concentración 100 veces superior al suero sanguíneo, reuniendo las características suficientes para ser utilizado como marcador forense de presencia de semen (Pavesi y col., 2010). La fosfatasa ácida prostática (FAP), es sintetizada por la glándula prostática y secretada en el semen durante la eyaculación. La actividad de FAP está incrementada en el fluido seminal y es detectable aun en muestras sometidas a condiciones desfavorables, como la exposición a temperaturas elevadas; su determinación es un recurso aplicable a la búsqueda de semen, adquiriendo importancia como marcador forense en casos de muestras azoospérmicas (no contienen espermatozoides) u oligozoospérmicas (concentración espermática menor a 15 millones por mL de semen) (Pavesi y col., 2008). Otro marcador de presencia de fluido seminal es la determinación de la enzima lactato deshidrogenasa (LDH), cuya actividad en plasma seminal es superior al valor en suero y además, la isoenzima LDH C4 es específica del epitelio seminal (Pavesi y col., 2011). La detección de componentes del fluido semi nal es importante, sin embargo, el diagnóstico de certeza de la presencia de semen es el hallazgo de al menos un espermatozoide.
Aunque el hecho de no observar un espermatozoide en las muestras examinadas no excluye la presencia de semen, dado que por la fragilidad del espermatozoide a nivel del segmento intercalar pueden aparecer sólo cabezas espermáticas, que debido a su morfología ovoide y longitud de 4 μm a 5 μm, pueden confundirse con levaduras en las observaciones microscópicas en fresco, e incluso con coloración de Gram-Nicolle, ya que los espermatozoides se colorean como Gram negativos y las levaduras son Gram variables.
Ante la elevada frecuencia de muestras forenses clasificadas como presuntivas, es un desafío buscar métodos confiables que permitan corroborar la presencia de cabezas de espermatozoides, logrando un punto de inflexión en la química forense, dado que el hallazgo certero de cabezas de espermatozoides permite confirmar la presencia de semen y además en las cabezas espermáticas se encuentra el ácido desoxirribonucleico (ADN), permitiendo la identificación del agresor. Por otra parte, el no hallazgo de espermatozoides en el material proveniente de una violación puede deberse a que el causante del delito es azoospérmico o puede haber utilizado preservativo, y es otra de las situaciones en las que un ensayo de laboratorio puede dar resultado negativo (Támara, 2013; Turvey, 2014).
El objetivo de este estudio fue reconocer espermatozoides humanos en muestras contaminadas con levaduras.
MATERIALES Y MÉTODOS
Se trabajó con muestras seminales provenientes de pacientes del Laboratorio Mixto de Reproducción de las Facultades de Ciencias Bioquímicas y Farmacéuticas y de Ciencias Médicas de la Universidad Nacional de Rosario, radicado en el Hospital Provincial del Centenario de la ciudad de Rosario en la provincia de Santa Fe de la República Argentina. El proyecto fue revisado y aprobado por evaluadores designados por la Secretaría de Ciencia y Tecnología y el Comité de Ética de dicha Secretaría. Todos los pacientes entregaron su consentimiento informado, para que el remanente de la muestra de semen, luego de procesar e informar las determinaciones indicadas por el médico solicitante, se utilicen con este propósito. Se seleccionaron 46 muestras de semen fresco, que se dividieron en dos grupos: G1 (n = 28) integrado por muestras de semen normo u oligozoospérmicas con concentración espermática entre 10 millones por mL y 30 millones por mL de semen; y G2 (n = 18) muestras seminales azoospérmicas: sin espermatozoides y sólo contenían fluido seminal. Se tomó 1 mL de cada una de las muestras y se diluyó en proporción 1:1 con solución fisiológica. A cada tubo se le adicionaron 0.05 mL de suspensión de levaduras Candida albicans, conteniendo 20 millones de células/mL, contadas utilizando una cámara de Neubauer (bright-line HBG, Germany) provenientes de un cultivo en medio Sabouraud-glucosa. Como control de la observación microscópica de las células a identificar (espermatozoides y levaduras), se procesaron testigos puros, consistentes en: una muestra con espermatozoides en concentración de 20 millones de espermatozoides/mL en solución fisiológica (Ce) y una muestra con levaduras en concentración de 20 millones de células/mL en el mismo medio (CL) (Guarner y Brandt, 2011; Villarroel-Rodríguez y Santa-Cruz-Rodríguez, 2011). Todas las muestras analizadas se procesaron por duplicado y como resultados se tomaron los promedios de los porcentajes de espermatozoides y de levaduras hallados en los duplicados. Se apli caron diferentes tinciones y recursos microscópicos con el fin de identificar con certeza espermatozoides y levaduras.
Identificación de espermatozoides aplicando microscopio óptico
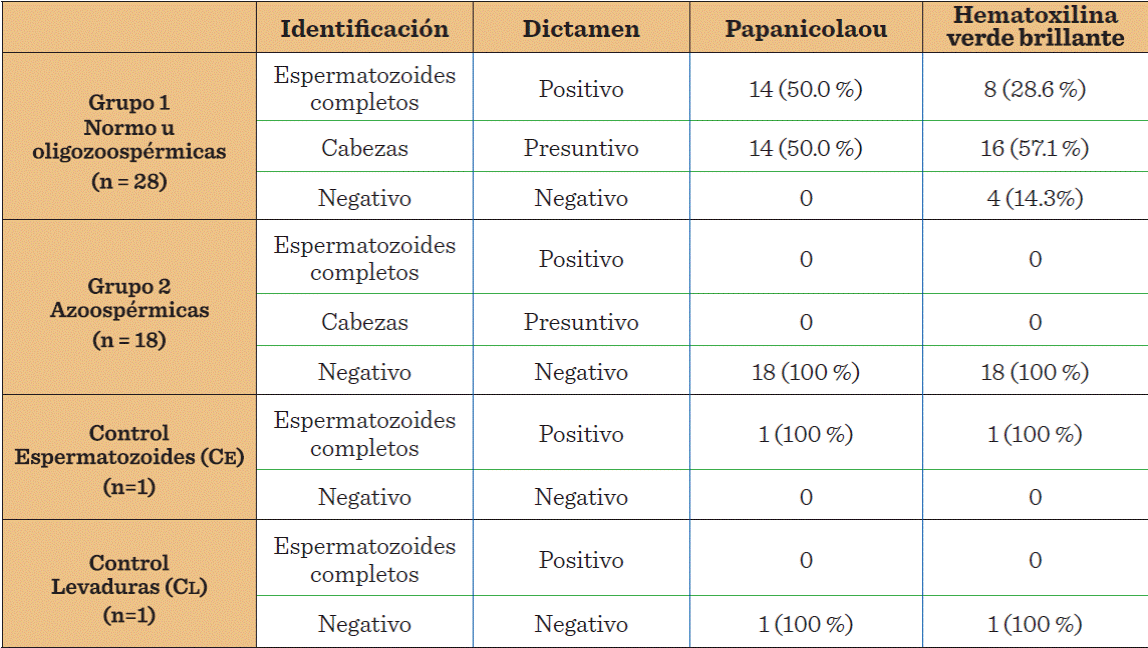
Se analizó la eficiencia de las tinciones hematoxilina verde brillante y Papanicolaou para identificar la presencia de espermatozoides, a través de sus características morfológicas, en muestras normo u oligozoospérmicas (G1); además, se analizaron las muestras azoospérmicas (G2) y los controles de espermatozoides y levaduras, para evaluar resultados falsos positivos y falsos negativos (WHO, 2010; Brito y col., 2011). Se trabajó con 0.5 mL de las muestras, las cuales, se centrifugaron durante 10 min a 250 xg. Se descartó el sobrenadante y con el sedimento se realizaron dos extendidos en portaobjetos que se fijaron con etanol-éter (1:1); y se aplicaron las respectivas tinciones, utilizando colorantes nuevos, para evitar el arrastre de material proveniente de coloraciones previas. Los extendidos teñidos se evaluaron con microscopio óptico (Leitz Laborlux 11, Germany) y objetivo de inmersión (1000x). Se consideró:
Resultado positivo: hallazgo de al menos un espermatozoide completo.
Resultado presuntivo: solo se observan cabezas.
Resultado negativo: no se observan células espermáticas.
Se compararon los resultados obtenidos con ambas tinciones aplicando la prueba Chi cuadrado (χ2).
Identificación de espermatozoides y levaduras aplicando microscopio con contraste de fases, luz polarizada y de fluorescencia
Se trabajó con las muestras de los grupos G1 y G2 provenientes de diluciones de semen a las que se agregó suspensión de levaduras. Como control de la observación microscópica se procesaron testigos puros de espermatozoides (CE) y de levaduras (CL). Se tomaron 0.5 mL de cada muestra y se centrifugaron 10 min a 250 xg. Se descartó el sobrenadante y se colocó una gota del sedimento entre porta y cubre objeto, se aplicaron distintos recursos microscópicos.
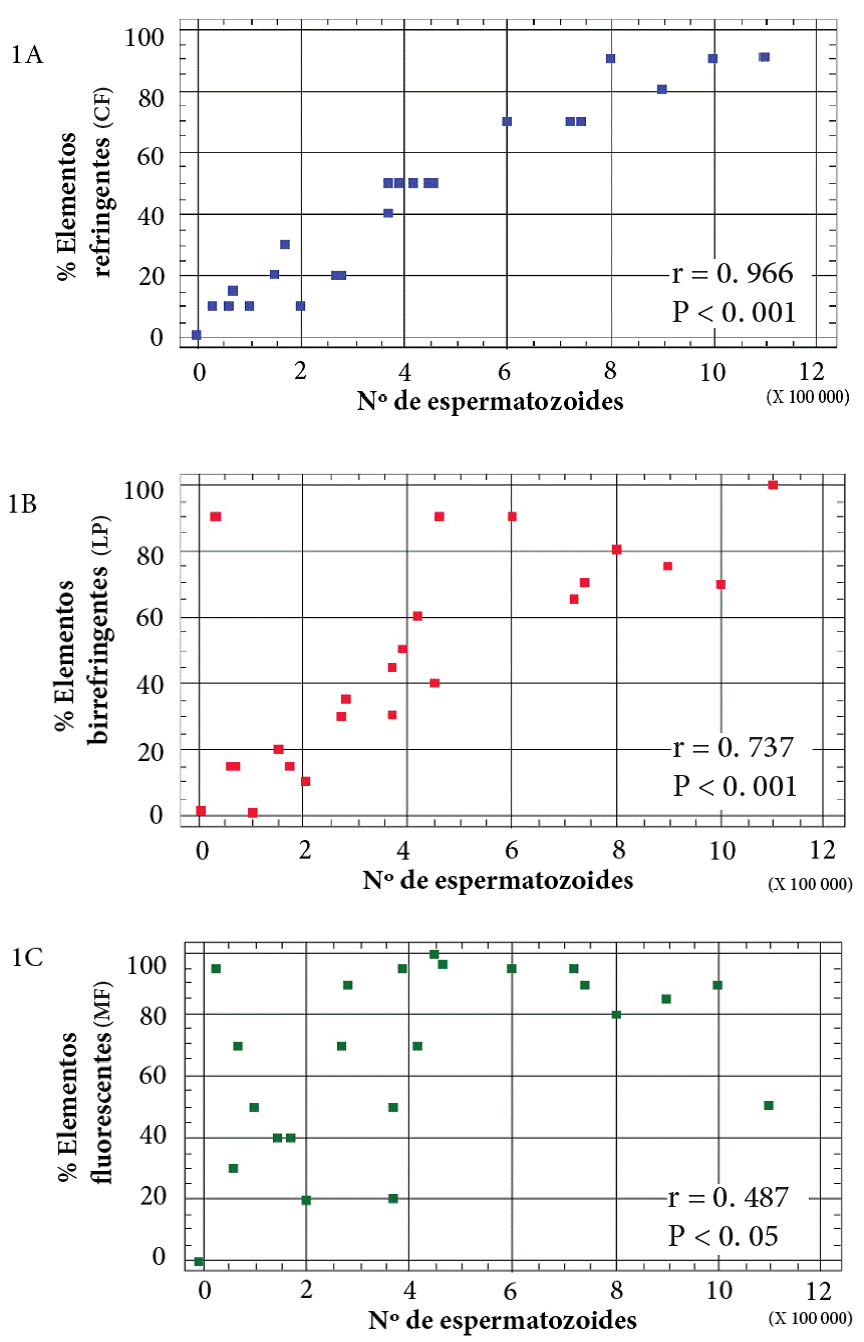
Mediante microscopía con contraste de fases (CF) utilizando microscopio (Zeiss 37081, Germany) se determinó el porcentaje de elementos refringentes (espermatozoides) y opacos (levaduras).
Con microscopio óptico (Leitz Laborlux 11, Germany) y colocando polarizadores en los oculares y en el objetivo, para generar luz polarizada (LP), se identificaron espermatozoides y/o cabezas espermáticas. La técnica se fundamenta en las características birrefringentes que presenta el espermatozoide como consecuencia de las propiedades anisotrópicas de su textura protoplásmica interna. El análisis de birrefringencia de los espermatozoides mediante la aplicación de microscopía con LP es una herramienta adicional que permite evaluar la organización de los organelos situados en la cabeza y el flagelo espermático. El núcleo espermático maduro presenta birrefringencia intrínseca asociada con sus filamentos proteicos ordenados y orientados longitudinalmente. La organización microtubular del axonema y de las mitocondrias en la pieza intermedia también presentan birrefringencia (Gianaroli y col., 2010).
En el análisis con microscopio de fluorescencia (MF) (Nikon Eclipse 50 i, Japón) se utilizó el fluorocromo naranja de acridina, el cual, por sus características metacromáticas, al intercalarse como monómero entre las dos cadenas del ADN nuclear de las cabezas de los espermatozoides, presenta un máximo de excitación a 502 nm y de emisión a 525 nm, que se observa de color verde si el ADN se encuentra nativo y anaranjado si se encuentra desnaturalizado. En dichas condiciones, las levaduras no producen interferencia. Por otra parte, este mismo fluoro-cromo puede asociarse con el ácido ribonucleico (ARN) fúngico, y bajo condiciones de excitación de 460 nm y de emisión a 550 nm emite una fluorescencia roja, la cual fue analizada pero no reportada, para confirmar que las muestras no presentaban interferencia cromáticas durante su análisis.
En este análisis se trabajó solo con 23 de las 28 muestras disponibles por cuestiones técnicas. Se midió el grado de asociación de las tres variables CF, LP y MF con el número de espermatozoides a través del coeficiente de correlación de rangos Spearman.
Identificación de levaduras aplicando microscopía confocal con blanco de calcofluor-azul de Evans y naranja de acridina
El microscopio confocal (MFC) emplea una técnica óptica de imagen para incrementar el contraste o reconstruir imágenes tridimensionales utilizando un colimador para eliminar la luz desenfocada o destellos de la lente, en especímenes que son más gruesos que el plano focal (Saldaña y col., 2010). La apertura localizada delante del fotomultiplicador evita el pasaje de fluorescencia de las regiones de la muestra que no están en foco, la luz que proviene de regiones localizadas por encima o por debajo del plano focal no converge en el orificio y no es detecta da por el fotomultiplicador (Saldaña y col., 2010).
La aplicación de MCF, al eliminar la luz procedente de los planos fuera de foco, permite observar imágenes con alta resolución, nitidez y contraste. Se pueden utilizar varios fluorocromos y obtener señales sin solapamiento, generando múltiples imágenes de cada uno de los fluorocromos superpuestas en una imagen única (Sánchez-Armendáriz y col., 2013). Se aplicó MCF para identificar levaduras que son frecuentes contaminantes de las muestras forenses donde se investiga presencia de semen. Se utilizó una solución en proporción 1:1 de dos fluorocromos: a) blanco de calcofluor 1.0 g/L y azul de Evans 0.5 g/L, que emite fluorescencia azul en presencia de levaduras (ARN). El blanco de calcofluor tiñe de color azul las paredes celulares que contienen quitina, celulosa y otros polisacáridos con uniones β-1,4 (Vázquez y col., 2016). Cuando se emplea la luz UV, las paredes fúngicas emiten fluorescencia de color entre verde brillante y azul, mientras que otros materiales fluorescen de color rojizo-amarronado; b) naranja de acridina 0.01 % en buffer fosfato salino (PBS, por sus siglas en inglés phosphate buffered saline) que emite fluorescencia verde en presencia de cabezas espermáticas (ADN). Esta técnica microscópica utiliza iluminación puntual, en un plano óptico conjugado frente del detector, por lo que elimina la información ubicada fuera del plano focal, registrando solamente la luz que está dentro de este plano (Alberts y col., 2006). Además es sensible, específica, brinda imágenes tridimensionales con elevada resolución y es utilizada con creciente frecuencia para estudios micológicos (Forbes y col., 2009; Sánchez-Armendáriz y col., 2013).
Se analizaron por separado 0.5 mL de muestras correspondientes a los grupos G1 y G2 así como CE y CL. Se centrifugaron durante 10 min a 250 xg. Luego de descartar el sobrenadante se agregó al sedimento de cada muestra 0.05 mL de la solución compuesta por los 2 fluorocromos (a:b) y se analizó con el microscopio confocal Nikon Eclipse TE-2000-E (Japón). El análisis estadístico de los promedios de los porcentajes de células azules, indicadoras de presencia de levaduras, entre los grupos; se realizó aplicando la prueba t - Student.
RESULTADOS
La tinción de hematoxilina verde brillante permitió identificar sólo 8 muestras positivas (28.6 %) del total de 28 analizadas del Grupo 1 (normo u oligozoospérmicas), y dio 4 resultados negativos (Tabla 1). La tinción Papanicolaou permitió identificar como positivas al 50 % de las muestras, y como presuntivas al otro 50 %, sin arrojar muestras negativas. En el grupo G2 se obtuvieron resultados negativos aplicando ambas tinciones en las 18 (100 %) muestras analizadas. El análisis de las muestras control confirmó que ambas tinciones daban positivo en presencia de espermatozoides y negativo en presencia de levaduras. Estos resultados indicaron que las dos tinciones pueden utilizarse para la búsqueda de espermatozoides en muestras biológicas contaminadas por levaduras, pero la tinción de Papanicolaou ofrece mayor sensibilidad (P < 0.05).
En cuanto al análisis de las muestras seminales, con distintos recursos microscópicos, para reconocer espermatozoides en muestras contaminadas con levaduras, se analizó la correlación de las variables con el porcentaje de elementos refringentes (CF) (Figura 1A), el porcentaje de elementos birrefringentes (LP) (Figura 1B) y el porcentaje de elementos fluorescentes (MF) (Figura 1C) con el número de espermatozoides observados en las muestras. Aplicando el coeficiente de correlación de rangos Spearman, se encontró que, si bien las tres variables correlacionan con el número de espermatozoides en forma directa y significativa, el mayor coeficiente se observó con la variable porcentaje de elementos refringentes obtenido por CF (r = 0.966), indicando una fuerte asociación con el número de espermatozoides (P < 0.001) (Figura 1A). Estos resultados demostraron que mediante la aplicación de CF es posible identificar espermatozoides en presencia de levaduras, brindando información importante en el esclarecimiento de casos periciales donde se investiga la presencia de semen humano. Se encontró también un nivel más bajo de asociación (aunque significativo) para el análisis de LP (r = 0.737; P < 0.001) (Figura 1B) y MF (r = 0.487; P < 0.05) (Figura 1C) por lo que no son técnicas adecuadas cuando se busca alto nivel de discriminación en el laboratorio, especialmente al tratarse del esclarecimiento de delitos graves.
En las muestras seminales y controles analizados con MCF, y la tinción blanco de cal cofluor-azul de Evans y naranja de acridina para identificar levaduras en presencia de espermatozoides, se observó en G2 solo células azules (100 %) indicadoras de presencia de levaduras, como en la muestra CL. Mientras que G1 presentó menor porcentaje de células azules (22.62 %), porque además de levaduras las muestras contenían espermatozoides. En la muestra CE no se observaron células azules. Se aplicó la prueba t Student para evaluar la diferencia entre los promedios de los porcentajes de células azules indicadoras de levaduras entre los grupos G1 y G2 y se halló diferencia estadísticamente significativa (P < 0.001) (Tabla 2). Estos resultados indicaron que la metodología aplicada contribuye al reconocimiento de levaduras que son frecuentes contaminantes del material que se recoge en las pericias forenses; siendo un recurso microscópico confiable en la resolución de casos periciales que involucran abuso sexual, donde muchas veces, por las condiciones adversas a las que son sometidas las muestras, es difícil determinar si son levaduras o cabezas espermáticas.
DISCUSIÓN
La Criminalística es una ciencia de carácter empírico e interdisciplinario, donde se integran métodos y técnicas para verificar, examinar y analizar vestigios, indicios y evidencias de toda índole y origen, dejados por cualquier individuo, sea éste presunto o culpable de la comisión de un delito (Ccaza-Zapana, 2013). El semen está constituido por las secreciones provenientes de los testículos, el epidídimo, la glándula prostática, las vesículas seminales, las glándulas de Cowper y de Litreé.
El estudio de manchas de semen tiene gran importancia en criminalística, ya que constituye una prueba precisa y está asociada a crímenes de índole sexual. El reconocimiento es sencillo en manchas seminales de reciente data, pero se complica al transcurrir el tiempo (Támara, 2013). Si bien, el hallazgo de un espermatozoide es diagnóstico genérico de semen en química forense (Tratado de Criminalística, 2007), es importante recordar que pueden no hallarse espermatozoides en casos de violaciones realizadas por sujetos azoospérmicos e incluso oligozoospérmicos, y en estas situaciones el estudio de marcadores bioquímicos del fluido seminal contribuye a esclarecer el delito (Pavesi y col., 2008; 2010; 2011).
La mayoría de las investigaciones se focalizaron en la búsqueda de los espermatozoides (Quispe-Mayta y col., 2010), seguidos por los marcadores de las glándulas anexas como FAP y cinc, que adquieren relevancia en casos de delitos sexuales realizados por sujetos azoospérmicos (Pavesi y col., 2008; 2010). Además, Támara (2013), estudió la aplicación de diferentes métodos y recursos analíticos, según las disponibilidades de cada laboratorio para el reconocimiento e identificación de manchas de semen (Támara, 2013).
En el presente estudio, la tinción de hematoxilina verde brillante permitió la detección positiva de semen en el 85.7 % de las 28 muestras del G1, pero solo permitió detectar espermatozoides completos en el 28.6 % de las muestras (dictamen positivo). La tinción de Papanicolaou fue más eficiente, determinando semen en el 100 % de las muestras analizadas y cabezas espermáticas (espermatozoides incompletos: dictamen presuntivo) en el 50 % de las muestras. Estos porcentajes son mayores a los reportados por Quispe-Mayta y col. (2010), quienes lograron la detección positiva de semen en 60 % de los casos evaluados, aplicando la combinación de tres métodos para pesquisar fluido seminal en muestras forenses, en 37 % de los casos detectaron presencia de fosfatasa ácida, en 35 % encontraron antígeno prostático específico, y espermatozoides en 25 %, aplicando tinción Fast Nuclear Red (Quispe-Mayta y col., 2010).
El hallazgo de un espermatozoide es un estándar de oro en la ciencia forense, pero este caso no es de alta frecuencia, debido a la labilidad del espermatozoide frente a cambios osmóticos y a la deshidratación, que trae como consecuencia la observación de sólo cabezas de los mismos (Khaldi y col., 2004). El espermatozoide es una célula con características morfológicas especiales, y aplicando diferentes coloraciones se observa intensamente teñido el núcleo y en forma tenue el acrosoma (WHO, 2010). Estas peculiaridades pueden no ser óptimas en circunstancias donde el material estuvo expuesto a condiciones desfavorables y en presencia de contaminantes como las levaduras. En dichas condiciones se observan solo cabezas espermáticas y debido a sus características morfológicas pueden confundirse con levaduras en las observaciones microscópicas en fresco e incluso aplicando coloración de Gram-Nicolle.
En este trabajo se aplicaron técnicas microscópicas especiales como CF, LP y MF para identificar espermatozoides en muestras contaminadas con levaduras. Los resultados mostraron buena correlación con LP (P < 0.001) y son coincidentes con las conclusiones de Collodel y col. (2013), quienes evaluaron los espermatozoides con microscopio óptico, empleando tinción Papanicolaou, LP y microscopía electrónica de transmisión, encontrando buena correlación con LP (P < 0.01). Por otra parte, si bien Collodel y col. (2013), aplicaron los recursos microscópicos mencionados, no trabajaron con CF, que es una de las metodologías empleadas en el presente estudio, en la cual, se obtuvo el mayor coeficiente de correlación (r = 0.966; P < 0.001) (Figura 1A).
Otras de las tecnologías aplicadas fueron la MCF y las tinciones blanco de calcofluor-azul de Evans y naranja de acridina, mediante las cuales, se logró identificar las levaduras presentes en las muestras (P = 000). En cuanto a la confiabilidad que demuestra la aplicación de blanco de calcofluor-azul de Evans en el reconocimiento de levaduras, los resultados del presente trabajo son comparables a los de Sánchez-Armendáriz y col. (2013), autores que evaluaron la aplicación de esta tinción en el diagnóstico de onicomicosis y encontraron 65 % de pruebas positivas para levaduras aplicando blanco de calcofluor-azul de Evans. Además, Vázquez y col. (2016), utilizaron blanco de calcofluor para estimar la biomasa fúngica en muestras de suelo y obtuvieron resultados sensibles a los cambios climatológicos y comparables con los obtenidos por otros autores que habían aplicado metodologías más sofisticadas en la identificación de hongos (Vázquez y col., 2016). Otra técnica utilizada es la de hidróxido de potasio negro de clorazol que dio el 47 % de resultados positivos obtenidos (Collodel y col., 2013; Sánchez-Armendáriz y col., 2013).
Disponer de una técnica que permita reconocer levaduras, que son contaminantes frecuentes en las muestras periciales relacionadas con delitos sexuales sometidas a condiciones ambientales desfavorables, es un aporte importante a la hora de tener que definir si se está en presencia de cabezas espermáticas o son levaduras que contaminan la muestra (Pavesi y col., 2015). Y la confirmación de la presencia de semen en materiales sometidos a condiciones desfavorables, a través de la utilización de distintas tinciones y recursos microscópicos, brinda un alto grado de certeza, aunque solo se observen cabezas espermáticas, lo que facilita el trabajo parcial.
CONCLUSIONES
El diagnóstico genérico del semen se ha detenido en su evolución, debido a la falta de aplicación de técnicas adecuadas y modernas que aporten mayor credibilidad al hallazgo. La aplicación de diferentes tinciones y recursos microscópicos superadores de la microscopia óptica, como el contraste de fases, luz polarizada y microscopia fluorescente con naranja de acridina como fluorocromo, contribuyen al esclarecimiento de muchos casos periciales. La microscopia confocal combinando blanco de calcofluor y azul de Evans permitió detectar la presencia de levaduras que son frecuentes contaminantes de las muestras forenses. Los recursos presentados en este estudio contribuyen al diagnóstico de casos periciales de violación caracterizados como positivos y presuntivos.











 text new page (beta)
text new page (beta)