INTRODUCCIÓN
El desarrollo económico demanda un elevado consumo de los diferentes recursos energéticos, por lo que se pronostica un aumento en su costo y su probable escasez en el mediano plazo. Un problema adicional es que los combustibles fósiles han sido asociados con los problemas de contaminación actuales (Carreón-Rodríguez y col., 2009; Saha y col., 2014). Ante esto, se hace necesario encontrar soluciones a la demanda de combustible con reducido impacto ambiental, por ejemplo, energía mareomotriz, hidroeléctrica, geotérmica, solar, eólica y biocombustibles, como el bioetanol obtenido a partir de materiales celulósicos (Suleiman, 2010; Saha y col., 2014).
Existe gran interés en aprovechar los materiales lignocelulósicos que se descartan en los procesos agrícolas y forestales, para transformarlos, a través de hidrólisis química o enzimática, en azúcares fermentables que puedan ser convertidos por diversos microorganismos en metabolitos de interés comercial (Field y col., 2015). La hidrólisis química o enzimática del material lignocelulósico proveniente de residuos de cosecha, como bagazos, sobrantes forestales, pajas o cascarillas, permite su conversión en etanol, que se utiliza como combustible, pero también puede aprovecharse en la obtención de diversos productos químicos (Aguilar-Rivera, 2007; 2011; 2013). El bagazo de caña de azúcar (Saccharum officinarum) es un material lignocelulósico ampliamente utilizado para la producción de etanol en diferentes países, como Cuba, Brasil y Estados Unidos, entre otros, sin afectar la producción de alimentos (Fernández y col., 2009).
El etanol fue empleado inicialmente solo para la producción de bebidas alcohólicas, vinagres y conservas, pero actualmente es aplicado a la industria de fármacos, perfumes y cosméticos; en la fabricación de colorantes, materiales explosivos, seda artificial y materiales plásticos (Brooks, 2008). Sin embargo, debido a que el etanol es una fuente neta de energía, fácilmente almacenable, con alto contenido de oxígeno (35 %) y combustión limpia, se le considera de gran aplicación potencial como combustible (Agüero-Rodríguez y col., 2015), siendo utilizado como alternativa para la oxigenación y aumento de octanaje de la gasolina o como aditivo de la misma y como insumo para la producción de biodiésel (Carreón-Rodríguez y col., 2009).
La producción de etanol empleando diferentes levaduras y utilizando bagazo de caña de azúcar como sustrato, se considera una excelente opción industrial por la amplia disponibilidad de esta materia prima. Las levaduras más ampliamente utilizadas desde hace siglos, pertenecen al género Saccharomyces sp., por su capacidad de convertir rápidamente los azúcares a etanol, además de presentar una amplia aceptación en los procesos industriales (Ingram y Buttke, 1985). Se han realizado investigaciones para obtener microorganismos capaces de producir etanol eficientemente, a partir de diferentes hexosas y pentosas provenientes de la hidrólisis química o enzimática de los materiales lignocelulósicos (Huerta-Beristain y col., 2008; Chandel y col., 2011).
En el proceso de producción artesanal de etanol, a partir de caña de azúcar, participan mi croorganismos nativos de la caña, entre los que destacan levaduras de Saccharomyces sp., Torula sp. y Pichia sp. Sin embargo, en el proceso industrial de obtención de etanol, particularmente para fines carburantes, no es deseable tener la permanencia de linajes diferentes a Saccharomyces sp., debido a los requerimientos de alto rendimiento necesarios para alcanzar la rentabilidad económica (Pataro y col., 2000; Schwan y col., 2001). En estos procesos se utilizan inóculos de cepas puras de Saccharomyces cerevisiae, para sustituir las levaduras nativas de la caña y tener un mejor control de la fermentación (Carreón-Rodríguez y col., 2009). Es por ello, que regularmente se aíslan levaduras de diversas fuentes naturales, para evaluar su capacidad fermentativa, tolerancia al alcohol y la presión osmótica, habilidad para usar la maltosa o el almidón como sustrato (Yeon-Ju y col., 2011). Los bagazos de caña de azúcar, melazas, mostos para pulques, mezcales, tequilas y otras destilerías pueden ser empleadas como fuentes para la búsqueda, selección y evaluación de cepas de interés en la producción biotecnológica de etanol (Lappe-Oliveras y col., 2008). La actividad killer, que es la capacidad de liberar toxinas que matan a otros microorganismos presente en el medio, es una característica deseable para algunos autores, ya que da una ventaja durante la producción de etanol (Magliani y col., 1997; Marquina y col., 2002; Nally y col., 2005).
Ceccato-Antonini y col. (2004) y Ortiz-Zamora y col. (2009), evaluaron la resistencia de diferentes levaduras a altas concentraciones de sustratos y productos. Actualmente se estudian algunas bacterias, como Zymomonas mobilis sp., debido a que son capaces de transformar la glucosa en etanol, con rendimientos del 5 % al 10 %, los cuales son más altos que los rendimientos obtenidos por la mayoría de las levaduras (García, 1998; Mielenz, 2001), aun que presentan algunas desventajas, como su baja tolerancia al alcohol y su tamaño pequeño, lo cual hace difícil su separación, al momento de recuperar el etanol (Ingram y Buttke, 1985). También existe la posibilidad de buscar nuevos microorganismos productores de etanol en ambientes extremos (Oliart-Ros y col., 2016).
El objetivo del presente estudio fue determinar la capacidad de producción de etanol de diferentes cepas de levadura nativas aisladas en medio YPD e hidrolizado de bagazo de ca ña concentrado hasta un 75 %.
MATERIALES Y MÉTODOS
Materia prima
El bagazo de caña de azúcar fue proporcionado por el Ingenio Aarón Sáenz Garza de Ciudad Mante, Tamaulipas, México, el cual fue sometido a un proceso de secado, molienda y tamizado; posteriormente, fue almacenado en recipientes cerrados para evitar fluctuaciones de humedad.
Análisis del bagazo
Una alícuota de bagazo de caña fue sometida a secado en estufa (FELISA Mod. FE-291, Jalisco, México) a 105 °C, para determinar la humedad, y en mufla (Thermo Lyne 600, Modelo F6018, EUA) durante 2 ciclos de 3 h cada uno, a 550 °C para calcular el % de cenizas. La muestra seca se sometió a una hidrólisis ácida cuantitativa en dos etapas de tratamiento ácido para calcular su composición química. La primera etapa se realizó con ácido sulfúrico al 72 % a 30 °C por 1 h; la segunda etapa consistió en diluir el medio hasta alcanzar 3 % de concentración de ácido sulfúrico y se calentó a 121 °C por 1 h. El residuo sólido después de la hidrólisis fue considerado como lignina de Klason. Se analizaron el jarabe obtenido en la hidrólisis y el concentrado. Se realizó un análisis cromatográfico (Cromatógrafo marca Waters Mod. 2695, Milford, EUA), para cuantificar azúcares simples, filtrando las muestras con una membrana de 0.45 µm y usando un flujo de 0.5 mL/min-1, columna ion-exclusión 50 µm a 7 µm, 7.8 mm x 300 mm, 37 °C, detector de IR (índice de refracción) a 40 °C, fase móvil H2SO4 al 0.01 N para conocer la concentración de azúcares (glucosa, xilosa, arabinosa y ácido acético). posteriormente, se hizo un análisis espetrofotométrico para medir la concentración de inhibidores como el furfural y 5-hidroximetilfurfural, usando un espectrofotómetro UV-Vis (Perkin Elmer Mod. Lambda 35 Shelton, EUA), midiendo la absorbancia en longitudes de onda de 230 nm y 260 nm para su cuantificación.
Obtención de hidrolizados
El bagazo de caña fue tratado con ácido sulfúrico al 2 % a 122 °C, y un tiempo de reacción de 60 min, en una relación 1:8, siguiendo el procedimiento descrito por Aguilar y col. (2002). El hidrolizado hemicelulósico obtenido fue separado del material fibroso por filtración y concentrado al vacío a 50 °C, con un rotoevaporador (Rotary evaporator Mod. H5-2001NS, Nae-dong, Korea del Sur), para aumentar la concentración de azúcares fermentables, principalmente la glucosa. El hidrolizado se redujo hasta un 75 % de su volumen inicial, ajustando el pH inicial de 0.76 hasta 5.3 con la adición de CaCO3.
Selección y mantenimiento de células
Se aislaron 15 cepas de levadura nativas, productoras de etanol, presentes en bagazo de caña de azúcar y se realizaron fermentaciones, como principal prueba fisiológica utilizada en la identificación de levaduras productoras de etanol, de acuerdo a Orberá (2004). Las cepas seleccionadas (UAT-3, UAT-5, UAT-6, UAT-7, UAT-8, UAT-9, UAT-10, UAT-11, UAT-20, UAT-23 y UAT-24), por su capacidad productora de etanol, fueron mantenidas en glicerol (crioprotector) a una temperatura de - 18 °C.
Las cepas se reactivaron utilizando la técnica de estrías en tubo inclinado, en medio nutritivo sintético YPD (glucosa 20 g/L, peptona 20 g/L y extracto de levadura 10 g/L, agar 20 g/L). Después de las 48 h de incubación, se etiquetaron y conservaron en refrigeración (4 °C ± 1). La productividad de las cepas se evaluó usando un medio de cultivo YPD que contenía 20 g/L de glucosa, 20 g/L de peptona y 10 g/L de extracto de levadura, en matraces de 250 mL estériles, con un volumen total de 120 mL de medio, incubados a 29 °C ± 1, a una velocidad de agitación de 100 revoluciones por minuto (rpm) por 48 h. Se tomaron muestras cada 12 h, determinando en cada una: 1) Biomasa producida, determinada por peso seco celular; 2) Recuento directo de célu las totales utilizando una cámara de Neubauer en microscopio óptico (Modelo Revelation III, marca LW Scientific, Law-renceville, Georgia, EUA); 3) Consumo de sustrato, por determina ción de grados Brix; 4) Consumo de sustrato (glucosa) y formación de productos (etanol y ácido acético), por Cromatografía Líquida de Alta eficacia (CLAE), usando una Columna de Intercambio iónico ION-300 (Fase móvil con H2SO4 al 0.01M; flujo de 0.4 mL/min-1; IR y de tección UV).
Evaluación de la cepa nativa seleccionada en medios con hidrolizado
La cepa de levadura seleccionada como la mejor productora de etanol (UAT-3), se evaluó en medios formulados con concentrado del hidrolizado de bagazo de caña de azúcar, conteniendo 65.42 g/L de xilosa, 20.40 g/L de glucosa y 7.83 g/L de arabinosa. El contenido de compuestos inhibidores en el medio fue de 3.47 g/L de ácido acético, 1.71 g/L de furfural y 1.24 g/L de 5-hidroximetilfurfural. Se comparó la producción de esta levadura en un medio de cultivo YPD que contenía 20 g/L de glucosa, 20 g/L de peptona y 10 g/L de extracto de levadura. Se realizó una cinética de producción durante 216 h. Se tomó muestra cada 24 h y se realizaron análisis de consumo de sustrato, formación de productos y biomasa producida; determinando la productividad volumétrica (Qp) (g/L-h), rendimiento en producto (Yp/s) (g/g), y rendimiento en biomasa (Yx/s) (g/g).
Análisis estadístico
Los resultados fueron analizados utilizando los programas de Microsoft Excel 2007 y Statgraphics, versión 5.1. Para conocer el efecto de la composición del medio en los rendimientos de Yp/s, Qp, Yx/s y del tiempo de la cinética de fermentación para cada una de las cepas, se realizó un ANOVA multifactorial con un nivel de confiabilidad del 95 %, evaluando los parámetros de rendimiento durante la fermentación.
RESULTADOS Y DISCUSIÓN
La caracterización química permitió establecer que el bagazo de caña de azúcar contenía 8.94 ± 0.07 % de humedad y 3.03 ± 0.1 % de cenizas. Pandey y col. (2000), mencionaron que el bajo contenido de cenizas del bagazo de caña le permite ser un mejor sustrato durante la fermentación, comparado con otros residuos lignocelulósicos como la paja de arroz o trigo.
La composición estructural del bagazo, obtenida mediante una hidrólisis ácida cuantitativa, para establecer el contenido de glucano, xilano, arabano y lignina, se muestra en la Tabla 1. Los valores obtenidos son cercanos a los valores teóricos reportados en la literatura por diferentes autores para caña de azúcar (Pandey y col., 2000; Ferrer y col., 2002; Boussarsar y col., 2009; Zumalacárregui-De-Cárdenas y col., 2015).
La hidrólisis ácida permite degradar el bagazo, obteniendo glucosa, que puede ser utilizada en procesos de fermentación etanólica con alto rendimiento (Guarnizo-Franco y col., 2009). En hidrolizados lignocelulósicos, la concentración de azúcares depende de las condiciones de hidrólisis utilizadas (Larsson y col., 1999; Palmqvist y Hahn-Hágerdal, 2000a). En este sentido, Chandler y col. (2012), mencionaron que se pueden obtener altas concentraciones de azúcares si se realiza hidrólisis en dos etapas, aplicando inicialmente temperaturas entre 100 °C y 140 °C, seguido de un calentamiento entre 160 °C a 180 °C. Sin embargo, si en la primera etapa se utilizan rangos de 140 °C a 160 °C cambia el comportamiento, disminuyendo la cantidad de azúcares producidos. En el presente estudio, se obtuvo un alto contenido de carbohidratos con las condiciones de hidrólisis química empleadas, lo que puede ser aprovechado para transformar el bagazo de caña de azúcar en un medio fermentable, que puede ser convertido por fermentación microbiana en productos con alto valor agregado, como el etanol (Chandler y col., 2012).
La concentración del hidrolizado utilizada en este trabajo permitió incrementar el contenido de los azúcares fermentables: xilosa, glucosa y arabinosa (Tabla 2). Sin embargo, se concentraron también el ácido acético, el furfural y el hidroximetilfurfural, compuestos derivados del furano y que pueden actuar como inhibidores en el proceso de fermentación, afectando el crecimiento de las levaduras y el rendimiento en la producción de etanol (Oliva, 2003). En la Tabla 2 se observa que el ácido acético alcanzó valores de 10.21 g/L, concentración muy superior a los 3 g/L que ha sido reportada como suficiente para afectar el proceso de fermentación (Felipe y col., 1995). Zyl y col. (1991), utilizaron Pichia stipitis para producir etanol a partir de hidrolizado hemicelulósico de bagazo de caña, y descubrieron que el grado de inhibición causado por el ácido acético no sólo dependía de su concentración, sino también de la concentración de oxígeno y pH del medio.
El furfural e hidroximetilfurfural alcanzaron concentraciones de 4.88 g/L y 2.27 g/L res pectivamente. Estos compuestos fenólicos de bajo peso molecular son tóxicos y afectan el crecimiento celular (Purwadi y col., 2004). Se ha reportado que concentraciones de 0.25 g/L a 0.5 g/L de furfural no afectaron el crecimiento de S. stipitis; aunque concentraciones más altas (1.5 g/L a 2 g/L) afectaron el crecimiento de la levadura y disminuyeron el rendimiento de etanol y la productividad (Nigam, 2001). Palmqvist y Hahn-Hágerdal (2000b), demostraron que el efecto inhibitorio de hidroximetilfurfural es similar al de furfural, causando de igual forma un retraso tardío en el crecimiento celular, sin embargo se considera menos tóxico al hidroximetilfurfural.
Por otra parte, es posible reducir el efecto que pudiera causar la presencia de compuestos in hibidores en el hidrolizado, aplicando un método de detoxificación que permita reducir su concentración a niveles más bajos de los requeridos para afectar el metabolismo de los microorganismos fermentadores de interés (Yong-Jin y col., 2011; Field y col., 2015).
Selección de la cepa nativa mayor productora de etanol
La capacidad productora de etanol de las levaduras varía entre géneros, especies e incluso entre cepas dentro de una misma especie. S. ce-revisae es la levadura más utilizada para la obtención de etanol, sin embargo, se ha reportado que las diferentes cepas varían en su rendimiento de etanol, dependiendo de las condiciones de proceso (Tuite y Oliver, 1991; Carballo, 2000). Entre los criterios de selección de las cepas destacan, su capacidad fermentativa, medida como producción de etanol, la tolerancia a la acidez, el consumo de azúcares y la buena productividad volumétrica de etanol. La capacidad fermentativa se ve influenciada por diferentes factores, como la temperatura, la concentración de azúcares, el pH, y algunas otras variables que influyen en el crecimiento de los microorganismos (Caridi, 2003).
En este estudio, las cepas de levadura nativas, aisladas previamente, fueron evaluadas en su capacidad productiva de etanol usando medio comercial YPD (Figura 1), determinando el rendimiento en producto (Yp/s), el rendimiento de biomasa (Yx/s) y la productividad volumé trica (Qp) (Tabla 3). Las principales cepas productoras identificadas fueron UAT-3, UAT-5, UAT-9 y UAT-10 con 9.28 g/L, 8.4 g/L, 8.31 g/L y 8.37 g/L de etanol respectivamente (Figura 1). La cepa nativa UAT-3 fue seleccionada como la mejor productora de etanol, por presentar el valor más alto de rendimiento (Yp/s) con 0.504 6 g/g, muy cercano al rendimiento teórico (0.51 g/g); y la mayor productividad volumétrica (Qp) de 0.386 g/L-h (Tabla 3). Los resultados de esta cepa fueron mayores a los obtenidos en fermentaciones en fedbatch de hidrolizados enzimáticos no deslignificados de bagazos realizados por Albuquerque-Wanderley y col. (2013), lo que indica que es una cepa con buena capacidad de producción de etanol. Gómez-Ruiz y col. (2007), aislaron cepas de levaduras S. cerevisiae de la región productora de mezcal, reportando resultados de Yp/s de 0.068 0 g/g, biomasa (cel/mL) de 1.37E + 08 y una Qp de 0.136 5 g/L-h, valores inferiores a los presentados por la cepa UAT-3 de este estudio.
La cepa UAT-24 tuvo la menor productividad de etanol (1.34 g/L) (Figura 1) y los menores valores de rendimiento y productividad volumétrica (Tabla 3), pero presentó la mayor producción de biomasa (Tabla 3). Estos resultados indicaron que esta levadura destinó el consumo de azúcares al crecimiento celular, teniendo baja eficiencia fermentativa.
Las cepas productoras de etanol pueden ser aisladas de fuentes diversas a las exploradas en el presente estudio. Oviedo-Zumaqué y col. (2009), utilizaron excedentes de plátano para darle un valor agregado a los residuos poscosecha, logrando una evaluación de cepas nativas con potencial en la producción de etanol. Joshi y col. (2005) y Mohanty y col. (2006), alcanzaron altas concentraciones usando células de S. cerevisiae en pulpa de piña, durazno y marañón, adicionando sales minerales. por otra parte, se puede mejorar la productividad de las levaduras mediante su inmovilización, proceso que permite un mayor aprovechamiento del sustrato. Matiz y col. (2002), ensayaron con diferentes cepas nativas inmovilizadas a partir de Z. mobilis sp. utilizando el medio de fermentación sintético modificado en condiciones de microaerofilia, obteniendo mejores resultados que al utilizar células libres.
Cinética de fermentación utilizando la cepa seleccionada en hidrolizado de bagazo de caña de azúcar
En la Figura 2 se observa la cinética de crecimiento celular de la cepa nativa seleccionada UAT-3, tanto en el medio de cultivo YPD caldo (control), como en hidrolizado de caña de azúcar concentrado, enriquecido con 10 g/L de extracto de levadura y 20 g/L de Peptona, para determinar la producción de etanol y su capacidad de adaptación al medio con diversos inhibidores presentes en el hidrolizado, realizando una cinética de fermentación de 216 h y tomando muestra cada 24 h. El medio control presentó una concentración inicial de 20 g/L de glucosa. En tanto que la concentración inicial de glucosa en el hidrolizado de bagazo de caña de azúcar fue de 20.40 g/L.
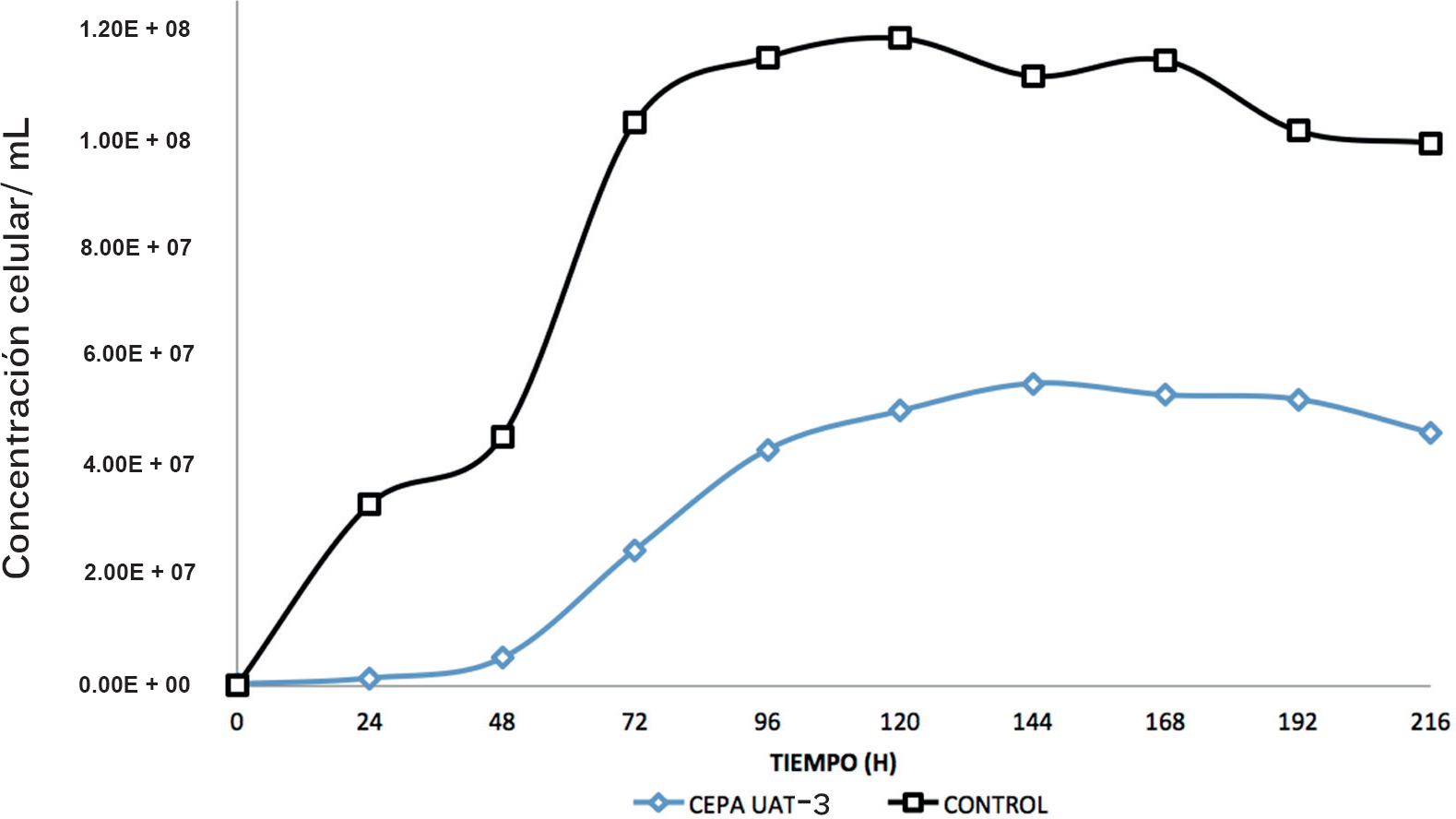
El crecimiento celular de la cepa nativa UAT-3 en el medio control fue mayor y alcanzó una concentración celular superior a 1.10E + 08 a las 96 horas (Figura 2), en tanto que su crecimiento mostró una fuerte inhibición en el hidrolizado de bagazo de caña de azúcar durante las primeras 48 horas, provocado por una lenta adaptación al medio, lo que causó que se presentase una fase exponencial prolongada, obteniéndose una concentración celular máxima de 4.50E + 07 a las 144 horas, debido a la presencia de sustancias inhibidoras liberadas tras el tratamiento ácido que se realizó en el bagazo de caña de azúcar. Aunque el crecimiento celular de la cepa UAT-3 fue afectado negativamente, Ortiz-Zamora y col. (2009), obtuvieron valores muy por de bajo de los obtenidos en este ensayo, en un tiempo de fermentación de 144 h, con cepas de levadura aisladas de fuentes naturales (melaza de caña de azúcar, jugo de uva, miel de caña, jugo de caña y piña), que fueron inhibidas por la concentración de azúcares en el medio. La inhibición de sustrato se hace muy significativa en rangos de 5 % p/v a 25 % p/v de azúcar, con una inhibición completa del crecimiento de 25 % p/v a 40 % p/v de glucosa, dependiendo de la cepa (Jones y col., 1981; Attfield y Ketsas, 2000; Malacrino y col., 2005).
En la Figura 3 se muestra la cinética de producción de etanol y consumo de azúcares de la cepa nativa UAT-3, en medio obtenido a partir del hidrolizado de caña. El incremento en la producción de etanol estuvo directamente asociado con la disminución en el contenido de glucosa, alcanzándose el valor máximo de producción etanólica y el agotamiento del carbo hidrato a las 72 horas. Aunque existen cepas de levaduras capaces de producir etanol hemicelulósico, al metabolizar la xilosa, además de glucosa (Antunes y col., 2014), la cepa seleccionada, no fue capaz de hidrolizar la D-xilosa presente en el medio, ni la L-arabinosa (datos no mostrados), ambos denominados azúcares residuales. Algunos investigadores han demostrado que los suplementos de urea pueden aumentar la producción de etanol, ya que la urea es un componente esencial en el crecimiento de la levadura (Lopes y Sola-Penna, 2001; Choi y col., 2009).
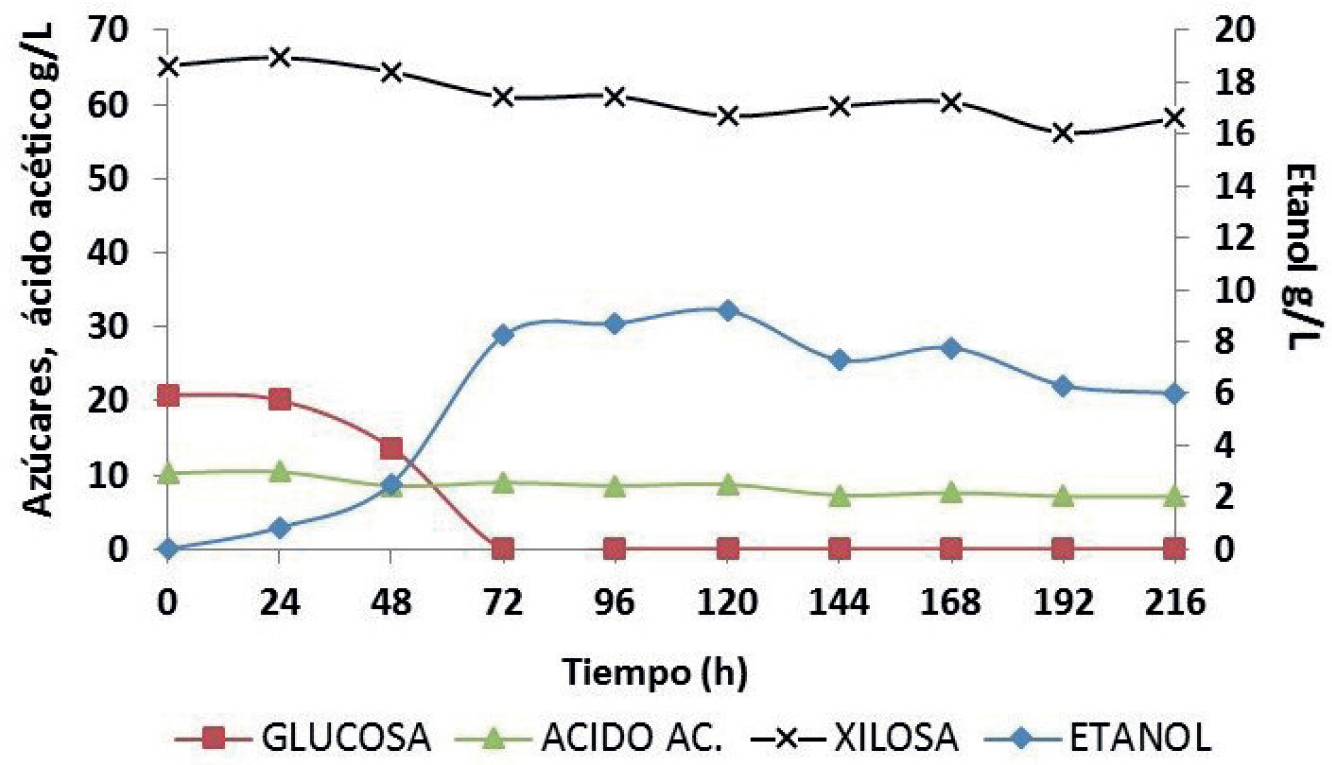
En la Tabla 4 se muestran los parámetros cinéticos de etanol obtenidos por la cepa nativa UAT-3, utilizando el hidrolizado de bagazo de caña de azúcar. A los 120 días se alcanzó el valor más alto de rendimiento de etanol (YP/S), que fue de 0.442 g de etanol/g de glucosa, que representa el 86 % del máximo rendimiento teórico (0.511 g/g); así como el máximo valor de productividad (Qp), siendo de 0.077 (g/L-h). Los valores de productividad obtenidos por la cepa UAT-3 fueron superiores a los publicados por Fernández y col. (2009), quienes reportaron una productividad de 0.12 g/g y rendimiento de 0.19 g/L-h, empleando una cepa de S. cerevisiae nativa en hidrolizados ácidos de bagazo con una concentración inicial de 12.1 g/L de glucosa, 2.0 g/L de ácido acético, 0.8 g/L de furfural y 2.0 g/L de hidroximetilfurfural. Al utilizar dos cepas industriales en el mismo medio, la productividad máxima alcanzada fue de 0.06 g/g, 0.43 g/g, y el rendimiento máximo de 0.06 g/L-h, 0.46 g/L-h respectivamente. También existen estudios en los que se han aislado cepas de levaduras con capacidad de fermentación en ambientes severos, estableciendo las características de crecimiento en varios monosacáridos y evaluando su capacidad para fermentar etanol a partir de glucosa, manosa, galactosa, fructosa y xilosa (Kodama y col., 2013). En este estudio se observó que la inhibición del rendimiento de etanol fue mayor a la productividad volumétrica, debido probablemente a que los inhibidores presentes en el hidrolizado impidieron una producción rápida de etanol durante las primeras horas, pero luego ocurrió un proceso de adaptación de la cepa UAT-3, lo que permitió incrementar el rendi miento de etanol.
CONCLUSIONES
Las condiciones utilizadas en el presente estudio, para la hidrólisis química del bagazo de caña de azúcar, permitieron obtener un mosto fermentable, compuesto principalmente por azúcares hemicelulósicos, en el que pudieron crecer las cepas de levaduras seleccionadas y producir etanol. El proceso de acondicionamiento para las cepas de levaduras aisladas, permitió su adaptación y crecimiento en el mosto obtenido por hidrólisis química, alcanzando la máxima productividad de etanol a los 120 días, siendo del 86 % del máximo rendimiento teórico. Es conveniente mantener la búsqueda de nuevas cepas productoras de etanol, con mayor capacidad de fermentación, preferentemente capaces de consumir y transformar en etanol arabinosa y xilosa.











 nueva página del texto (beta)
nueva página del texto (beta)