Dedico esta investigación realizada con tiempo, esfuerzo, esmero y con mucho amor a mi esposo e hijas por su apoyo incondicional en todo momento. Dedicado también a la Naturaleza porque merece nuestro respeto ecológico. Se agradece la guía recibida por revista RIDE.
Introducción
La didáctica, con toda certeza, es la herramienta más valiosa que tiene un docente para enseñar un tema de cualquier asignatura, de cualquier nivel, de cualquier área y en cualquier ámbito. Los jóvenes científicos ya no se preocupan de aprender la tabla de memoria. Y los profesores tampoco lo demandan; como en la Universidad de Liubliana, Eslovenia (Vazquez, 1 de septiembre de 2017), prefieren desarrollar habilidades en el aula y consultarla cada vez que sea requerida. Hay datos que se tienen que memorizar (número de teléfono, direcciones, ríos, capitales, países) porque no tienen lógica ni deducción, mientras que hay otros que implican razonamiento como las tablas de multiplicar y los elementos de la tabla periódica y sin embargo se han enseñado memorizando (Agudelo, 2015; Arranz, 14 de septiembre de 2017). En particular, entender y comprender la organización de los elementos que existen en la naturaleza es relevante para abordar temas del comportamiento macro de la materia y, por ende, los fenómenos presentados en la misma naturaleza.
Para que un alumno entienda, tiene que desarrollar habilidades cognitivas básicas; para que comprenda, tiene que desarrollar habilidades cognitivas superiores (Caamaño, 2011): interpreta y representa, traslada el conocimiento a nuevos contextos. El desarrollo de habilidades (ver Tabla 1) ha sido pieza clave para lograr la parte científica en el nuevo diseño de la tabla periódica (ver Figura 3) propuesto en este trabajo de investigación. Se recomienda como una estrategia de enseñanza el método de enseñar a pensar (Swartz, 2019; Woolfolk, 2010) y de aprendizaje, el de desarrollar habilidades. Cabe aclarar que habilidad se refiere al “saber cómo”. Al respecto, Portillo (2017) menciona algo importante: “Las habilidades son de naturaleza individual y las competencias de naturaleza social” (p. 4). Y más adelante añade lo siguiente: “La educación por habilidades tiene su principal interés en la idea del progreso de una habilidad y, por ende, en el progreso de cada estudiante en el desarrollo de la habilidad en el proceso educativa (Heritage, 2015)” (Portillo, 2017). Además, la evaluación mundial Programa Internacional para la Evaluación de Estudiantes (PISA) requiere la preparación de alumnos con habilidades científicas al desarrollar habilidades cognitivas (Franco, 2015; Sanz, 2010; Barbán, 2008).
Tabla 1 Habilidades cognitivas a desarrollar en química
| Macro | Micro | Simbólico | ||||
|---|---|---|---|---|---|---|
| Sentidos | Pensamiento abstracto | Razonamiento lógico | ||||
| Observar en tabla periódica | Identificar en tabla periódica | Interpretar, relacionar | Diferenciar, comparar | Clasificar o described | Representar | Calcular |
| Grupos o columnas, nivel o periodo, bloques. | Bloques s, p, d, f | Conceptos: elemento, sustancia, átomo, partículas, molécula, compuesto,entre otros | Diversos modelos atómicos;niveles de subniveles; orbital de mayor nivel de orbital de menor energía | Describir con sus propias palabras cómo reconocer el átomo central en las moléculas | Fórmulas | Notación científica, radio atómico, ángulo de enlace, longitud de enlace |
| Periodos o filas | Patrón que rige la tabla periódica | Teorías | Principios de teoría cuántica | Clasificar las fórmulas químicas al aprender ejemplos | Moléculas, estructura de Lewis, tipos de enlaces | Estado de oxidación, carga formal |
| Propiedades físicas y químicas por grupo y periodo. | Tipos de fórmula, enlaces; átomo central (1, 2, 3) | Fórmulas | Variables n y m: AX n E m de n, l, m, s | Clasificar las propiedades físicas y químicas | Modelos | Números cuánticos |
| Número de columnas por bloque, número de elementos por periodo y número de elementos por bloque | Fórmulas matemáticas | Hibridación, números cuánticos | Valencia de estado de oxidación | Configuración electrónica | Restar números atómicos de parejas en elementos por grupo | |
Fuente: Elaboración propia con base en: (Portillo & Torres, 2017) (Cutrera & Stipcich, 2016) (Atkins, 2007)
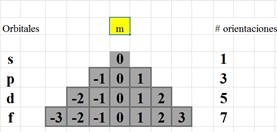
Fuente: Goodstein (SEP, 2014)
Figura 1 Patrón comprobado experimentalmente por el Dr. David Goodstein (2014) y sustento de este trabajo de investigación
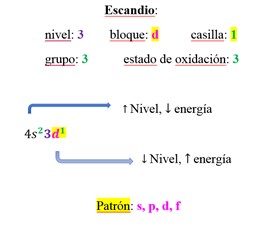
Fuente: Orgel (2003, p. 3) y Grosvenor y Gálvez (1976, p.7)
Figura 2 Propuesta de autora: patrón identificado como el último orbital de la configuración electrónica que modifica el diseño tradicional de la tabla periódica, modelando con el elemento escandio
La química se ha visto siempre como un área del conocimiento profundamente científica, y es rechazada por muchos estudiantes porque dicen que no van a ser químicos. Sin embargo, lo que desconocen muchos es que aprender química ofrece la oportunidad para desarrollar todas las habilidades que son reconocidas en la educación como útiles para la vida cotidiana.
La relevancia de enseñar cómo está organizada la tabla periódica estriba, en primer lugar, en aceptar que la naturaleza se encuentra en ella y está organizada a nivel micro y de ello depende el comportamiento macro de la materia; en ambos niveles se involucra a los conocimientos previos (Woolfolk, 2010) y básicos de la física y las matemáticas, ya que se requiere cierto nivel de abstracción y conocimientos elementales para entender y comprender la química. En segundo lugar, es relevante en la vida cotidiana para formar humanos respetuosos de la naturaleza, con toma de decisiones acertadas y susceptibles a lo micro, algo que no podemos ver, pero existe (Busquets t.e, 2016) (Agudelo, 2015).
Para la parte teórica, al enseñar temas de química, se recomienda utilizar técnicas que aplican códigos de colores en actividades para que los alumnos puedan desarrollar las “habilidades básicas”: observar, relacionar, comparar, clasificar y describir (Swartz, 2019; Sanz, 2010; Woolfolk, 2010;) (ver Tabla 1); asimismo, usar ordenadamente el pizarrón, así como el uso de analogías para enseñar a pensar (Woolfolk, 2010). Para la parte experimental, en la actualidad existen en Internet ya muchos simuladores educativos (Caamaño, 2011) que contribuyen también al desarrollo de las habilidades y evitan, por ejemplo, el riesgo de que el alumno se vaya a quemar con algún reactivo en laboratorio, los cuales, además, son caros para muchas escuelas.
Aquí se sugiere no memorizar la tabla periódica (ver Figura 3); lo que se debe de hacer con ella es utilizarla como un formulario más de consulta, entender y comprender su organización de acuerdo al patrón identificado. Como ya se mencionó, en la Universidad de Liubliana, Eslovenia (Vazquez, 1 de septiembre de 2017), no la memorizan, la consultan cada vez que sea requerida. Lo relevante es entender y comprender la organización a nivel micro que rige a los elementos en ella bajo un patrón (ver Figura 2) (ver Tabla 2), para posteriormente entender y comprender a nivel macro temas de química.
Tabla 2 Relación de los elementos con el patrón identificado y su ubicación en un nuevo diseño de la tabla periódica
| Elemento | Orbitales antecesores al patrón en estado basal del átomo |
Patrón identificado | Bloque | Nivel ó periodo |
Grupo | Casilla |
|---|---|---|---|---|---|---|
| He | 1s 2 | S | 1 | 8 ó 18 ó 0 | 2 | |
| C | 2s 22p 2 | 2p 2 | P | 2 | 4 ó 14 | 2 |
| Cl | 3s 23p 5 | 3p 5 | P | 3 | 7 ó 17 | 5 |
| Sc | 4s 23d 1 | 3d 1 | D | 3 | 3 | 1 |
| Lu | 6s 24f 145d 1 | 5d 1 | D | 5 | 3 | 1 |
| Cr | 4s 23d 4 | 3d 5 | D | 3 | 6 | 4 |
| Cu | 4s 23d 9 | 3d 9 | D | 3 | 11 ó 1 | 9 |
| Si restamos número atómico en
parejas de elementos en un mismo grupo, encontraremos como resultado 2n2; lo cual confirma su ubicación correcta. |
|
|
||||
Fuente: Elaboración propia con base en (Cassabo, 1996) ( p. 70)
Como parte de este trabajo, se han encontrado diversas propuestas didácticas (ver ejemplo de clase en Métodos), en la enseñanza de la tabla periódica (ver Tabla 1). El estudio de Arévalo (2016) aborda los temas de química lúdicamente para un nivel básico; favorece el aprendizaje de nombres, números atómicos, propiedades y símbolos. El problema de entender y comprender en los alumnos de nivel medio superior y superior, en la parte microscópica de la materia (Busquets, t.e. 2016) estriba en que no aplicarán los sentidos como lo hacemos al aprender o enseñar la parte macroscópica de la materia, sino que se debe aplicar el nivel de abstracción, se tiene que imaginar algo que no se ve (Busquets, e.t. 2016) y aceptar fotos o videos que nos proporcionan los científicos con el apoyo de herramientas como el microscopio electrónico (Agudelo, 2015). Otro estudio a nivel básico y medio superior afirma que el libro de texto se ve como el único recurso didáctico (Agudelo, 2015). Además, debate que “la enseñanza de la tabla periódica contribuye a perpetuar la idea de que los átomos son el objeto de estudio de la química, más que una herramienta para pensar los cambios químicos e intervenirlos de manera racional y razonable” (p. 10). Los alumnos pueden observar fenómenos difíciles de comprender, he aquí donde hace falta implementar el desarrollo de habilidades (Busquets, t.e.2016) cognitivas básicas y superiores, (Canmaño, 2011) como son representar e interpretar (Pasek y Matos, 2007; Sanz, 2010; Woolfolk, 2010). Siguiendo el modelo de Johnstone (Cutrera y Stipcich, 2016), en la didáctica se puede conseguir un mejor aprendizaje al separar lo macro (se aplican los sentidos), lo micro (pensamiento abstracto y organizado) (ver Tabla 1) y lo simbólico (fórmulas y ecuaciones) (ver Tabla 3). Para poder entender la parte macro de la materia, hay que comprender la parte micro, ambas convergen en la parte simbólica.
Tabla 3 Algunos patrones matemáticos que rigen la organización en la tabla periódica
| Nivel o periodo (n) |
Oorbital | Número cuántico secundario (l) |
Número de orbitales (m) |
Suma acumulada de orbitales |
Número de electrones en orbitales |
Número de electrones acumulados |
Orbitales mayor ó menor energía |
||
|---|---|---|---|---|---|---|---|---|---|
| (n - 1) | 2l + 1 | 2(2n - 1) | 2n 2 | (n + l ) | |||||
| 1 | S | 0 | 1 | 1 | 2 | 2 | 4s 2 | 3d 1 | |
| 2, 3 | P | 1 | 3 | 4 | 6 | 8 | 4 + 0 = 4 | 3 + 2 = 5 | |
| 4, 5 | D | 2 | 5 | 9 | 10 | 18 | 3s 2 | 3p 5 | |
| 7 | F | 3 | 7 | 16 | 14 | 32 | 3 + 0 = 3 | 3 + 1 = 4 | |
Fuente: Atkins (2007, p. 25), Burns (2011, p. 142) y Grosvenor y Gálvez (1976, p. 6)
La tabla periódica (ver Figura 3) está clasificada por bloques siguiendo un patrón del número atómico implementado por el químico ruso Dimitri I. Mendeléyev en 1869 (Agudelo, 2015). En esta investigación, sin embargo, se rediseña la tabla periódica con un segundo patrón que incluye al primero y a todos los principios ya reconocidos y establecidos por la teoría cuántica. Para entender esto, los alumnos deben de imaginar algo que no ven, (Busquets, t.e.2016) lo que se logra utilizando material concreto para ver cómo están constituidos los átomos por orbitales (s, p, d, f), los cuales se han estudiado analíticamente (por separado). Así, deben armar (síntesis) (Sanz, 2010) con material concreto un átomo y una molécula, exponiendo el siguiente ejemplo: sodio (Na), su configuración electrónica es: 1s2 2s2 2p6 3s1, esto quiere decir que un mismo eje de simetría contiene a los orbitales (s, p), como lo especifica su particular configuración electrónica (Burns, 2011); el alumno debe aprender a identificar al patrón (ver Tabla 2)(ver Fig. 2) que asigna a este y a todos los elementos su ubicación en el nuevo diseño de la tabla periódica (ver Figura 3), para que se pueda comprender que, por ello, este elemento se encuentra en el bloque (s), grupo 1, periodo 3, casilla 1 (ver Fig. 3) Es común que se enseñe a memorizar los elementos de la tabla periódica, cuando es más interesante y relevante entender y comprender el patrón que ubica a cada elemento en el lugar que les corresponde en el diseño propuesto.
Justificación
De acuerdo con el Dr. Eric R. Scerri (2019), la tabla periódica no está terminada. Al respecto, hay varias controversias:
En cuanto a Escandio, se dice que el electrón adicional no se sitúa en los orbitales 4p, sino en 3d: efectivamente, ocurre un proceso de hibridación de orbital de 4s a 3d, afirmado por el Dr. Heber Gabriel Pico Jiménez (Pico, 20 de octubre de 2014) y comprobado teóricamente en este trabajo de investigación al realizar una serie de ejercicios de hibridación de varios compuestos para poder observar este comportamiento; el último electrón es el responsable de buscar el equilibrio en el orbital, tema detallado dado a conocer en un siguiente artículo por autora.
El hidrógeno y el helio aún son tema de discusión: se trata de elementos que deben estar juntos por fundamentos aprobados y comprobados. Uno de ellos es que el número cuántico (l) asigna el patrón que rige los elementos de la tabla periódica (ver Tabla 2). El diseño propuesto tiene como fundamento la regla de Madelung, conocida aún más por el diagrama de Moeller, por contener al patrón adicional en el último orbital del último nivel.
Un número cada vez mayor de investigadores considera que los dos últimos elementos del grupo 3 deberían ser reemplazados por el Lutecio y el Lawrencio, en vez del Lantano y el Actinio, y ser parte del grupo del Escandio y el Ytrio: así es, la configuración electrónica de estos elementos termina en d, por lo cual deben estar en el bloque d (ver Tabla 2); efectivamente, serán reemplazados: el 71 y 103, ese es su lugar en el nuevo diseño propuesto.
Elementos de transición como el Cobre y el Cromo son difíciles de conciliar con los patrones globales de la tabla periódica: en el bloque d ocurre un tipo de hibridación (spd) con un enlace delta (Atkins y Jones, 2006; Pico, 20 de octubre de 2014); el último electrón es el responsable de lograr el equilibrio en el orbital, tema detallado será dado a conocer en un siguiente artículo por autora.
El principio de Aufbau usa una simple regla numérica para describir la secuencia en la que se llenan los orbitales. Esta se conoce como la regla de Madelung, por el físico Erwin Madelung, quien la formuló en la década de 1930 (Agudelo, 2015). La secuencia de llenado es sencilla para las tres primeras filas de la tabla periódica, en las que los elementos solamente tienen electrones en los orbitales s y p. Aquí, por el contrario, el principio de Aufbau dejará de considerarse una simple regla numérica; la regla de Madelung es la secuencia de llenado no solo para las tres primeras filas, sino para toda la tabla periódica.
Los orbitales 3p se van llenando en los elementos que van del aluminio al argón. Pero las cosas se complican cuando llegamos a la cuarta fila de la tabla. El orbital 4s se llena a continuación en el potasio y el calcio. Efectivamente, sigue el orden de la regla de Madelung.
Se piensa que los elementos no siguen la regla de Madelung, que es ilógico que el escandio pierda un electrón del orbital 4s, donde se observa experimentalmente, ya que este orbital tiene menor energía que el orbital 3d: no es ilógico, este elemento se encuentra en el bloque d, nivel 3, casilla 1, de acuerdo con patrón propuesto; hay tres fundamentos que sustentan el caso: a) el electrón que reacciona primero es el del mayor nivel (4s 2) y menor energía (3d 1) (Atkins y Jones, 2006; Grosvenor y Gálvez, 1976; Orgel, 2003); b) los electrones se reparten buscando el equilibrio, un electrón en el bloque d (Orgel, 2003); c) esto se complementa con el tema de hibridación (Pico, 20 de octubre de 2014), donde el electrón de 4s se ubica en la segunda orientación de d, así se obtienen tres espacios vacíos para que se unan tres cloros y se forme el tricloruro de escandio, por ejemplo.
El cromo es uno de esos elementos anómalos. La regla de Madelung predice que debería tener cuatro electrones en sus orbitales 3d y dos en el 4s. Sin embargo, la espectroscopía muestra que el cromo tiene cinco electrones en los orbitales 3d y uno en el 4s. De forma análoga, el cobre, el niobio, el rutenio, el rodio y una docena más de elementos tienen un electrón adicional en los orbitales d o f, en lugar de que lo presenten los orbitales más exteriores, como cabría esperar. En la presente investigación, esto no se considera ninguna anomalía, ocurren los fundamentos anteriormente mencionados; es un enlace delta que ocurre entre el orbital 3d y el orbital 4s en un metal de transición del cuarto periodo (Pico, 20 de octubre de 2014) y comprobado teóricamente al realizar una gama de ejercicios relacionados con el tema de hibridación; donde actúa el último electrón del último nivel 4s y de menor energía (Atkins y Jones, 2006) y se ubica en una orientación del orbital d, así logra ser un orbital semi ocupado que logra el equilibrio (Orgel, 2003); con seis espacios (uno en s, cinco en d) logra su máximo estado de oxidación (+6); para alcanzar su estado de oxidación (+3) se reduce. Se recomienda entender y comprender este artículo como conocimiento previo al siguiente tema a presentar. Se le ha identificado al patrón porque lo que ya está establecido lo incluye (ver Tabla 2) (ver Fig. 2) Con el diseño propuesto, se espera contribuir con la didáctica y disipar todas o la mayor parte de las dudas científicas que se tienen con respecto a la tabla periódica en pleno siglo XXI.
Materiales y métodos
Los métodos didácticos sugeridos en química son, en la enseñanza, el método de enseñar a pensar (Swartz,2019; Woolfolk, 2010); mientras que en el aprendizaje, el desarrollo de habilidades cognitivas y superiores (Canmaño, 2011) (Woolfolk, 2010). A continuación se describe un ejemplo de clase: 1) Realizar un sondeo de conocimientos previos y homogeneizar al grupo el tiempo necesario. 2) Definir las habilidades que deben desarrollar los alumnos, de inicio y continuo, básicas o elementales, como son observar, relacionar, comparar, clasificar y describir. Mostrar a los alumnos un video educativo en relación con el tema del átomo, células partiendo de la naturaleza, donde el alumno elabore preguntas sobre este y con guía de su maestro se pueda ir involucrando al tema, con respuestas encontradas en mencionado video sin sonido. 3) Mediante un mapa conceptual, separar lo que estudiaremos y exponerlo en clase: a) micro, b) macro y c) simbólico (Tabla 1) (método de Johnstone) (Cutrera y Stipcich, 2016). 4) Paulatinamente, ir involucrando otras habilidades de orden superior, a saber: interpretar, representar, análisis, síntesis, entre otras. 5) Que los alumnos, por equipo, investiguen y expongan casos reales donde se involucren productos o fenómenos químicos; que desarrollen su pensamiento crítico, habilidades de comunicación y lingüísticas al entregar un reporte individual para el final del tema. 6) Las clases expositivas del docente deben incluir análisis y analogías (Caamaño, 2011; Sanz, 2010; Woolfolk, 2010). 7) Los alumnos que entienden rápido pueden ayudar a quienes no han entendido aún (andamiaje de J. Brunner) (Woolfolk, 2010) (Barbán, 2008). 8) Los alumnos deben aprender a identificar patrones y series numéricas (ver Tabla 3) en la tabla periódica; realizarán ejercicios aplicando los principios de teoría cuántica (enactivo, icónico y simbólico; teoría J. Brunner) (Woolfolk, 2010). 9) Proporcionar pistas en la resolución de problemas (teoría de Vigotsky). 10) Realizar con material concreto átomos y moléculas para formar redes moleculares con la finalidad de comprender cómo se unen y cómo están acomodados los elementos en la tabla periódica, de acuerdo con sus orbitales (s, p, d, f). 11) Utilizar el laboratorio o simuladores para complementar con la parte práctica (gamificación y experimental) (Caamaño, 2011). 12) Realizar prácticas caseras nada peligrosas como observar un material oxidado en una soda con ph ácido; con globos como material concreto podemos representar a los orbitales y ver cómo se acomodan en un espacio tridimensional (método sintético). 13) Evaluar su habilidad para identificar la geometría molecular tridimensional al formar redes con la molécula del agua, elemental para la vida, y crear conciencia ecológica en el cuidado de esta.
En cuanto al método científico utilizado para crear el nuevo diseño de la tabla periódica, se trata del documental e hipotético-deductivo, el cual tiene la finalidad de comprender los fenómenos y explicar las causas que lo generan y parte de premisas generales para llegar a una premisa en particular (derrama magisterial, 11 de mayo de 2006; Sánchez, 2019). Y consistió en lo siguiente: 1) se observó un desfase en los elementos del bloque d comparado con elementos del bloque p cuando en la tabla consultada se arroja el mismo dato para ambos niveles y se encuentran en otro nivel (Zn y Ga; Cd e In; Hg y Tl; Ca y Sc; Sr e Y; Ba y Lu); se observó que los orbitales llevan un orden vertical, horizontal y diagonal en la regla de Madelung (Atkins y Jones, 2006), y este orden tiene relación con la tabla periódica y la composición interna del átomo; y que la organización de los elementos se rige por patrones matemáticos (ver Tabla 3) y un patrón identificado (ver Figura 2) (ver Tabla 2), además de todo lo establecido. 2) Se planteó una hipótesis: los bloques se deben reordenar para evitar el desfase observado. 3) Solo que, al reordenar los bloques, en la parte interna el orden del número atómico, no era secuencial; se logró identificar el patrón escalonado mediante la aplicación de un sistema de código de colores que lo hace resaltar claramente, es decir, del periodo séptimo al primero. 4) Se verifica que el patrón es el último orbital que ubica a los elementos en un nuevo diseño de la tabla periódica (ver Figura 3), y se organizarán teóricamente de acuerdo con la regla de Madelung o en su estado basal. Así fue cómo se llegó a los resultados obtenidos y presentados en este trabajo de investigación.
Resultados
El diseño propuesto comprende dos clasificaciones, una externa y otra interna. la externa conserva el orden de grupo y periodo reorganizando bloques; la interna organiza a los elementos de acuerdo con el patrón que es el último orbital del último nivel de la configuración electrónica, ubicando a los elementos en su acertada casilla (ver Figura 3 y Tabla 2). La didáctica consiste en desarrollar habilidades bajo los criterios de forma y color. En la Tabla 1 se muestran las habilidades que deben desarrollar los alumnos en temas de química. En la Tabla 2 se aporta la relación del patrón identificado con la organización de los elementos. Y en la Tabla 3 se encuentran algunos patrones matemáticos elementales en la tabla periódica. En la Figura 1, por su parte, se muestra el patrón que comprobó experimentalmente el Dr. David Goodstein (Secretaría de Educación Pública [SEP], 2014); en la Figura 2 se propone la forma de identificar al patrón, tomando como ejemplo al elemento escandio, y en la Figura 3 se muestra el nuevo diseño propuesto de la tabla periódica.
Discusión
El diseño propuesto coincide con la forma escalonada del modelo presentado por Charles Janet en 1928 (Arévalo, 2016); solo se difiere en la parte interna de la tabla periódica, pues el modelo presentado no consideraba la configuración electrónica. Se fundamenta de la parte experimental del Dr. David Goodstein (SEP, 2014) del Instituto de Tecnología en California, quien afirma que el patrón que rige los elementos es el número cuántico (m), lo cual ha sido base para que se identifique como patrón más bien al último orbital del último nivel de la configuración electrónica de cada elemento, ya que el segundo número cuántico (l) es el que da los valores al tercer número cuántico (m); en palabras coloquiales, l da la forma y m es la orientación de la molécula, y por lo tanto, el patrón será el último orbital, el que ubica a los elementos en su respectiva casilla en la tabla periódica.
Se fundamentó también con el Dr. Gabriel Heber Pico (20 de octubre de 2014), científico colombiano, quien ha sido base en el tema de hibridación; no obstante, al igual que en el caso anterior, aquí también hay una excepción, pues se propone un diseño diferente al que él propuso en 2014 para la tabla periódica, a saber, el escandio conserva su lugar como en la tabla tradicional. Además, este autor une el bloque d con el bloque f y el bloque s lo cambia de lugar repartiéndolo en casillas de dos en dos escalonados; en esta propuesta también se cambia de lugar al bloque s, pero de forma diferente, siguiendo el patrón y los bloques d y f se unen, pero estos se encuentran en diferente nivel, tomando en cuenta la regla de Madelung. Finalmente, se encontró un cuestionario presentado por el Departamento de Educación de Puerto Rico, sin datos del autor: “Patrones en la configuración electrónica”, donde se menciona e identifica al patrón como el último orbital sin profundizar en este concepto; aunado a ello, cabe aclarar, no se encontró más información sobre el tema y no se encontró bibliografía sobre el Dr. Goodstein, sino que solo video (SEP, 2014).
Conclusiones
Por lo que respecta a la didáctica, hay dos vertientes: por un lado, ¿cómo se enseña?, y por el otro, ¿cómo se aprende? En la primera, se recomienda el enfoque de enseñar a pensar como metodología para cualquier tema de cualquier asignatura de cualquier nivel y en cualquier ámbito, el cual consta, como ya se dijo anteriormente, de realizar preguntas junto con el grupo y con respecto al tema; y en la segunda, se recomienda aplicar actividades y material educativo que favorezca el desarrollo de habilidades cognitivas; además, desarrollar las habilidades científicas. El alumno, para comprender, primero tiene que entender, y esto se logra desarrollando habilidades básicas. Las habilidades cognitivas se complementan con el resto de habilidades que existen en educación, tal y como habilidades inter e intrapersonales, de comunicación, de autocontrol, de pensamiento crítico, sociales y toma de decisiones, por mencionar algunas. Los conocimientos previos son pieza clave. Así, para entender y comprender este tema en específico, las habilidades que se requieren son: en matemáticas, operaciones básicas, fracciones, potencias, series, sustituir una variable en una ecuación, lenguaje algebraico, notación científica, la elipse, ejes tridimensionales; en física, diferenciar lo que es un fenómeno físico de un químico, ejes tridimensionales, vector, momento angular; en química, distinguir conceptos como elemento, átomo, molécula, enlace, configuración electrónica y principios de teoría cuántica.
Científicamente se concluye que, al identificar el patrón como el último orbital localizado en la configuración electrónica, es este el que rige la organización de los elementos en la tabla periódica, y es el eslabón para comprender el nuevo diseño de esta y de otros temas. Los elementos se ubican en el nuevo diseño de la tabla periódica siguiendo teóricamente la regla de Madelung o en su estado basal.
Académicamente, a nivel medio superior de México, se observa que química se cursa en primer semestre y física en tercer semestre, esto es, en dos tiempos diferentes; debería, además de estar relacionadas en tercero, en primer semestre haber una asignatura introductoria o taller de habilidades científicas previas a ambas asignaturas, incluyendo habilidades matemáticas no traducidas a resolver ejercicios, sino a interpretar conceptos y reforzar el lenguaje algebraico, esto es solamente una sugerencia.
Este trabajo de investigación se complementará con otro artículo y un libro de actividades que será enfocado al desarrollo de habilidades cognitivas. Se finalizó este trabajo justamente en un momento histórico, en el 150 aniversario de la tabla periódica, y dado a conocer hasta el presente 2020, con la ilusión de que sea aceptado por la comunidad científica, docente y estudiantil.











 nueva página del texto (beta)
nueva página del texto (beta)




