Introducción
La medicina herbolaria se refiere al uso de extractos de plantas medicinales o sus derivados con fines terapéuticos para la prevención y tratamiento de diversas enfermedades a través de su empleo. El hombre desde el principio de los tiempos, ha hecho lo posible por atenuar sus enfermedades y mejorar su calidad de vida y la medicina herbolaria ha jugado un papel muy importante en esto1. La medicina herbolaria en odontología ha estado presente a través de la historia y es un recurso accesible para gran parte de la población2. Las plantas y los productos naturales han sido empleados por muchos años, algunas veces con resultados terapéuticos favorables, pero también en ocasiones resultados poco esperados, por eso es importante realizar pruebas que permitan evaluar sus propiedades3. Aproximadamente la mitad de los productos farmacéuticos a base de plantas que se fabrican en los Estados Unidos son indicados para su uso como antimicrobianos. Existen aproximadamente entre 250,000 y 500,000 especies de plantas en el mundo, pero sólo entre el 1 al 10% de ellas, son usadas como comida tanto por humanos como por animales. Las plantas contienen químicos como los fenoles, terpenoides, quinonas y taninos que son metabolitos que pueden ser efectivos contra virus, bacterias y hongos4. El Tepezcohuite (Mimosa tenuiflora) fue descrita por Wild en 1810, también llamado árbol de la piel es una especie arbustiva localizada abundantemente en la región central de Chiapas e Istmo de Tehuantepec, Oaxaca, México; se le atribuyen cualidades de cicatrización de la piel por quemaduras de sol, exposición accidental al fuego, úlceras estomacales y uso en cosméticos. Se han fabricado productos artesanales e industrializados a partir de su corteza contra heridas y quemaduras de la piel que han sido muy populares desde los años ochenta5. Equisetum arvense o cola de caballo fue descrita por Carlos Linneo en 1753. Una de las propiedades que hacen única a esta planta es su alto contenido en sales de sílice, algunas de ellas hidrosolubles. Este mineral es indispensable en la formación de tejido conectivo, uñas y huesos, además se considera que acelera la regeneración del tejido conectivo dañado. El equiseto se encuentra distribuido por las zonas templadas del hemisferio septentrional y se han identificado dos quimiotipos, uno en Europa y otro en Asia y América del Norte que se pueden distinguir químicamente de flavonoides los cuales caracterizan a esta planta6. El clavo de olor o Syzygium aromaticum, también conocido como Eugenia caryophyllata fue descrito por L. Merr y L. M. Perry en 1929 y es una especia ampliamente usada y conocida, su aceite esencial y extractos han sido analizados y caracterizados debido a que han demostrado tener amplio espectro de acción contra una gran variedad de microorganismos que causan distintos padecimientos que afectan a los humanos, animales y plantas. El clavo de olor es una especia perteneciente a la familia Myrtaceae, la cual se caracteriza por habitar en ambientes principalmente tropicales7. Otra especia de gran valor es el orégano que fue descrito por Kunth en 1818, es una planta herbácea arbustiva comúnmente utilizada con propósitos culinarios8. En el planeta existen diferentes especies conocidas como orégano y las de mayor importancia económica son orégano griego (Origanum migare), orégano español (Coridohymus capitatus), orégano turco (Origanum onites) y orégano mexicano (Lippia graveolens). Una planta de gran interés es el Aloe vera también llamada sábila, ya que posee muchos usos en las industrias alimentaria, farmacéutica y cosmética; fue descrita por Carlos Linneo en 1753 y una de las partes más utilizadas de esta planta es el gel debido a sus propiedades funcionales, antioxidantes y terapéuuticas. El A. vera o sábila es una planta la cual presenta alrededor de 360 especies diferentes y pertenece a la familia de las asfodeláceas o liláceas, con hojas perennes en forma de roseta; su tamaño puede alcanzar desde unos cuantos centímetros hasta los 50 cm9. Para evaluar las propiedades de una planta, existen diferentes pruebas, algunas determinan la susceptibilidad de un microorganismo frente a éstas o a los fármacos y se realizan a partir de la exposición de una concentración estandarizada del germen a estos fármacos, éstas pruebas se denominan pruebas de sensibilidad, también llamadas antibiogramas. Pueden realizarse para bacterias, hongos o virus. El estudio de susceptibilidad in vitro a antimicrobianos de los microorganismos patógenos puede realizarse a través de diversos métodos, el de uso más común por los laboratorios de microbiología es el de difusión en agar estandarizado para microorganismos de crecimiento rápido. El método estandarizado y recomendado se basa en el descrito originalmente por Bauer, llamado también de sensibilidad en disco, que obtiene resultados cualitativos que se correlacionan bien con los resultados cuantitativos obtenidos mediante determinación de halos de inhibición10. En cuanto a la bacterias orales de interés odontológico tenemos dos que son las más importantes: el Streptococcus mutans, el cual es uno de los microorganismos cariogénicos asociados a la caries dental y es muy importante el estudio de su participación en la colonización de tejidos dentales, implantación e interacción con otros microrganismos para la comprensión de la dinámica de las biopelículas dentales11; además el Streptococcus sobrinus que es una variedad de S. viridans y que vive en la flora de la boca humana. Tanto S. mutans como S. sobrinus deben considerarse igualmente virulentos con respecto a la caries dental12. El objetivo de este estudio fue la evaluación antibacteriana y coagulante de los extractos de Mimosa tenuiflora (tepezcohuite), Equisetum arvense (cola de caballo), Syzygium aromaticum (clavo), Lippia graveolens (orégano) y Aloe vera (sábila).
Materiales y métodos
El estudio se realizó previa autorización del Comité de Bioética de la Facultad de Odontología de la UANL Folio 00152. El material vegetal fue obtenido de un lugar reconocido de venta. Una muestra del producto natural elegido fue depositado en el herbario de la facultad de Ciencias Biológicas de la Universidad Autónoma de Nuevo León para su identificación taxonómica correspondiente. M. Tenuiflora 26334, E. Arvense 26468, S. aromaticum 26467, L. graveolens 26469, y A. vera 26332. .Se prepararon extractos etanólicos y liofilizado de aloe vera13. Los extractos fueron colocados en frasco ámbar estéril a temperatura de 4ºC para su conservación y posteriormente se fabricaron las concentraciones de 500 y 1000 µg/mL con las diferentes plantas y en cada ensayo se respetó el siguiente orden metodológico M. Tenuiflora (1), E. Arvense (2), S. aromaticum (3), L. graveolens (4), y A. vera (5).
Actividad antibacteriana
Primeramente se evaluó la actividad antibacteriana de los extractos contra los microorganismos orales. La evaluación de la actividad antibacteriana se realizó mediante prueba de técnica de pozo en agar14,15. Se preparó inicialmente una suspensión de microorganismos a 0.05 de la escala de Mc Farland, lo cual representa 1x106 UFC/mL y se evaluaron concentraciones de 500 y 1000 µg/mL de cada extracto. Se inocularon y sembraron 100μL de cada cepa sobre medio de cultivo Muller Hinton empleando la técnica de pozo en agar para probar si los extractos presentaban actividad antibacteriana. Se realizaron cinco pozos en el agar y se adicionaron 20μL de cada extracto a evaluar y como control positivo clorhexidina al 0.12% (1200 µg/mL). Las cajas fueron incubadas a 37ºC durante 24 horas para evaluar posteriormente la actividad.
Actividad coagulante
La actividad coagulante de los extractos de M. tenuiflora, E. arvense, S. aromaticum, L. graveolens y A. vera se analizó en el laboratorio certificado PROMEDIC midiendo mediante coagulómetro los tiempos TP (tiempo de protrombina) y TTPa (tiempo de tromboplastina parcial activado) de cada extracto aplicado a muestra de sangre humana y comparando con la sangre sin extracto (control)16. Los resultados se expresan en segundos y el instrumento marca exactamente el momento en el que se produce el coágulo, para todas las concentraciones se procede de la misma manera verificando por triplicado. Para el análisis estadístico se empleó el programa estadístico IBM SPSS (Statistical Program for Social Sciences) versión 26.0. Los datos se analizaron por medio de una prueba t de student con diferencia de medias con 95% de Intervalo de Confianza (IC) y un valor p < 0.05.
Resultados
Las siguientes figuras muestran la media de los halos de inhibición de los diferentes extractos en concentraciones de 500 y 1000 µg/mL contra S. mutans y S. sobrinus comparando con el control positivo que fue clorhexidina a 1200 µg/mL la cual se eligió por ser el antimicrobiano más utilizado odontología. Se consideró significación estadística una p<0.05.
La figura 1 muestra la actividad antibacteriana de los extractos de las plantas de M. tenuiflora, E. arvense, S. aromaticum, L. graveolens y A. vera sobre cepas de S. mutans a 500 µg/ mL en donde se observa una diferencia estadística altamente significativa de los extractos de E. arvense y L. graveolens (p= 0.0057) y (p= 0.0000) respectivamente, los cuales mostraron un efecto antimicrobiano superior a clorhexidina.

Figura 1 Actividad antibacteriana de los extractos de las plantas de M. tenuiflora, E. arvense, S. aromaticum, L. graveolens, y A. vera sobre cepas de S. mutans. Concentración 500 µg/mL. Las barras representan el promedio del triplicado de tres ensayos totalmente independientes. Los datos representan las medias ± DE de los halos tomando como como control positivo clorhexidina a 1200 µg/mL. Fuente: Elaboración propia
La figura 2 muestra la actividad antibacteriana de los extractos de las plantas de M. tenuiflora, E. arvense, S. aromaticum, L. graveolens y A. vera sobre cepas de S. mutans a 1000 µg/ mL en donde se observa una diferencia estadística altamente significativa de los extractos de E. arvense y L. graveolens (p= 0.0001) los cuales mostraron un efecto antimicrobiano superior a clorhexidina.
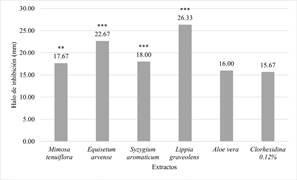
Figura 2 Actividad antibacteriana de los extractos de las plantas de M. tenuiflora, E. arvense, S. aromaticum, L. graveolens, y A. vera sobre cepas de S. mutans. Concentración 1000 µg/mL. Las barras representan el promedio del triplicado de tres ensayos totalmente independientes. Los datos representan las medias ± DE de los halos tomando como como control positivo clorhexidina a 1200 µg/mL. Fuente: Elaboración propia
La figura 3 muestra la actividad antibacteriana de los extractos de las plantas de M. tenuiflora, E. arvense, S. aromaticum, L. graveolens y A. vera sobre cepas de S. sobrinus a 500 µg/ mL en donde se observa una diferencia estadística altamente significativa de los extractos de A. vera (p= 0.0011) y L. graveolens (p= 0.0089), los cuales mostraron un efecto antimicrobiano superior a clorhexidina.
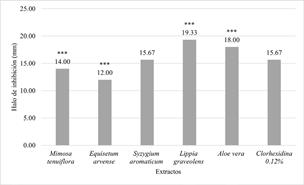
Figura 3 Actividad antibacteriana de los extractos de las plantas de M. tenuiflora, E. arvense, S. aromaticum, L. graveolens, y A. vera sobre cepas de S. sobrinus. Concentración 500 µg/mL. Las barras representan el promedio del triplicado de tres ensayos totalmente independientes. Los datos representan las medias ± DE de los halos tomando como como control positivo clorhexidina a 1200 µg/mL. Fuente: Elaboración propia
La figura 4 muestra la actividad antibacteriana de los extractos de las plantas de M. tenuiflora, E. arvense, S. aromaticum, L. graveolens y A. vera sobre cepas de S. sobrinus a 1000 µg/ mL en donde se observa una diferencia estadística altamente significativa de los extractos de A. vera (p= 0.0127) y L. graveolens (p= 0.0006), los cuales mostraron un efecto antimicrobiano superior a clorhexidina.

Figura 4 Actividad antibacteriana de los extractos de las plantas de M. tenuiflora, E. arvense, S. aromaticum, L. graveolens, y A. vera sobre cepas de S. sobrinus. Concentración 1000 µg/mL. Las barras representan el promedio del triplicado de tres ensayos totalmente independientes. Los datos representan las medias ± DE de los halos tomando como como control positivo clorhexidina a 1200 µg/mL. Fuente: Elaboración propia
En cuanto a los resultados de las pruebas de coagulación la figura 5 muestra la evaluación in vitro del tiempo de protrombina (TP) de los extractos de M. tenuiflora, E. arvense, A. vera, S. aromaticum y L. graveolens en concentraciones de 1000 y 500 µg/mL. Observamos que el valor de TP al medir en el coagulómetro la sangre sin extracto es 12.27 segundos mientras que E. arvense y S. aromaticum ambos a 1000 µg/ mL presentaron tiempos de 13.37 segundos.
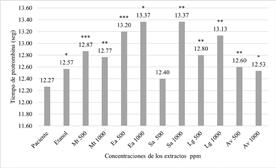
Figura 5 Evaluación in vitro del tiempo de protrombina (TP) de los extractos de M. tenuiflora (Mt), E. arvense (Ea), A. vera (Av), S. aromaticum (Sa) y L. graveolens (Lg) a 500 y 1000 µg/mL. Los datos representan las medias en segundos tomando como control positivo una muestra de sangre humana. Fuente: Elaboración propia
La figura 6 muestra la evaluación in vitro del tiempo de tromboplastina parcial activada (TTPa) de los extractos de M. tenuiflora, E. arvense, A. vera, S. aromaticum y L. graveolens. Los datos representan las medias en segundos tomando como control positivo la muestra de sangre sin extracto observando que el valor es de 32.63 segundos (p<0.05) sin embargo, M. tenuiflora a 500 µg/mL aumentó los tiempos a 39.17 segundos.
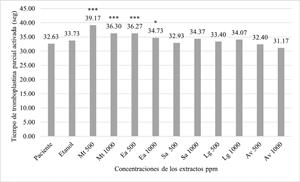
Figura 6 Evaluación in vitro del tiempo de tromboplastina parcial activada (TPPa) de los extractos de M. tenuiflora (Mt), E. arvense (Ea), A. vera (Av), S. aromaticum (Sa) y L. graveolens (Lg) a 500 y 1000 µg/mL. Los datos representan las medias en segundos tomando como control positivo una muestra de sangre humana. Fuente: Elaboración propia
Discusión
Los extractos de E. arvense y L. graveolens presentaron mejor efecto contra S. mutans y S. sobrinus en concentraciones de 1000 µg/mL, además L. graveolens mantuvo su efecto a 500 µg/mL (p=0.0001). Erazo et al. (2017) mencionan actividad antibacteriana en los extractos de S. aromaticum y L. graveolens sin encontrar diferencias significativas (p> 0,05) en comparación con clorhexidina a 1200 µg/ mL tanto a la 24 como 48 horas15. Schovelin et al. (2018) hablan del efecto antibacteriano de L. graveolens sobre el crecimiento de Streptococcus mutans en infusiones sobre el 20% de concentración17. En este estudio obtuvimos efecto inhibitorio contra S. mutans y S. sobrinus a las 24 horas similar o superior al obtenido con clorhexidina al 0.12% (1200 µg/mL) con una diferencia estadística altamente significativa en las diferentes concentraciones. Con respecto a la evaluación de la actividad coagulante el estudio de Nayal et al. (2015) mostró resultados con algunas plantas. Los resultados de la determinación del TP muestran que Alchemilla vulgaris, Equisetum arvense y Potentilla erecta disminuyeron el TP en diferentes porcentajes pero sin significancia estadística p>0,05. Los resultados de la determinación de TTPa mostraron que Plantago lanceolata, Alchemilla vulgaris, Artemisia absinthium y Potentilla erecta aumentaron el TTPa en comparación con el control sin significación estadística p>0,05. Solo Equisetum arvense disminuyó el tiempo en comparación con el control pero sin significancia estadística p>0.0518. En este estudio se determinó que ninguno de los extractos prolongó de manera estadística significativa los tiempos de TP excepto E. arvense a 1000 µg/mL (P= 0.0415) y S. aromaticum a 1000 µg/mL (P= 0.048) (p<0,05), los cuales lo elevaron por un segundo pues presentaron ambos tiempos de 13.37 seg. En cuanto al valor de TPPa se observó que M. tenuiflora a 500 µg/mL con un valor (P=0.0001) (p<0,05) aumentó los tiempos por 6 segundos a 39.17 segundos.
Conclusiones
E. arvense y L. graveolens son los extractos que muestran el mejor efecto antibacteriano en los resultados sobre cepas de S. mutans en ambas concentraciones. L. graveolens y A. vera muestran el mejor efecto antibacteriano en los resultados sobre cepas de S. sobrinus en ambas concentraciones. En el ensayo de coagulación observamos que el valor de TP del control fue 12.27 segundos, los extractos que aumentaron los tiempos fueron E. arvense y S. aromaticum a 1000 µg/ mL que presentaron tiempos de 13.37 segundos. En cuanto al valor TPPa el control fue de 32.63 seg y el extracto que presentó el tiempo más aumentado fue M. tenuiflora a 500 µg/mL que presentó tiempos de 39.17 segundos. Se sugiere plantear estudios y evaluaciones posteriores para considerar su efectividad en tratamientos orales











 nueva página del texto (beta)
nueva página del texto (beta)



