Introducción
El virus sincitial respiratorio (VSR), se considera como el principal agente causal de problemas en la salud de prematuros menores de 37 semanas de edad gestacional y con bajo peso; como de alto riesgo se incluye a los prematuros con diagnóstico de displasia broncopulmonar y cardiopatía congénita hemodinámicamente estable1 2 3 4 5 6 7-8.
Los problemas causados por este virus, generan anualmente altos costos sanitarios debido a la necesidad de hospitalizaciones, utilización de medicamentos y otros aspectos de la atención en salud; sin embargo, hasta la fecha, no se cuenta con una vacuna que evite la infección de este virus7,9 10,11,12,13-14; aunque, en proceso hay investigaciones al respecto1,5,14,15 16.
La estacionalidad del VSR cambia de un lugar a otro y se relaciona con las consecuencias que genera en cada zona geográfica, donde los prematuros de alto riesgo que se infectan, tienden a sufrir mayor número de episodios de bronquiolitis, caracterizados por taquipnea, dificultad respiratoria y sibilancias, debido a la obstrucción de la vía respiratoria y cuando progresa puede convertirse en neumonía. Esas dos condiciones ameritan de una mayor estancia hospitalaria, oxigenoterapia, ventilación mecánica y de la unidad de cuidados intensivos (UCI). Las complicaciones más graves, pueden llevar a la muerte del infante6,17,18,19,20,21, en especial, en los países en vías de desarrollo1,12,15 22. Asimismo, se ha reportado que en algunos casos hay una posible asociación entre este virus con el desarrollo de las crisis respiratorias y asmáticas que ocurren en años posteriores23.
La terapia inmunológica profiláctica con Palivizumab, es una opción terapéutica que disminuye los efectos que causa el VSR, pues disminuye en 80% la probabilidad de hospitalización, cuando se une a la proteína F viral e impide la fusión del virus a las células endoteliales de prematuros de alto riesgo y con factores de riesgo, como el hacinamiento, la exposición al fumado, una condición socioeconómica baja o la presencia de niños en edad escolar en el hogar7,8,24, 25,26,27 28.
Este producto, en concordancia con las recomendaciones de la Academia Americana de Pediatría; se utiliza desde 1998 en prematuros de 33 a 35 semanas de gestación con o sin displasia broncopulmonar y con factores de riesgo. En 2003, se incluyó también a los menores de dos años con enfermedad cardíaca congénita hemodinámicamente significativa29. Posteriormente, en 2012 y 2014, se incorporaron otras clarificaciones a la guía de uso de este producto7,26. No obstante, esta tecnología sanitaria o anticuerpo monoclonal humanizado, tiene un alto costo; por lo que su disponibilidad, resulta un desafío en aquellos sistemas de salud que tienen escaza limitada disponibilidad financiera; con grandes necesidades en salud30,31,32,33 34.
A partir de estudios científicos disponibles en la Internet, se ha demostrado la eficacia y efectividad del Palivizumab en otros contextos35,36. Además se reportan escasos efectos secundarios, entre los que se encuentran: eritema, fiebre, irritabilidad, exantema, dolor en el sitio de la aplicación, en el sistema respiratorio (infecciones), gastrointestinal, nervioso o hematopoyético21.
Sin embargo y aunque en Costa Rica, al igual que en otros países, se utiliza este medicamento de manera priorizada9, desde hace más de una década, no se había realizado ningún estudio fármaco-económico que evidenciara el uso de este recurso sanitario.
De ahí que, el objetivo de este trabajo sea la estimación de la eficiencia a través del análisis costo-efectividad incremental de la aplicación de la inmunoterapia con Palivizumab en prematuros versus la práctica tradicional o clínica habitual en la Caja Costarricense del Seguro Social de Costa Rica en el periodo 2010 a 2017.
Materiales y métodos
Se realizó una evaluación económica completa del tipo costo-efectividad acorde con la clasificación establecida por Michael Drummond y que ha sido utilizada por diversos autores a lo largo del tiempo37,38,39,40,41-42. Como parte del análisis costo-efectividad, se consideraron las unidades reales de los efectos en salud de la práctica clínica y los efectos económicos a través de las unidades monetarias de los costos. Se comparó la terapia tradicional o práctica clínica habitual como terapia de mantenimiento, contra el uso profiláctico de la inmunoterapia innovadora con Palivizumab.
El periodo en estudio contempló de 2010 a 2017; se estableció un horizonte temporal de un año, periodo para en el cual son válidos los resultados en salud y económicos. Se consideró la perspectiva desde la Seguridad Social de Costa Rica. Se buscaron inicialmente los expedientes clínicos de los prematuros nacidos en hospitales y que recibieron, por indicación médica, la profilaxis con Palivizumab y luego se buscaron los expedientes clínicos de los prematuros que no utilizaron la profilaxis; para ello se utilizaron las listas de los prematuros que habían tenido como egreso hospitalario la displasia broncopulmonar y la cardiopatía congénita hemodinámicamente estable.
El Comité Ético Científico Central de la Seguridad Social, autorizó el estudio y se incluyeron siete hospitales: uno hospital en niños, tres hospitales generales y tres periféricos; todos localizados en el Gran Área Metropolitana. Los datos de los prematuros con Palivizumab se obtuvieron de cuatro hospitales y el de los prematuros con la terapia de mantenimiento, de los tres restantes.
Para cada año, entre 2010 y 2017, se colectaron los datos clínicos de interés de los prematuros con o sin Palivizumab, se consideraron como variables de efectividad los siguientes aspectos: el número de episodios de bronquiolitis y neumonía, el número de días de hospitalización en otros servicios y en la Unidad de Cuidados Intensivos (UCI), el número de días con oxigenoterapia, el número de días con ventilación mecánica y el número de muertes. Se colectaron los mismos datos de interés en todos los prematuros; la única diferencia consistió en el uso o no del Palivizumab.
Para la recolección de los datos, se utilizó el procedimiento de desgaste, de modo que la búsqueda de datos en los expedientes clínicos en físico o digital (escaneados o expediente digital), se realizó en cada centro hospitalario y esa búsqueda concluyó cuando no fue posible acceder a más expedientes clínicos, dado que el personal de salud desconocía el destino final de los correspondientes documentos.
Los datos de los costos fueron suministrados por el personal a cargo en los servicios respectivos de cada hospital; estos surgen a partir de un tarifario institucional actualizado para cada año que contempla el efecto de la inflación. Dentro de los datos de costos se consideró: el de todos los medicamentos utilizados (inmunoterapia y otros), el costo de la aplicación de la inmunoterapia al considerar la dosis en miligramos por kilogramo de peso y el número de dosis aplicadas, el costo de la consulta médica, la prueba diagnóstica del VSR y el costo de la estancia hospitalaria (UCI u otro servicio). Los costos fueron expresados en dólares americanos en cada año y no se utilizó tasa de descuento, ya que el horizonte temporal fue menor de un año y por norma no se realiza.
Dada la diversidad de las fuentes de datos; se realizó el análisis de los datos agrupados mediante el árbol de decisiones y luego, se realizó el análisis según el grupo de edad gestacional en semanas (menores de 32, entre 32 a 35 y mayores de 35); además, se realizó el análisis del costo- efectividad medio, incremental y el análisis de sensibilidad con un intervalo de confianza del 90 y 95% mediante el promedio y desviación estándar del costo total del tratamiento por días totales de hospitalización. Dado que, en Costa Rica, no se han establecido límites de umbrales de costo, se comparó el costo-efectividad e incremental internamente, mediante los resultados obtenidos.
Esta investigación cumple con los principios de confidencialidad y anonimato.
Resultados
Durante el periodo en estudio, 200 prematuros utilizaron Palivizumab (solo el 2% tuvo diagnóstico del VSR) y 206 no lo utilizaron.
Datos agrupados mediante el análisis del árbol de decisiones (figura 1 y cálculo del valor esperado del costo- efectividad incremental): se encontró que el valor esperado del costo- efectividad incremental fue de $1,799.00 por cada día de hospitalización con Palivizumab.
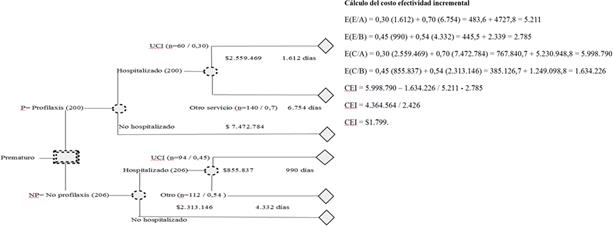
Fuente: Elaboración propia. Estudio farmacoeconómico palivizumab. 2019.
Figura 1 Árbol de decisiones
Datos por grupo de edad gestacional: los datos de la tabla 1 muestran que, a mayor edad gestacional, disminuyó el número de prematuros que recibieron el Palivizumab y que hubo una mayor cantidad de prematuros hombres
Tabla 1 Datos generales por grupo gestacional con* o sin** Palivizumab, 2010 a 2017. Costa Rica.
| Edad gestacional en semanas | ||||||||||||
| Variable | Menos de 30* | Entre 32-35* | Mayor de35* | Menos de 32** | Entre 32-35** | Mayor de 35** | ||||||
| n | 170 | 26 | 4 | 96 | 49 | 61 | ||||||
| Sexo | 65M 105H | 15M 11H | 0M 4H | 43M 53H | 16M 33H | 34M27H | ||||||
| Peso | a | 14 | a | 1 | a | 0 | a | 4 | a | 0 | a | 0 |
| b | 48 | b | 0 | b | 0 | b | 30 | b | 1 | b | 0 | |
| c | 92 | c | 16 | c | 0 | c | 48 | c | 8 | c | 0 | |
| d | 16 | d | 7 | d | 0 | d | 11 | d | 16 | d | 4 | |
| e | 0 | e | 2 | e | 4 | e | 3 | e | 25 | e | 57 | |
| E | 159 DBP 7 ECC 4 DBP+ECC | 25 DBP 1 ECC | 12 BPC ECC 1 DPC+ECC | 90 DBP 5 ECC 1 DBP+ECC | 41 DPC 9 ECC | 27 DPC 33 ECC 1 DPC+ECC | ||||||
n: número de prematuros; H: Hombre, M: mujer; Peso al nacer: a (<750 gramos), b (750-999 gramos), c (1000 a 1499 gramos), d (1500 a 1999 gramos), e (>2000 gramos); E: enfermedad, BPC: displasia broncopulmonar, ECC: enfermedad cardiaca congénita.
Fuente: Elaboración propia. Estudio fármaco-económico Palivizumab. 2019.
(H:233, M:173) con o sin Palivizumab. La mayor cantidad de casos estuvo en el sub grupo de menores de 32 semanas de edad gestacional. De acuerdo con el peso al nacer, en los subgrupos de menores de 32 semanas, la mayor cantidad de prematuros (92/170, 54% con Palivizumab; 48/96, 50%) tuvo entre 1.000 a 1.499 gramos; igual situación se presentó en el subgrupo de entre 32 a -35 semanas con Palivizumab (16/26, 62%). En el subgrupo de entre 32 a 35 semanas sin Palivizumab (25/49, 51%) y mayores de 35 semanas con (100%) o sin Palivizumab (57/61, 93%), la mayor cantidad estuvo en mayores de 2,000 gramos.
Se encontró que, 29 prematuros (14,5%) recibieron Palivizumab y tenían más de 1,500 gramos, el cual, se considera como un peso por arriba del rango que establece la OMS para ser considerado como prematuro de muy bajo peso al nacer; en los prematuros, que no recibieron Palivizumab hubo 116 (53%) prematuros en igual condición. En los sub grupos de menores de 35 semanas, prevaleció la enfermedad de displasia broncopulmonar, 184 prematuros con Palivizumab y 131 prematuros sin Palivizumab; mientras que, en los mayores de 35 semanas, prevaleció la enfermedad cardíaca congénita, 8 prematuros con Palivizumab y 9 prematuros sin Palivizumab. Solo en el sub grupo de entre 32 a 35 semanas, con o sin Palivizumab, no hubo casos de prematuros con ambas enfermedades.
En la tabla 2, se muestran los datos de las variables de efectividad, según la edad gestacional. Los prematuros de menores de 32 semanas con Palivizumab en comparación con aquellos sin Palivizumab, muestran valores más altos en todas las variables de efectividad, excepto en el número de muertes; lo contrario, ocurrió en el sub grupo de entre 32 a 35 y en el de mayores de 35 semanas, donde el comportamiento varía acorde con la variable. Se encontró que los prematuros del sub grupo de menores de 32 semanas que recibió Palivizumab (42%) tuvieron la mayor severidad en la hospitalización, esto al considerar el número de díasde hospitalización (10,601), el número de días con ventilación mecánica (1,749), el número de días con oxigenoterapia (11,094) y la estancia en la unidad de cuidados intensivos (1,361).
Tabla 2 Variables de efectividad según edad gestacional en semanas con* o sin** Palivizumab. 2010 a 2017, Costa Rica.
| Variable | Menor de 32* | Menor de 32** | Entre 32 a 35* | Entre 32 a 35** | Mayor de 35 * | Mayor de 35 ** |
| Bronquiolitis | 33 | 9 | 2 | 9 | 1 | 3 |
| Neumonía | 19 | 13 | 1 | 3 | 1 | 3 |
| Oxigenoterapia | 11,094, n=170 | 5,605, n=95 | 782, n=25 | 1,224, n=49 | 720 n=25 | 797 n=61 |
| Ventilación mecánica | 1,749 n=170 | 1,050 n=95 | 167 n=25 | 249 n=48 | 174 n=4 | 119 n=57 |
| Hospitalización | 10,601 n=170 | 5,014 n=96 | 1,088 n=26 | 1,609 n=49 | 510 n=4 | 1,289 n=61 |
| Días en UCI | 1,361 n=50 | 759 n=67 | 114 n=6 | 162 n=6 | 137 n=4 | 89 n=9 |
| Número muertes | 1 | 2 | 0 | 0 | 0 | 0 |
n: número de prematuros Fuente: Elaboración propia. Estudio fármaco-económico Palivizumab. 2019. Fuente: Elaboración propia.
De los datos de los costos según la edad gestacional que se muestran en la tabla 3, destaca que el costo total del tratamiento con la tecnología innovadora es mucho mayor que el de la práctica clínica habitual.
Tabla 3 Datos de costos según edad gestacional con* o sin** Palivizumab, 2010 a 2017. Costa Rica.
| Costos | Menor de 32* | Entre 32 y 35* | Mayor de 35* | Menor de 32** | Entre 32 y 35** | Mayor de 35** |
| Hospital- ización | $13.338,278.00 | $1.244,330.00 | $795,570.00 | $3.029,998.00 | $1.080,984.00 | $650,228.00 |
| UCI | $ 2.131,631.00 | $215,007.00 | $212,831.00 | $ 632,021.00 | $181,545.00 | $42,271.00 |
| Otros medicamentos | $32,950.00 | $4,449.00 | $1,559.00 | $12,127.00 | $4,975.00 | $2,659.00 |
| Prueba | $5,712.00 | $486.00 | $234.00 | $9.00 | $100.00 | $76.00 |
| Palivizumab | $502,843.00 | $74,307.00 | $18,182.00 | 0.00 | 0.00 | 0.00 |
| Aplicación | $1,869.00 | $530.00 | $152.00 | 0.00 | 0.00 | 0.00 |
| Consulta médica | $20,991.00 | $3,190.00 | $628.00 | $54,603.00 | $29,117.00 | $39,783.00 |
| Innovación | $13.902,643.00 | $1.327,292.00 | $816,325.00 | 0.00 | 0.00 | 0.00 |
| Habitual | 0.00 | 0.00 | 0.00 | $3.096,737.00 | $1.115,176.00 | $692,746.00 |
| Total | $16.046,.260.00 | 0.00 | 0.00 | 0.00 | ||
| Total | 0.00 | 0.00 | 0.00 | $4.904,659.00 | ||
Fuente: Elaboración propia. Estudio fármaco-económico Palivizumab. 2019.
En correspondencia, sucede igual con el costo-efectividad medio que se muestra en la tabla 4 ; no obstante, el costo- efectividad incremental en el sub grupo de entre 32 a 35 y en mayores de 35 semanas fueron los más costosos-efectivos.
Tabla 4 Costo-efectividad medio e incremental según edad gestacional con* o sin** Palivizumab, 2010 a 2017. Costa Rica.
| Edad gestacional en semanas | ||||||
| Variable | Menor de 32 * | Menor de 32** | Entre 32 y 35 * | Entre 32 y 35 ** | Mayor de 35 * | Mayor de 35** |
| Costo-efectividad medio hospitalización en otros servicios | $1,311.00 | $617.00 | $1,220.00 | $693.00 | $1,600.00 | $537.00 |
| Costo-efectividad medio hospitalización en UCI | $1,566.00 | $833.00 | $1,886.00 | $1,121.00 | $1,554.00 | $475.00 |
| Costo-efectividad incremental hospitalización en otros servicios | $1,935.00 | $407.00 | $158.00 | |||
| Costo-efectividad incremental hospitalización en UCI | $2,491.00 | $697.00 | $3,553.00 | |||
Fuente: Elaboración propia. Estudio fármaco-económico Palivizumab. 2019.
Acorde con los resultados que se encuentran en la tabla 5, se puede determinar que el costo-promedio del tratamiento tiene un amplio rango de variabilidad, por lo que es altamente sensible a los cambios.
Tabla 5 Análisis de sensibilidad del costo total de la alternativa innovadora según el grupo gestacional con* o sin ** Palivizumab. 2010 a 2017. Costa Rica
| Menor de 32 semanas * Desviación estándar | Menor de 32 semanas ** Desviación estándar | ||||
| $ 13.902,643.00/170 = $ 81,780.00 | $ 67,731.00 | $ 3.096,737.00/96 = $ 32,258.00 | $ 25,284,00 | ||
| + 2 DE | 95 % | $ 217,242.00 | + 2 DE | 95 % | $ 82,826.00 |
| + 1 DE | 90 % | $ 149,511.00 | + 1 DE | 90 % | $ 57,542.00 |
| - 2 DE | 95 % | -$ 53, 682.00 | - 2 DE | 95 % | -$ 18,283.00 |
| - 1 DE | 90 % | $ 14,049.00 | - 1 DE | 90 % | $ 7,001.00 |
| Entre 32 a 35* | Entre 32 a 35** | ||||
| $1.327,.292.00 / 26 = $51,049.00 | $ 4 0,851.00 | $1.115,716.00 /49 = $22, 770.00 | $ 21,766.00 | ||
| + 2 DE | 95 % | $ 132,754.00 | + 2 DE | 95% | $ 66,302.00 |
| + 1 DE | 90 % | $ 91, 903.00 | + 1 DE | 90% | $ 44,536.00 |
| - 2 DE | 95% | - $ 30,653.00 | - 2 DE | 95% | - $ 21, 262.00 |
| - 1 DE | 90% | $ 10,198.00 | - 1 DE | 905 | $504.00 |
| Mayor de 35* | Mayor de 35** | ||||
| $816,325.00 / 4 = $204,081.00 | $ 44,915.00 | $ 692,/61.00 = $ 11,356.00 | $ 11,598.00 | ||
| + 2 DE | 95% | $ 293.911 | + 2 DE | 95% | $ 34.534 |
| + 1 DE | 90% | $ 248,996.00 | + 1 DE | 90% | $ 22,945.00 |
| - 2 DE | 95% | $ 111,821.00 | - 2 DE | 95% | - $ 11,822.00 |
| - 1 DE | 90% | $ 155,595.00 | - 1 DE | 90% | - $ 233.00 |
Fuente: Elaboración propia. Estudio fármaco-económico palivizumab. 2019.
Discusión
Se encontró que 200 prematuros utilizaron el Palivizumab como medida profiláctica contra el Virus Sincitial Respiratorio y 206 no utilizaron esa medida profiláctica; en ambos casos esto ocurrió según el criterio médico. Se enfrentó como principal limitación la búsqueda para encontrar los expedientes clínicos, dado el manejo particular de este documento en cada centro hospitalario.
La mayoría de los prematuros que se encontraron fueron hombres (57%), con displasia broncopulmonar (84%),< 1,500 gramos de peso al nacer (65%), menores de 32 semanas de edad gestacional (66%), 2% con VSR y 42% con una importante severidad hospitalaria. Algunos de estos hallazgos concuerdan con los encontrados en otros estudios. Boyadjian y col.43 estudiaron 226 neonatos entre 2010 a 2013, 51% hombres, 6% con bajo peso al nacer (<2,500 gramos), 8% con menos de 37 semanas, 60% con VSR y ninguno recibió Palivizumab; Calderón44, estudió a 81 prematuros en 2017, 52% hombres, 7% con displasia broncopulmonar, 25% con < 1,500 gramos, 35% de 33 a 36 semanas, 33% 37 a 41 semanas; Camps en 2015 , encontró que las hospitalizaciones por bronquiolitis fueron más frecuentes en hombres con displasia broncopulmonar; Choueiry y col.46 estudiaron prematuros menores de 32 semanas con displasia broncopulmonar, entre 2014 a 2016 que recibieron inmunoprofilaxis; Chow y col.33consideraron entre 2009 y 2012, a 172 prematuros, 42 con 29 a -31 semanas, 38 de 32 a 34 semanas, 86 hombres y 21 con displasia broncopulmonar. De los resultados globales de este periodo en estudio, se destaca que el Palivizumab tuvo un uso en general inadecuado, esto a pesar de su alto costo, pues la mayoría (n=170) de los prematuros que lo recibieron fueron menores de 32 semanas de edad gestacional; también cuatro prematuros fueron mayores de 35 semanas de edad gestacional; esto se contrapone con la pauta o recomendación de uso internacional del producto.
Asimismo; Fulgencio47, estudió a 224 (121/54% H) casos de bronquiolitis en el País Vasco en España en 2015, 41% con 2 meses o menos al ingreso, con infecciones causadas por el VSR (56%), 149 (66%) entre 25 y 42 semanas de edad gestacional y 106 (47%) con factores de riesgo (n=10 con 2 hermanos, enfermedades), donde solo 2 recibieron Palivizumab; Glick y col.48 incluyeron a 5,743 niños (55,6% H, 60%< 6 meses) que recibieron Palivizumab entre 2010 y 2013 en una región de Estados Unidos de América; Gonzalez19 también estudio casos de bronquiolitis en el Perú (2016), incluyó 72 prematuros, 57% H, 72% < 6 meses, 13% prematuros y 68% con < 9 días; Lim y col.49 en su estudio (2012 a 2016), incluyeron 66 sujetos de complejidadmédica (54 con Palivizumab, 12 sin Palivizumab), 22 (41%) con desordenes multisistémicos, 18 (33%) con traqueostomía y 1.4% infectados con VSR; Olicker y col.26 entre 2006 y 2011, estudiaron 165 prematuros entre 32 a 34 semanas de edad gestacional. Aunque en la literatura científica se reconoce la eficacia y efectividad del Palivizumab; no obstante, en este estudio, se encontró que 2% de los prematuros desarrollaron infección por el VSR; este resultado concuerda con el obtenido por Sharif,8 donde (n=461 casos) 3% que recibió Palivizumab, también desarrolló la infección del VSR y esto en parte se explica por los cuidados sanitarios de los prematuros intra y extra hospital.
De igual manera, se halló que los prematuros menores de 32 semanas de edad gestacional, en general, mostraron una mayor severidad hospitalaria, pues todos requirieron de oxigenoterapia, ventilación mecánica e incluso hubo tres muertes; sin embargo, los prematuros de entre 32 a 35 semanas mostraron una menor frecuencia en todas las variables de efectividad por lo que la severidad fue menor. Cuando se analizan otros estudios, Boyadjian41 menciona que sólo 10% de los prematuros utilizaron oxigenoterapia y 35% ventilación mecánica; Calderón44 señala 75% con ventilación mecánica, 35% con neumonía, 78% con más de 7 días de hospitalización y 70%, con intubación de al menos una semana; Fulgencio,47 indica una estancia media de hospitalización de 5 a 7 días, 31 casos (14%) en la UCI, con estancia promedio de 3.8 días y 20 (9%) casos que tuvieron neumonía; Gonzales,19 aporta que 4% estuvo en la UCI; López,50 retoma que el sexo masculino fue el más afectado con 63 (53%) casos con ventilación mecánica y Capizzi,51 señala que el no uso de Palivizumab, causa un incremento en las hospitalizaciones en menores de 36 semanas y el aumento de ventilación por cánula; de igual manera, en el estudio de Choueiry,46 se muestra una reducción en el ingreso y la permanencia hospitalaria (promedio de estancia de 4 días), así como la necesidad de oxígeno (80% de los casos) y el ingreso a la UCI (promedio de 3 días); Glick,48 reportó 3% de fallecidos; donde, así como lo indica Geoghegan y col.22, el VSR es una importante causa de mortalidad.
En este estudio, se obtuvo que la valoración de efectividad está sujeta al rango de edad gestacional del prematuro, ya que en algunos fue mejor que en otros, al evidenciar que en el sub grupo de entre 32- a 35 semanas, los requerimientos hospitalarios fueron menores en los prematuros que utilizaron Palivizumab; esto concuerda con Camps17 cuando menciona que existe falta de claridad en la efectividad con Palivizumab; Yekta y col.,52 también encontraron que el Palivizumab no aporta beneficios en cuanto a los costos, aunque sí disminuyó la tasa de internamiento en prematuros menores de 29 semanas de edad gestacional. Además, en esta investigación, se encontró cómo en los datos agrupados, el costo-efectividad incremental mediante el análisis del árbol de decisiones resultó en US$1,799.00 por día de hospitalización, mientras que, en el cálculo del costo total de tratamiento, en el sub grupo de entre 32 a 35, el costo efectividad incremental fue de US$407.00 y de US$697.00 en la UCI; donde el costo promedio del tratamiento osciló entre US$2,958.00 y 4,545.00
Los resultados guardan relación con los reportes de otros estudios: Choueiry,46 reportó un costo de hospitalización entre USD1,099.00 a 5,495.00 (promedio USD 2,411.00), para el costo de Palivizumab por ampolla entre USD557.00 y 967.00 y del total de las dosis, USD1,114.00 a 3,458.00 Sharif8 en Canadá, menciona que los costos de servicios médicos oscilaron entre $813,314.oo y 1.409,723.00 y por caso, el costo promedio estuvo entre $10,928.00 y 16,651.00; por su parte, Ginsgberg53 acota que hubo un costo de Palivizumab por prematuro entre $2,800.00 y 4,200.00; Olchansky,7 señala un costo del esquema de Palivizumab entre $1,500.00 a 4,300.00 por mes y $6, 000.00 a 20,000.00 por 4 a 5 dosis y un costo-efectividad incremental de UD$15,000.00 a 140,000.00 por año de vida ajustado por calidad (AVAC); Salinas,54 reportó un costo efectividad incremental de $25,029.00 en menores de 29 semanas y de $29,637.00, entre las 29 a 32 semanas.
Durante la realización de este estudio, se colectaron datos de la práctica hospitalaria de una variedad de fuentes y esto tiende a generar mayor incertidumbre; además, el horizonte temporal fue de un año, el cual guarda correspondencia con el efecto de la inmunoprofilaxis que es de corto tiempo, por lo que se requirió de menos de un mes entre una aplicación y la siguiente con la intención de mantener la acción profiláctica; esto en concordancia con la estacionalidad del VSR que también puede cambiar año tras año según los efectos del cambio climático. Así, también cada prematuro, tenía una condición de salud muy diferentes a la de los otros prematuros, lo que generó incertidumbre en las variables de efectividad; los costos procedían de siete hospitales altamente complejos con variedad en la atención de los prematuros y del cálculo de los costos directos. De ahí que el análisis de sensibilidad refleje que el costo promedio tenga un amplio rango y que resulte ser altamente sensible a los cambios. Esto hace que los resultados no puedan ser generalizados. Lo anterior, concuerda con el estudio de Shahabi,55 donde se menciona que el Palivizumab genera costos de gran variabilidad, pues hay condiciones que no se pueden controlar, tal es el caso del número de dosis del medicamento que depende del peso del prematuro o de la semana gestacional y la fecha en que ocurre el nacimiento del prematuro; asimismo, se destaca la estacionalidad del VSR que tiende a cambiar en las regiones, incluso dentro de una misma región y esto, tras los efectos del cambio climático en el mundo48.
Conclusión
La inmunoprofilaxis con Palivizumab resultó ser una alternativa costo-efectiva en los prematuros entre 32 y 35 semanas de edad gestacional en el periodo 2010 a 2017 en la Seguridad Social de Costa Rica cuando se compararon los resultados obtenidos contra la práctica clínica habitual.
Los tomadores de decisiones de la Seguridad Social deben asegurar todos los mecanismos adecuados que permitan que el personal clínico realice el uso adecuado de la terapia inmunoprofiláctica en prematuros en la edad gestacional que muestra el uso eficiente de este recursosanitario.
Asimismo, el costo promedio del tratamiento con esta tecnología innovadora tiene una alta sensibilidad a los cambios en función de un conjunto de factores que no pueden ser fácilmente controlados.











 nueva página del texto (beta)
nueva página del texto (beta)



