Introducción
Los medicamentos deben vigilarse durante todo el tiempo que estén en el mercado, pues se dispone de escasa información sobre sus efectos, beneficiosos y perjudiciales, en las condiciones reales de la práctica médica. 1
La Farmacoepidemiología es la rama de la Salud Pública que se ocupa de auditar lo anterior, contribuye a establecer medidas preventivas que lleven al uso racional de los medicamentos y por tanto a una relación beneficio-riesgo favorable; la información que aporta es de utilidad para las autoridades sanitarias en la toma de decisiones, sobre las ventajas de la utilización de los medicamentos o la supresión de su comercialización, teniendo en cuenta los resultados de dicha relación.1,2
Una de las estrategias fundamentales de la Farmacoepidemiología es la farmacovigilancia; se ocupa sobre todo de identificar las reacciones adversas que provocan los medicamentos. Los métodos para detectar las reacciones adversas pueden ser pasivos, como la notificación voluntaria que hacen los profesionales sobre las reacciones adversas que sospechan, o métodos activos, basados en el seguimiento sistemático y detallado de los pacientes tratados con el medicamento en estudio. 3,4
El factor de transferencia (FT) es un hemoderivado; consiste en un extracto dializable de leucocitos que transfiere inmunidad de un donante inmune a un receptor con déficit inmunológico. Su principal indicación es en pacientes con inmunodeficiencia celular, enfermedad caracterizada por la presencia de infecciones recurrentes en los pacientes;5 en Cuba está registrado como medicamento, lo produce el Centro de Ingeniería Genética y Biotecnología con el nombre comercial Hebertrans®.6,7
Los ensayos clínicos publicados después de su aprobación por la autoridad reguladora se refieren a su efectividad, no a sus reacciones adversas.8,9,10Los productores del medicamento solo señalan que el FT provoca eritema en el sitio de inyección en el 2% de los pacientes.5Sin embargo, investigaciones realizadas por la red cubana de farmacoepidemiología11,12detectan otras reacciones adversas.
La primera de estas investigaciones observa las reacciones adversas presentadas en 387 pacientes durante el tratamiento con FT; 13estos mismos pacientes son vigilados durante el año siguiente al tratamiento, para identificar reacciones adversas que demoran más tiempo en aparecer, 14y también se analiza su evolución clínica en las condiciones de la práctica médica habitual, pero en este segundo momento del estudio sólo se obtiene información completa para el análisis de 282 pacientes.15En el año 2010, a partir de alertas internacionales sobre problemas de seguridad con medicamentos biológicos, que se presentan años después del tratamiento, se realiza una segunda investigación para identificar en estos pacientes reacciones adversas, sobre todo transmisión de infecciones y neoplasias, entre otros eventos. 16
A partir de los resultados del primer estudio, surge la oportunidad de comparar los riesgos del uso del FT 13,14con sus beneficios.15El objetivo de este trabajo fue analizar la relación beneficio-riesgo del uso de FT (Hebertrans®), a partir de los resultados de estas investigaciones.
Método
Se analizaron las reacciones adversas que presentaron 282 pacientes durante o después del tratamiento con FT, información que se obtuvo de las publicaciones antes mencionadas y del informe final de investigación.
Los eventos adversos con grado de imputabilidad definitiva, probable o posible -según el algoritmo de Karch y Lasagna-, se consideraron en este análisis reacciones adversas del FT; se estudió la presentación de reacciones adversas según grupos de edad (niños: 0 a 18 años, adultos: 19 a 59 años, ancianos: 60 años y más) así como la gravedad de las mismas.
Con relación a la evolución clínica, la información procedente de los 282 pacientes se analizó según las enfermedades que tenían los pacientes, para las cuales fue indicado el FT y según los grupos de edad. La investigación publicada establece que la evolución clínica es satisfactoria si no hay recaídas de la enfermedad o éstas son menos frecuentes que antes del tratamiento y no satisfactoria si se presentan igual o mayor número de recaídas que antes del tratamiento con FT.
Como beneficio, se estimó el desenlace favorable de la variable evolución clínica (satisfactoria) y como riesgo el desenlace desfavorable expresado como presencia de reacciones adversas.
Se estimaron medidas de resumen para datos cualitativos, puntuales e intervalos de confianza al 95 % (IC 95%) para porcentajes y tasas. Como medida de análisis beneficio-riesgo se estimó el Factor de Bayes. 17
Consideraciones éticas: se esperó un balance beneficio-riesgo favorable para los pacientes, toda vez que el FT es un medicamento aprobado para su utilización en la población por la agencia reguladora cubana.
Resultados
Durante el tratamiento con FT y hasta un año después del mismo, 54 pacientes presentan reacciones adversas (20,1% del total). En todos los grupos de edad predomina la ausencia de reacciones adversas: 80% de los niños, 80.8 % de los adultos y 84.4% de los ancianos.
En total, se registran 85 reacciones adversas; la mayoría son leves (98,8%), dos fueron moderadas y ninguna se clasifica como grave o fatal.
En la Tabla 1 se exponen las reacciones adversas registradas según grupos de edad. La fiebre es más frecuente en niños; en los adultos predomina el dolor en el sitio de inyección.
Tabla 1: Pacientes según tipo de reacción adversa y grupo de edad
| Reacción adversa | Total | Niños (N=125) | Adultos (N=125) | Ancianos (N=32) | |||
| No. | Tasa x 100 (IC 95%) | No. | Tasa x 100 (IC 95%) | No. | Tasa x 100 (IC 95%) | ||
| Fiebre | 21 | 12 | 9,6 (5,2-24,5) | 7 | 5,6 (0,7-6,4) | 2 | 6,6 (1,5-9,1) |
| Dolor en sitio de la inyección | 18 | 4 | 3,2 (1,1-9,2) | 12 | 9,6 (5,2-4,5) | 2 | 6,6 (0,6-5,8) |
| Cefalea | 10 | 3 | 2,4 (0,2-7,1) | 6 | 4,8 (0,7-6,4) | 1 | 3,1 (0,1-2,3) |
| Eritema en zona de aplicación | 7 | 5 | 4,0 (0,3-8,3) | 2 | 1,6 (0,2-6,4) | 0 | 0,0 |
| Vómitos | 3 | 2 | 1,6 (0,2-6,4) | 1 | 0,8 (0,2-6,4) | 0 | 0,0 |
| Erupción cutánea | 2 | 1 | 0,8 (0,2-6,4) | 1 | 0,8 (0,2-6,4) | 0 | 0,0 |
| Inflamación zona de aplicación | 2 | 2 | 1,6 (0,2-6,4) | 0 | 0,0 | 0 | 0,0 |
| Otras | 23 | 12 | 9,6 (5,2-24,5) | 11 | 8,8 (0,4-5,7) | 0 | 0,0 |
No se observan diferencias significativas entre cada tipo de reacción adversa y los grupos de edades, aunque en los ancianos solo se presentan fiebre, dolor en el sitio de inyección y cefalea y en los adultos no se presentan casos de inflamación.
Otros tipos de reacciones adversas reportadas son fatiga, disnea, endurecimiento en la zona de aplicación, dolor en el brazo de la inyección, escalofríos, malestar general y dolor muscular.
Con relación a la evolución clínica, 159 pacientes evolucionan de forma no satisfactoria (56,4%).
La Tabla 2 muestra que hay más mejoría en ancianos (56,3 %), que en niños (44,0 %) y adultos (40,0 %), aunque no se observan diferencias significativas según los grupos de edad.
Tabla 2: Pacientes tratados con factor de transferencia según evolución clínica y grupo de edad.
| Grupo de edad | Evolución clínica | ||||
| Satisfactoria | No Satisfactoria | Total | |||
| No. | % | No. | % | No. | |
| Niños | 55 | 44,0 | 70 | 56,0 | 125 |
| Adultos | 50 | 40,0 | 75 | 60,0 | 125 |
| Ancianos | 18 | 56,3 | 14 | 43,8 | 32 |
Χ2= 2,7491 gl= 2 p= 0,2530
La Tabla 3 expone la evolución clínica en función de los motivos de prescripción de FT, se observa que los pacientes con queratoconjuntivitis alérgica tienen mejor evolución clínica (12,2 %; IC 95% 6,0-18,4), seguidos de los que presentan neutropenia por citostáticos (9,8 %; 4,1-15,4) y de los pacientes con otros motivos de prescripción (22 %; 14,2-29,7), a pesar que en estos últimos el productor no recomienda el uso de FT.
Tabla 3: Pacientes tratados con factor de transferencia según evolución clínica y motivo de prescripción
| Motivo de prescripción | Total | Evolución clínica | |||
| Satisfactoria N=123 | No satisfactoria N=159 | ||||
| No. | No. | % (IC 95%) | No. | % (IC 95%) | |
| Infecciones recurrentes | 148 | 48 | 39,0 (30,0-48,1) | 100 | 62,9 (55,1-70,7) |
| Asma bronquial | 23 | 8 | 6,5 (1,7-11,3) | 15 | 9,4 (4,6-14,3) |
| Queratoconjuntivitis alérgica | 17 | 15 | 12,2 (6,0-18,4) | 2 | 1,3 (0,2-4,5) |
| Herpes simple | 16 | 5 | 4,1 (1,3-9,2) | 11 | 6,9 (2,7-11,2) |
| Neutropenia por citostáticos | 15 | 12 | 9,8 (4,1-15,4) | 3 | 1,9 (0,4-5,4) |
| Inmunodeficiencia celular | 11 | 2 | 1,6 (0,2-5,8) | 9 | 5,7(1,8-9,6) |
| Dermatitis atópica | 6 | 3 | 2,4 (0,5-7,0) | 3 | 1,9 (0,4-5,4) |
| Neoplasia | 6 | 2 | 1,6 (0,2-5,8) | 4 | 2,5 (0,7-6,3) |
| Herpes zoster | 1 | 1 | 0,8 (0,0-4,4) | 0 | 0,0 |
| Otros (no recomendados) | 39 | 27 | 22,0 (14,2-29,7) | 12 | 7,5 (3,1-12,0) |
La Tabla 4 analiza la presencia de reacciones adversas durante o después del tratamiento con FT y la evolución clínica de los pacientes. Se observa que 87,8 % evolucionó de manera satisfactoria sin presentar reacciones adversas, mientras que un menor porcentaje (24,5 %) evolucionó de forma insatisfactoria y presentó reacciones adversas.
Tabla 4: Pacientes según evolución clínica y presencia de reacciones adversas
| Reacciones adversas | Evolución clínica | |||||
| No satisfactoria | Satisfactoria | Total | ||||
| No. | % | No. | % | No. | % | |
| Si | 39 | 24,5 | 15 | 12,2 | 54 | 19,1 |
| No | 120 | 75,5 | 108 | 87,8 | 228 | 80,9 |
| Total | 159 | 100,0 | 123 | 100,0 | 282 | 100,0 |
Χ2=6.0402 gl= 1 p= 0,0140
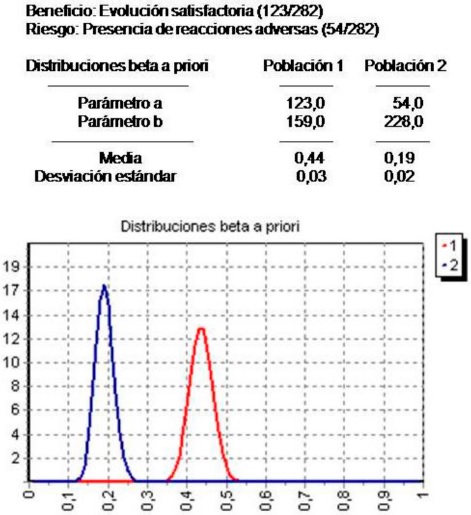
La relación beneficio-riesgo se analizó a partir de un enfoque bayesiano. La Figura 1 ilustra el resultado de la comparación de ambas proporciones, se observa que la diferencia entre beneficio y riesgo favoreció al primero (Factor de Bayes=2,3).
Discusión
A pesar de que el uso de FT provoca pocas reacciones adversas su uso debe vigilarse; los ensayos clínicos publicados no tienen como objetivo principal registrar reacciones adversas, por lo que las investigaciones realizadas constituyen información importante para las autoridades sanitarias, los productores del FT y para los propios pacientes.
Los niños y los ancianos son los grupos de edad más susceptibles de presentar reacciones adversas, sobre todo por inmadurez o deterioro de los sistemas enzimáticos y de eliminación que intervienen en el metabolismo y excreción de los medicamentos,18aunque esto se observa más en los reportes de reacciones adversas provenientes de países de alto desarrollo económico. En el resto de los países las diferencias entre grupos de edad y aparición de reacciones adversas no son significativas, 19,20no se explica ese patrón en los reportes.
Con relación a la evolución clínica, puede estar presente un error de memoria por parte de los pacientes, al referir un menor o mayor número de recaídas de las que realmente tenían. En el caso de los niños, 44,3 % de los pacientes observados, fue difícil que sucediera eso, debido a la habitual vigilancia y preocupación de los padres por la enfermedad de los hijos. Además, se debe tener en cuenta el método empleado, antes y después, pues otros factores también pueden haber modificado esta variable.
Casi la totalidad de los autores señalan que el FT mejora la condición clínica de la mayoría de los pacientes tratados, pero los ensayos clínicos en los que se basan tienen pocos pacientes, se realizaron hace años cuando las buenas prácticas estaban lejos de ser las de hoy y en los artículos publicados no se detalla con claridad el método utilizado.
Se detectan diferencias significativas con relación a la evolución clínica cuando los motivos de prescripción son infecciones recurrentes, queratoconjuntivitis alérgica, neutropenia por citostáticos y otros, aunque la mayoría de los intervalos de confianza son muy amplios y poco informativos debido al pequeño número de casos de cada indicación.
Estos resultados quizás se deben a que los pacientes no presentaban déficit inmunológico o a que recibieron pautas terapéuticas no adecuadas. Por ejemplo, de los nueve pacientes con inmunodeficiencia celular, tres lo utilizaron sólo durante un mes. Además, la sola aparición de infecciones recurrentes en los niños -como las respiratorias- no constituye sospecha de inmunodeficiencia.21 En estos pacientes es frecuente la enfermedad alérgica respiratoria, que no se acompaña de inmunodeficiencia.
Se detectaron diferencias significativas entre la presencia de reacciones adversas y la evolución clínica, ya que se observó mayor porcentaje de reacciones adversas entre los que evolucionaron de forma no satisfactoria (24.5%), que entre los que evolucionaron bien (12.2%). Como la fiebre fue una reacción adversa frecuente en estos pacientes, pudo suceder que este síntoma también se interpretó como una recaída de la enfermedad. Este resultado es importante para los médicos prescriptores de FT, quienes deberán sospechar la presencia de reacciones adversas en los pacientes, cuando observen en ellos una evolución clínica desfavorable.
El presente análisis involucra dos criterios principales a considerar cuando se prescribe un medicamento a un paciente: la efectividad (beneficio) y la seguridad (riesgo). El primero condiciona la selección; si un medicamento no es efectivo o no se conoce si lo es, no debe ser considerado de elección para el tratamiento de una enfermedad y será utilizado de forma eventual si los riesgos de su uso son escasos; si provoca más riesgos que beneficios no debe ser considerada su inclusión en el listado nacional de medicamentos.
Lo observado justifica la presencia de FT en el Cuadro Básico de Medicamentos de Cuba; sin embargo, la ausencia de estudios controlados que evalúen su efectividad, dificulta valorar su verdadera relación beneficio-riesgo en las condiciones reales de la práctica médica.
El número de pacientes es bajo para detectar reacciones adversas raras, a pesar de eso tiene importancia para generar posibles alertas, pues hasta el momento, al fármaco apenas se le atribuyen reacciones adversas. También pudo suceder que se registraran solo aquellos eventos que se consideraron provocados por el FT y no todos los que se presentaron.
La presente información es útil para la toma de decisiones en el sistema sanitario. El Centro de Ingeniería Genética y Biotecnología, deberá incluirla en la ficha técnica y en el prospecto, el Centro para el Control Estatal de Medicamentos, Equipos y Dispositivos Médicos deberá exigir que se cumpla. Esto permitirá a los prescriptores estar atentos a la aparición de reacciones adversas y orientar al paciente para mejorar la adhesión al tratamiento; los pacientes a su vez estarán mejor informados para aceptar su utilización.
Conclusiones
El balance beneficio-riesgo por el uso de factor de transferencia, (Hebertrans®), fue a favor del beneficio, pues a pesar que la evolución clínica de los pacientes no es satisfactoria, este medicamento provoca pocas reacciones adversas; las más frecuentes están relacionadas con el sitio de administración y son leves. Sin embargo, son necesarios estudios epidemiológicos controlados para verificar estos resultados.











 nueva página del texto (beta)
nueva página del texto (beta)