Los psicoestimulantes como la cocaína (COC) y la anfetamina (ANF), son agonistas monoaminérgicos indirectos que tienen afinidad por los transportadores involucrados en la recaptura y sistemas de almacenamiento vesicular de la dopamina (DA), norepinefrina (NE) y serotonina (5-HT) (Rothman & Baumann, 2003). La COC es un inhibidor de la recaptura de DA, NE y 5-HT y de este modo incrementa los niveles sinápticos de estos neurotransmisores. La ANF actúa en los transportadores de las vesículas sinápticas de la DA, NE y 5-HT para promover un incremento en las concentraciones citoplasmáticas de las monoaminas, además, revierte la dirección de los transportadores monoaminérgicos de membrana, facilitando la salida de los neurotransmisores al espacio intersináptico (Elliott & Beveridge, 2005; Rothman & Baumann, 2003).
El sistema mesocorticolímbico de la DA, en particular, la proyección del área tegmental ventral (ATV) al núcleo accumbens (nAcc), es una vía importante para la producción de los efectos locomotores, reforzantes, gratificantes y de señales discriminativas producidos por la COC y la ANF (Di Chiara, 1995; Koob, 1992). Aunque es claro que la administración de ANF o COC producen un incremento importante de la señal DAérgica en áreas límbicas (Koob & Bloom, 1988; Koob, 1992), hoy en día existe evidencia de que, de forma indirecta, el glutamato (Glu) también podría jugar un papel crítico en la modulación de algunos efectos conductuales de estos psicoestimulantes (Faraone, 2018; Fischer et al., 2021; Ishiguro et al., 2019; Scofield et al., 2016).
En la actualidad se sabe que existen al menos 12 receptores a Glu. Se han identificado 3 tipos de receptores ionotrópicos: AMPA, NMDA y Kainato y 8 receptores metabotrópicos (mGluR1-mGluR8) divididos en 3 grupos (Coutinho & Knöpfel, 2002). De entre estos receptores, se ha propuesto que el grupo II, compuesto por los receptores mGluR2 y mGluR3 (mGluR2/3), podría modular los procesos de gratificación y búsqueda de algunas drogas adictivas (Moussawi & Kalivas, 2010).
En particular, se ha reportado que los agonistas a los receptores mGluR2/3 son efectivos para atenuar algunos efectos conductuales relacionados con el abuso de psicoestimulantes como la COC y la ANF. Por ejemplo, diversos autores han reportado que la administración sistémica del agonista selectivo de los receptores mGluR2/3 LY379268, disminuye los puntos de ruptura generados con programas de razón progresiva (PRP) reforzados con metanfetamina (MET) (Crawford et al., 2013) y COC (Karkhanis et al., 2016), sin afectar los puntos de ruptura generados en PRP reforzados con sacarina. También se ha reportado que la administración sistémica del agonista de los receptores mGluR2/3 LY379268 disminuyó otras conductas relacionadas con la adicción, como la expresión de la sensibilización locomotora producida por la administración repetida de ANF (Arndt et al., 2014; Kim & Vezina, 2002) y fenciclidina (Clark et al., 2002), así como las autoadministraciones de COC (Baptista et al., 2004; Justinova et al., 2016), nicotina (Cross et al., 2018; Justinova et al., 2015, 2016; Liechti et al., 2007) y alcohol (Augier et al., 2016). Dado que un obstáculo significativo para el tratamiento exitoso de la adicción a las drogas es la vulnerabilidad persistente a la recaída, es en esta área en la que se han centrado la mayoría de los estudios dirigidos a evaluar el efecto de la activación de los receptores mGluR2/3 sobre las conductas relacionadas con la adicción a diferentes drogas. En este sentido, se ha reportado que la administración sistémica del agonista mGluR2/3 LY379268, disminuyó la reinstalación de la conducta de palanqueo inducida por señales previamente asociadas con COC (Baptista et al., 2004; Cannella et al., 2013), MET (Kufahl et al., 2013), heroína (Bossert et al., 2004), alcohol (Zhao et al., 2006) y nicotina (Cross et al., 2018; Liechti et al., 2007), o inducida por estrés cuando previamente fue reforzada con COC (Martin-Fardon & Weiss, 2012) y alcohol (Zhao et al., 2006), mientras que su administración directa en el ATV, disminuyó la reinstalación producida por señales previamente asociadas con heroína (Bossert et al., 2004).
Aunque hay evidencia sobre el efecto de la activación de los receptores mGluR2/3 sobre las conductas relacionadas con la adicción a los psicoestimulantes, ninguno de los artículos ha dirigido su atención a las propiedades discriminativas de los psicoestimulantes como la ANF. Todas las drogas de abuso comparten la capacidad de producir poderosos estímulos interoceptivos, todos ellos diferentes entre sí, de acuerdo con el tipo de droga, y son considerados como una medida indirecta del potencial de abuso de una droga. El paradigma de discriminación de drogas es una herramienta conductual útil para evaluar estas propiedades interoceptivas producidas por las drogas de abuso (Riley et al., 2016). La ANF es capaz de producir una señal discriminativa que es modulada por ligandos relacionados con la DA (Sandoval-Sánchez et al., 2020). Por ello, los procedimientos de discriminación de drogas que usan ANF como droga de entrenamiento podrían ser útiles para estudiar las interacciones DA-Glu. El presente estudio fue diseñado para evaluar los efectos del agonista de los receptores mGluR2/3 (2R,4R)-APDC (APDC) sobre la señal discriminativa de la ANF en ratas, usando el condicionamiento de aversión a los sabores (CAS) como procedimiento de discriminación. Para determinar si estos efectos resultan de la acción específica del agonista APDC en los receptores mGluR2/3, también se evaluó el efecto del antagonista selectivo de los receptores mGluR2/3 LY341495 sobre los efectos del APDC en la señal discriminativa de la ANF.
Método
Sujetos
Diez ratas Wistar macho de aproximadamente 120 días de edad y un peso de 200-250 g al inicio del experimento, provenientes de la colonia del bioterio general de la FES Iztacala, UNAM, México. Las ratas fueron alojadas individualmente en cajas de acero inoxidable (30 x 20 x 20 cm), con comida ad libitum (Teklad LM485 Rat Diet, Harlan). Se mantuvieron bajo un ciclo luz-oscuridad de 12h con luz a las 8h, y una temperatura de 21(±1) °C. Los animales tuvieron acceso a las soluciones líquidas mediante uno o dos cilindros graduados invertidos colocados en la pared frontal de las cajas. El cuidado y manejo de los animales se llevó a cabo de acuerdo con el protocolo experimental y los principios éticos para la investigación con animales de laboratorio previstos en la Norma Oficial Mexicana (NOM-062-ZOO-1999: Especificaciones técnicas para la producción, cuidado y uso de animales de laboratorio).
Drogas
Las drogas que se usaron fueron sulfato de D-anfetamina (Sigma-Aldrich, St. Louis MO, EE. UU.), agonista a los receptores mGluR2/3 (2R,4R)-APDC (Tocris, Ballwin, MO, EE. UU.), antagonista a los receptores mGluR2/3 LY341495 (Tocris, Ballwin, MO, EE. UU.) y cloruro de litio (LiCl; Sigma-Aldrich, St, Louis, MO, EE. UU.). Las diferentes dosis de todas las drogas se calcularon de acuerdo con el peso de la sal y fueron disueltas en solución salina isotónica al 0.9% y administradas ip (1ml/kg). El LiCl fue administrado a una dosis de 0.34 mEq (2.0 ml/kg de una solución 0.177 M). La sacarina (Elly-Lilly, Ciudad de México, México) fue disuelta en agua destilada a una concentración de 0.15% (p/v). Las drogas y la solución de sacarina se prepararon diariamente.
Procedimiento
Entrenamiento de discriminación ANF-Salina
Todos los sujetos fueron entrenados por 7 días a tomar agua en periodos de 20 minutos por día. Posteriormente, durante 2 días fueron entrenados a tomar la solución de sacarina por 10 min. Para el entrenamiento en la discriminación de drogas por medio del CAS, los sujetos fueron sometidos a ensayos droga o ensayos salina siguiendo el protocolo descrito por Miranda et al. (2009). De forma breve, durante los ensayos droga a las ratas se les administró ANF (1.0 mg/kg ip) 30 min antes de un periodo de 10 min de acceso a un cilindro graduado invertido con la solución de sacarina. Inmediatamente después, los sujetos recibieron una inyección ip de LiCl y fueron regresados a sus cajas hogar. Durante los ensayos salina, las ratas recibieron una inyección de salina (1.0 ml/kg ip), 30 minutos antes del acceso a una solución de sacarina por 10 min. Inmediatamente después, las ratas recibieron nuevamente una inyección de salina y fueron devueltas a sus cajas hogar. Los ensayos droga y los ensayos salina estuvieron separados por 2 días; en esos días las ratas permanecieron en sus cajas hogar y tuvieron acceso a agua purificada por 30 min al día. En total se realizaron 10 ensayos droga y 10 ensayos salina que fueron alternados y presentados aleatoriamente con la única restricción de que los ensayos droga no se repitieran en más de dos ocasiones consecutivas.
Pruebas de generalización y combinación con ANF y ligandos mGluR2/3
Las pruebas fueron llevadas a cabo en ciclos de 4 días con todos los sujetos bajo las mismas condiciones. El ciclo se repitió hasta que todas las dosis de las drogas de substitución y sus combinaciones fueron evaluadas. En el primer día, se realizó un ensayo droga como fue descrito previamente. En el segundo día, los sujetos permanecieron en sus cajas hogar y tuvieron un periodo de 30 min de acceso libre a agua purificada. En el tercer día se llevó a cabo un ensayo salina como se describió anteriormente. Finalmente, en el cuarto día, se les administró a los sujetos una dosis específica de ANF, una dosis del agonista o del antagonista a los receptores mGluR2/3 o una combinación de las tres drogas; inmediatamente después de la administración, se realizó una prueba de dos botellas por 10 min; una botella tenía agua purificada y la otra la solución de sacarina. Durante las pruebas, no se administró salina o LiCl. Las dosis e intervalos de tiempo entre las administraciones y pruebas para cada droga fueron; ANF: 0.1, 0.3 y 1.0 mg/kg, -30 min; APDC: 0.1, 0.3 y 1.0 mg/kg, -30 min; LY341495: 1.0, 3.0 y 5.6 mg/kg, -30 min. Las pruebas de generalización se llevaron a cabo con el fin de evaluar si las drogas empleadas podían substituir o alterar la señal discriminativa de la ANF. Para ello, en el día 4 del ciclo, se administraron diferentes dosis de ANF (0.1, 0.3 y 1.0 mg/kg), diferentes dosis del agonista mGluR2/3 APDC (0.1, 0.3 y 1.0 mg/kg) y diferentes dosis del antagonista mGluR2/3 LY341495 (1.0, 3.0 y 5.6 mg/kg). Para evaluar el efecto de los ligandos a los receptores mGluR2/3 sobre la señal discriminativa producida por la ANF, en el día 4 se administraron una de las diferentes dosis de APDC (0.1, 0.3 y 1.0 mg/kg) + ANF (1.0 mg/kg) o una de las diferentes dosis de LY341495 (1.0, 3.0 y 5.6 mg/kg) + APDC (1.0 mg/kg) + AMPH (1.0 mg/kg) (ver diseño en Figura 1A). Todas las dosis fueron evaluadas en todos los sujetos. El orden en que las dosis fueron evaluadas se eligió aleatoriamente. La dosis de entrenamiento de ANF también fue evaluada inmediatamente después del periodo de entrenamiento inicial, y esta prueba fue repetida antes de la evaluación de cada una de las diferentes dosis de las drogas, incluyendo las ocasiones en que se evaluaron diferentes dosis de ANF, con el fin de tener una estimación de la curva-dosis respuesta completa.
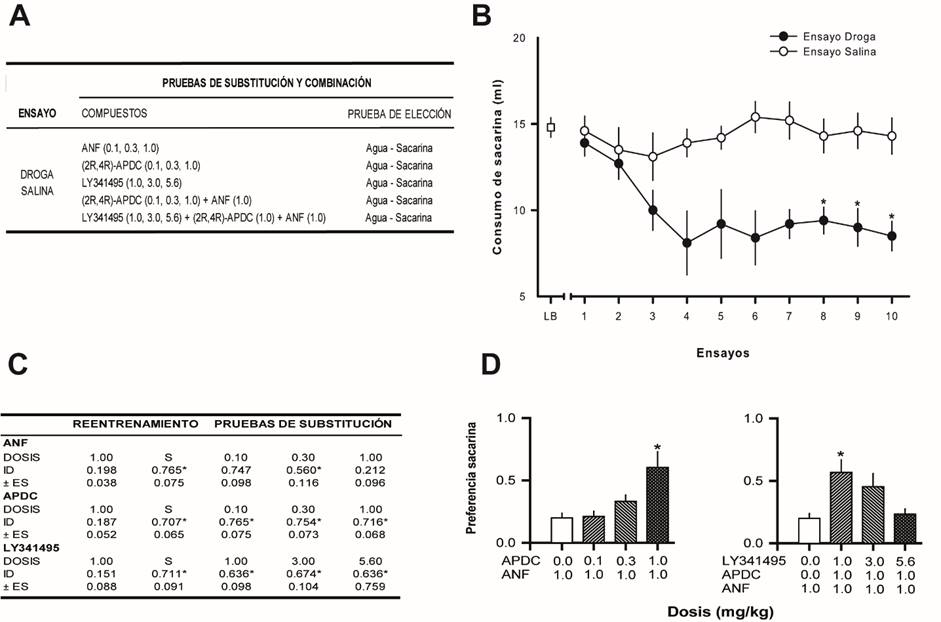
Figura 1 Efectos de ligandos mGluR2/3 sobre la señal discriminativa de la ANF. A. Diseño empleado para la evaluación del efecto de ligandos mGluR2/3 sobre la señal discriminativa de la ANF (n=10). Las dosis entre paréntesis se expresan en mg/kg. B. Desarrollo de la discriminación ANF-Salina (n=10). LB-Línea Base. Los círculos indican el promedio del consumo de sacarina ± error estándar de la media. * indican diferencias significativas con la prueba de comparaciones posteriores Dunnett (p<0.05), con los correspondientes ensayos salina. C. Resultados de las pruebas de substitución con diferentes dosis de ANF (0.1, 0.3 y 1.0 mg/kg), (2R,4R)-APDC (0.1, 0.3 y 1.0 mg/kg) y LY341495 (1.0, 3.0 y 5.6 mg/kg). Se muestra la preferencia por la sacarina (0.0 indica una aversión a la sacarina y 1.0 indica una preferencia por la sacarina). ID: Índice de discriminación. ES: Error estándar. * indica diferencias significativas (Dunnett, p < 0.05) con la dosis de reentrenamiento de ANF. D. Resultados de las pruebas de combinación con diferentes dosis de (2R,4R)-APDC (0.1, 0.3 y 1.0 mg/kg) + ANF (0.1 mg/kg) y diferentes dosis de LY341495 (1.0, 3.0 y 5.6 mg/kg) + (2R,4R)-APDC (1.0 mg/kg) + ANF (0.1 mg/kg). Se muestra la preferencia por la sacarina (0.0 indica una aversión a la sacarina y 1.0 indica una preferencia por la sacarina). * indica diferencias significativas (Dunnett, p < 0.05) con la dosis de reentrenamiento de ANF.
Análisis estadístico
Durante la adquisición, se registró el consumo de la solución de sacarina en los ensayos droga y salina y se comparó usando un ANOVA de dos vías con las condiciones droga-salina como primer factor y el número de ensayo como segundo factor (sólo los últimos tres ensayos de cada condición fueron analizados). Durante las pruebas de generalización de dos botellas, se registraron el consumo de agua y de sacarina, y la preferencia por la sacarina fue calculada de acuerdo con la fórmula A/(A+B), donde A fue el consumo de sacarina y B el consumo de agua. Con esta fórmula, un índice de 0.0 indica una fuerte aversión por la sacarina, mientras que 1.0 indica una fuerte preferencia por la sacarina. Los datos de la preferencia fueron analizados usando un ANOVA de una vía. Cuando los ANOVAs fueron significativos, se usó una prueba de comparaciones Dunnett (p < 0.05). Para la descripción de las pruebas de generalización, se usaron los siguientes criterios: substitución completa: > 80%; substitución parcial: < 80% y > 30%; no substitución: < 30%.
Resultados
Adquisición de la discriminación ANF-Salina
Las ratas aprendieron la discriminación entre la ANF y la solución salina (ver Figura 1B). No se observaron diferencias entre el consumo de sacarina durante la línea base, el primer ensayo droga y el primer ensayo salina (F [2,27] = 0.410, p = 0.667). En los ensayos en los que la administración de ANF fue seguida por la asociación de la solución de sacarina-LiCl, se observó una reducción en el consumo de sacarina. Esta disminución no ocurrió en los ensayos salina. Un ANOVA de dos vías indicó diferencias significativas entre los últimos 3 ensayos droga y los últimos 3 ensayos salina; estas diferencias fueron atribuidas al tipo de ensayo, droga o salina (F [1,54] = 47.304, p = 0.0001), mientras que el número de ensayo (F [2,54] = 0.130, p = 0.878) y la interacción (F [2,54] = 0.119, p = 0.888) no fueron significativos.
Pruebas de generalización con ANF
La tabla en la Figura 1C muestra los datos obtenidos tras la administración de las diferentes dosis de ANF. En ella se observa que la administración de las diferentes dosis de ANF evaluadas en la prueba de dos botellas, produjo un control de estímulos dependiente de la dosis. La dosis de 1.0 mg/kg administrada durante la evaluación de la curva dosis respuesta replicó el control de estímulos ejercido por la dosis de entrenamiento de ANF. En contraste, la dosis de 0.1 mg/kg, produjo resultados similares a la administración de salina. Un ANOVA de una vía mostró la existencia de diferencias significativas (F [4,45] = 9.717, p = 0.0001). Las comparaciones posteriores con la prueba Dunnett mostraron diferencias significativas entre la dosis de entrenamiento y las dosis de 0.1 y 0.3 mg/kg. En contraste, la condición en la que se administró 1.0 mg/kg de ANF no fue diferente de la dosis de entrenamiento. Los datos experimentales también indicaron que ninguna de las dosis de ANF empleadas, alteró el consumo total de líquidos, datos no mostrados (F [4,45] = 1.25, p = 0.302).
Pruebas de generalización con ligandos a los receptores mGluR2/3
La tabla en la Figura 1C, también muestra los resultados de las pruebas de generalización con los diferentes ligandos. En ella se observa que ni el agonista a los receptores mGluR2/3 APDC (F [4,45] = 14.698, p = 0.0001), ni el antagonista a los receptores mGluR2/3 LY341495 (F [4,45] = 8.184, p = 0.0001) substituyeron la señal discriminativa de la ANF. Las comparaciones posteriores con la prueba Dunnett mostraron que la preferencia por la sacarina con todas las dosis de ambos ligandos mGluR2/3, fue diferente de la observada con la dosis de entrenamiento de ANF. Adicionalmente, se encontró que el consumo total de líquidos no se alteró con ninguna de las dosis de APDC (F [4,45] = 0.898, p = 0.473) o LY341495 (F [4,45] = 0.728, p = 0.577) (datos no mostrados).
Pruebas de combinación con ligandos a los receptores mGluR2/3 + ANF
La Figura 1D (lado izquierdo) muestra los resultados de las pruebas de combinación con APDC + ANF. El agonista mGluR2/3 produjo una disminución dependiente de la dosis en la señal discriminativa de la ANF (F [3,36] = 6.544, p = 0.001). Las comparaciones posteriores con la prueba de Dunnett, mostraron una diferencia significativa entre la dosis más alta de APDC (1.0 mg/kg) + ANF y la dosis de entrenamiento de ANF (1.0 mg/kg).
Adicionalmente, la Figura 1D (lado derecho) muestra los resultados de las pruebas de combinación con LY341495 + APDC + ANF. Se observa una disminución en el efecto del APDC + ANF de forma dependiente de la dosis de LY341495. El ANOVA de una vía reveló diferencias significativas entre los grupos (F [3,36] = 5.079, p = 0.005) y la prueba de comparaciones posteriores de Dunnett, señaló que estas diferencias se encontraban únicamente entre el grupo al que se le administró la dosis más baja de LY341495 (1.0 mg/kg) y la dosis de entrenamiento de la ANF. Es decir, las dosis de 3.0 y 5.6 mg/kg del antagonista de los receptores mGluR2/3 LY341495, lograron disminuir significativamente el efecto del APDC sobre la señal discriminativa de la ANF. Finalmente, se observó que ni la administración de APDC + ANF (F[3,36]=0.235, p=0.871) ni de LY341495 + APDC + ANF (F[3,36]=1.440, p=0.247), afectaron el consumo total de líquidos (datos no mostrados).
Discusión
El objetivo del presente estudio fue evaluar los efectos del agonista de los receptores mGluR2/3 APDC sobre la señal discriminativa de la ANF en ratas usando el CAS como procedimiento de discriminación de drogas. Además, se evaluó el efecto del antagonista selectivo a los receptores mGluR2/3, LY341495, sobre los efectos del APDC en la señal discriminativa de la ANF. Los resultados obtenidos muestran, en primer lugar, que las ratas fueron capaces de discriminar la señal discriminativa de la ANF de salina después de 10 ensayos droga y 10 ensayos salina. Estos resultados son similares a los obtenidos en estudios previos usando ANF como droga de entrenamiento en un paradigma de CAS (Herrera & Velazquez Martinez, 1997; Sandoval-Sánchez et al., 2016, 2020). También se encontró, en las pruebas de generalización, que ni el APDC ni el LY341495 substituyeron la señal discriminativa de la ANF.
Los resultados coinciden con reportes previos acerca del efecto de la ANF sobre los transportadores de DA. La ANF revierte la función del transportador induciendo así un incremento en los niveles extra sinápticos de DA en el sistema mesocorticolímbico, particularmente en las neuronas DAérgicas que proyectan del ATV al nAcc. Esta proyección es una vía importante para la producción de los efectos reforzantes, adictivos y discriminativos de los psicoestimulantes (Koob & Volkow, 2016).
En cuanto a las pruebas de combinación, se observó que la administración sistémica del agonista de los receptores mGluR2/3 APDC, disminuyó la señal discriminativa de la ANF de forma dependiente de la dosis. El APDC es un agonista a los receptores metabotrópicos del Glu, sistémicamente activo y altamente selectivo a los receptores metabotrópicos a Glu del grupo II (mGluR2/3) (Monn et al., 1996). Por otro lado, el antagonista LY341495, altamente selectivo a los receptores mGluR2/3, disminuyó el efecto del APDC, de forma dependiente de la dosis. La administración de un antagonista selectivo se usa frecuentemente para confirmar mecanismos asociados a la acción de un agonista sobre alguna conducta. Estos resultados sugieren que los receptores mGluR2/3 podrían modular la señal discriminativa de la ANF.
Los resultados conductuales del presente estudio concuerdan con reportes previos que sugieren que los agonistas mGluR2/3 pueden modular algunas conductas relacionadas con el consumo de psicoestimulantes y otras drogas de abuso (Fischer et al., 2021). Por ejemplo, en cuanto a la motivación al consumo ejercida por psicoestimulantes, se ha reportado que el agonista selectivo a los receptores mGluR2/3 LY3792 disminuye los puntos de ruptura generados por PRP reforzados con MET (Crawford et al., 2013) y COC (Karkhanis et al., 2016), disminuye las autoadministraciones de COC (Baptista et al., 2004; Justinova et al., 2016), nicotina (Justinova et al., 2015, 2016; Liechti et al., 2007) y alcohol (Augier et al., 2016) e inhibe la expresión de sensibilización locomotora resultado de la administración repetida de ANF (Arndt et al., 2014; Kim & Vezina, 2002) y fenciclidina (Clark et al., 2002). Además, nuestros resultados concuerdan con la extensa evidencia del efecto del agonista mGluR2/3 LY379268, que reduce la reinstalación de la conducta de palanqueo inducida por señales asociadas a drogas como la COC (Baptista et al., 2004; Cannella et al., 2013), MET (Kufahl et al., 2013), heroína (Bossert et al., 2004), alcohol (Zhao et al., 2006) y nicotina (Liechti et al., 2007).
Un mecanismo que podría explicar por qué en la presente investigación se observa una disminución de los efectos discriminativos de la ANF tras la administración del agonista a los receptores mGluR2/3 APDC, es el siguiente. Los receptores mGlu del grupo II, funcionan principalmente como autorreceptores inhibitorios en vías Gluérgicas para regular la liberación de Glu y DA (Dietrich et al., 2002). En relación con la regulación del sistema mesocorticolímbico de la DA, vía importante para la producción de efectos reforzantes e interoceptivos de las drogas de abuso, existen reportes que indican un papel importante de los receptores mGluR2/3 ubicados en el ATV. Los receptores mGluR2/3 se encuentran ubicados como autorreceptores en las terminales Gluérgicas del ATV, su activación disminuiría la liberación de Glu disminuyendo así la actividad de las neuronas DAérgicas y, por tanto, la liberación de DA en el nAcc. Esta posibilidad concuerda con reportes hechos por Bossert et al. (2004), quienes evaluaron los efectos de la administración del agonista a los receptores mGluR2/3 LY379268 en ATV, sobre la recaída en la búsqueda de COC inducida por el contexto. Los autores reportaron que el LY379268 atenuó la recaída inducida por el contexto y que este efecto podría deberse a la modulación de vías Gluérgicas provenientes de la corteza prefrontal, el núcleo pedúnculo pontino o el núcleo del lecho de la estría terminal.
Otro posible mecanismo que podría explicar nuestros resultados es la activación de los receptores mGuR2/3 directamente en el nAcc. En el nAcc, los receptores mGluR2/3 se expresan en las terminales de neuronas Gluérgicas corticales que hacen sinapsis en las neuronas espinosas medianas (NEM) (Scofield et al., 2016). La activación de estos receptores decrementa la liberación de Glu sobre las NEM disminuyendo así su activación. La modulación de las NEM del nAcc es importante ya que, como se mencionó, esta región es crítica para la producción de efectos reforzantes e interoceptivos producidos por las drogas de abuso como la ANF. Esta explicación es apoyada por reportes que indican que la administración in situ del agonista a los receptores mGluR2/3 LY379268 en el core del nAcc bloqueó la recaída en la búsqueda de COC (Peters & Kalivas, 2006).
Aun cuando nuestros resultados podrían ser explicados por los mecanismos mencionados, es importante señalar que una de las limitaciones del presente estudio es que no realizamos ninguna prueba que nos permitiera corroborar estas hipótesis, por lo que se sugiere se lleven a cabo investigaciones adicionales con dicho fin. Una segunda limitante que resulta importante señalar es que aunque los resultados parecen ser positivos, el uso de dosis elevadas de agonistas de los receptores mGluR2/3 ha mostrado afectar la conducta motora (Cartmell et al., 2000), por lo que también se sugieren estudios adicionales con base en la creciente literatura que propone la evaluación de farmacoterapias que permitan el uso de dosis bajas de dos fármacos con un potencial para reducir la motivación para la administración de drogas de abuso, como lo hemos reportado con otras drogas en animales de laboratorio (Acosta-García et al., 2017; Cedillo et al., 2019; Cedillo & Miranda, 2013).
En conclusión, los resultados de presente estudio indican que el agonista de los receptores mGluR2/3 APDC, puede disminuir la señal discriminativa de la ANF y este efecto fue revertido por el antagonista selectivo a los receptores mGluR2/3 LY341495. Aunque en este estudio no se realizaron pruebas dirigidas a evaluar el mecanismo, la literatura sugiere que el resultado conductual podría deberse a la activación de receptores mGluR2/3 ubicados como autorreceptores en terminales Gluérgicas ubicadas en el nAcc y el ATV. Estos datos aportan evidencia adicional sobre el papel modulatorio que podrían ejercer los ligandos mGluR2/3 sobre las conductas relacionadas con los psicoestimulantes, particularmente en las propiedades discriminativas de la ANF. Además, los datos se suman a una creciente literatura que sustenta el papel de los receptores mGluR2/3 en el desarrollo de un potencial tratamiento farmacológico para el manejo de la adicción a diferentes sustancias de abuso.











 nueva página del texto (beta)
nueva página del texto (beta)


