Diversos estudios han documentado los efectos del estrés agudo sobre la actividad neurofisiológica central (sistema límbico y su interacción con la corteza prefrontal media, corteza cingulada anterior y corteza orbitofrontal); actividad autonómica, somática, cognitiva, endocrinológica e inmunológica (Allen, Kennedy, Cryan, Dinan & Clarke, 2014; Allen, Kennedy, Dockray, Cryan, Dinan, & Clarke, 2017). Para inducir estrés agudo se ha utilizado el Trier Social Stress Test (TSST) (Kirschbaum, Pirke & Hellhammer, 1993), como un protocolo de estrés social experimental, el cual incrementa la actividad autonómica simpática, endocrinológica e inflamatoria (Marsland, Walsh, Lockwood & John-Henderson, 2017). Para el lector interesado en ahondar en los efectos psicofisiológicos periféricos, inmunológicos y endocrinológicos, la Tabla 1 recoge los estudios empíricos más recientes.
Tabla 1 Efectos autonómicos, endocrinológicos e inflamatorios del TSST
| Autor | Año | Tipo de estudio | N | Medidas | Resultados |
|---|---|---|---|---|---|
| Boesch, et al. | 2014 | Cuasi-experimental | primer estudio: 294; segundo estudio: 105 | alfa-amilasa salival y FC | Al comparar ambos, TSST-G-2-defensa y 2-presentación, la primera dio lugar a una mayor respuesta al estrés con respecto a la FC y la VFC. |
| Cooper, et al. | 2015 | Correlacional | 1255 | Hemoglobulina, Colesterol, IL-6, fibrinógeno, VFC. | Los resultados apoyan la existencia de la vía antiinflamatoria vagal y sugieren que tiene efectos similares en hombres y mujeres |
| Fogelman & Canli | 2015 | Cuasi-experimental | 44 adultos mayores | Cortisol salival | Los datos sugieren que los individuos con alto propósito en la vida muestran reactividad al estrés adaptativo (alostasis), pero reducen el estrés crónico a través de la recuperación del cortisol (carga alostática). |
| Slavish, et al. | 2015 | Revisión sistemática | 22 estudios | Biomarcadores inflamatorios salivales | Algunas citoquinas, especialmente IL-1β, TNF-α e IL-6, aumentan en saliva en respuesta al estrés agudo. |
| Petrowski, et al. | 2016 | Cuasi-experimental | 33 participantes con TP y 34 controles | alfa-amilasa salival y FC | No se encontraron diferencias significativas en las respuestas autonómicas entre ambos grupos. Los hombres tuvieron mayor actividad autonómica. Relación entre FC y alfa-amilasa. |
| Lockwood, et al. | 2017 | Experimental | 159 hombres negros y 129 blancos | FC, VFC y marcadores de inflamación sistémica: IL-6, PCR | La FC y el tiempo en que se realiza la tarea, así como la VFC evocada por el estrés se asocian con inflamación. Los marcadores de inflamación se asociaron a la VFC. |
| Reschke, et al. | 2017 | Cuasi-experimental | 20 mujeres y 20 hombres | Cortisol salival, estrés subjetivo. | No existe diferencia entre mujeres y hombres en los niveles de estrés. Sin embargo, los hombres mostraron un nivel más elevado de cortisol. |
| Liu, et al. | 2017 | Meta-análisis | 34 estudios: 640 mujeres y 710 hombres | Cortisol | Los hombres incrementan más cortisol que las mujeres durante y después del TSST. |
Nota: TP= Trastorno de pánico; FC= Frecuencia cardiaca; VFC= Variabilidad de la frecuencia cardiaca; IL-6= Interleucina 6; PCR= Proteína C reactiva.
De manera particular, la actividad simpática genera vasoconstricción cutánea. Al estrecharse el diámetro de los vasos sanguíneos periféricos aumenta la presión arterial y disminuye el volumen sanguíneo lo cual decrementa la temperatura periférica (manos, nariz, pies) (Ioannou, Gallese & Merla, 2014; Kano, Hirata, Deschner, Behringer & Call, 2016).
La actividad simpática promueve la respuesta inflamatoria (Pongratz & Straub, 2014) de citoquinas como la interleucina 6 (IL-6). La IL-6 se ha estudiado durante el paradigma TSST (Marsland, et al., 2017; Steptoe, Hamer & Chida, 2007) mostrando incrementos respecto al nivel basal, con mayores niveles de concentración entre personas que han estado expuestas a experiencias traumáticas en etapas tempranas de su vida (Carpenter, Gawuga, Tyrka, Lee, Anderson, & Price, 2010).
Una medida para evaluar los cambios psicofisiológicos autonómicos de diversos estados afectivos es la temperatura periférica. Un estudio reciente evalúo el efecto del TSST sobre la temperatura periférica cuyo resultado principal mostró el descenso de la temperatura en los dedos de las manos (Cruz-Albarrán, Benítez-Rangel, Osornio-Ríos, Domínguez-Trejo, Rodríguez-Medina & Morales-Hernández, 2018). Sin embargo, debido a la estructura del paradigma, el TSST solo incluye una fase de recuperación natural pero no de desactivación simpática sobre los efectos que produce en el participante (Birkett, 2011). Para ello, se han desarrollado algunas estrategias estructuradas como las técnicas de relajación, las cuales promueven la actividad parasimpática. Una de las técnicas de relajación que promueve la actividad parasimpática es la respiración diafragmática, una estrategia psicofisiológica no invasiva, en la cual se induce al participante a respirar de manera rítmica, lenta, con inhalaciones profundas, exhalaciones pronunciadas y pausas entre la inspiración y la expiración. Su aplicación se ha descrito en diversos estudios; sin embargo, en muchos casos la evaluación de su utilidad clínica se ha limitado a las escalas o medidas de autorreporte (medidas indirectas), dejando fuera medidas fisiológicas (directas). Por ejemplo, la respiración diafragmática promueve un incremento en la temperatura nasal (Figura 1); por el contrario, eventos aversivos disminuyen la temperatura nasal (Kano, et al., 2016). En la Tabla 2 se presenta una breve revisión de los estudios antecedentes que han evaluado los efectos de la respiración diafragmática sobre la actividad autonómica, en particular, la reducción de la actividad cardiovascular; sin embargo, se desconoce su capacidad de regulación de la actividad inflamatoria después del estresor agudo.
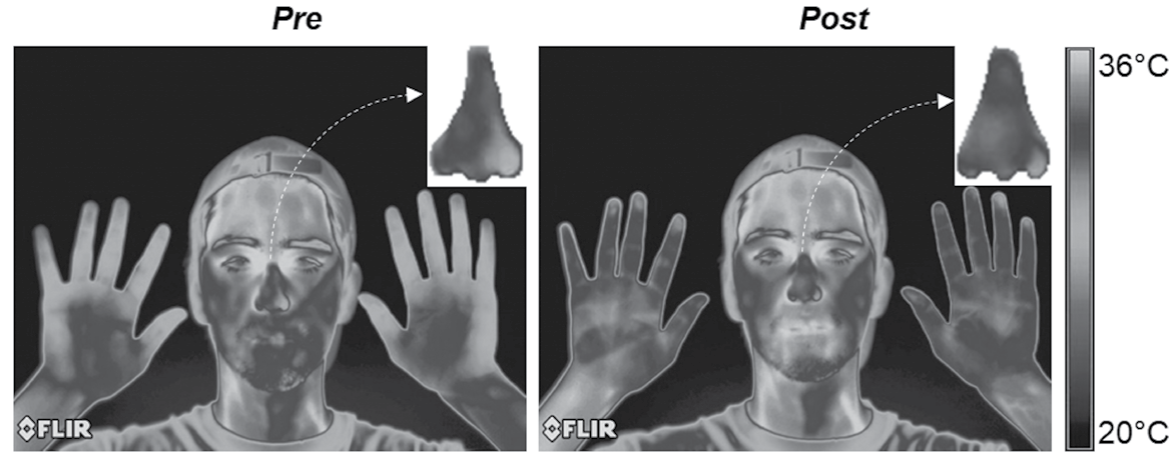
Figura 1 Imagen térmica infrarroja del efecto de la respiración diafragmática sobre la temperatura periférica. La respiración diafragmática (3 minutos) produce un efecto de vasodilatación periférico: incrementa el volumen sanguíneo aumentando la temperatura en manos y en nariz (Rodríguez-Medina, Domínguez-Trejo, Cruz-Albarrán, Morales-Hernández & Leija-Alva, 2018,).
Tabla 2 Efectos psicofisiológicos de la respiración diafragmática
| Autor | Año | Tipo de estudio | N | Medidas | Resultados |
|---|---|---|---|---|---|
| Chang, et al. | 2013 | Experimental | 53 participantes voluntarios | PA, RR, FC, VFC | La RD a 8 respiraciones por minuto disminuyó la PA, decrementó la frecuencia baja e incrementó la frecuencia alta de la VFC, |
| Ferrerira, et al. | 2013 | Cuasi- experimental | 13 pacientes hipertensos | PA, RR, VFC, | El grupo de tratamiento decrementó la PA, la baja frecuencia de VFC e incrementó la alta frecuencia. |
| Russell, et al. | 2016 | Experimental | 40 participantes voluntarios | FC, VFC | La RD sin pausa entre ciclos mostró una baja VFC, mientras que la pausa entre ciclos respiratorios incrementa la frecuencia alta de VFC. |
| Zou, etal. | 2017 | Revisión | 6 estudios: 269 pacientes cardiovasculares y controles | FC, PA | La RD redujo la FC significativamente (-1.72 latidos por minuto), y la PA (sistólica: -6.36 mmHg: distólica: -5.63 mmHg) comparado con los controles. |
| Ma, et al. | 2017 | Experimental | 40 participantes voluntarios | Cortisol, PANAS, NCT | La RD mejora la atención sostenida, disminuye el afecto y los niveles de cortisol. |
| Jafari, et al. | 2017 | Revisión sistemática | 31 estudios sobre respiración y dolor | RR, ENA, CP | Disminuye la baja frecuencia de VFC, el dolor y la CP. |
| de Abreu, et al. | 2017 | Revisión sistemática | 6 estudios en control autonómico | PA, FC, VFC | La RD promueve la alta frecuencia de VFC, disminuye la baja frecuencia de VFC, reduce la FC en pacientes con diabetes, hipertensión e insuficiencia cardiaca. |
Nota: PA=Presión arterial; RR= intervalo RR FC= Frecuencia cardiaca; VFC= Variabilidad de la frecuencia cardiaca; RD= Respiración diafragmática; PANAS= Escala de afecto positivo y negativo; NCT= Test de cancelación del número; ENA=Escala Numérica Análoga (dolor); CP= Conductancia de la piel
Cuando un participante no se beneficia de las estrategias de relajación es necesario recurrir a procedimientos externos que disminuyan los efectos psicofisiológicos de estrés. Una estrategia para ello es la estimulación térmica corporal (Lee, Park & Kim, 2011), cuyo propósito es reducir la vasoconstricción generada por la actividad simpática, la conductancia de la piel y el nivel de cortisol. El incremento periférico de temperatura genera un proceso vasodilatador, el cual inhibe la descarga simpática y la producción de catecolaminas. La estimulación térmica local a los 42°C aumenta el flujo sanguíneo de la piel permitiendo la relajación del músculo donde se administra la estimulación (Johnson & Kellogg, 2010). Se han documentado las vías termosensoriales y circuitos neurales implicados en la disminución de estados afectivos negativos, promoviendo el involucramiento social (Raison, Hale, Williams, Wager & Lowry, 2015). Esta estimulación térmica no debe superar los 43°C, temperatura a la cual se activa el receptor TRPV1 que induce una respuesta simpática (Alawi, Aubdool, Liang, Wilde, Vepa & Psefteli, 2015).
Con base a lo anterior, la presente investigación planteó dos objetivos: el primero, evaluar si la respiración diafragmática puede regular la actividad autonómica y la producción de IL-6 después de aplicar el TSST; segundo, evaluar el efecto inhibitorio autonómico de la estimulación térmica (≈ 41°C) en manos durante y después del TSST.
Estudio 1. Efecto del estrés social agudo y la respiración diafragmática sobre la actividad autonómica, la respuesta inflamatoria y el autorreporte.
Hipótesis
1)La aplicación del TSST aumentará la actividad inflamatoria (IL-6) y la actividad autonómica simpática (incremento en la presión arterial; y decremento de la temperatura nasal y dedo de la mano izquierda); así como el puntaje de estrés por autorreporte.
2)La respiración diafragmática disminuirá la actividad inflamatoria, la actividad autonómica simpática y el nivel de autorreporte de estrés.
Método
Participantes
Se contó con una participación voluntaria de N= 11 estudiantes universitarios (10 mujeres y 1 hombre). La edad M= 23.25 (±5.024) años, y con M= 15.62 (±7.042) días a partir del ciclo menstrual en el caso de las mujeres. Como criterio de inclusión se establecieron que fueran estudiantes normotensos, no consumir fármacos previos a los días del estudio y con un ayuno de al menos tres horas entre las 06:00 y las 09:00 hrs. Todos los participantes dieron su consentimiento informado con base a la declaración de Helsinki.
Instrumentos y materiales
Se utilizaron medidas de distrés psicológico como pruebas de tamizaje, medidas psicofisiológicas de actividad autonómica y respuesta inflamatoria (IL-6 salival) (Figura 2a).

Figura 2 Materiales, instrumentos y diseño de investigación. A. Materiales e instrumentos psicofisiológicos. B Protocolo de TSST y recuperación
Patient Health Questionarie (PHQ-4) (Kroenke, Spitzer, Williams & Löwe, 2009). Es un instrumento breve de cuatro reactivos (dos para evaluar ansiedad y dos para depresión), con una escala de medición tipo Likert del 0 al 3. Si el participante tiene una puntación de 0 a 2 se considera sin distrés, una puntuación de 3 a 5 se considera nivel bajo, puntajes de 6 a 8 un nivel moderado y 9 a 12 un nivel alto de distrés.
Primary Care of Post-Traumatic Stress Disorder (PC-PTSD) (Prins et al., 2003). Basado sobre los criterios clínicos del Trastorno de Estrés Postraumático (TEP) del DSM-IV-R, utilizado en población mexicana (Rodríguez-Medina, et al., 2018), evalúa la presencia de TEP en cuatro reactivos con opciones de respuesta dicotómicas (si/no). Se considera el TEP si el sujeto contesta tres o cuatro positivos a las preguntas.
Escala Numérica de Estrés subjetivo. El autorreporte del estrés subjetivo de una situación particular en una línea horizontal que va del 0 (nada) al 10 (extremo).
Baumanómetro Digital Citizen CH-656C. Es un dispositivo que registra la presión arterial y el pulso. Para esta investigación se utilizó la presión arterial media:
PAM ≅ 2/3 (PD)+1/3 (PS)
Donde:
PAM: Presión Arterial Media, PD: Presión Diastólica y PS: Presión Sistólica
Non contact infrared body Thermometer DM300®. Termómetro de infrarrojo con diámetro de 0.5cm2, el cual permite registrar la temperatura de la piel en un rango de 0°C a 100°C. Para este estudio se registró la temperatura en la línea media de la punta de la nariz, así como del dedo medio de la mano izquierda.
Interleucina 6 salival. La interleucina 6 es la citoquina con mayor concentración en sistema nervioso central, la cual regula la actividad inflamatoria sensible a la alteración física o psicológica (afectiva) del organismo. Para su análisis en laboratorio se procedió con las indicaciones del fabricante Sallimetrics®.
Trier Social Stress Test (TSST). Protocolo de inducción de estrés agudo psicosocial. Consiste en cuatro fases (Figura 2b): (1) reposo en sala de espera; (2) preparación de un discurso que describa porqué es un buen candidato para su trabajo ideal, (3) Exposición del discurso verbal, y (4) tarea aritmética en voz alta de restar de 17 en 17 desde 1021 (si se equivoca el participante reinicia desde el principio).
Procedimiento
Se programó, en una sola semana, a los participantes para que acudieran a las salas de registro psicofisiológico entre las 09:00 y las 11:00 horas. Se requirieron dos salas con iluminación a una temperatura constante a 20°C, escritorio y sillas. En la primera sala al llegar cada estudiante universitario firmó un consentimiento informado; posteriormente contestaron las medidas psicométricas de estrés y al terminar permanecieron sentados en reposo 10 minutos para tomar su PAM e IL-6 inicial. Después se les aplicó el protocolo del TSST en la segunda sala y se volvió a registrar la PAM, IL-6 y estrés subjetivo. A continuación, se les instruyó a realizar un ejercicio de respiración diafragmática durante 3 minutos con apoyo de un video y las indicaciones de un experimentador y finalmente se volvieron a tomar las muestras salivales de IL-6, la PAM y el estrés subjetivo.
Análisis estadísticos
Se extrajeron los datos descriptivos (media, mediana, y desviación estándar) de las medidas psicométricas y psicofisiológicas. Se exploró la normalidad de los datos con una prueba de Kolmogórov-Smirnov (p<.05). Debido a que no se encontró una distribución normal se realizó un análisis estadístico no paramétrico de medidas repetidas de Friedman para las mediciones psicofisiológicas y de estrés subjetivo, y una prueba de Wilcoxon para evaluar las diferencias pre - post y post - relajación. Se considero un nivel de significancia ≤.05.
Resultados
La escala de distrés PHQ-4 tuvo una puntuación media = 1.81 (D.E. = 0.75). En su dimensión ansiedad la media = 2 (D.E. = 1.612). En la dimensión depresión la puntuación media = 1.27 (D.E. = 1.1). La escala breve de desorden de estrés postraumático (PC-PTSD) tuvo una puntuación media = 1.55 (D.E. = 1.44). De los 11 participantes, 3 de ellos (27.3%) obtuvieron una puntuación clínica de estrés postraumático (EP), los cuales mostraron una diferencia estadísticamente significativa (Z = -2.075, p= .048) en la dimensión de ansiedad de la escala PHQ-4 respecto a quienes no puntuaron con EP.
La Figura 3 ilustra los cambios psicofisiológicos del TSST y la respiración diafragmática. La temperatura periférica en el dedo (medio, mano izquierda), disminuyó pre - post TSST (Media pre = 27.27°C, Media post = 25.55 °C, Z= -2.023, p= .043) (Figura 3a). La temperatura nasal también disminuyó (pre= 31.17°C, post= 30.59°C) significativamente (Z= -2.23, p= .042) (Figura 3b).
La IL-6 salival solo tuvo un cambio estadísticamente significativo, (Z= -2.597, p=.009) incrementando con el TSST (Figura 3c).

Figura 3 Efectos psicofisiológicos del TSST y la respiración diafragmática. Las gráficas muestran la media de cada medida y el error estándar pre -post estresor social (TSST), y la respiración diafragmática: (a) la temperatura en el dedo medio de la mano izquierda; (b) la temperatura nasal; (c) la interleucina 6 salival; d) la presión arterial media; (e) la tasa cardiaca y (f) el autorreporte. * p<.05, ** p<.01.
La presión arterial media tuvo cambios estadísticamente significativos (X2= 9.677 (2), p= .008). La presión arterial incrementó con el estresor social (PAM pre= 86.06 mmHg, PAM post= 90.36 mmHg, Z= -2.245, p= .025), y disminuyó con la respiración diafragmática (PAM relajación= 83.25 mmHg, Z= -2.31, p= .021) (Figura 3d).
La tasa cardiaca no tuvo cambios estadísticamente significativos (X2= 0.57, (2), p=.972) en ninguna condición (Figura 3e).
El autorreporte de estrés mostró efectos estadísticamente significativos (X2= 8.57, (2), p= .012). El puntaje de estrés incrementó con el estresor social (ENE pre= 3.09, ENE post= 5.91, Z= -2.277, p= .006), y disminuyó con la respiración diafragmática (ENE relajación= 2.25, Z= -2.207, p= .027) (Figura 3f).
Discusión
Como se hipotetizó, el TSST incrementó la actividad autonómica simpática y la respuesta inflamatoria IL-6 (Slavish, Graham-Engeland, Smyth & Engeland, 2015). La disminución de la temperatura nasal es consistente con estudios previos en estrés (Kano, et al, 2016). La respiración diafragmática disminuyó la actividad autonómica simpática pero no la IL-6. Pocos estudios han explorado la vida media de la IL-6 (Godbout & Johnson, 2004) pero su duración en el organismo puede durar algunas horas. Sin embargo, el nivel de IL-6 muestra una tendencia a la baja que podría incrementarse de manera significativa con el entrenamiento en relajación durante algunas sesiones, como los estudios revisados por Lopresti (2017), en la que las estrategias cognitivo-conductuales tienen un efecto sobre distintos biomarcadores de inflamación en pacientes con depresión.
Para su entrenamiento, el biofeedback de temperatura, volumen sanguíneo y/o VFC podría ser útil (se sugiere utilizar la variabilidad de la frecuencia cardiaca en lugar de la tasa cardiaca).
Las escalas psicométricas utilizadas son sensibles clínicamente; sin embargo, en los trastornos de salud y afectivos que comprometen el funcionamiento autonómico (estrés crónico, fatiga, hipertensión, dolor crónico, inflamación, entre otros) sería pertinente el uso de medidas psicofisiológicas sensibles a los objetivos terapéuticos de intervención.
Estudio 2. Efecto de la estimulación térmica en la palma de las manos durante el TSST sobre la actividad autonómica.
Participantes
Similar al estudio 1, se igualaron las características sociodemográficas de los participantes: 11 estudiantes universitarios (10 mujeres y 1 hombre) voluntarios. La edad M= 22.54 (±2.03) años, y con M= 9.6 (±6.103) días a partir del ciclo menstrual en el caso de las mujeres. Como criterio de participación se estableció que fueran estudiantes normotensos, no consumir fármacos previos a los días del estudio y con un ayuno de al menos tres horas previas al estudio.
Instrumentos y materiales
Los mismos que el estudio 1, más una compresa rectangular con gel termorreactivo (de la empresa Home Care®, medidas: 10 X 9 cm) que al activarse alcanza una temperatura aproximada de 41°C durante 15 a 20 minutos.
Procedimiento
Se programó en una sola sesión a los participantes para que acudieran a las salas de registro psicofisiológico (Temperatura media constante= 24°C) entre las 09:00 y las 13:00 horas. Como en el estudio 1, se utilizó el TSST con la diferencia que los participantes sostuvieron en las manos la compresa con gel termorreactivo. Se evaluaron las medidas (pre - post y recuperación) de autorreporte de distrés psicológico PHQ-4, el PC-PTSD y la escala numérica de estrés; como medidas psicofisiológicas se registró la presión arterial con el baumanómetro Citizen CH-656C y la temperatura nasal y en el dedo medio de la mano izquierda con el Non contact infrared body Thermometer DM300t, todos los materiales descritos en el estudio 1.
Análisis estadísticos
Se exploró la normalidad de los datos con una prueba de Kolmogórov-Smirnov (p<.05). Debido a que no se encontró una distribución normal se realizó un análisis estadístico no paramétrico de medidas repetidas de Friedman para las mediciones psicofisiológicas y de estrés subjetivo, y una prueba de Wilcoxon para evaluar las diferencias pre - post y post - relajación. Adicionalmente se exploraron las correlaciones entre las variables psicométricas y psicofisiológicas. Para todos los análisis estadísticos se consideró un nivel de significancia ≤.05.
Resultados
La escala de distrés PHQ-4 tuvo una puntuación media = 5.7 (D.E. = 3.43). En su dimensión ansiedad la media = 3.1 (D.E. = 1.79). En la dimensión depresión la puntuación media = 2.6 (D.E. = 1.83). La escala breve de desorden de estrés postraumático (PC-PTSD) tuvo una puntuación media = 1.9 (D.E. = .316). De los 11 participantes, solo 1 de ellos (9.09%) obtuvo una puntuación clínica de estrés postraumático (EP); además fue quien registró la menor temperatura en el dedo medio izquierdo (25.8°C), cuyo valor se encontró 2.33°C por debajo de la media del grupo (28.13°C).
La única relación entre las mediciones que se encontró estadísticamente significativa fue entre los puntajes de ansiedad y depresión (r= .789, p= .007).
La Figura 4 ilustra los cambios psicofisiológicos del TSST mientras los participantes sostuvieron el estímulo térmico.
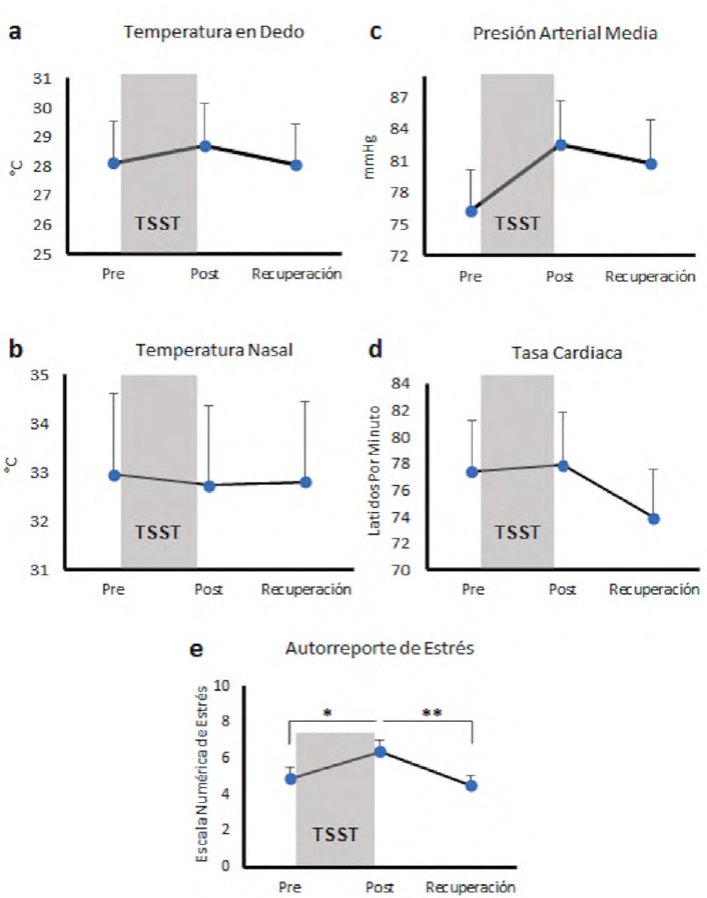
Figura 4 Efectos psicofisiológicos del TSST con estimulación térmica. Se muestra la media y el error estándar de la actividad autonómica y el autorreporte de estrés producidas por el TSST con la estimulación térmica (a) la temperatura en el dedo medio de la mano izquierda; (b) la temperatura nasal; (c) la presión arterial media; (d) la tasa cardiaca y (e) el autorreporte * p<.05, ** p<.01.
La temperatura en los dedos, al sostener el estímulo térmico, no varió significativamente (X2= 0.25, (2), p=.882) durante el TSST (Figura 4a). Tampoco cambió la temperatura nasal (X2= 0.359, (2), p= .836) (Figura 4b).
La presión arterial media no mostró cambios estadísticamente significativos (X2= 5.027, (2), p= .081) en ninguna de las condiciones (Figura 4c).
La tasa cardiaca, aunque cambió, no lo hizo significativamente (X2= 3.436, (2), p= .179) (Figura 4d).
A diferencia de las medidas autonómicas, el autorreporte de la escala numérica de estrés mostró cambios estadísticamente significativos (X2= 9.879, (2), p= .007); el autorreporte de estrés incrementó con el TSST (Z= -2.124, p= .034), y disminuyó en la fase de recuperación con la respuesta natural de relajación sosteniendo el estímulo térmico (Z= -2.716, p= .007) (Figura 4e).
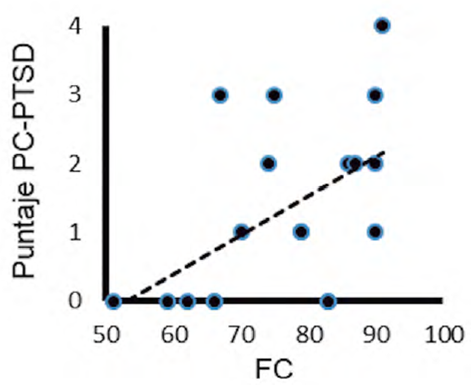
Se exploraron las correlaciones entre las medidas autonómicas y las psicométricas. Únicamente al juntar los puntajes de los participantes del estudio 1 y 2, se encontró una relación entre el puntaje de EP con la frecuencia cardiaca (r= .526, p= .026) (Figura 5). El resto de las correlaciones no fueron significativas (p>.05).
Discusión
Como se hipotetizó, la vasodilatación generada por la estimulación térmica inhibió los efectos autonómicos simpáticos: temperatura periférica (dedos y nariz) y la presión arterial, después y en la fase de recuperación del TSST se mantuvieron sin cambios. También, como se esperaba, la estimulación térmica tuvo un efecto en la fase de recuperación natural en el autorreporte de estrés disminuyendo el estado afectivo negativo (Raison, et al., 2015). La tendencia en la reducción de la tasa cardiaca durante el periodo de recuperación sugiere la evaluación de la variabilidad de la frecuencia cardiaca (VFC) (Chen, Sun, Wang, Lin & Wang, 2015; Lehrer & Gevirtz, 2014). Esta medida puede ser útil para explicar el autorreporte de estrés, el cual se modificó con el TSST y en la fase de recuperación.
De acuerdo con la Teoría Polivagal (Porges, 2001, 2003 y 2009) la neurocepción facilita la activación autonómica ante un evento afectivo: si es agradable prepara una organización autonómica de involucramiento disminuyendo la actividad simpática y aumento la activación parasimpática, como el decremento de la tasa cardiaca. Por el contrario, si la valencia del estímulo es negativa, predispone al organismo a incrementar la actividad simpática. Esto podría explicar la asociación encontrada entre el puntaje de estrés postraumático y la frecuencia cardiaca: entre mayor es el puntaje (estímulo negativo) se incrementa la actividad. La Teoría Polivagal sostiene 3 niveles de activación fisiológica jerárquicamente caracterizados: 1) Congelamiento, la cúspide del arousal la temperatura desciende, así como el contacto visual y social; 2) Lucha/Huida, caracterizada por el predominio simpático, promueve conductas protectoras; 3) Involucramiento Social, con predominio parasimpático, inhibe las funciones defensivas tanto conductuales como fisiológicas, decrementando la actividad cardiovascular. Cuando el sujeto logra transitar con facilidad del estado de lucha/ huida al de involucramiento social cuenta con regulación emocional. Los estudios en imagen térmica infrarroja de Rodríguez-Medina, et al. (2018) y Panasiti et al. (2016) sugieren que la actividad parasimpática promueve el incremento de temperatura periférica. El compromiso clínico será con aquellos que se encuentran en un estado de congelamiento, quienes van a requerir mayor atención clínica, como las estrategias cognitivo-conductuales (Lopresti, 2017) donde se pueden condicionar los efectos autonómicos de la estimulación térmica local (cuyos mecanismos se pueden revisar en Johnson & Kellogg, 2010) con una estrategia psicológica de relajación cuyo propósito sea inhibir las conductas defensivas, la activación fisiológica y promover el comportamiento social (Porges, 2001, 2003, 2009; Raison, et al., 2015).
Las características sociodemográficas y el criterio normotenso fueron similares entre los sujetos del estudio 1 y estudio 2. Sin embargo, el nivel de distrés reportado por los sujetos del estudio 2 fue mayor. Se sugiere considerar el periodo de registro para futuras investigaciones, pues, aunque los estudios se realizaron en el mismo semestre académico, no se corrieron paralelamente, lo cual no permite comparar el efecto de interacción por grupos, y se ha documentado que el estrés académico influye en la actividad inflamatoria (Espinosa & Bermúdez-Rattoni, 2001) si se desea comparar la interacción de los grupos.
Conclusiones
La respiración diafragmática es útil para disminuir la actividad simpática asociada al estrés agudo. Se sugiere utilizar instrumentos de medición apropiados, como los revisados en los estudios antecedentes, para valorar sus efectos psicofisiológicos para el abordaje clínico de trastornos crónicos. La línea de investigación sugiere evaluar el efecto de un programa de estimulación térmica para condicionar la respuesta autonómica con estrategias de relajación cuando el participante no cuente con las habilidades para incrementar deliberadamente su temperatura periférica (aumento de actividad parasimpática) por sí mismo durante la relajación, como lo sugieren los resultados de estudios clínicos en los que la elevada concentración de IL-6 no permite alcanzar la regulación autonómica (Rodríguez-Medina, et al., 2018).











 nueva página del texto (beta)
nueva página del texto (beta)