Las diferencias en la forma o estructura de los organismos dentro de un mismo grupo biológico se conocen como variación morfológica (Jeffers 1967, Foote 1997, MacLeod & Forey 2002, Adams & Collyer 2019, De Luna 2020). Ejemplos de esta variación son las diferencias en el tamaño, la forma u otras características externas, las cuales pueden ser causadas por factores genéticos, ambientales o una combinación de ambos. Existen diferentes maneras de medir la variación morfológica que ayudan a postular tendencias fenotípicas de las especies o grupos de especies. La morfometría geométrica es una de ellas, que analiza el registro numérico de la “forma” a partir de puntos de referencia basados en posiciones anatómicas homólogas bien reconocidas en todos los especímenes (marcas o landmarks en inglés), así como en contornos o curvas que pueden ser delimitados bajo distintos algoritmos (semimarcas o semilandmarks en inglés). Estas coordenadas ayudan a definir formas que pueden ser evaluadas mediante métodos estadísticos multivariados, con las que se obtiene un espacio multidimensional también conocido como morfoespacio, el cual permite describir patrones morfológicos (Bookstein 1997, MacLeod 2017, De Luna 2020).
La morfometría geométrica ha sido mejor explorada en zoología, siendo su uso más limitado en botánica; Christodoulou et al. (2020)) proporcionan ejemplos del uso en botánica de esta herramienta. En particular, los estudios enfocados a las láminas foliares se concentran en caracterizar la forma y como apoyo en la clasificación de las especies (Viscosi & Cardini 2012, Conesa et al. 2012, Fragoso-Martínez et al. 2015, Lima-Morales et al. 2021); otros relacionan la morfometría con características genéticas (Chitwood et al. 2014, Pessoa et al. 2021, Rejlova et al. 2021), pero pocos son los trabajos publicados que evalúan patrones macroevolutivos (Gallaher et al. 2019).
Uno de los métodos estadísticos para evaluar tendencias fenotípicas (como la conservación o la divergencia morfológica), es realizar cálculos en el morfoespacio usando por ejemplo un análisis de variables canónicas (CVA por sus siglas en inglés). Este análisis, que utiliza las distancias de Mahalanobis, no refleja las relaciones filogenéticas, pero permite deducir si existe o no similitud en las formas geométricas o en caracteres morfológicos (De Luna 2020).
En contraste, un filomorfoespacio combina la filogenia (filograma, como en Mason et al. 2016, Morello et al. 2018) o el cronograma (como en Schneider 2016, Gaudioso et al. 2020) con el morfoespacio (ejes de componentes principales o de variables canónicas) para trazar la diversificación de los rasgos fenotípicos, resultando en un gráfico que permite evaluar patrones fenotípicos multivariados (Adams & Collyer 2019). Una forma de evaluar estos patrones fenotípicos es midiendo la magnitud e innovación morfológica, lo que permite explorar hipótesis macroevolutivas y escenarios evolutivos (Sidlauskas 2008). Parte de estos análisis consisten en estimar la magnitud, es decir, la cantidad de cambio morfológico desde un nodo hasta algún linaje definido de la filogenia, o la innovación, que es la eficiencia evolutiva estimada por la densidad de linajes en una región del morfoespacio (Figura 1). De esta manera es posible reconocer el grado de similitud morfológica por la cercanía de las formas en el morfoespacio y proponer si los linajes de los grupos que se comparan se han conservado en un mismo lugar del morfoespacio.
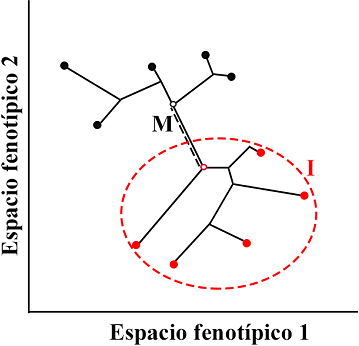
Figura 1 Representación de métricas del filomorfoespacio (modificado de Sidlauskas, 2008). Los espacios fenotípicos representan el morfoespacio, los puntos (negros y rojos) representan la morfología del grupo de especies y las líneas son relaciones de parentesco. M = Magnitud morfológica (línea punteada negra), que define la distancia en el filomorfoespacio entre los nodos ancestrales (círculos sin relleno) de las especies “negras” y “rojas” (Rohlf, 2002, Stone 2003, Sidlauskas 2008); a mayor distancia entre nodos ancestrales, mayor magnitud (cambio) morfológico. I = Innovación morfológica (elipse punteada roja), mide el volumen que ocupa el grupo de especies “rojas” (Sidlauskas 2008); a mayor densidad (volumen), mayor conservación en la forma y menor innovación.
Brickellia (Eupatorieae, Asteraceae) es un género con alrededor de 100 especies, considerado monofilético con base en una filogenia molecular (Schilling et al. 2015a). Muestra una gran variabilidad fenotípica, pero se puede conceptualizar por la presencia de una base del estilo grande (aproximadamente 1 mm de largo), pubescente, un vilano de numerosas cerdas capilares y un número cromosómico base x = 9. La filogenia del género fue elaborada con 85 de las 94 especies reconocidas a la fecha del análisis, identificando nueve grupos (secciones) como monofiléticos (Schilling et al. 2015a, b): B. sección Barroetea (A. Gray) E.E. Schill. & R. Scott, B. sección Brickellia, B. sección Coleosanthus (Cass.) E.E. Schill. & R. Scott., B. sección Gemmipedium B.L. Rob., B. sección Kuhnia (L.) E.E. Schill. & R. Scott, B. sección Leptanthodium B.L. Rob., B. sección Microphyllae (B.L. Rob.) E.E. Schill. & R. Scott, B. sección Phanerostylis (A. Gray) E.E. Schill. & R. Scott y B. sección Xerobrickellia B.L. Rob.
Las secciones definidas en términos moleculares permiten estudiar de manera más eficiente un género tan diverso como Brickellia. Algunas de esas secciones han sido propuestas anteriormente como géneros, que morfológicamente pueden ser reconocidos fácilmente (e.g. Barroetea o Kuhnia) y otras tienen una amplia superposición en sus características morfológicas (Schilling et al. 2015b). Varias de estas secciones fueron establecidas por Robinson (1917), quien utilizó la forma de la hoja de manera preponderante para separarlas; por ejemplo, las secciones Barroetea, Brickellia, Leptanthodium y Xerobrickellia presentan láminas deltoides, con márgenes serrados, aunque las bases son variables. La sección Phanerostylis tiene hojas elíptico-ovadas, base atenuada y margen serrado. Brickellia sección Leptanthodium tiene hojas triangulares, reniformes, base cordada y márgenes dentados a serrados. Por otro lado, la sección Coleosanthus muestra hojas lanceoladas y crenadas, las secciones Gemmipedium y Kuhnia tienen hojas lineares y bases atenuadas, en tanto que la sección Microphyllae presenta hojas reniformes y crenadas (Figura 2, Tabla 1). Se propone que el estudio de la variación foliar de las plantas en un grupo tan diverso como Brickellia permitirá determinar el grado de similitud morfológica entre especies y secciones bajo un contexto taxonómico y filogenético.

Figura 2 Forma principal de la lámina foliar de 25 especies de Brickellia, ordenadas de acuerdo con la filogenia propuesta por Schilling et al. (2015a). A, B, C. Brickellia secc. Xerobrickellia; D. Brickellia secc. Microphyllae; E. Brickellia secc. Gemmipedium; F, G, H. Brickellia secc. Phanerostylis; I, J, K, L, M, N. Brickellia secc. Barroetea; O, P. Brickellia secc. Leptanthodium; Q, R, S. Brickellia secc. Brickellia; T. Brickellia secc. Kuhnia; U, V, W. Brickellia secc. Coleosanthus.
Tabla 1 Ejemplos de la variación de la forma de la lámina foliar, base y margen entre las especies de Brickellia Elliot y géneros relacionados, siguiendo la propuesta de Schilling et al. (2015a).
| Taxon | Forma | Base | Margen |
|---|---|---|---|
| B. secc. Xerobrickellia B.L. Rob. | Deltoide | Atenuada, cordada | Dentado, lobulado |
| B.secc. Microphyllae (B.L.Rob.) E.E. Schill. & R. Scott | Reniforme | Cordada | Crenado |
| B.secc. Gemmipedium B.L. Rob. | Linear | Atenuada | Dentado |
| B. secc. Phanerostylis (A. Gray) E.E. Schill. & R. Scott | Eliptica, ovada | Atenuada | Serrado |
| B. secc. Barroetea (A. Gray) E.E. Schill. & R. Scott | Deltoide, ovada | Atenuada, cordada | Serrado-cuspidado |
| B. secc. Leptanthodium B.L. Rob. | Deltoide | Cordada | Dentado, serrado |
| B. secc. Brickellia | Deltoide | Hastada | Serrado |
| B. secc. Kuhnia (L.) E.E. Schill. & R. Scott | Linear | Atenuada | Semientero |
| B. secc. Coleosanthus (Cass.) E.E. Schill. & R. Scott | Lanceolada | Atenuada, decurrente | Crenado, dentado |
La sección Barroetea fue reconocida originalmente como género, hasta que Turner et al. (1991), con base en un estudio comparativo de las microestructuras de la flor y el fruto (cipsela) entre los géneros Barroetea A. Gray, Brickellia Elliott y Phanerostylis (A. Gray) R.M. King & H. Rob., propusieron su estrecha relación, ubicándolos como un mismo género. Como resultado, circunscriben a los géneros Barroetea y Phanerostylis como grupos de especies herbáceas dentro de Brickellia y realizaron las transferencias taxonómicas correspondientes. Sin embargo, King & Robinson (1987, 1995) discrepan de la propuesta anterior, especialmente por las contrastantes diferencias morfológicas entre ellos y Brickellia, especialmente en la forma de sus hojas y de sus cipselas, manteniéndolos como géneros distintos.
Estudios filogenéticos recientes apoyan la hipótesis de Turner et al. (1991), permitiendo reconocer a Barroetea y Phanerostylis como parte de Brickellia. En particular, el margen con dientes cuspidados en la ahora sección Barroetea se considera como un carácter único de la sección (sinapomorfia), la cual incluye seis especies reconocidas principalmente por presentar diferencias en el largo del peciolo, largo del pedúnculo, largo de la primera bráctea del involucro y número de costillas externas de la cipsela (Morales-Garduño 2022). Observaciones de las hojas en las especies de la sección permite postular su potencial uso para diferenciarlas; sin embargo, esto no se ha probado.
En este estudió se utilizó a la sección Barroetea como un caso de estudio para medir la variación morfológica foliar y llevar a cabo una comparación entre sus especies y con otras especies del género Brickellia. Se utilizó la morfometría geométrica con el fin de expresar la similitud o disimilitud de las formas foliares y su relación con la filogenia. Se postula que un morfoespacio con base en las formas de la hoja permite circunscribir a la sección Barroetea y sus especies. Por otra parte, los diferentes linajes (secciones) de Brickellia se distinguirán con base en un filomorfoespacio.
Materiales y métodos
Ejemplares estudiados. Como parte de Brickellia sección Barroetea, se seleccionaron las seis especies reconocidas en la actualidad (Morales-Garduño 2022). Para comparar entre las secciones de Brickellia se seleccionaron 19 especies (Tabla 2); su selección fue de acuerdo con la disponibilidad del material de herbario, poniendo énfasis en aquellas especies fáciles de determinar con la bibliografía actual, ya que muchos ejemplares tuvieron que ser identificados o re-identificados.
Tabla 2 Secciones del género Brickellia Elliot y especies utilizadas para los análisis morfométricos. N = número de especímenes analizados.
| Sección | Especies | N |
|---|---|---|
| 1. Barroetea | Brickellia brevipes (B. L. Rob.) Morales-Gard., Villaseñor & S. Valencia | 9 |
| Brickellia jimenezii Hinojosa & Cruz-Durán | 8 | |
| Brickellia laxiflora (Brandegee) B.L. Turner | 7 | |
| Brickellia pavonii (A. Gray) B.L. Turner | 17 | |
| Brickellia sonorana B.L. Turner | 3 | |
| Brickellia subuligera (S. Schauer) B.L. Turner | 14 | |
| 2. Brickellia | Brickellia simplex A. Gray | 6 |
| Brickellia grandiflora (Hook.) Nutt. | 5 | |
| Brickellia monocephala B.L. Rob. | 17 | |
| 3. Coleosanthus | Brickellia secundiflora (DC.) A. Gray | 17 |
| Brickellia lemmonii A. Gray | 11 | |
| Brickellia pendula(Schrad.) A. Gray | 13 | |
| 4. Kuhnia | Brickellia scoparia (DC.) A. Gray | 16 |
| 5. Gemmipedium | Brickellia spinulosa (A. Gray) A. Gray | 3 |
| 6. Leptanthodium | Brickellia diffusa (Vahl) A. Gray | 12 |
| Brickellia coulteri A. Gray | 8 | |
| 7. Microphyllae | Brickellia veronicifolia (Kunth) A. Gray | 20 |
| 8. Phanerostylis | Brickellia problematica B.L. Turner | 10 |
| Brickellia pedunculosa (DC.) Harc. & Beaman | 5 | |
| Brickellia coahuilensis (A. Gray) Harc. & Beaman | 7 | |
| 9. Xerobrickellia | Brickellia rhomboidea Greene | 5 |
| Brickellia cardiophylla B.L. Rob. | 5 | |
| Brickellia laciniata A. Gray | 3 | |
| Grupo externo (GE) | Ageratina wrightii (A. Gray) R.M. King & H. Rob. | 11 |
| Carminatia tenuiflora DC. | 14 |
Para la comparación morfológica se seleccionaron como grupo externo dos especies de géneros estrechamente relacionados con Brickellia, Ageratina wrightii (A. Gray) R.M. King & H. Rob. y Carminantia tenuiflora DC. Se revisó y seleccionó el mayor número posible de individuos de las 25 especies analizadas, a partir de los ejemplares depositados en el Herbario Nacional (MEXU) del Instituto de Biología, Universidad Nacional Autónoma de México, así como ejemplares recolectados en trabajo de campo realizado en Guerrero, Oaxaca, Puebla y Querétaro, durante el otoño de 2021. El número mínimo de especímenes por cada especie fue tres, mientras que el máximo fue de 20 ejemplares.
Registro de coordenadas de la forma de la lámina de la hoja. Se seleccionaron para fotografía aquellas hojas que no tuvieran daños estructurales por el proceso de herborización, enfermedades o herbivoría, utilizando en primera instancia imágenes modificadas en Adobe Photoshop CS6 de los ejemplares digitalizados en IBdata (2020) y el resto de los especímenes con ayuda de una cámara fotográfica de celular de 48 Mpx. Cada una de las imágenes fue guardada en un archivo jpg y para despreciar las diferentes distancias a las que fueron tomadas las fotografías se usó una resolución de 1,536 × 2,048 pixeles, con una escala de 1 cm y etiquetadas con un número de catálogo del ejemplar de herbario (o en su caso con el número de recolecta) y especie correspondiente (ej. 535472_Blaxiflora).
Las imágenes fueron usadas para construir un archivo tps con la función ‘Build tps file from image’ del software tpsUtil v. 1.81 (Rohlf 2021); este archivo fue utilizado para definir la ubicación de las marcas con ‘Digitalize landmark’, y las semimarcas en cada imagen con ‘Draw background curves’ para registrar el margen de la lámina foliar. Los puntos equidistantes se obtuvieron indicando la operación ‘Resample curve’, en el software tpsDig2 v.2.31 (Rohlf 2017). Se usaron dos marcas y dos curvas, cada una con 25 semimarcas para comparar el margen de las hojas de las 25 especies analizadas (Figura 3). Las dos marcas homólogas están ubicadas una en la inserción de la lámina foliar con el peciolo y la otra en el ápice de la hoja; las dos curvas constituyen puntos equidistantes en cada margen de la hoja.
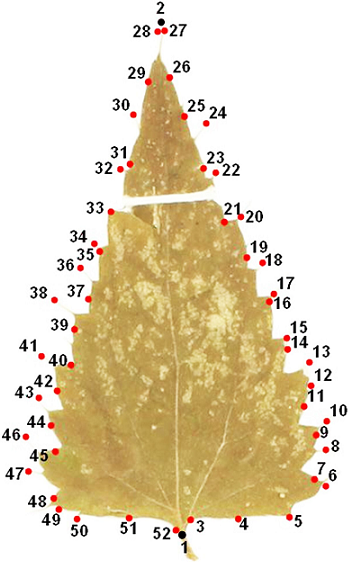
Figura 3 Se ilustra la ubicación de las 2 marcas (puntos negros) y las 50 semimarcas (puntos rojos) utilizadas para analizar cada ejemplar de hoja en el análisis morfométrico
Las coordenadas en el archivo tps se importaron al software R v. 4.3.1 (R Core Team 2023) con ayuda del paquete ‘geomorph’ v. 4.0.5 (Adams & Otárola-Castillo 2013, Baken et al. 2021), usando la función ‘readland.tps’. Se realizó una superposición generalizada de Procrustes con la función ‘gpagen’, requerido para ajustar los valores de las coordenadas de las marcas y eliminar los efectos de rotación, translación y tamaño (Rohlf & Slice 1990). Las semimarcas por otra parte se alinearon minimizando las distancias Procrustes, usando el argumento ‘ProcD = TRUE’ de la función ‘gpagen’. Las variaciones de la forma fueron visualizadas a través de la función ‘plotRefToTarget’ de ‘geomorph’; de esta manera se conocieron las desviaciones existentes entre la forma media de cada especie, sección y la forma consenso de todas ellas.
Con el fin de conocer el efecto del tamaño en la forma, se realizó una regresión multivariada entre las coordenadas Procrustes obtenidas y el tamaño del centroide. Este último se utilizó como una estimación del tamaño de la lámina foliar y se calculó como la raíz cuadrada de la suma de las distancias al cuadrado de cada marca y semimarca con el centroide de la forma (Bookstein 1991, Zelditch et al. 2004). Este análisis se realizó mediante la función ‘procD.lm’ de ‘geomorph’.
Morfoespacio. Se realizó un análisis de variables canónicas (CVA) para probar si existen diferencias significativas entre la forma de la lámina de la hoja de las seis especies de Brickellia secc. Barroetea y de las nueve secciones comparadas; sin embargo, en este análisis se excluyó a Brickellia secc. Gemmipedium, dado el poco material disponible.
El análisis linear discriminante se llevó a cabo por medio de la función ‘CVA’ del paquete ‘Morpho’ v 2.11 de R (Schlager et al. 2021). Su resultado se muestra como ejes de variables canónicas o eigenvalores (VC), que se calculan maximizando la distancia promedio de los grupos. Cada VC representa una proporción de la variabilidad morfológica de los grupos y va disminuyendo hasta el último par de promedios más cercanos; generalmente los últimos ejes se consideran no significativos (McGarigal et al. 2013, De Luna 2020). La ubicación de los vectores propios (eigenvectors) indican la distancia entre las formas en cada VC; a mayor distancia mayor disimilitud (McGarigal et al. 2013). El análisis estima la similitud promedio entre grupos mediante la distancia de Mahalanobis con sus valores P asociados, distancia que es favorable para datos multivariados, en comparación con la distancia Euclidiana, pues tiene la ventaja de eliminar la correlación entre variables a partir de la rotación de los ejes (McGarigal et al. 2013). Se documentaron los eigenvalores y eigenvectores de cada VC con las cuales se elaboraron gráficas, que incluyen resultados de frecuencias y porcentajes de clasificación por el método de validación cruzada. Este último es un método iterativo que se inicia empleando como conjunto de entrenamiento todas las observaciones disponibles excepto una, que se excluye para emplearla como validación (McGarigal et al. 2013). Con el análisis fue posible conocer si la forma de la hoja es útil como carácter taxonómico para diferenciar entre especies, además de determinar el porcentaje de ejemplares que no están correctamente clasificados.
Filogenia molecular. Para elaborar el filograma utilizado en los análisis del filomorfoespacio, se empleó el conjunto de secuencias de las especies analizadas, previamente publicadas en la filogenia molecular de Brickellia (Schilling et al. 2015a). Se incluyeron marcadores moleculares de tres regiones relativamente variables del espaciador transcrito interno ribosómico nuclear (ITS), del espaciador transcrito externo (ETS) y del espaciador psbA-trnH del plastidio. De todos ellos sólo el ETS para las dos terminales del grupo externo no está disponible.
Cada marcador se alineó independientemente con ayuda del programa MAFFT v. 7 (Katoh et al. 2019). La selección de modelos evolutivos para cada marcador se especificó con base en los comandos ‘showmodel’ y ‘automodel’ del programa PAUP v. 4 (Swofford 2003) y el criterio de información de Akaike (Akaike 1974). Se asignaron los modelos evolutivos en una matriz particionada, para el marcador ETS se usó TrN + G, para el marcador ITS se ocupó HKY85 + G y para el marcador del cloroplasto psb-A se utilizó TVM + G. Posteriormente, las secuencias de las 25 especies fueron concatenadas en una sola matriz en formato FASTA con ayuda del programa Mesquite v. 3.61 (Maddison & Maddison 2019).
La búsqueda del árbol filogenético óptimo se realizó por inferencia Bayesiana en el programa MrBayes v. 3.2.7 (Ronquist et al. 2012). Se realizaron dos corridas independientes con tres cadenas calientes y una fría. La estabilidad de las cadenas de Markov Monte Carlo y los tamaños de muestra efectivos se visualizaron en Tracer v. 1.7 (Rambaut 2018). Se eliminaron como burn-in 25 % de los primeros árboles durante 10 millones de generaciones en cada caso y se muestrearon las probabilidades posteriores cada 1,000 generaciones. El árbol obtenido fue editado en el programa FigTree v. 1.4.4 (Rambaut 2018). El árbol de consenso de mayoría (50 %) del archivo tre obtenido del programa MrBayes se utilizó para elaborar el gráfico del filomorfoespacio; por otro lado, se usaron 9,900 árboles muestreados después del 25 % de árboles eliminados del archivo “.run1.t” para evaluar las tendencias evolutivas en el filomorfoespacio por el método de Sidlauskas (2008).
Filomorfoespacio. Con las especies incluidas en la Tabla 2 se obtuvieron las métricas de magnitud e innovación morfológica utilizando el script modificado de Sidlauskas (2008). Este método compara métricas por pares de linajes, por lo que el primer paso para generar el filomorfoespacio fue delimitar con el árbol de consenso de mayoría, seis linajes principales dentro del género Brickellia para buscar las diferencias en magnitud e innovación en todo el género, haciendo énfasis en la sección Barroetea. De esta manera, las comparaciones se hicieron entre los principales linajes, desde el linaje ancestral hasta los de reciente divergencia del árbol filogenético (Figura 4). La primera comparación fue entre Brickellia secc. Xerobrickellia (linaje A) y las demás secciones del género Brickellia (linaje B); la segunda fue entre las secciones Gemmipedium, Microphyllae, Phanerostylis (linaje C), Barroetea, Brickellia, Coleosanthus, Kuhnia y Leptanthodium (linaje D); por último, se compararon solamente las secciones Barroetea (linaje E), Brickellia, Coleosanthus, Kuhnia y Leptanthodium (linaje F).

Figura 4 Filogenia del género Brickellia obtenida con los datos de Schilling et al. (2015a). Las letras localizadas en los nodos indican los linajes utilizados para aplicar el método del filomorfoespacio de Sidlauskas (2008).
Para obtener las métricas macroevolutivas del filomorfoespacio de los datos generados se utilizaron los largos de rama medias conseguidas a partir del muestreo de los 9,900 árboles filogenéticos post-burn-in, que representó la tasa de cambio molecular por evento de especiación para cada uno de los linajes. Los vectores propios (eigenvectores) de los primeros cuatro componentes principales (que conformaron 91 % de la varianza total), se usaron como el morfoespacio de las formas medias de las ramas y los ancestros de los linajes comparados. Los eigenvectores se obtuvieron por medio de la función ‘gm.prcomp’ del paquete ‘geomorph’ con argumentos estándar basados en mínimos cuadrados ordinarios.
Los datos en conjunto permiten conocer la magnitud e innovación morfológica entre linajes adyacentes en los árboles filogenéticos de Brickellia. La magnitud se calcula con la distancia que existe entre la forma ancestral de cada par de linajes definidos; a mayor distancia mayor cambio morfológico. Por su parte, la innovación se mide a partir de la densidad que ocupa cada linaje en el filomorfoespacio, desde la forma ancestral hasta las formas de las ramas, a mayor densidad menor innovación morfológica, es decir, mayor es la conservación de la forma (ver Figura 1).
Para evaluar la probabilidad de generar aleatoriamente los valores observados, se compararon los valores de las simulaciones obtenidas con un modelo browniano nulo (trayectoria aleatoria). Este modelo tiene como hipótesis morfológica que los descendientes son más similares a sus ancestros; en contraste, modelos estabilizadores, como el de Ornstein-Uhlenbeck consideran que las formas de los descendientes no son necesariamente más similares a las de los ancestros (Blomberg et al. 2003).
Para realizar las simulaciones, se utilizaron los valores de información filogenética disponibles (Schilling et al. 2015a), como la tasa de diversificación (lambda, λ), de extinción (mu, μ) y de diversificación neta (rho, ρ), que generaron los largos de rama media simulados para los linajes establecidos y se obtuvieron mediante una función desarrollada por Sidlauskas (2008). Por otra parte, se manejaron los valores singulares de forma de la matriz de componentes principales para establecer la varianza esperada para cada eje del morfoespacio simulado y generar vectores propios simulados mediante la función ‘sim.char’ del paquete ‘geiger’ v. 2.0.1 (Harmon et al. 2008); esta función permite conocer las posiciones de los linajes y sus ancestros en el morfoespacio bajo un modelo Browniano. Las métricas fueron elaboradas mediante el script modificado de Sidlauskas (2008), disponible en el Material suplementario 1 y su interpretación se hizo siguiendo al autor (ver Material suplementario 2 donde se anexa la tabla de interpretaciones posibles).
El gráfico del filomorfoespacio de los primeros cuatro componentes principales se elaboró con la función ‘phylomorphospace’ del paquete ‘phytools’ v. 1.5 (Revell 2012), la cual utiliza los valores obtenidos por el método de Sidlauskas (2008). Las interpretaciones se basan en tendencias evolutivas como las que sugieren Adams & Collyer (2019). Todos los análisis de este apartado se llevaron a cabo en R.
Señal filogenética. Para probar la hipótesis de que las especies más estrechamente relacionadas morfológicamente se parecen entre sí, debido a la herencia de características de sus ancestros más recientes (Modelo Browniano), se utilizó una prueba de señal filogenética para fenotipos multivariados (Blomberg et al. 2003, Adams & Collyer 2019). Esta prueba cuantifica la cantidad de variación en la matriz de datos con relación a un muestreo aleatorio de valores fenotípicos (Adams & Collyer 2019); para ello se utilizó la función ‘physignal’ de ‘geomorph’ (Adams & Otarola-Castillo 2013, Baken et al. 2021). Para evaluar su significancia se realizó una prueba de permutación (9,999 iteraciones) que aleatorizó los datos en las puntas de la filogenia; esto se llevó a cabo en R. El valor K indica la evolución del carácter según el modelo browniano, cuando K > 1 indica una fuerte señal filogenética, lo que significa que el rasgo se conserva a lo largo de la filogenia (los parientes cercanos son más similares). Por otro lado, sí el valor K está cerca de 0, no indica señal filogenética (el rasgo ha evolucionado independientemente de la filogenia y los parientes cercanos no son más similares que los parientes lejanos).
Resultados
Registro de coordenadas de la forma de la hoja. Se tomaron fotografías de 248 hojas de diferentes ejemplares correspondientes a las 25 especies analizadas y los nueve grupos asignados previamente (Tabla 2). Las coordenadas utilizadas para los análisis de la caracterización de la forma de las láminas se pueden consultar en el Material suplementario 3. La regresión multivariada registró una baja relación (33 %) entre la forma y el tamaño de las hojas de Brickellia en todo el conjunto de datos (P = 0.002).
Morfoespacio. El CVA centrado en la sección Barroetea resaltó cinco funciones discriminantes como importantes (Material suplementario 4); la Figura 5 ilustra las primeras dos funciones, que explican 67.6 % del total de la varianza. Las pruebas por pares de la distancia de Mahalanobis indicó que en casi todas las especies existen diferencias significativas entre las formas foliares de las especies de esta sección, excepto para Brickellia sonorana que no presentó diferencias significativas cuando se compara con B. brevipes, B. jimenezii y B. subuligera (Tabla 3). La clasificación de los especímenes en su especie correspondiente tuvo un éxito de 100 % en casi todos los ejemplares asignados, excepto cinco, dos de ellos asignados a B. subuligera y uno de B. brevipes, B. jimenezii, y B. pavonii (Tabla 4).

Figura 5 Morfoespacio de la variación de la forma de la lámina foliar entre las especies de Brickellia sección Barroetea. CV = Variable canónica.
Tabla 3 Diferencias en el CVA para las distancias de Mahalanobis entre pares de especies de Brickellia sección Barroetea (A. Gray) E.E. Schill. & R. Scott estudiadas. La significancia se asignó en función de los valores P de las pruebas de permutación (10000 permutaciones) como sigue: P > 0.05, NS (no significativa); 0.01 < P ≤ 0.05, *; P ≤ 0.01, **.
| Taxones | B. brevipes | B. jimenezii | B. laxiflora | B. pavonii | B. sonorana | B. subuligera |
|---|---|---|---|---|---|---|
| B. brevipes | 0 | |||||
| B. jimenezii | 5.80 ** | 0 | ||||
| B. laxiflora | 6.12 ** | 8.26 ** | 0 | |||
| B. pavonii | 4.81 ** | 4.82 * | 7.49 ** | 0 | ||
| B. sonorana | 6.79 NS | 6.77 NS | 9.33 ** | 7.00 * | 0 | |
| B. subuligera | 6.00 ** | 4.70 * | 8.20 ** | 5.13 ** | 5.84 NS | 0 |
Tabla 4 Porcentaje de ejemplares clasificados positivamente por el método de validación cruzada, de Brickellia sección Barroetea (A. Gray) E.E. Schill. & R. Scott.
| Taxones | B. brevipes | B. jimenezii | B. laxiflora | B. pavonii | B. sonorana | B. subuligera |
|---|---|---|---|---|---|---|
| B. brevipes | 99.89 | 0 | 0 | 0.11 | 0 | 0 |
| B. jimenezii | 0 | 99.89 | 0 | 0.11 | 0 | 0 |
| B. laxiflora | 0 | 0 | 100 | 0 | 0 | 0 |
| B. pavonii | 0 | 0.11 | 0 | 99.89 | 0 | 0 |
| B. sonorana | 0 | 0 | 0 | 0 | 100 | 0 |
| B. subuligera | 0 | 0 | 0 | 0 | 0.22 | 99.78 |
La comparación entre la sección Barroetea y las demás secciones permitió detectar como importantes ocho funciones discriminantes del CVA (Material suplementario 4), las cuales fueron graficadas para conocer la máxima varianza entre cada grupo (Figura 6). La comparación entre las variables canónicas y por pares, usando la prueba de permutación con la distancia de Mahalanobis, indicó que existen diferencias significativas entre algunas de las secciones analizadas (Tabla 5).

Figura 6 A. Morfoespacio de la variación de la forma de lámina de la hoja entre las secciones de Brickellia por pares de variables canónicas; B. Láminas de cada sección discriminada por cada variable canónica. CV = Variable canónica.
Tabla 5 Diferencias por pares del CVA entre las secciones de Brickellia Elliot. P de las pruebas de permutación (10,000 permutaciones) como sigue: P > 0.05, NS (no significativa); 0.01 < P ≤ 0.05, *; P ≤ 0.01, **. EG = grupo externo, Barr = Brickellia secc. Barroetea, Bric = Brickellia secc. Brickellia, Cole = Brickellia secc. Coleosanthus, Kuhn = Brickellia secc. Kuhnia, Lept = Brickellia secc. Leptanthodium, Micr = Brickellia secc. Microphyllae, Phan = Brickellia secc. Phanerostylis, Xero = Brickellia secc. Xerobrickellia.
| Taxones | Barr | Bric | Cole | EG | Kuhn | Lept | Micr | Phan | Xero |
|---|---|---|---|---|---|---|---|---|---|
| Barr | 0 | ||||||||
| Bric | 5.44 NS | 0 | |||||||
| Cole | 5.08 NS | 5.15 NS | 0 | ||||||
| EG | 5.35 NS | 5.66 NS | 5.37 NS | 0 | |||||
| Kuhn | 30.21 ** | 30.54 ** | 30.11 ** | 30.27** | 0 | ||||
| Lept | 5.63 NS | 5.36 NS | 6.36 NS | 5.44 NS | 30.72** | 0 | |||
| Micr | 9.24 ** | 8.37 * | 8.84 * | 6.95 NS | 30.33 ** | 8.92 * | 0 | ||
| Phan | 7.17 * | 5.49 NS | 5.73 NS | 5.4 NS | 29.57 ** | 6.68 NS | 6.68 NS | 0 | |
| Xero | 5.63 NS | 6.01 NS | 6.12 NS | 6.03 NS | 30.46 ** | 5.51 NS | 9.21 NS | 7.36 NS | 0 |
Las láminas foliares de las especies de la sección Barroetea mostraron diferencias significativas con las secciones Kuhnia (eigenvector = 30.21), Microphyllae (eigenvector = 9.24) y Phanerostylis (eigenvector = 7.17); en la VC2 se observó la separación de la sección Barroetea (Figura 5). Por su parte, la sección Brickellia presentó diferencias significativas sólo con Kuhnia (eigenvector = 30.54) y Microphyllae (eigenvector = 8.37) y es apreciable su aislamiento en las CV3 y CV4. La sección Phanerostylis registró diferencias significativas con respecto a Barroetea (eigenvector = 7.17) y Kuhnia (eigenvector = 29.57), como se observa en los ejes CV1 vs CV2. Las otras diferencias de cada sección se muestran en la Tabla 5 y la Figura 6. Se destaca que la sección Kuhnia es la única que presenta diferencias significativas con respecto a las demás secciones analizadas y se separa en el lado positivo de la gráfica CV1 vs CV2 (Figura 6A). Las varianzas de las hojas en las CV7 vs CV8 no se incluyeron en la Figura 6, debido a que no resultaron significativas para estas CV (1.19 y 1.14 % de varianza, respectivamente); además, las comparaciones mostradas lograron discriminar parcialmente las nueve secciones analizadas.
La clasificación correcta de las hojas de los ejemplares analizados tuvo un éxito de más del 80 %. Cada sección se clasificó positivamente de acuerdo con el método de validación cruzada. Las secciones Barroetea y Brickellia registraron más del 95 % de sus láminas foliares bien clasificadas, mientras que la sección Phanerostylis tuvo 86.4 %; los demás porcentajes de identificación positiva por sección se muestran en la Tabla 6, donde la columna “Ninguno” añade aquellas hojas que no pudieron ser clasificadas bajo ningún grupo reconocido a priori.
Tabla 6 Porcentaje de ejemplares clasificados positivamente por el método de validación cruzada de las secciones de Brickellia Elliot. EG = grupo externo, Barr = Brickellia secc. Barroetea, Kuhn = Brickellia secc. Kuhnia, Bric = Brickellia secc. Brickellia, Cole = Brickellia secc. Coleosanthus, Lept = Brickellia secc. Leptanthodium, Micr = Brickellia secc. Microphyllae, Phan = Brickellia secc. Phanerostylis, Xero = Brickellia secc. Xerobrickellia. La columna “Ninguno” añade aquellas láminas foliares que no pudieron ser clasificadas bajo ningún grupo a priori reconocido.
| Taxones | Barr | Bric | Cole | EG | Kuhn | Lept | Micr | Phan | Xero | Ninguno |
|---|---|---|---|---|---|---|---|---|---|---|
| Barr | 98.4 | 1.6 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Bric | 3.6 | 96.4 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Cole | 0 | 4.9 | 90.2 | 2.5 | 0 | 0 | 0 | 0 | 0 | 2.4 |
| EG | 0 | 4 | 0 | 80 | 0 | 0 | 0 | 0 | 4 | 12 |
| Kuhn | 0 | 0 | 0 | 0 | 93.7 | 0 | 0 | 0 | 0 | 6.3 |
| Lept | 0 | 5 | 0 | 0 | 0 | 85 | 0 | 0 | 0 | 10 |
| Micr | 0 | 0 | 0 | 0 | 0 | 0 | 95 | 5 | 0 | 0 |
| Phan | 0 | 0 | 0 | 4.5 | 0 | 0 | 0 | 86.4 | 0 | 9.1 |
| Xero | 0 | 0 | 0 | 0 | 0 | 7.7 | 0 | 0 | 92.3 | 0 |
Filomorfoespacio. Los linajes se superponen en los cuatro primeros componentes principales, observándose una concentración de las secciones en todos los componentes hacia una sola área de los ejes del morfoespacio, con excepción de las secciones Gemmipedium, Kuhnia y Microphyllae (Figura 7). La variación en la forma de la lámina de la hoja se observa en los componentes principales, la cual va de formas ovadas (Ageratina wrightii, Brickellia sección Phanerostylis) a reniformes (secciones Leptanthodium y Microphyllae) hacia los ejes X negativos, a deltoides (Carminatia tenuiflora, secciones Barroetea, Brickellia, Leptanthodium y Xerobrickellia) y lanceoladas (sección Coleosanthus) hacia la región central de los ejes X; hacia la parte positiva, las formas dominantes son elípticas (sección Phanerostylis) a lineares (secciones Gemmipedium y Kuhnia).

Figura 7 Filogenia de las 23 especies de Brickellia con las formas medias de las láminas de las hojas de cada sección taxonómica. Al lado de la filogenia se muestran los filomorfoespacios considerando los primeros cuatro componentes principales de la forma de las láminas foliares.
La evaluación de la magnitud de cambio morfológico observado y simulado de los linajes principales en el género Brickellia (Tabla 7), indicó que el linaje A (Xerobrickellia) y B (las demás secciones de Brickellia) muestran largos de rama media similares (largos de rama: 4.01 ≈ 4.48); sin embargo, estos son significativamente diferentes a la simulación (largos de rama: 0.89 ≠ 0.02). El linaje C (secciones Gemmipedium, Microphyllae y Phanerostylis) registró una mayor magnitud de cambio morfológico observado en el largo de sus ramas (largos de rama: 7.27 > 3.82) en comparación con el linaje D (secciones Barroetea, Brickellia, Coleosanthus, Kuhnia y Leptanthodium); en este caso, los largos de rama son significativamente similares a lo simulado (largos de rama: 1.9 ≈ 1.13). Por último, los linajes E (Barroetea) y F (Brickellia, Coleosanthus, Kuhnia y Leptanthodium) presentaron diferencias en las magnitudes de cambio morfológico entre sus ramas, siendo el linaje E el que tuvo menor magnitud observada en comparación con el linaje F (largos de rama: 1.4 < 5.6); por otra parte, los largos de rama obtenidos por simulación mostraron valores observados diferentes, pero no significativamente (largos de rama: 0.24 ≠ 0.39). Para estos linajes en particular, es probable que las tasas de diversificación, de extinción y de diversificación neta son significativamente diferentes.
Tabla 7 Magnitudes medias de cambio morfológico y desviaciones estándar de las longitudes de las ramas observadas y simuladas en Brickellia Elliot, bajo un modelo browniano nulo, utilizando el método de Sidlauskas (2008). P es la significancia de la proporción observada en comparación con la distribución de proporciones de cada uno de los 1,000 árboles elaborados por simulaciones. Los linajes se describen en la Figura 4.
| Linaje | Largos de rama media observada | Comparación | Proporción de largos de ramas medias observadas | Proporción de largos de ramas medias de simulaciones | Valor P |
|---|---|---|---|---|---|
| A | 4.01 ± 0.3 | A vs B | 0.89 ± 0.1 | 0.02 ± 0.14 | 0.008 |
| B | 4.48 ± 0.05 | ||||
| C | 7.27 ± 0 | C vs D | 1.9 ± 0.03 | 1.13 ± 0.42 | 0.046 |
| D | 3.82 ± 0.07 | ||||
| E | 1.4 ± 0.006 | E vs F | 0.24 ± 0.005 | 0.99 ± 0.39 | 1 |
| F | 5.6 ± 0.1 |
La innovación morfológica (Tabla 8) no se pudo calcular para el linaje A, debido a que presentó valores colineales y no fue posible calcular un volumen; por lo tanto, se excluyó su comparación con el linaje B (Figura 7). El linaje C (secciones Gemmipedium, Microphyllae y Phanerostylis) registró una menor innovación morfológica (densidad de linajes: 0.39 > 0.006) en comparación con el linaje D (Barroetea, Brickellia, Coleosanthus, Kuhnia y Leptanthodium), las simulaciones muestran valores diferentes. De manera similar ocurre para los linajes E (Barroetea) y F (Brickellia, Coleosanthus, Kuhnia y Leptanthodium), donde el linaje E (densidad de linajes: 2.7 > 0.005) presenta una menor innovación morfológica en comparación con el linaje F, aunque las simulaciones muestran valores diferentes. En ambos casos se puede sugerir que al menos uno de los linajes ha evolucionado de una forma alternativa al modelo browniano.
Tabla 8 Medias y desviaciones estándar de densidades de linajes observadas y simuladas bajo un modelo browniano nulo en Brickellia Elliot, utilizando el método de Sidlauskas (2008). P es la significancia de la proporción observada en comparación con la distribución de proporciones de cada uno de los 1,000 árboles elaborados por simulaciones. Los linajes se describen en la Figura 4.
| Linaje | Media de la densidad de linaje observada | Comparación | Proporción de las medias de densidades de linajes observadas | Proporción de las medias de densidades de linajes en las simulaciones | Valor P |
|---|---|---|---|---|---|
| A | NA | A vs B | NA | NA | NA |
| B | 0.002 ± 0 | ||||
| C | 0.39 ± 0 | C vs D | 0.016 ± 0 | 0.18 ± 0.33 | 0.81 |
| D | 0.006 ± 0 | ||||
| E | 2.7 ± 0.01 | E vs F | 0.002 ± 0 | 0.54 ± 1.05 | 0.99 |
| F | 0.005 ± 0 |
Señal filogenética. El estadístico K reveló que, bajo un modelo de evolución Browniano, no existe una conservación en las formas foliares de Brickellia de manera significativa (K = 0.3752, P = 0.0074); por lo tanto, se postula que evolucionaron independientemente de la filogenia y los descendientes no son tan similares a sus ancestros.
Discusión
Los resultados del CVA sugieren que la mayoría de los ejemplares de las especies de Brickellia sección Barroetea son reconocibles por su forma foliar. Esta sección se caracteriza por la forma deltoide de sus hojas, aunque en Brickellia jimenezii y B. subuligera son un poco más angostas en comparación con las demás especies; sus bases son atenuadas (excepto en B. pavonii que es cordada) y su margen es serrado, aunque en Brickellia sonorana los dientes son un poco más separados. No se realizaron pruebas posteriores para corroborar si la forma de las hojas puede ser de utilidad en la delimitación de las especies, pero con base en la experiencia es posible hacer esta distinción. Sin embargo, existen otros caracteres que al parecer tienen mayor peso como apoyo para su delimitación, como los largos del peciolo, del pedúnculo, de la primera bráctea del involucro y el número de costillas de la cipsela (Morales-Garduño 2022). Morello et al. (2018), en un estudio sobre variación de la forma foliar en especies de Oxalis sección Alpinae utilizando elípticas de Fourier, reportaron divergencia en las formas, aunque su análisis de variables canónicas no les permitió clasificar exitosamente las especies, lo cual aquí sí fue posible para la mayoría de los especímenes analizados.
Las variables canónicas del CVA indican que, en promedio, las formas de las láminas foliares de la sección Phanerostylis son diferentes a las de Barroetea. Lo anterior es relevante, pues si se considerara toda su morfología, estas secciones probablemente ocupan un morfoespacio similar, ya que comparten una forma de crecimiento herbáceo (carácter también compartido con la sección Leptanthodium) y la forma comprimida de las cipselas. Tomando en cuenta lo anterior, ambos estados de carácter probablemente sean resultado de una convergencia, pues no comparten un ancestro en común (Schilling et al. 2015a, b).
Por otro lado, las secciones Barroetea y Brickellia presentan sólo diferencias con las secciones Kuhnia y Microphyllae. Gráficamente tanto en el CVA como en los filomorfoespacios, los linajes se traslapan, aunque de manera cuantitativa las distancias de Mahalanobis registraron diferencias significativas entre las secciones Kuhnia, Microphyllae y Phanerostylis. Robinson (1917) señala a la forma de la hoja en el género Brickellia como un carácter práctico para separar la sección Bulbostylis, así como otros grupos que ahora son reconocidos como secciones (Schilling et al. 2015b). Con base en los resultados, sólo es posible reconocer dos secciones como diferentes de las otras secciones de Brickellia. Estas son la sección Kuhnia con hojas lineares y semienteras y Microphyllae con hojas cordadas, reniformes y crenadas. Desde un punto de vista taxonómico, los resultados apoyan el uso de la forma foliar en la circunscripción de las secciones de Brickellia.
La comparación en las magnitudes de cambio morfológico permite reconocer que las secciones Gemmipedium, Microphyllae y Phanerostylis (linaje C) mostraron un mayor cambio morfológico en comparación con Barroetea, Brickellia, Coleosanthus, Kuhnia y Leptanthodium (linaje D). Se puede inferir que las formas foliares de las últimas secciones son más conservadas por presentar un menor cambio morfológico. Probablemente estas desigualdades en la magnitud de cambio morfológico del linaje C, sea la respuesta a la presión ambiental ocasionada por los eventos de sequía durante su diversificación en el Mioceno (Ramírez-Arriaga et al. 2014, Stull 2023); la mayoría de las especies actuales del linaje prosperan en zonas áridas o semiáridas, mientras que las especies del linaje D (excepto Kuhnia) se distribuyen en zonas templadas o tropicales, ambientes al parecer menos estresantes para la mayoría de las plantas (Stebbins 1952). Los resultados apoyan la hipótesis de una migración de Brickellia hacia el sur, siguiendo el enfriamiento de las temperaturas después del Mioceno (Stull 2023).
Diversos estudios proponen que la orografía juega un papel importante en la diversificación de taxones (Sosa & Loera 2017, Carrasco-Ortiz et al. 2019). Es de esperar que las formas foliares se diversifiquen también como respuesta a esta variación orográfica; sin embargo, la morfología de las láminas foliares más bien conserva su forma en el filomorfoespacio, como ocurre por ejemplo en el linaje D, con una contrastante diversidad taxonómica y distribuido en diversos ambientes geográficos. Algo parecido ocurre en Poaceae, donde la mayoría de las especies con hojas lineares (Gallaher et al. 2019) se observan en ambientes abiertos y secos, mientras que un número menor de especies tiene formas ovadas o lanceoladas, con afinidades centradas más bien en ambientes templados y boscosos. La hipótesis de que a mayor diversidad de especies mayor cantidad de formas no es sustentada por los resultados obtenidos; por ejemplo, el linaje C contiene un menor número de especies (19 especies, Schilling et al. 2015b) pero muestra un cambio morfológico mayor, ocupando más regiones del morfoespacio y del filomorfoespacio que el linaje D (64 especies, Schilling et al. 2015b). Probablemente la orografía influya de manera importante en la diversificación, pero al parecer las formas foliares en las plantas no parecen responder a su influencia, tal y como los resultados en Brickellia y Poaceae sugieren.
La divergencia temprana del linaje C en el árbol filogenético y un cambio morfológico mayor es un patrón similar al observado en animales, donde las especies que están más relacionados a linajes de divergencia temprana muestran un cambio morfológico mayor en comparación con los de ramas más recientemente derivadas (Oyston et al. 2016, López-Estrada et al. 2019) En plantas se han evaluado grandes linajes con ayuda de caracteres discretos de las flores y se han obtenido resultados similares a los aquí encontrados como en animales (Chartier et al. 2014, Oyston et al. 2016, López-Martínez et al. 2022).
La sección Barroetea mostró una menor magnitud morfológica en comparación con su linaje hermano, conformado por las secciones Brickellia, Coleosanthus, Kuhnia y Leptanthodium. Estas diferencias en magnitud no son significativas bajo el modelo browniano, es probable que la evolución morfológica de estos linajes haya sido distinta a la elegida en el presente estudio. Análisis futuros en las secciones Brickellia, Coleosanthus, Kuhnia y Leptanthodium, utilizando otros modelos evolutivos alternativos como el modelo Ornstein‐Uhlenbeck (Cooper et al. 2016), probablemente sugieran que, al ampliar el número de especies de las secciones del linaje F, los resultados de la evolución foliar comprueben una magnitud mayor entre las otras secciones y una baja innovación morfológica.
La evaluación de la innovación morfológica permite reconocer el traslape de linajes, como se observa de manera gráfica en los filomorfoespacios (Figuras 1, 7). Los resultados sugieren que la forma deltoide de la lámina foliar es conservada por el traslape en el filomorfoespacio, comportándose como un estado de carácter plesiomórfico en la mayoría de los linajes, excepto en las secciones Gemmipedium y Kuhnia. La señal filogenética con los datos evaluados no apoya una hipótesis de conservación de la forma, y la comparación por linajes muestra una conservación morfológica, aunque está no es significativa.
Nuevos estudios taxonómicos y morfométricos en Brickellia seguramente ayudarán a evaluar mejor las preguntas macroevolutivas, lo que permitirá corroborar la robustez de los resultados obtenidos en este estudio. Es probable que la topología del árbol reportado por Schilling et al. (2015a) se mantenga, dado el buen muestreo taxonómico utilizado para generarlo. Los análisis aquí mostrados tomaron en cuenta un pequeño grupo de especies, elegidos por su disponibilidad y fácil reconocimiento; cuando se tenga un muestreo taxonómico más completo, es probable que la variación morfológica, considerando la forma foliar, esté mejor representada en algunas secciones como Microphyllae y Coleosanthus. Sin embargo, se postula que las tendencias morfológicas no cambien a nivel de sección, por lo que no se esperan cambios considerables con respecto a los resultados aquí obtenidos. Sería interesante evaluar los patrones morfológicos de un morfoespacio de las especies de Brickellia para otros caracteres, como hábito, arquitectura foliar, forma de la primera bráctea del involucro o forma de las cipselas, donde las secciones probablemente se distingan mucho mejor tanto en el morfoespacio como el filomorfoespacio.
En este estudio se utilizaron para el análisis dos marcas homólogas y 52 semimarcas; es importante considerar que las marcas como la inserción de la lámina y el pecíolo pueden tener patrones evolutivos y de desarrollo distintos cuando se comparan taxones con diferentes orígenes evolutivos (Jensen 2003). Por consiguiente, es necesario ubicar puntos de referencia en las hojas que puedan ser utilizados de manera sistemática en estudios posteriores, sobre todo si se pretende comparar la evolución de las láminas foliares en las plantas con flores, o incluso ser usados para elaborar su reconstrucción filogenética (De Luna 2020).
Algunos de los problemas del uso de la morfometría geométrica en las hojas fueron discutidos por Cope et al. (2012). Para ellos, la variabilidad en formas, márgenes y arquitectura foliar es un reto, especialmente cuando se pretenden reconocer puntos homólogos. El reto es debido a que los únicos puntos homólogos en todas las especies son el ápice y el punto de inserción de la lámina con el pecíolo (excluyendo plantas con hojas peltadas). No obstante, la morfometría geométrica tiene la ventaja de caracterizar cuantitativamente las formas y utilizarlas para relacionar el fenotipo con la filogenia y al mismo tiempo con otros procesos biogeográficos, evolutivos, genéticos y ecológicos, como lo discuten Esquerré et al. (2020), Hughes et al. (2022) o Jardine et al. (2022).
Una sugerencia para estudios futuros es enfocarse sólo en la arquitectura foliar, principalmente en el inicio y final de las venas primarias y secundarias. También podría usarse el margen, uniformizando el número de semimarcas para que los estudios sean comparables. Se invita a realizar estudios con las hojas a nivel interespecífico, comparando secciones, complejos taxonómicos o subgéneros, para evaluar su poder taxonómico en las clasificaciones actuales y sus relaciones macroevolutivas.
Los patrones morfológicos observados en el morfoespacio y el filomorfoespacio son congruentes; esto nos ayuda a concluir que las especies de Brickellia sección Barroetea pueden diferenciarse sólo conociendo la forma foliar. Brickellia presenta en la mayoría de sus secciones formas foliares ovado-deltoideas, comunes entre las especies evaluadas de las secciones Barroetea, Brickellia, Coleosanthus, Leptanthodium y Xerobrickellia, pero diferentes en Phanerostylis, donde son ovadas o elípticas, Gemmipedium y Kuhnia con formas lineares y en Microphyllae que son reniformes. Por lo tanto, con base en la evaluación de la forma aquí propuesta, el postulado de que Brickellia sección Barroetea puede ser diferenciada de las demás secciones no se cumple, aunque se destaca su importancia dentro de la sección.
El filomorfoespacio gráficamente muestra un traslape de las secciones analizadas, lo que sugiere una conservación de la forma deltoide en las láminas foliares, observándose más en los linajes más derivados. Bajo el modelo Browniano y los resultados de las métricas del filomorfoespacio, las secciones Gemmipedium, Microphyllae y Phanerostylis, muestran un cambio morfológico mayor, en comparación con las secciones Barroetea, Brickellia, Coleosanthus, Kuhnia y Leptanthodium. Desafortunadamente los resultados de las métricas a nivel de linajes y con el modelo utilizado no confirman fehacientemente si la innovación morfológica entre los linajes principales de Brickellia sean diferentes, ni corroboran estadísticamente su traslape en el filomorfoespacio. La señal filogenética permitió reconocer que con los datos analizados las formas foliares probablemente evolucionaron de manera independiente de la filogenia y que aquellas de los descendientes no son similares a la de los ancestros, es decir, no siguen un modelo Browniano.
Material Suplementario
El material suplementario puede ser accesado aquí: https://doi.org/10.17129/botsci.3350
Material suplementario 1, 2, 3 y 4.











 nueva página del texto (beta)
nueva página del texto (beta)



