El estudio de la biología reproductiva en plantas ha mostrado como patrón consistente que un alto porcentaje de especies de diversas familias de angiospermas producen muchas más flores y óvulos de los que se convierten en frutos y semillas, respectivamente (Augspurger 1980, Kearns & Inouye 1993, Burd 1994, Larson & Barrett 2000, Jackson et al. 2022). Para explicar este patrón se han generado numerosas hipótesis relacionadas con factores como la biología floral de las especies (e.g., la expresión sexual y el sistema de compatibilidad), la limitación por polen, la interacción con polinizadores y depredadores de semillas, hasta restricciones en la disponibilidad de recursos necesarios para el desarrollo de los óvulos que son fertilizados y para la maduración de los frutos (Stephenson 1981, Valle et al. 1990, Knight et al. 2005, Almeida-Soares et al. 2010, Groeneveld et al. 2010). En particular, en especies de árboles hermafroditas tropicales polinizados por animales se ha observado que la producción de frutos maduros y semillas que presentan es típicamente baja debido a que sufren un alto porcentaje de aborción de frutos (e.g., Koptur 1983, Bawa & Webb 1984, Ramírez 1993, Parra-Tabla & Bullock 1998, Voigt et al. 2005, Collevatti et al. 2009, Jackson et al. 2022), el cual puede ir de un 40 hasta un 80 % (Ramírez 1993, Parra-Tabla & Bullock 1998 Jackson et al. 2022).
Estudios en estas especies de árboles tropicales polinizados por animales han encontrado algunos patrones entre la producción de frutos y semillas con la expresión de las funciones sexuales de las flores, el sistema de compatibilidad, el origen, la cantidad y la calidad del polen, el despliegue floral, así como la conducta de forrajeo de los polinizadores (e.g., Koptur 1983, Kato & Hiura 1999, Pinto et al. 2008, Salinas-Peba & Parra-Tabla 2007). Por ejemplo, las especies autocompatibles producen una mayor proporción de frutos y semillas que especies autoincompatibles (Bawa & Webb 1984, Bullock 1995, Parra-Tabla & Bullock 2002). Este patrón se ha relacionado con el hecho de que, al presentar un gran despliegue floral, la mayoría de las visitas de los polinizadores ocurre entre flores de un mismo individuo, lo que restringe la llegada de polen de entrecruza y favorece la geitonogamia (Koptur 1983, Parra-Tabla & Bullock 2002, Ramalho 2004, Jacquemyn & Honnay 2008, Pinto et al. 2008). Estos resultados son consistentes incluso en especies que presentan separación temporal de las funciones sexuales (i.e., dicogamia) debido a que se espera que la dicogamia reduzca tanto el movimiento de polen entre flores de un mismo individuo como su pérdida (pollen discounting; Sargent et al. 2006, Narbona et al. 2011). Esto parece deberse a que la dicogamia rara vez es completa, es decir, que exista una separación temporal absoluta de las funciones sexuales (Lloyd &Webb 1986, Rosas-Guerrero et al. 2017).
La dicogamia puede expresarse a diferentes niveles: dentro de una flor (dicogamia intrafloral), o entre flores de una misma inflorescencia o de diferentes inflorescencias (dicogamia interfloral). En esos niveles la dicogamia puede ser parcial si en algún momento se traslapa la maduración de ambos órganos o completa si no hay traslape en absoluto (Lloyd & Webb, 1986). Por ejemplo, a nivel floral la dicogamia completa en especies autoincompatibles evita la interferencia antera-estigma, ya sea física o bioquímica disminuyendo la autopolinización (Bertin 1993, Sargent et al. 2006, Dai & Galloway 2010). Por otro lado, otra consecuencia importante del cambió simultáneo de la fase sexual de todas las flores en una inflorescencia o en todo el individuo (dicogamia sincrónica) es que se reduce la geitonogamia (i.e., polinización entre flores de un mismo individuo) (Harder & Aizen 2004).
Si bien causas como las descritas arriba ayudan a explicar la baja producción de frutos y semillas en especies de árboles tropicales hermafroditas polinizadas por animales, dentro de éstas hay casos extremos que se caracterizan por presentar una nula o muy baja producción de frutos y semillas. Las causas de este fenómeno han sido estudiadas en especies de interés comercial bajo condiciones de cultivo, pero menos evaluadas en especies silvestres (e.g., Bullock 1995, Cuevas et al. 1994, Trueman & Turnbull 1994, Machado & Bezerra 2000, Klein et al. 2003, Campos et al. 2016, Salinas-Peba & Parra-Tabla 2007). Dentro de las especies silvestres llaman especialmente la atención aquellas que a pesar de reproducirse sexualmente de manera esporádica y presentar una muy limitada producción de frutos y semillas, son abundantes en los ecosistemas que ocupan sugiriendo que el reclutamiento de individuos vía reproducción sexual debería ser importante. Por ejemplo, especies como Caesalpinia eriostachys Benth (Fabaceae), Tabebuia rosea Bertol (Bignonaceae) y Cordia leucocephala Moric (Boraginaceae) producen de manera natural entre cero y apenas un 1 % de frutos maduros a pesar de ser especies abundantes en selvas secas tropicales (Bawa & Webb 1984, Machado & Bezerra 2000).
Gymnopodium floribundum Rolfe es una especie arbórea tropical hermafrodita que se caracteriza por producir una muy baja cantidad de semillas a pesar de ser una especie abundante de las selvas bajas caducifolias de la Península de Yucatán (Rico-Gray et al. 1988, González-Ramírez 2014, Valdez-Hernández et al. 2010 Interián-Ku et al. 2018). El extremo bajo rendimiento de semillas en esta especie es paradójico, ya que produce grandes cantidades de flores visitadas por diferentes especies de insectos que colectan néctar (Chemas & Rico-Gray 1991, Vicario-Mejía & Echazarreta 1999). Pese a ser una especie abundante, algunas observaciones sugieren que G. floribundum tiene una baja representación en el banco de semillas o como plántulas en el sotobosque de la selva caducifolia (Rico-Gray et al. 1988, Rico-Gray & García-Franco 1992). Su alta abundancia se ha atribuido a que presenta reproducción clonal (Rico-Gray et al. 1988), pero su patrón de distribución no agregado sugiere la existencia de eventos de reclutamiento vía reproducción sexual.
Aun cuando G. floribundum es la especie más importante para la producción de miel en la región (Chemas & Rico-Gray 1991, Vicario-Mejía & Echazarreta 1999), se desconocen aspectos básicos de su biología floral. Por ejemplo, aunque G. floribundum se ha descrito como dicógama protándrica (López-Rodríguez 1994), se desconoce si ésta es completa o incompleta y cómo varía a nivel intrafloral, e intra e interindividualmente. Se ha sugerido que la aparente ausencia de semillas en esta especie está relacionada con una dicogamia completa a todos sus niveles de expresión sexual, de tal forma que al momento de que las flores son funcionalmente femeninas existe una muy baja disponibilidad de polen (González-Ramírez 2014, y ver Zhao et al. 2020). Adicionalmente, la producción de frutos y semillas también puede depender del sistema de compatibilidad, ya que si G. floribundum es autoincompatible y presenta dicogamia incompleta, la transferencia de polen dentro de cada individuo favorecida por su despliegue floral, resultaría en un alto porcentaje de aborción de estructuras reproductivas (Knight et al. 2005).
En este trabajo se evaluó si el nivel de sincronía de las funciones sexuales y el sistema de compatibilidad son factores que podrían explicar la notable baja producción de semillas de G. floribundum.
Materiales y métodos
Sitio de estudio. Se estudió una población de G. floribundum en un fragmento de vegetación natural de 5,328 m2, localizado en el Km 1.6 carretera Xmatkuil a Dzununcan dentro de la reserva ecológica Cuxtal, al noroeste del estado de Yucatán (20.860855 latitud norte, -89.641104 longitud oeste, 10 m snm). El clima es cálido, el más seco de los subhúmedos, con lluvias en verano, así como alto porcentaje de lluvia invernal (Orellana et al. 2010), la temperatura media anual es de 24 a 28 ºC y la precipitación está en el rango de 500 a 1,000 mm (INEGI 2010). El suelo es leptosol, muestra poco desarrollo y es pedregoso (Bautista et al. 2015). La población estudiada es un parche de vegetación de aproximadamente 50 años que creció de forma natural mucho después de que el terreno fuera ocupado para el cultivo de henequén.
Especie de estudio. Gymnopodium floribundum var. antigonoides (Polygonaceae) es una especie arbórea nativa del estado de Yucatán (Standley & Steyermark 1946, Ancona et al. 2019). Se caracteriza por la alta densidad de individuos adultos en zonas de vegetación secundaria de la selva caducifolia y subcaducifolia (Vicario-Mejía & Echazarreta 1999, Balam 2009). Puede reproducirse vegetativamente vía brotes de raíces laterales o de troncos cortados (Rico-Gray et al. 1988, Vicario-Mejía & Echazarreta 1999). Sus inflorescencias son panículas racemosas terminales cuyas flores son hermafroditas, presentan protandria (López-Rodríguez 1994) (Figura 1) y cuentan con 9 estambres y 1 ovario súpero con 3 estilos, 3 estigmas y 1 óvulo (Souza-Novelo 1981, Ortiz-Díaz 1994). La sucesión de la floración dentro de la panícula es de la base hacia el ápice, pero dentro de cada racimo el botón más grande es el que abre primero.

Foto: Sara Paquini.
Figura 1 Flor en fase masculina (a la izquierda) y flor en fase femenina (a la derecha) del árbol tropical Gymnopodium floribundum.
Cada flor de G. floribundum produce en promedio de 1.28 a 1.64 µl de néctar al día (González-Ramírez 2014) y esta especie es la principal planta productora de néctar de Yucatán. Su néctar es un recurso floral utilizado por diferentes familias de insectos, en particular por la abeja Europea Apis mellifera Lineo (Rico-Gray et al. 1998, Chemas & Rico-Gray 1991, Vicario-Mejía & Echazarreta 1999, González-Ramírez 2014).
El fruto de G. floribundum es un aquenio que contiene una sola semilla (Souza-Novelo 1981, Ortiz-Díaz 1994), el cual generalmente se forma aun cuando la semilla no se desarrolle y se mantiene en las inflorescencias hasta que éstas se secan. El perianto interno y externo es acrescente en el fruto (Ancona et al. 2019), y persiste después de la formación del fruto y de la semilla.
Las fenofases de G. floribundum en Yucatán presentan variación interanual, lo cual está relacionado con eventos meteorológicos atípicos y/o extremos, pero en general la defoliación y las floraciones principales coinciden con la sequía pre-estival (diciembre a mayo) (Flores 1990, Valdez-Hernández et al. 2010, Interián-Ku et al. 2018). Durante la floración principal la mayor parte de los individuos florecen de manera sincrónica y masiva. Esta especie puede florecer en noviembre y en diciembre, pero son pocos los árboles que florecen y generalmente producen pocas inflorescencias por lo que se les considera como floraciones secundarias. La variación en la abundancia de flores y néctar durante las floraciones principales y las secundarias parece depender de las lluvias previas (Vicario-Mejía & Echazarreta 1999, Valdez-Hernández et al. 2010, Refugio Rivera, INIFAP 2021).
Dicogamia. El tipo de dicogamia de G. floribundum fue estudiado evaluando el nivel de sincronía de las funciones sexuales dentro de una flor, entre flores de inflorescencias de un mismo individuo y entre los individuos de la población. Se seleccionaron18 árboles separados por al menos 15 metros para asegurar que no fueran el mismo individuo genético. Tres inflorescencias a una altura de entre 2 y 6 m por cada individuo fueron elegidas al azar y en ellas se contabilizaron las flores en cada fase sexual diariamente en un horario de 7:30 am a 2:30 pm. El periodo de observación abarcó del 26 de febrero al 19 de marzo de 2022 que fue lo que duró la floración principal. El registro de flores se llevó a cabo utilizando una escalera de 3.5 m de altura, lo cual sumado a la altura del observador permitió hacer un conteo adecuado.
La fase masculina de la flor ocurre cuando los nueve estambres están en posición vertical y los tres estilos están enrollados entre sí, hacia abajo, con los estigmas dando la cara al nectario. En la fase femenina, los filamentos, de los cuales ya se han desprendido las anteras, están doblados hacia abajo y los estilos están desenrollados y separados con los estigmas expuestos (López-Rodríguez 1994) (Figura 1). Las flores que han pasado por su fase masculina, pero todavía no están en fase femenina se les considera en transición, y las flores que presentan la mayor parte de las anteras con el polen expuesto mientras exhiben al mismo tiempo los estigmas se les considera bisexuales.
El índice de sincronía entre funciones sexuales fue obtenido en dos niveles: entre inflorescencias del mismo individuo y entre inflorescencias de distintos individuos (Albert et al. 2001). La fase sexual (masculina o femenina) de las flores de una inflorescencia fue comparada con la de las otras dos inflorescencias de un mismo individuo. Por ejemplo, en los días de observación 1, 2 y 3 (que corresponden a los días julianos 56, 57 y 58) no hubo flores abiertas en ninguna de las inflorescencias 1 y 2 del individuo 1; el día 4 la inflorescencia 1 tuvo tres flores en fase masculina y la inflorescencia 2 tuvo dos flores en fase masculina por lo que no hubo oportunidad de apareamiento. Para obtener la sincronía entre individuos distintos, la fase sexual de las flores de las tres inflorescencias elegidas por árbol fue comparada con las de los otros árboles, así, con un total de 153 combinaciones que resultaron de colacionar al individuo 1 con el individuo 2, el individuo 1 con el individuo 3 y así sucesivamente, se calculó el promedio del índice de sincronía entre pares de individuos.
El índice de sincronía de las fases sexuales por pares de inflorescencias de un mismo individuo y entre individuos fue calculado usando la fórmula de Albert et al. (2001). Esta fórmula fue adaptada para este caso: Si = (1/n-1) Σ (aij/bij) donde Si es el índice de sincronía, n es el número de flores que abrieron ese día, aij es el número de días en que la flor i está en fase masculina o femenina y la flor j está en fase femenina o masculina, bij es el número de días en que al menos una de ellas está en fase femenina o masculina. Este índice tiene un rango desde 0, cuando no hay sincronía, hasta 1 cuando el traslape es completo. La flor i y la flor j son del mismo individuo cuando se consideran las tres inflorescencias por individuo; la flor i es de un individuo y la flor j es de otro individuo al considerar el índice de sincronía entre pares de los 18 individuos.
Para determinar la variación del número de flores en fase masculina y femenina a través del periodo de floración, se calculó el género fenotípico con la fórmula presentada por Zhao et al. (2020). En esta fórmula confluyen la disponibilidad relativa del polen (flores en fase masculina) y de los óvulos (flores en fase femenina) en la población: G i, t = f i, t / (f i, t + m i, t Et) donde G i, t es el sexo fenotípico de la planta i en el día t, f i, t y m i, t es el número de flores en fase femenina y en fase masculina respectivamente en el día t de las tres inflorescencias observadas por individuo y Et es la oportunidad de las flores en fase masculina de donar polen para producir semilla tomando en cuenta el contexto poblacional, como un factor de equivalencia: Et = Σf i,t / Σm i,t
Sistema de compatibilidad. Se llevó a cabo un experimento de polinización manual durante la floración secundaria entre los meses de noviembre y diciembre de 2022. Para este fin 14 árboles diferentes separados por al menos 15 m fueron marcados, así como las inflorescencias disponibles a diferentes alturas (1.5 a 5 m). Estas inflorescencias fueron aisladas con bolsas de tul antes de la antesis floral. Las flores de la mitad de las inflorescencias fueron polinizadas con polen del mismo árbol (tratamiento de autocruza, N = 1,597) mientras que las flores de la otra mitad fueron polinizadas con polen de otros árboles (tratamiento de polinización cruzada, N = 1,239). La polinización consistió en verificar la exposición de polen en las anteras y en frotar las anteras sobre los estigmas. Al realizar la polinización cruzada, se depositó polen de un solo árbol en los estigmas de una flor individual y cuando el polen de ese árbol se agotaba se buscaban otros donadores por lo que una misma inflorescencia podía tener flores fertilizadas con polen de diferentes árboles. Dado que las flores abren de manera progresiva dentro de la inflorescencia y no de manera simultánea, solo hasta que varias flores estuvieron en fase masculina fueron emasculadas; cuando las flores pasaron a su fase femenina fueron polinizadas, los botones removidos y las inflorescencias embolsadas nuevamente, la bolsa de tul fue amarrada con un listón donde se escribieron los datos de identificación. Los frutos de los dos tratamientos fueron cosechados, se les quitó el perianto y luego fueron disectados en el laboratorio para verificar la presencia de la semilla. Los frutos que no formaron semillas fueron clasificados como “frutos iniciados” (proporción de frutos iniciados = número de frutos formados/número de flores) y aquellos que produjeron semilla como “frutos maduros” (proporción de frutos maduros = número de frutos con semilla/número de flores).
Adicionalmente, se calculó el índice de compatibilidad propuesto por Becerra & Lloyd (1992), el cual consiste en dividir el porcentaje de frutos iniciados provenientes de autocruza entre el porcentaje de frutos iniciados resultado de la polinización cruzada. Si el valor del índice es ≤ a 0.75 se considera que la especie es autoincompatible.
Finalmente, se calculó el índice de depresión endogámica usando la fórmula propuesta por Ågren & Schemske (1993): δ = 1 - (Ws/Wo), donde δ es el índice de depresión endogámica, Ws es la proporción de frutos maduros resultado de la autopolinización y Wo es la proporción de frutos maduros por entrecruza.
Análisis estadísticos. Para determinar el cambio del género fenotípico de la población (i.e., cambio en la expresión sexual) a lo largo de la floración, se ajustó un modelo de regresión lineal utilizando el estimador G i de Zhao et al. (2020) descrito arriba como variable dependiente y el día del año como variable independiente. Un valor de G i igual a cero representa un género totalmente masculino y un valor cercano a uno representa un género totalmente femenino (Zhao et al. 2020).
Para evaluar el efecto del tratamiento de polinización en la producción de frutos iniciados y de frutos maduros (frutos que produjeron semillas maduras) se realizaron dos modelos mixtos lineales independientes. Las variables de respuesta fueron en cada caso la proporción de frutos iniciados y la proporción de frutos maduros. En este análisis el tratamiento de polinización (autopolinización y polinización cruzada) fue considerado como factor fijo y cada árbol como efecto aleatorio. Adicionalmente se incluyó en los modelos el diámetro a la altura del pecho (DAP) como covariable para controlar posibles efectos del tamaño de los árboles con la eficiencia en la producción de frutos. La prueba de normalidad de los residuales se llevó a cabo con la prueba de Kolmogorov-Smirnov (Gallucci 2019) mostrando en ambos casos una distribución normal (K-S ≥ 0.16, P ≥ 0.29).
Para estimar si existían diferencias en la probabilidad de maduración de las semillas entre los tratamientos de autopolinización y de entrecruza, se ajustó un modelo de regresión logística binaria tomando como variable de respuesta el éxito o fracaso de un fruto en madurar su única semilla. Los modelos mixtos así como la regresión logística binaria fueron llevados a cabo siguiendo las funciones de Gallucci (2019) en la interfase Jamovi (The Jamovi Project 2002) del software estadístico R (R Core Team 2021).
Por último, para evaluar la depresión por endogamia en la producción de frutos se calculó la diferencia en el tamaño de efecto (valor de g de Hedges & Olkin 1985) entre las autocruzas y las entrecruzas aplicando la fórmula Hedges (g) corregida para tamaños de muestra <50 (Hedges & Olkin 1985):
donde Wo es el promedio del número de frutos maduros entre el número de flores polinizadas con polen de otros individuos, Ws es el promedio del número de frutos maduros entre el número de flores autopolinizadas y SD es la desviación estándar ponderada para dos grupos.
Resultados
Dicogamia. Todos los árboles marcados produjeron inflorescencias casi al mismo tiempo y exhibieron flores en fase masculina y en fase femenina abiertas simultáneamente a partir del segundo día de observación y hasta el final de la floración (Figura 2). La mayor cantidad de flores en fase femenina y masculina se produjeron a los 8 y 9 días (días julianos 63 y 64) respectivamente después del inicio de la floración en la población estudiada.

Figura 2 Número total de flores en fase masculina y femenina N = 2750 del árbol tropical Gymnopodium floribundum a lo largo de la floración de febrero-marzo 2022 en una selva baja caducifolia de Yucatán.
Del total de flores individuales observadas en los 18 árboles (N = 2,876 flores) sólo el 1.6 % fueron bisexuales, ya que mostraron al mismo tiempo su fase masculina y femenina dentro de la misma flor. Este bajo porcentaje de traslape sugirió que a nivel intrafloral G. floribundum muestra dicogamia completa. De manera adicional, un 2.8 % de las flores presentaron una fase de transición entre la fase masculina y femenina. En contraste, el promedio del índice de sincronía entre pares de inflorescencias de un mismo individuo fue 0.48 ± 0.13 (Media ± D. E.), y entre pares de individuos de 0.64 ± 0.11 (Media ± D. E.), revelando que la dicogamia en G. floribundum fue incompleta.
El análisis de regresión para estimar la variación temporal en el promedio del género fenotípico indicó que al inicio de la floración existe una predominancia de expresión masculina, la cual fue cambiando de manera constante a una predominancia de género fenotípico femenino hacia el final de la floración (Figura 3).

Figura 3 Promedio diario del género fenotípico en la población estudiada de Gymnopodium floribundum. Género fenotípico = -0.94174 + 0.022×Día del año (día juliano), R 2 = 75.31, P < 0.001, coeficiente de correlación = 0.87. Las líneas verdes muestran el intervalo de confianza a 90 y 95 % respectivamente.
Producción de frutos, sistema de compatibilidad. No se encontraron diferencias significativas entre tratamientos en la proporción de frutos iniciados (F 1, 19 = 0.916, P = 0.361) (Figura 4).
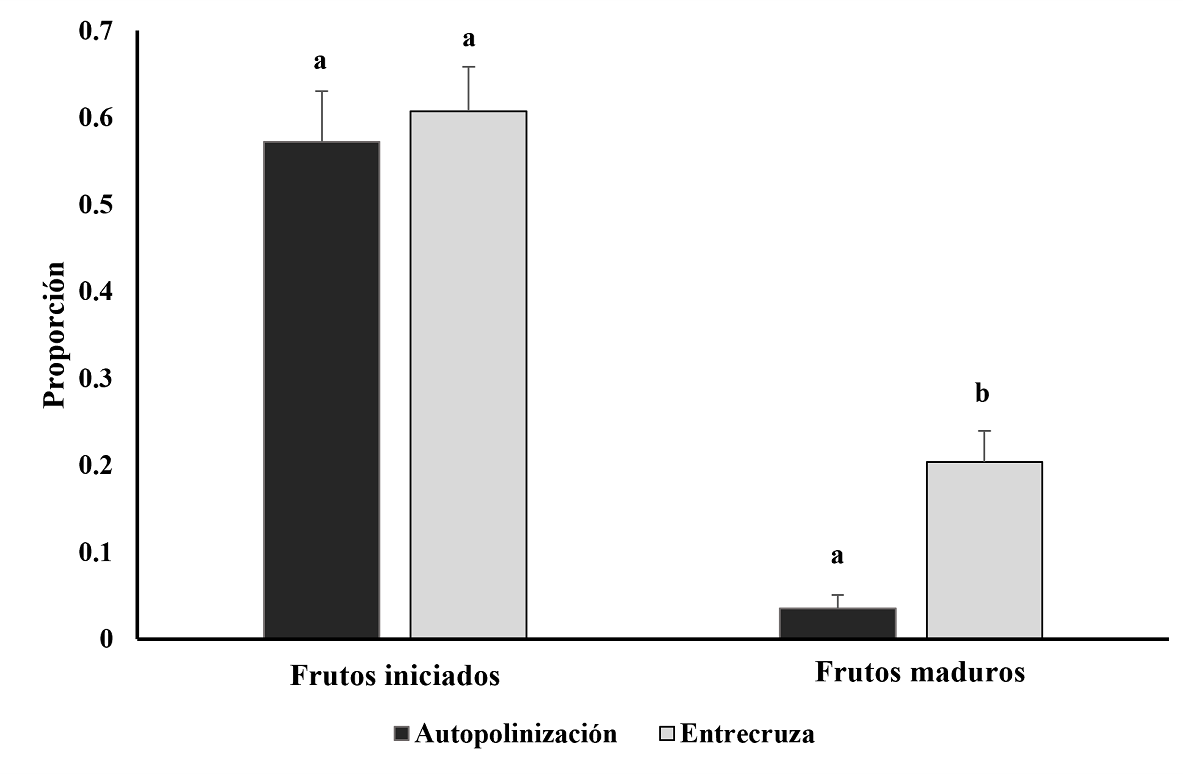
Figura 4 Media (± EE) de la proporción de frutos iniciados y frutos maduros entre tratamientos de polinización en el árbol tropical Gymnopodium floribundum. Letras similares indican que no hay diferencias significativas entre tratamientos (P < 0.05).
Aunque la proporción de frutos iniciados fue relativamente alta, la producción de frutos maduros fue notablemente menor (Figura 4). Ni en la producción de frutos iniciados ni en la de frutos maduros el tamaño de los árboles mostró un efecto significativo (P > 0.1 en ambos casos). La proporción de frutos maduros bajo el tratamiento de autopolinización alcanzó cerca del 3 %. En contraste, el tratamiento de polinización por entrecruza produjo cerca de 6 veces más frutos maduros (≈ 20 %; Figura 4) que el tratamiento de autopolinización. El análisis estadístico mostró diferencias significativas entre los tratamientos (F 1, 19 = 20.53, P < 0.001), específicamente en el tratamiento de autopolinización la proporción de frutos maduros fue significativamente menor respecto al tratamiento de entrecruza (Figura 4).
A pesar de la baja producción de frutos maduros observados en el tratamiento de autopolinización el valor del índice de compatibilidad fue de 0.98, sugiriendo que G. floribundum es una especie autocompatible.
El análisis de regresión logística mostró diferencias significativas en las probabilidades de formación de semillas entre el tratamiento de autopolinización y el de polinización cruzada (Ⲭ 2 1 = 21.6, P < 0.001). Es decir que, aunque el tratamiento de autopolinización mostró una probabilidad > 0 de producir semillas, los frutos producto de fecundación cruzada tuvieron 3.66 más probabilidades de formar una semilla (z = 4.75, P < 0.001), sugiriendo ventajas del polen de entrecruza respecto al de autocruza. Este resultado fue coincidente con el análisis del tamaño de efecto de las diferencias entre el tratamiento de polinización de autocruza y entrecruza (valor de Hedges de g = 1. 14, intervalo de confianza 1.94 a 0.34, P < 0.05). Más aún, el índice de depresión endogámica (δ) fue alto (0.834 ± 0.19; Media ± SD), sugiriendo un efecto intenso en la formación de frutos de autocruza.
Discusión
Los resultados del análisis sobre el tipo de dicogamia en Gymnopodium floribundum mostraron que a nivel intrafloral la dicogamia es completa (≈ 98 % de las flores), pero a nivel individual y entre individuos es incompleta. Este resultado de G. floribundum es consistente con el patrón observado en otras especies dicógamas (e.g., Bertin & Newman 1993, Rosas-Guerrero et al. 2017) y tiene implicaciones importantes para explicar el éxito reproductivo de esta especie considerando que el experimento de polinización manual mostró que es autocompatible.
La baja coincidencia temporal en las funciones sexuales a nivel intrafloral en G. floribundum sugiere que la dicogamia en esta especie promueve la eficiente dispersión del polen al reducir la interferencia antera-estigma dentro de la misma flor (Bhardwaj & Eckert 2001, Sargent et al. 2006). En contraste, a nivel individual y entre individuos el índice de sincronía se ubicó entre casi un 50 y un 60 % respectivamente, sugiriendo simultaneidad de las fases masculina y femenina por lo que las probabilidades de polinización entre flores del mismo individuo (geitonogamia) o entre individuos (entrecruza) en la población son altas. Estos resultados no apoyan la hipótesis de González-Ramírez (2014), quien sugirió que la dicogamia completa a nivel intrafloral, dentro de los individuos y entre los individuos sería la causa de la casi nula producción de semillas en G. floribundum.
Un aspecto notable del análisis de la dicogamia fue que se observó un cambio en el género fenotípico de los árboles de G. floribundum a lo largo de la floración. Al inicio de la floración la mayoría de los árboles se expresaron como individuos funcionalmente masculinos y cambiaron gradualmente de tal forma que al final de la floración la mayoría se mostraron como funcionalmente femeninos. Es decir, a nivel poblacional se observó que mientras las primeras flores protándricas de G. floribundum liberan el polen a pocos estigmas disponibles, al final de la floración, cuando existe una mayor disponibilidad de estigmas, la oferta de polen disminuye. Este resultado sugiere que a nivel poblacional la disponibilidad de polen que puede llegar a fecundar los óvulos aprovechables se va perdiendo a lo largo del tiempo, lo que podría contribuir a la baja producción de frutos maduros. Este mismo análisis también sugirió que hacia la mitad de la floración las probabilidades de producir frutos y semillas sería alta, ya que virtualmente se tuvo una proporción en la expresión sexual de 1:1 (Figura 3). No obstante, es importante notar que debido al corto periodo de floración (21 días duró la floración de febrero-marzo de 2022) de G. floribundum, el número de días en los que la población se encuentra en esta situación es reducido (ca. 5 días).
Resultados similares de esta dinámica de expresión sexual se han observado en otras especies dicógamas donde el cambio en el género fenotípico puede ser desde principalmente masculino a femenino (con protandria a nivel de individuo) (Ross 1977, Horovitz 1978) o incluso temporalmente dioico (Bell 1971). Esta variación temporal en el género fenotípico dentro de las poblaciones de especies dicógamas tiene consecuencias importantes en el éxito reproductivo a lo largo de la fenología de floración. Por ejemplo, Zhao et al. (2020) documentaron un patrón similar de expresión sexual a G. floribundum en la especie protándrica Aconitum gymnandrum Maxim (Ranunculaceae) donde la alta disponibilidad de polen al inicio de la floración favoreció la producción de frutos y semillas de individuos con una expresión sexual femenina “precoz”. Estudios futuros en G. floribundum deberían de considerar correlaciones entre el valor de la expresión sexual promedio y el éxito en la formación de frutos maduros a lo largo de la fenología de la floración. Más aún, ya que esta especie muestra una floración primaria y eventos secundarios de producción de flores, sería relevante evaluar las diferencias entre estos eventos de floración en el éxito de polinización que podría estar siendo regulado por variaciones en la actividad de los polinizadores. Estos resultados sugieren que en especies dicógamas la variación en la disponibilidad de polen es clave para su éxito reproductivo y ayuda a explicar diferencias en la distribución del éxito reproductivo dentro las poblaciones.
En G. floribundum los resultados indican que la dicogamia incompleta a nivel individual y entre individuos no evita la autofecundación. Debido al traslape promedio a nivel individual de casi el 50 % en las funciones sexuales, en G. floribundum se puede predecir que la probabilidad de que ocurran polinizaciones por geitonogamia es alta, ya que sus visitantes (especialmente la abeja europea Apis mellifera, González-Ramírez 2014), tienden a pecorear un gran número de flores dentro de un mismo individuo.
De esta manera en G. floribundum la presencia de crecimiento clonal, la dicogamia incompleta y la conducta de forrajeo del principal polinizador, sugieren una intensificación de la geitonogamia lo que muy probablemente tiene consecuencias en la estructura genética de esta especie.
Debido a que el experimento de polinización manual mostró que G. floribundum es autocompatible se esperaría que las polinizaciones vía geitonogamia no fueran desventajosas, como se ha reportado en otras especies dicógamas (e.g., Hossaert-Mckey & Bronstein 2001, Rosas-Guerrero et al. 2017). Sin embargo, el experimento de polinización manual indicó diferencias significativas entre el tratamiento de autopolinización y el de entrecruza en la producción de frutos maduros. La autopolinización no solamente mostró una muy baja probabilidad de producir frutos maduros (< 3 %), sino que ésta fue casi 6 veces menor al tratamiento de entrecruza. Este resultado sugiere una clara ventaja determinada por el origen del polen en G. floribundum, siendo el polen de entrecruza claramente “superior” al de autocruza. Esto se soporta además con el hecho de que las flores polinizadas con polen de entrecruza tuvieron 3.66 más probabilidades de formar frutos maduros y por el alto valor del índice de depresión endogámica observado. Este tipo de depresión por endogamia temprana ha sido observado en otras especies en las que, además, se relaciona con consecuencias a largo plazo en la germinación y la supervivencia (Goodwillie et al. 2005, Gibbs 2014). De acuerdo con estos resultados sería importante evaluar si en G. floribundum la depresión por endogamia se presenta además en otras etapas de su ciclo de vida comparando el desempeño de individuos provenientes de autocruza con aquellos provenientes de entrecruza. Este análisis podría ayudar a explicar al menos parcialmente si la depresión por endogamia contribuye al aparente bajo reclutamiento de nuevos individuos producto de la autocruza vía polinizaciones geitonogámicas en G. floribundum en las comunidades que ocupa.
Así, parece ser que la dicogamia incompleta en G. floribundum ayuda a promover la polinización cruzada, favoreciendo su éxito reproductivo. Sin embargo, este experimento también mostró que la producción de frutos maduros vía entrecruza en G. floribundum apenas superó en promedio el 20 % sugiriendo la existencia de otros factores que limitan la maduración de los frutos y la formación de su única semilla, lo cual parece ser común en especies de la misma familia (Cawoy et al. 2006).
La existencia de otros factores limitantes en la producción de frutos maduros en G. floribundum se apoya con los resultados que mostraron que la proporción de frutos iniciados fue más alta respecto a la proporción de frutos que finalmente maduraron. Aparte de la limitación por polen o polinizadores que sería importante evaluar, la producción de frutos y semillas de las plantas, incluyendo a especies de árboles tropicales como G. floribundum, está fuertemente afectada por la disponibilidad de recursos como nutrientes en el suelo o agua, (e.g., Stephenson 1981, Bierzychudek 1981, Valle et al. 1990, Parra-Tabla & Bullock 1998, Salinas-Peba & Parra-Tabla 2007, Valdez-Hernández et al. 2010, pero ver Groeneveld et al. 2010). Por ejemplo, en el árbol tropical Manilkara zapota (L.) P. Royen (Sapotaceae) se observó que la mayor disponibilidad de agua y nutrientes en el suelo incrementa hasta en tres veces la producción de frutos maduros (Salinas-Peba & Parra-Tabla 2007). En particular, un estudio correlativo en cinco especies de árboles de selvas secas que incluyó a G. floribundum, mostró que individuos de esta especie que se encontraban en sitios con mayor disponibilidad de agua presentaron una mayor producción de frutos (Valdez-Hernández et al. 2010). Estas evidencias resaltan la importancia de que experimentos futuros en G. floribundum consideren en su éxito reproductivo el papel de la disponibilidad de nutrientes y agua.
En general nuestro estudio muestra cómo la expresión sexual en conjunto con el sistema de compatibilidad y el origen del polen pueden ser factores relevantes para explicar la limitada producción de frutos y semillas en especies de árboles tropicales.











 nova página do texto(beta)
nova página do texto(beta)



