La vegetación de los ecosistemas áridos en México está siendo modificada aceleradamente, debido a cambios en el uso de suelo y el cambio climático global. Por ejemplo, en la región del Desierto Sonorense donde coexisten gran diversidad de especies y formas de vida en la vegetación (Shreve & Wiggins 1964, Dimmit et al. 2015) a pesar de las condiciones limitantes como el escaso suministro de agua y altas temperaturas (Brito-Castillo et al. 2010), se ha documentado que la modificación en la dominancia de las especies y tipos funcionales causada por la actividad antropogénica (Castellanos et al. 2010), genera cambios importantes en las relaciones hídricas (Castellanos et al. 2016) y en el funcionamiento de sus ecosistemas (Barron-Gafford et al. 2017, Hinojo-Hinojo et al. 2019, Castellanos et al. 2022). A pesar de esto, las estrategias hídricas de las especies en respuesta a la limitación de humedad son todavía poco claras, por lo que dados los escenarios futuros de mayor aridez (Zhang et al. 2021), su estudio y esclarecimiento será determinante, para avanzar en el entendimiento del funcionamiento de estos ecosistemas y en los esfuerzos de su conservación.
Las plantas presentan múltiples estrategias para evadir o tolerar los efectos causados por las limitantes en la disponibilidad de agua (Munson et al. 2021). Se ha propuesto la diferenciación de las especies de plantas por su capacidad para regular y mantener su potencial hídrico dependiendo de las condiciones variables del ambiente durante su crecimiento, manteniéndolo (iso-hidria) o modificándolo (aniso-hidria), utilizándolo como medida de la tolerancia a las condiciones extraordinarias de sequía (Meinzer et al. 2016). Por un lado, una planta evasora muestra un fuerte control para regular la transpiración y evitar la deshidratación (Meinzer et al. 2016), aunque incurrirá en altos costos y daños en su sobrevivencia por inanición de carbono, debido a los períodos prolongados de cierres estomáticos (McDowell et al. 2008). Una planta tolerante, sin embargo, invierte recursos para formar estructuras resistentes al embolismo, la osmorregulación, y el mantenimiento de la turgencia celular (Meinzer et al. 2016). Ambas estrategias representan extremos de un continuo de adaptaciones morfoestructurales y funcionales, que permiten a las plantas diferenciar sus nichos hidrológicos (Silvertown et al. 2015, Rodríguez-Robles et al. 2020).
De manera más fina, las plantas emplean estrategias funcionales para regular el transporte de agua. En este contexto, el flujo de savia en el tallo es útil para estimar la transpiración y uso de agua en plantas (Wullschleger et al. 1998, Salas-Acosta et al. 2022) y se relaciona estrechamente con atributos ecofisiológicos, y variables ambientales como la disponibilidad de agua en el suelo, el déficit de presión de vapor de agua entre la planta y la atmósfera (VPD), la densidad de flujo de fotones de radiación fotosintéticamente activa (PPFD) y la radiación solar (Bovard et al. 2005, Shen et al. 2015, Zhao et al. 2017). Por ejemplo, la conductancia estomática regula el flujo de savia cuando las condiciones de humedad disponible y PPFD no son limitantes (Xu & Ma 2007, Lambers & Oliveira 2019). Por otro lado, el VPD contribuye a establecer el gradiente del potencial hídrico y afecta el flujo de savia de manera directa (Granier 1985), tal como se ha encontrado en especies de regiones secas (Poyatos et al. 2013, Sánchez-Costa et al. 2015) y húmedas (Tullus et al. 2012). Es evidente que, en especies de regiones secas, aun cuando el VPD puede ejercer una alta demanda evaporativa, el cierre estomático (Grossiord et al. 2020) y una amplia diversidad de otros mecanismos morfoestructurales y fisiológicos (modificación de ángulos foliares, reducción de la superficie foliar, conductividad hidráulica, osmorregulación) se coordinan para el control y la reducción de la pérdida excesiva de agua.
Las especies creciendo en ambientes secos con eventos de sequía intra-estacional, definidos como los períodos entre diferentes pulsos de lluvia (sensu Noy-Meir 1973) en una misma estación, se caracterizan por tener mayor sensibilidad en su flujo de savia a la humedad en el suelo y la conductividad hidráulica del xilema (Chirino et al. 2011, Poyatos et al. 2013, Sánchez-Costa et al. 2015). Por ejemplo, en regiones semiáridas con clima Mediterráneo, se han encontrado coexistiendo especies de árboles (Quercus ilex, Q. agrifolia, Q. durata, Arbutus unedo y Pinus australis) con distintos flujos de savia debido a su diferente capacidad de conducir agua por el tallo (Chirino et al. 2011). Algo similar se ha descrito también en especies de sitios con clima semihúmedo y sequías estacionales, como los bosques mixtos de maples (Acer saccharum) y robles (Quercus velutina), donde los valores de flujo de savia entre los dominantes difieren hasta cinco veces (Guillén et al. 2022). En especies de plantas que crecen en ambientes de mayor disponibilidad de agua en el suelo, el flujo de savia es limitado en mayor medida por la conductividad hidráulica que por la demanda evaporativa, medida como déficit de presión de vapor de agua entre la planta y la atmósfera (Grossiord et al. 2019).
Aunque mejor conocidas para especies en otros ambientes, la caracterización y generación de información sobre atributos ecofisiológicos, de las tasas de flujo de savia y de sus dinámicas en especies de regiones con climas áridos y semiáridos aún requieren mayor comprensión (Poyatos et al. 2021, Gao et al. 2022). Particularmente en México, especies de estos ambientes han sido poco estudiadas y aún existen huecos importantes de información. En este estudio buscamos determinar las diferencias en los atributos ecofisiológicos de tres especies de árboles codominantes en el Desierto Sonorense. Mediante la caracterización de la densidad del flujo de savia (agua), variables ambientales y los atributos funcionales de las especies, buscamos caracterizar las diferencias en sus estrategias hídricas en respuesta a la sequía estacional e intra-estacional. Para responder lo anterior, se instalaron sondas de disipación de calor en árboles de tres especies, y se estudiaron atributos funcionales y estructurales que permitieran contrastar las diferencias en sus estrategias y adaptaciones a la sequía. Nuestra hipótesis sugiere que las especies estudiadas presentan estrategias ecofisiológicas diferentes para no competir por el recurso hídrico limitante, por lo que su estudio permitirá establecer cuáles y cómo son las diferentes estrategias utilizadas para coexistir como dominantes.
Materiales y métodos
Sitio de estudio. El estudio se desarrolló en el Rancho El Churi (28.698217 N, -110.539169 O), ubicado en La Colorada, Sonora, al Noroeste de México (Figura 1) a una altitud de 450 msnm. El sitio tiene un suelo de textura areno-limosa (> 80 % de arena) con 0.6-2.6 % de materia orgánica (Celaya-Mitchel et al. 2015, Castellanos et al. 2022). El clima en el sitio es semiárido, caracterizado por 348 mm de precipitación anual y temperatura media anual de 24.8 °C. En el sitio son frecuentes las altas temperatura en verano (hasta 48 °C) y ausencia de temperaturas congelantes en invierno (Hinojo-Hinojo et al. 2019, Castellanos et al. 2022). Se pueden diferenciar dos temporadas de lluvias al año y un largo periodo de sequía pre-monzón (Brito-Castillo et al. 2010, Dimmit et al. 2015, Castellanos et al. 2022). Durante el verano (julio a octubre), ocurre la temporada del Monzón de Norteamérica (Douglas et al. 1993, Gochis et al. 2006) que aportan el 60-95 % de la precipitación anual, mientras que en lo que resta del año (principalmente primavera e invierno), ocurren lluvias poco frecuentes con acumulados de 0-40 mm (Castellanos et al. 2022).
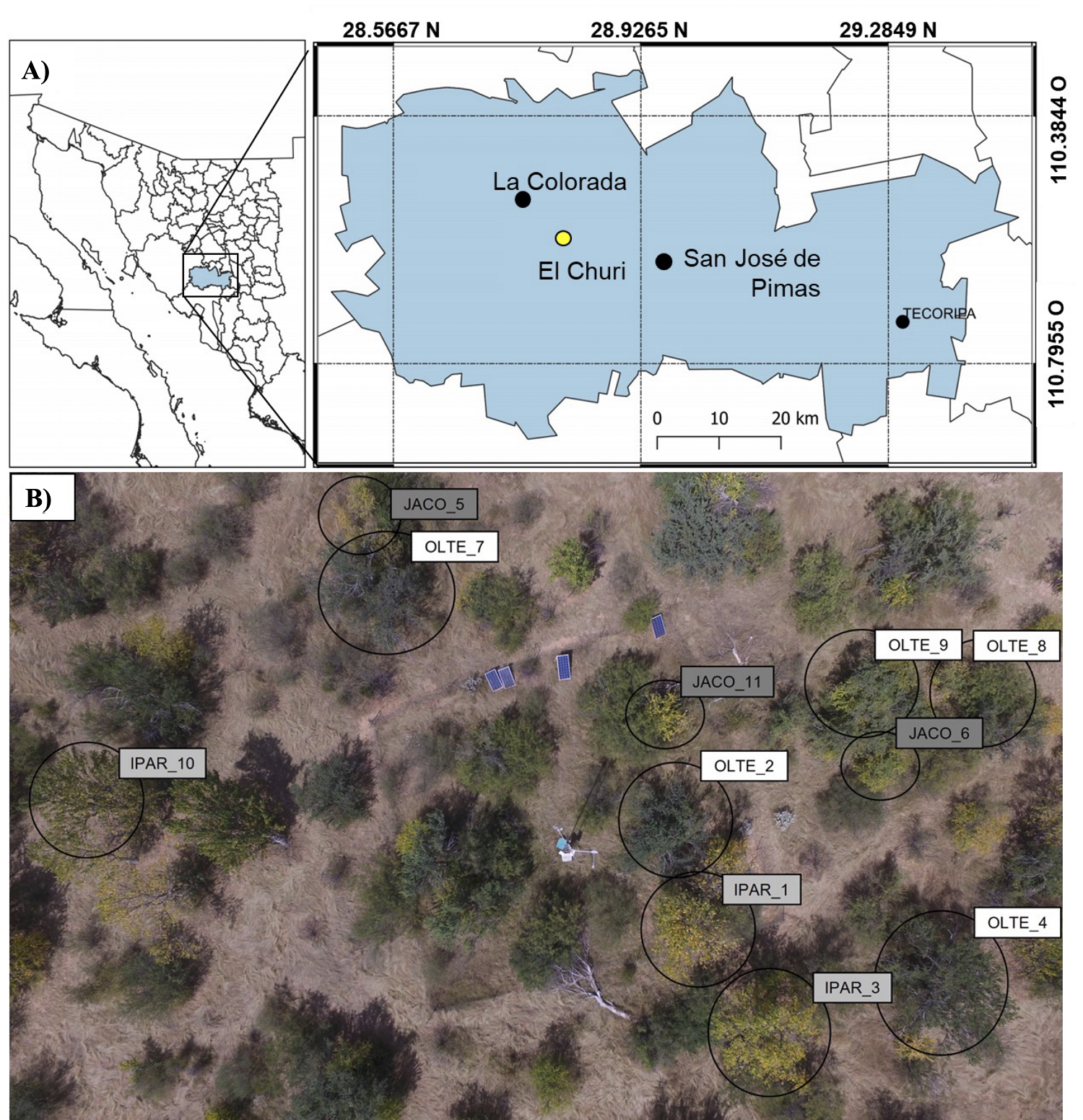
Figura 1 Sitio de estudio, A) se muestra la ubicación geográfica y B) una imagen desde un vehículo aéreo no tripulado (Vega-Puga et al. 2023). Se etiqueta a los árboles instrumentados con sensores de flujo de savia con OLTE (O. tesota), IPAR (I. arborescens) y JACO (J. cordata).
El área se localiza en una zona limítrofe al sureste del Desierto Sonorense. En el sitio convergen dos tipos de vegetación: matorral desértico micrófilo (Olneya tesota, Fouquieria macdougalli, Lycium sp) con matorral subtropical (Ipomoea arborescens, Jatropha cordata, Eysenhardtia orthocarpa) (INEGI 2015). La vegetación leñosa alcanza hasta 8 m de altura y los árboles dominantes son Olneya tesota e Ipomoea arborescens, además hay una gran proporción de suelo desnudo (Hinojo-Hinojo et al. 2019, Vega-Puga et al. 2023). La temporada de crecimiento inicia con el monzón de verano y las plantas leñosas producen hojas. En años lluviosos, el suelo desnudo se tapiza con una cubierta de pastos y herbáceas anuales, y en época de sequías, gran parte de las especies leñosas se inactivan al desprender sus hojas (Hinojo-Hinojo et al. 2019, Castellanos et al. 2022).
Especies de estudio. Se seleccionaron tres especies de árboles: Olneya tesota A. Gray, Ipomoea arborescens (Humb. & Bonpl. ex Willd.) G. Don y Jatropha cordata (Ortega) Müll.Arg. Se obtuvo la densidad de la madera de cada especie utilizando muestras de secciones transversales del tallo (n = 3), utilizando un taladro de Pressler (diámetro de 0.5 cm) (Pérez-Harguindeguy et al. 2013). Además, se midió el diámetro a la altura del pecho (DAP = 1.30 m del suelo) y la altura en los mismos individuos. Estas especies muestran diferencias contrastantes, puesto que difieren en su hábito foliar y poseen claras diferencias en altura, DAP y densidad de la madera (Tabla 1).
Tabla 1 Descripción y caracterización de especies de estudio.
| Especie | Familia | Hábito foliar | Densidad de madera (g cm-3) |
Diámetro a 1.3 m del suelo (cm) |
Altura (m) |
|---|---|---|---|---|---|
| Olneya tesota | Fabaceae | Perennifolia | 0.8 ± 0.04 | 27.7 ± 8.7 | 5.8 ± 1.2 |
| Ipomoea arborescens | Convolvulaceae | Caducifolia | 0.3 ± 0.03 | 27 ± 2.6 | 5.8 ± 0.3 |
| Jatropha cordata | Euphorbiaceae | Caducifolia | 0.4 ± 0.001 | 11.6 ± 2.9 | 3.7 ± 0.2 |
Olneya tesota (palo fierro) es una especie perennifolia perteneciente a la familia Fabaceae. Forma una madera muy densa y se ha clasificado previamente como madera de anatomía difuso-porosa (Aparecido et al. 2020). El mantenimiento de las hojas, incluso en la estación seca, se atribuye a la extracción de agua de suelo profundo al utilizar raíces pivotantes (Nilsen et al. 1984, Castellanos et al. 2016).
Ipomoea arborescens (palo santo) es una especie caducifolia perteneciente a la familia Convolvulaceae, que produce hojas al inicio de la estación húmeda y las pierde en la estación seca. Su madera es suave de tipo difuso-porosa y puede almacenar pequeñas cantidades de agua en tejidos especializados de los parénquimas radial y conjuntivo (Ceja-Romero & Pérez-Olvera 2016).
Jatropha cordata (papelillo) es una especie caducifolia perteneciente a la familia Euphorbiaceae, que se desprende de sus hojas al terminar la estación húmeda. Tiene un tallo poco denso y semi suculento, con capas de corteza que se desprenden del tallo (Vega-Ruiz et al. 2021). A nuestro conocimiento, no se cuenta con información sobre la anatomía del tallo para la especie.
Mediciones de flujo de savia. Se usó el método de sensores de disipación de calor (TDP) para monitorizar el flujo de savia en especies leñosas (Granier 1985, Lu et al. 2004). Se instalaron un par de sensores en cada individuo para cubrir la variación circunferencial en el tallo (Lu et al. 2004, Vandegehuchte & Steppe 2013), de 11 árboles en total de O. tesota (n = 5), I. arborescens (n = 3) y J. cordata (n = 3). Cada individuo difiere en altura y diámetro del tallo a 1.3 m del suelo (Tabla I), donde J. cordata tiene las menores dimensiones (11.6 cm de diámetro y 3.7 m de altura). Además, los individuos instrumentados estaban visiblemente sanos y tenían su copa completamente expuesta a la radiación solar.
Los sensores se fabricaron en el laboratorio siguiendo métodos previos (Granier 1985, Lu et al. 2004, Davis et al. 2012). Cada sensor está compuesto por un par de sondas (10 mm de longitud y 2 mm de diámetro) con termopares tipo-T cada una; una sonda es de referencia, y la otra sonda es calentada con un elemento calefactor (cobre enrollado). Ambas sondas se insertaron aproximadamente a 1.3 m de altura en el tallo y se colocaron con una separación de 40 mm entre sí. La sonda calentada se instaló en tubos de aluminio con grasa conductora (SuperLube®) para mejorar el intercambio térmico de la sonda calentada y la albura (Davis et al. 2012). Los sensores instalados en el árbol se recubrieron con una cubierta aislante y reflectiva para evitar la exposición directa a la radiación solar y sellada para impedir la infiltración de agua (Yan et al. 2018). Se aplicó energía constante con una potencial de 0.2 Watts para mantener la sonda calentada. La señal de la diferencia de temperatura (∆T) entre las dos sondas se registró cada minuto y se promedió cada 5 minutos en un registrador de datos CR1000 (Campbell Scientific Inc. USA).
Se estimó la densidad de flujo de savia (F d, en g [H2O] cm-2 [albura] s-1) a través de la ecuación empírica propuesta por Granier (1987) y Lu et al. (2004) (Ecuación 1):
donde ∆T equivale a la diferencia de la temperatura entre la sonda de referencia y calentada, durante cada medición. La ∆Tmax se refiere la diferencia máxima de temperaturas entre ambas sondas, condición que se cumple cuando la densidad de flujo de savia no se presenta (F d = 0). Esto sucede normalmente antes del amanecer (3:00 am a 5:00 am), en noches con poco viento, baja demanda evaporativa de la atmósfera (T y VPD) y alta humedad del suelo (Ward et al. 2017).
El procesamiento de datos de flujo de savia se realizó con el paquete AquaFlux (Speckman et al. 2020) en R (R Core Team 2022). Este paquete permite procesar datos para convertir valores de ∆T a F d, usando opciones como 1) selección automática de ∆Tmax, 2) remoción de valores atípicos y 3) rellenado de valores con interpolaciones tipo spline.
Mediciones meteorológicas y de humedad del suelo. El sitio cuenta con una estación micrometeorológica de covarianza de vórtices que monitorea los diferentes sensores para flujos de agua, carbono y energía (Castellanos et al. 2016, Hinojo-Hinojo et al. 2019, Castellanos et al. 2022). En nuestro estudio utilizamos datos de precipitación (P, en mm) obtenidos con un pluviómetro (TR-525M, Texas Electronics, Dallas, Texas), densidad de flujo de fotones de radiación fotosintéticamente activa (PPFD, en µmol m-2 s-1) mediante un sensor cuántico (LI-190, LI-COR, Lincoln, Nebraska), y contenido volumétrico de agua en el suelo a 10 cm (θ; m3 m-3) con dos sensores de humedad del suelo (ML2, Delta-T, Burwell, Cambridge).
Además, se obtuvo la temperatura (T, en °C) y humedad relativa del aire (HR, en %), utilizando un sensor de humedad (HMP-155, Vaisala Inc, Vantaa, Finland). Se utilizaron la temperatura y la humedad relativa del aire para el cálculo de la diferencia de presión de vapor de agua que hay entre las hojas (donde el aire está saturado en su interior) y la atmósfera (con aire más seco (VPD, en kPa), siguiendo fórmulas propuestas en FAO 56 (Allen et al. 2006), como indicador de la demanda evaporativa de la atmósfera (Ecuación 2):
utilizando la T y la HR medidas cada minuto.
Por otra parte, se calculó el agua relativamente extraíble (REW, adimensional) del suelo (Ecuación 3):
donde se usan mediciones de contenido volumétrico de agua en el suelo instantáneas (θ), su valor mínimo (θ mín) y máximo (θ max) del período de estudio. Esta conversión ayuda a estandarizar las mediciones de humedad en el suelo con valores dentro de un rango de 0 a 1 (Granier 1987, Shen et al. 2015).
Mediciones de conductancia estomática y potencial hídrico Se midió la conductancia estomática al vapor de agua (g s, en mmol m-2 s-1) en las especies de estudio (O. tesota, I. arborescens y J. cordata), utilizando un porómetro de difusión de estado transitorio (AP4, Delta-T Devices, Burwell, Cambridge). Las mediciones se realizaron entre 7:30 y 9:00 am en 3-5 hojas expuestas al sol, para cada uno de 3 individuos seleccionados por especie. Los mismos individuos se muestrearon en siete fechas diferentes durante la estación de crecimiento. En los mismos individuos y mismas fechas se midió el potencial hídrico (Ψ, en MPa) antes del amanecer (Ψpd, 5:30-6:00 am) y a mediodía (Ψmd, 12:00-12:30 pm), con una cámara de presión de tipo Scholander (Model 1000, PMS Instruments, Albany, Oregon). Se colectaron tres ramas de aproximadamente 10 cm de longitud de cada individuo, con hojas saludables, para un total de nueve muestras por cada especie. Inmediatamente después de su colecta se almacenaron en bolsas resellables y se colocaron en hieleras en la oscuridad para detener la transpiración y minimizar los cambios en la hidratación antes de hacer la medición. Todas las mediciones de potencial hídrico se realizaron en campo brevemente después de la colecta.
Clasificación de estrategia de uso de agua. Para clasificar a las especies de estudio según su estrategia de uso de agua, se determinó el área de hidroescape (HA, en MPa2). Esta es una forma cuantitativa de clasificar la respuesta de las especies dentro del continuo iso-/anisohídrico (Martínez‐Vilalta et al. 2014a, Fu & Meinzer 2018, Álvarez-Maldini et al. 2021). Para esto, se ajustó una recta en un gráfico de dispersión del Ψpd y Ψmd, y en el mismo gráfico se colocó una línea 1:1. La recta se interpoló hasta la intersección con el eje y, para obtener el valor del Ψmd cuando el Ψpd = 0. Por otro lado, la recta se interpoló hasta la línea 1:1 para conocer el Ψpd menor (Ψpd = Ψmd). Una vez que se trazó la gráfica, se generó un triángulo y se calculó el área de hidroescape (Martínez-Vilalta et al. 2014b, Meinzer et al. 2016) con la ecuación propuesta por Álvarez-Maldini et al. (2021) (Ecuación 4):
donde el coeficiente α es el intercepto de valor del Ψmd cuando el Ψpd = 0. Mientras que β se refiere al valor de Ψpd = Ψmd durante la sequía del suelo.
Análisis de datos. Se realizaron series de tiempo de la densidad de flujo de savia diario (Fd diario) para cada individuo y se realizó estadística descriptiva (promedio ± desviación estándar) para obtener el F d promedio por especie. Estos gráficos se compararon a series de tiempo de las condiciones ambientales, como humedad del suelo, VPD y PPFD. Se optó por dividir el año en dos periodos: el periodo seco (días del año 1-178 y 275-365) y el periodo húmedo (días del año 179-274), correspondiente este último a la estación principal de crecimiento.
Se realizaron regresiones lineales simples para conocer las diferencias de la densidad de flujo de savia a las condiciones ambientales. Para esto, se clasificaron los días a condición de mayor humedad en el suelo (REW > 0.4) y de sequía (REW < 0.4), ya que se considera que las plantas perciben mayor estrés hídrico a una REW < 0.4 (Granier 1987, Shen et al. 2015). Además, la base de datos se delimitó al período en que la vegetación presentó densidad de flujo de savia (día del año 187-270), y se seleccionaron días con alta radiación fotosintéticamente activa (PPFD, 2000 m-2 s-1) y VPD moderado (< 5 kPa) (Poyatos et al. 2013, Sánchez-Costa et al. 2015).
Para el análisis de respuesta de flujo de savia al ambiente, se separó la base de datos de flujo de savia en respuesta a días con condición seca (REW < 0.4) y húmeda (REW ≥ 0.4) en la estación de crecimiento. Después, se aplicaron pruebas de correlación de rangos de Spearman (rho) para probar el efecto de la humedad del suelo (x 1), VPD (x 2) y PPFD (x 3) sobre la densidad de flujo de savia (y) de cada especie. Este análisis estadístico se realizó con el paquete Hmisc en R (R Core Team 2022).
Por último, para caracterizar los atributos funcionales (Ψpd, Ψmd y g s) entre las tres especies, se utilizó estadística descriptiva (promedio ± desviación estándar). Para este análisis, se utilizó la clasificación de humedad y sequía intraestacional propuesta anteriormente, y se encontró que los días 216, 230, 231, 245 y 267 se clasificaron como húmedos (REW ≥ 0.4) y los días 237, 238, 257, 274, como secos (REW < 0.4). Para conocer las diferencias en respuesta de los atributos funcionales en días húmedos y secos, se aplicó una prueba de los rangos con signo de Wilcoxon (W) para comparar la respuesta del mismo atributo de cada especie dependiendo de las condiciones de humedad disponible del suelo.
Resultados
Condiciones meteorológicas y humedad del suelo. El periodo seco (enero a mediados de junio), se caracterizó por alta demanda evaporativa de la atmósfera y poca humedad en el suelo (Figura 2). En este período solo sucedieron cuatro eventos de precipitación pequeños (< 3 mm) y un evento grande (21 mm) que provocó un aumento en la humedad del suelo (REW de 0.1 a 0.8) en febrero del 2021. A partir de este pulso de lluvia, la REW comenzó a disminuir hasta los valores más bajos (0.02), y se observó un aumento gradual en el VPD (hasta 4.9 kPa) y PPFD promedio diurno (hasta 1300 µmol m-2 s-1).
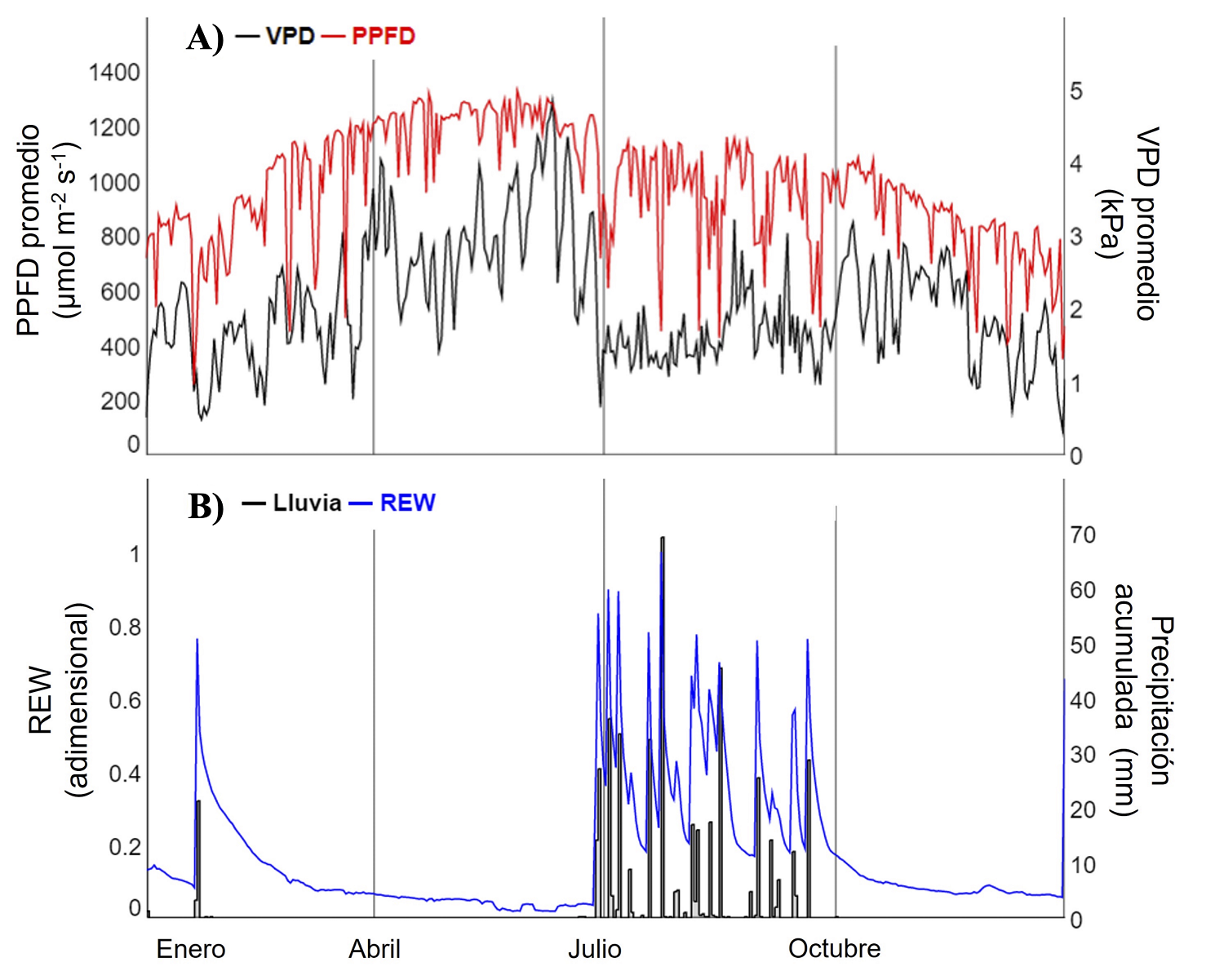
Figura 2 Variación diaria (año 2021) de A) la densidad de flujo de fotones fotosintéticamente activos (PPFD) promedio diurno y déficit de presión de vapor (VPD) promedio diurno, y B) del agua extraíble relativa (REW) y precipitación diaria.
La estación principal de crecimiento de las especies estudiadas se caracterizó por la disminución del VPD y el aumento de la humedad en el suelo, y corresponde al período de lluvias (Figura 2). Durante este periodo, se acumuló un total de 442.7 mm de lluvia. El primer evento de precipitación fue de 14 mm el 28 de junio y, a partir de esta fecha, se registraron eventos de magnitud y periodicidad variables. El evento más grande fue de 69 mm de lluvia el 24 de julio. El VPD disminuyó abruptamente y varió de 0.6 a 3.6 kPa, mientras que el PPFD promedio diurno disminuyó de 1,200 a 800 µmol m-2 s-1 a lo largo de la etapa de crecimiento. A pesar de ser un periodo húmedo, se detectaron días de condición húmeda (REW ≥ 0.4) y periodos de condición seca (REW < 0.4) entre cada evento de lluvia.
Variación estacional de flujo de savia. Durante el periodo seco, solo fue posible detectar baja densidad de flujo de savia (F d) en la especie perennifolia O. tesota (Figura 3A), pero no en las especies caducifolias, I. arborescens y J. cordata (Figura 3B y 3C). Los valores de F d en O. tesota durante el periodo seco se relacionaron con días lluviosos entre enero-febrero. Sin embargo, también fue posible detectar baja F d durante marzo-junio, aun siendo días con poca humedad del suelo superficial y alta demanda evaporativa.
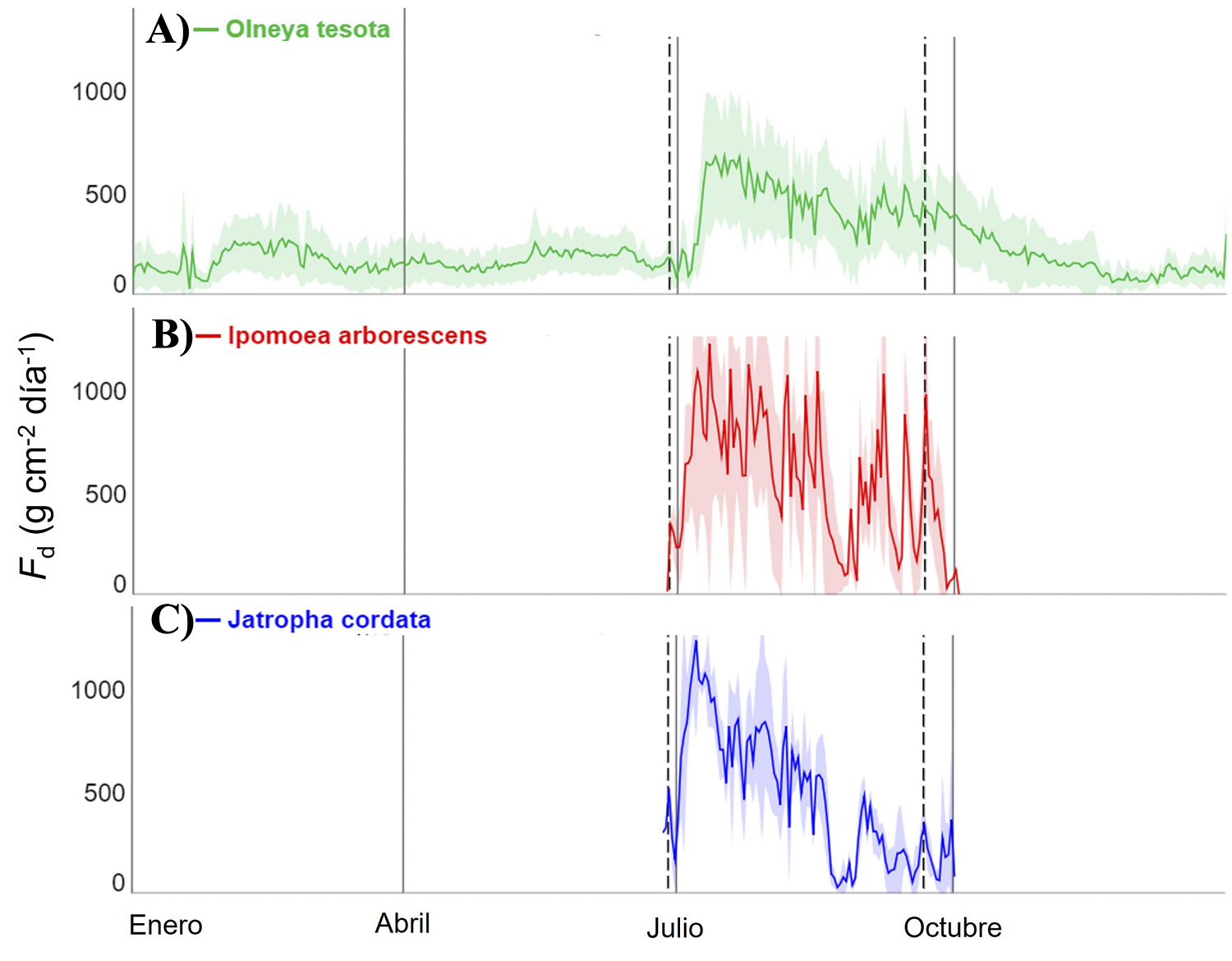
Figura 3 Flujo de savia (valores diarios acumulados) de A) O. tesota, B) I. arborescens y C) J. cordata durante el año 2021. El sombreado de las líneas representa la desviación estándar. La temporada de crecimiento aparece delimitada entre dos líneas punteadas que marcan el inicio y fin de la estación húmeda.
Al iniciar el periodo húmedo, las tres especies respondieron en cuestión de horas a la precipitación y alcanzaron tasas perceptibles de Fd (Figura 3). La especie caducifolia J. cordata alcanzó la máxima Fd (1,233 g cm-2 día-1) de manera más rápida, tan solo 12 días después del primer evento de lluvia (Figura 3C), de las tres especies en estudio. Por otra parte, la especie caducifolia I. arborescens alcanzó su máximo de Fd (1,223 g cm-2 día-1) 14 días después de la primera lluvia (Figura 3B). Por último, la perennifolia O. tesota alcanzó su Fd máxima (677 g cm-2 día-1) a los 16 días después del primer evento de precipitación (Figura 3A).
Para las tres especies, se observaron diferencias en la Fd durante los periodos intra-estacionales de días secos que existieron dentro de la temporada de lluvias. Las especies caducifolias, I. arborescens y J. cordata (Figura 3B y 3C), mostraron una reducción de Fd hasta valores casi nulos en días con condiciones de sequía. Por otra parte, la Fd de la especie perennifolia O. tesota (Figura 3A) varió desde 677 a 253 g cm-2 día-1 durante toda la temporada de crecimiento, manteniéndose dentro de un rango de valores relativamente constante. En esta especie, los valores en la densidad del flujo de savia fueron disminuyendo hacia el final de la temporada de crecimiento, pero nunca cesaron por completo.
Variación diaria de flujo de savia. Se encontraron diferencias en Fd en días húmedos y secos (Figura 4). En días húmedos (Figura 4A), el flujo de savia de las tres especies siguió el curso de una curva con forma de campana debido a que no hay limitaciones por agua (REWmedia = 0.35). Durante los cinco días, el flujo de savia de las tres especies inició con un incremento abrupto a las 5:00, en conjunto al amanecer (PPFD > 0), hasta alcanzar los valores máximos alrededor del mediodía, entre 12:00-14:00. Ninguna especie mostró alguna disminución de la curva de flujo de savia a mediodía (i.e. mid-day break) en respuesta a alto VPD. En ocasiones (27 y 30 de julio) se observó una disminución del flujo de savia, pero se asoció más a la disminución de la PPFD por nubes.
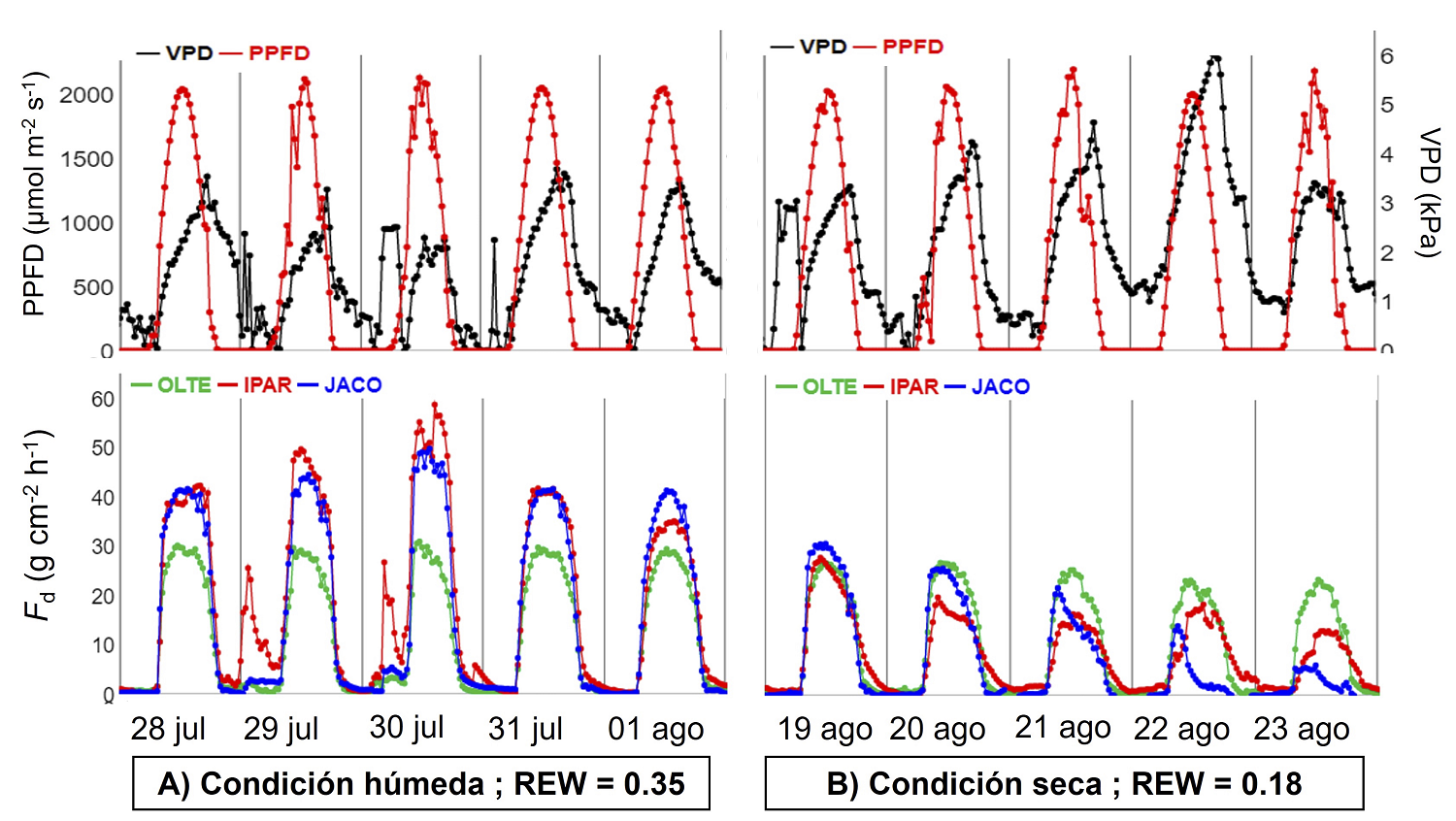
Figura 4 Patrón diario de flujo de savia en A) condiciones húmedas y B) condiciones secas intra-estacionales. En los gráficos superiores se encuentra el PPFD y el VPD en negro y rojo, respectivamente. En gráficos inferiores se observa O. tesota con una línea verde, I. arborescens con una línea roja y J. cordata con una línea azul.
En días con condición seca (Figura 4B), con la disminución en la humedad del suelo (REWmedia = 0.18) y al alza en la demanda evaporativa de la atmósfera (VPD ± 5-6 kPa), la densidad del flujo de savia disminuyó en las tres especies, aunque se comportaron de forma distinta. La especie perennifolia O. tesota, redujo su F d a una tasa máxima de 20 g cm-2 h-1, y mantuvo un patrón similar de la curva con forma de campana. Por otra parte, las caducifolias I. arborescens y J. cordata redujeron drásticamente Fd en el mismo período de días secos (3-6 g cm-2 h-1), modificando el patrón con forma de campana a formas menos regulares.
Durante la noche se observó baja actividad de flujo de savia en algunas especies, sin embargo, en noches con humedad en el suelo y menor VPD (2.5 kPa), se observó flujo de savia nocturno en las tres especies, en particular en I. arborescens (29 y 30 de julio, Figura 4A).
Flujo de savia en respuesta a diferentes condiciones del suelo y factores ambientales. Solamente en condiciones de sequía en el suelo (REW < 0.4) se encontró que existe una correlación positiva entre el flujo de savia de las tres especies y la humedad del suelo (Tabla 2). Las especies con mayor correlación con la humedad del suelo son I. arborescens (r = 0.67, P < 0.01) y J. cordata (r = 0.53, P < 0.01), mientras que en O. tesota fue menor (r = 0.43, P < 0.01). No se encontraron correlaciones significativas entre la humedad del suelo y F d en condiciones de mayor humedad disponible en el suelo (REW ≥ 0.4, Tabla 2). Esto ilustra la importancia de la humedad sobre el flujo de savia cuando hay limitaciones por agua.
Tabla 2 Valores de correlación de Spearman entre el flujo de savia (y) de las tres especies en condiciones húmedas (REW ≥ 0.4) y secas (REW < 0.4) de la humedad del suelo superficial, el déficit de presión de vapor (VPD) y densidad de flujo de fotones fotosintéticamente activos (PPFD). Los asteriscos representan relaciones significativas (* = P < 0.05 ; ** = P < 0.01).
| Flujo de savia | Condición | REW0-10 | VPD | PPFD |
|---|---|---|---|---|
| Olneya tesota | REW < 0.4 (n = 52) | 0.43** | -0.28* | 0.35** |
| REW ≥ 0.4 (n = 31) | -0.12 | -0.38* | 0.52** | |
| Ipomoea arborescens | REW < 0.4 (n = 52) | 0.67** | -0.44** | 0.12 |
| REW ≥ 0.4 (n = 31) | 0.03 | -0.24 | 0.47** | |
| Jatropha cordata | REW < 0.4 (n = 52) | 0.53** | -0.41** | 0.21 |
| REW ≥ 0.4 (n = 31) | -0.11 | -0.16 | 0.59** |
Por el contrario, se encontró correlación negativa entre el flujo de savia y el VPD en condiciones de sequía (REW < 0.4) para todas las especies (Tabla 2). En otras palabras, F d disminuye conforme aumenta el VPD en condiciones de estrés hídrico, particularmente para las especies caducifolias I. arborescens (r = -0.44, P < 0.01) y J. cordata (r = -0.41, P < 0.01), y menor para O. tesota (r = -0.28, P < 0.01). También una correlación negativa y significativa (r = -0.38, P < 0.05) se encontró para O. tesota en días con mayor humedad superficial en el suelo.
Por último, se encontró correlación positiva entre Fd y la PPFD para las tres especies, bajo condiciones húmedas (Tabla 2). Aquí, las tres especies mostraron correlaciones similares, J. cordata (r = 0.59, P < 0.01), O. tesota (r = 0.52, P < 0.01), e I. arborescens (r = 0.47, P < 0.01).
Cambios en conductancia estomática en días secos y húmedos. Las tres especies mostraron mayor conductancia estomática (g s) en días húmedos en comparación con los días secos, pero de manera diferenciada (Figura 5). La menor reducción en la g s (solo 1.8 veces) se encontró en la especie perennifolia, O. tesota, de 204.5 ± 80.6 mmol H2O m-2 s-1 en días de mayor humedad a 110.2 ± 56.9 mmol H2O m-2 s-1 en días con menor humedad en el suelo (W = 3,871.5, P < 0.05). También corresponde a esta especie la g s más alta registrada durante los días secos (Figura 5A). En contraste, I. arborescens redujo la g s casi 22.3 veces (W = 4,284, P < 0.05), de 371.7 ± 169.6 mmol H2O m-2 s-1 en días húmedos, a 16.7 ± 15.9 mmol H2O m-2 s-1 en días secos (Figura 5B). Por último, J. cordata una especie caducifolia como la anterior, modificó la g s (W = 2,930, P < 0.05) en forma intermedia a las anteriores, de 363.5 ± 194.3 mmol H2O m-2 s-1 en condiciones de mayor humedad en el suelo, a 29.5 ± 31.7 mmol H2O m-2 s-1 en días secos (Figura 5C).
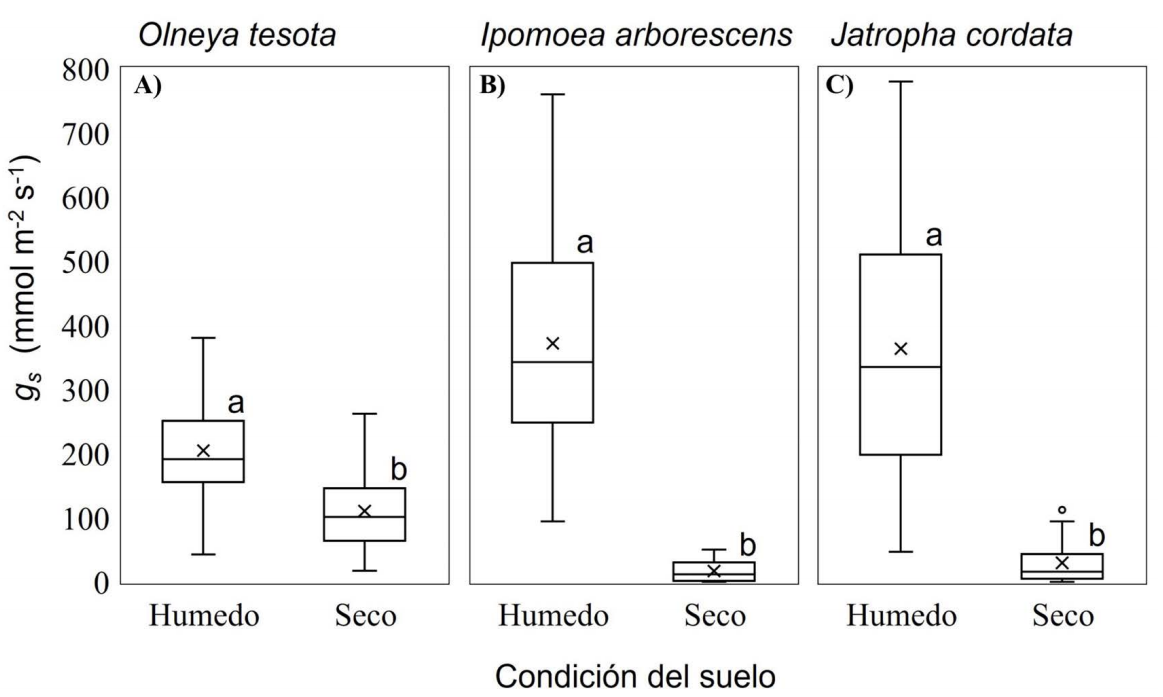
Figura 5 Variación de la conductancia estomática (g s) de A) O. tesota, B) I. arborescens y C) J. cordata, en días húmedos (REW ≥ 0.4) y secos (REW < 0.4) intra-estacionales. Las cruces representan la g s promedio. Diferentes letras (a, b) denotan diferencias significativas en g s entre condiciones de humedad del suelo (P < 0.05).
Cambios en el potencial hídrico en días secos y húmedos. Las tres especies siempre muestran una progresión de disminución en su potencial hídrico del amanecer (Ψpd) al mediodía (Ψmd), tanto en días húmedos como en días secos (Figura 6). La especie con los valores más negativos de Ψmd (hasta -3 MPa) y mayor variación diurna entre Ψpd y Ψmd (∆Ψ = 1.39 MPa) fue O. tesota (Figura 6A). Tuvo además diferencias significativas entre condiciones húmedas y secas en sus potenciales hídricos al amanecer (Ψpd; W = 1,347.5, P < 0.01) y el mediodía (Ψmd; W = 1,753, P < 0.01).
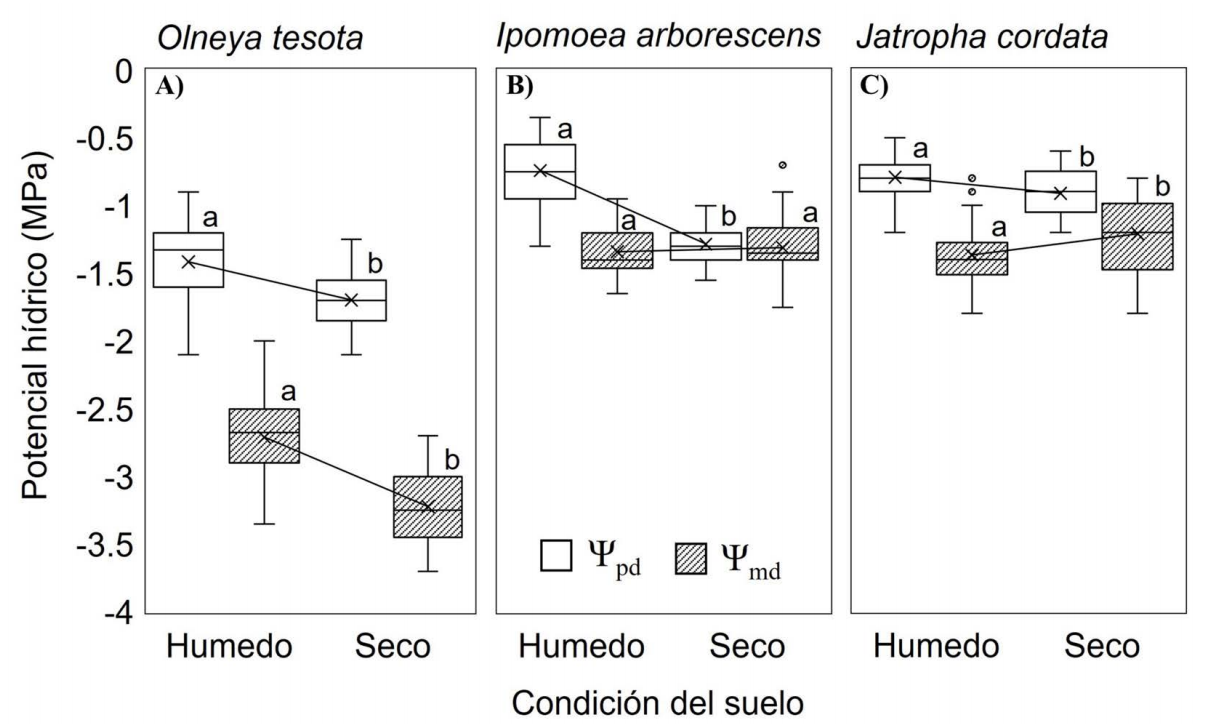
Figura 6 Variación del potencial hídrico antes del amanecer (Ψpd, cajas blancas) y al mediodía (Ψmd, cajas rayadas) de A) O. tesota, B) I. arborescens y C) J. cordata, en días húmedos (REW ≥ 0.4, días 216, 230, 231, 245 y 267) y secos (REW < 0.4, días 237, 238, 257, 274) intra-estacionales. Las cruces representan el Ψ promedio. Diferentes letras (a, b) denotan diferencias estadísticamente significativas (P < 0.05) entre condiciones del suelo y tipo de potencial hídrico en cada especie.
En contraste, las especies caducifolias mostraron respuestas muy similares en sus diferencias de potencial hídrico durante el día. I. arborescens (Figura 6B) mantuvo valores similares del Ψpd y del Ψmd en todo tiempo con una variación muy estrecha en sus potenciales diurnos (∆Ψ = 0.37 MPa) bajo condiciones húmedas y secas. El Ψpd en días de humedad fue ligeramente mayor (-0.7 ± 0.2 MPa; W = 1,699, P < 0.01), sin embargo, los valores de Ψmd (-1.3 ± 0.2 MPa) no fueron significativamente diferentes en ambas condiciones. La otra especie, J. cordata (Figura 6C) mantuvo también escasa variación diurna (∆Ψ = 0.47 MPa) tanto en días húmedos y secos, Ψpd poco diferentes entre días húmedos y secos (-0.8 ± 0.2 MPa; W = 1,153.5, P < 0.01), pero en contraste con I. arborescens, con menor Ψmd en días húmedos (-1.4 ± 0.2 MPa; W = 458.5, P < 0.05).
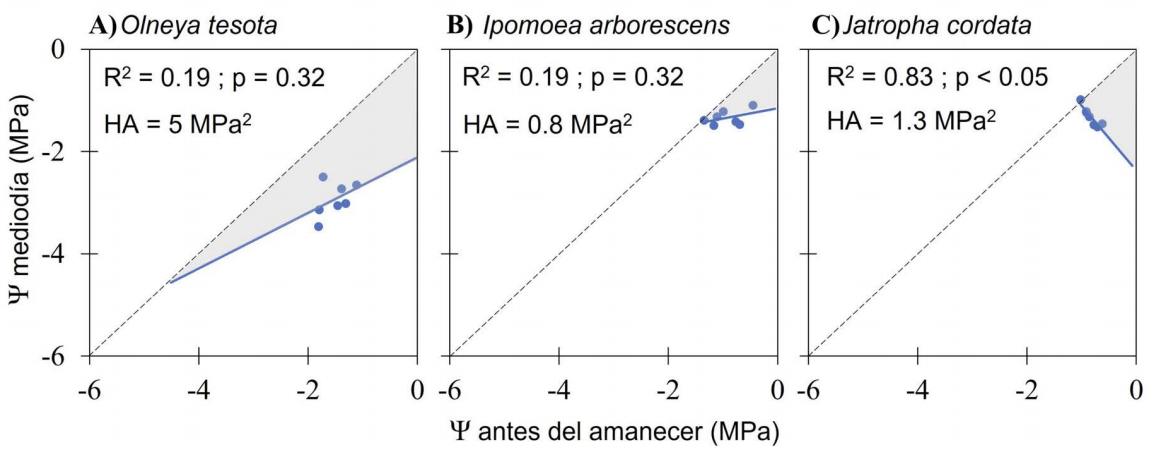
Estrategias hídricas. El área de hidroescape (HA) tuvo un rango de variación de 0.8 a 5 MPa2 entre las tres especies de estudio (Figura 7). La especie que opera dentro de un mayor rango fue O. tesota con un HA de 5 MPa2 (r 2 = 0.19, P = 0.32). La especie J. cordata tuvo un rango de operación intermedio, con un HA de 1.3 MPa2 (r 2 = 0.83, P < 0.05); sin embargo, se observó un comportamiento inverso al esperado. Por último, la especie con menor rango de operación fue I. arborescens con un HA de 0.8 MPa2 (r 2 = 0.19, P = 0.32).
Discusión
En este trabajo se monitorizaron los flujos de savia de tres especies dominantes con diferentes estrategias morfoestructurales, en un matorral subtropical dentro de los límites del Desierto Sonorense en el Noroeste de México. Hasta donde conocemos, este es el primer estudio publicado sobre el flujo de savia en especies arbóreas del Desierto Sonorense en México.
La dinámica del flujo de savia responde a la existencia de un gradiente de potencial hídrico entre el suelo, la planta y la atmósfera (Zimmermann et al. 1995, Asbjornsen et al. 2011). Dos funciones determinantes en la regulación del flujo de savia son la conductividad hidráulica y la conductancia estomática, generando diferentes estrategias de transporte de agua y transpiración en las especies, mientras se evita la formación del embolismo en vasos del xilema en los tallos (Domec & Gartner 2003, Donovan et al. 2003). Conocer los patrones de densidad de flujo de savia en especies codominantes, permite entender mejor las estrategias adaptativas existentes en comunidades vegetales de zonas áridas y semiáridas, caracterizadas por condiciones de alta variabilidad en la disponibilidad de agua en el suelo.
Dinámica del flujo de savia en tres especies co-dominantes durante la temporada de crecimiento. En comunidades vegetales del Desierto Sonorense, la estación de crecimiento puede restringirse a períodos de precipitación no mayores a tres meses. Incluso, aún en la misma estación de crecimiento, entre cada pulso de precipitación, existen periodos cortos de sequía intra-estacional, caracterizados por poca humedad del suelo y alto VPD (Munson et al. 2021). Generalmente, el flujo de savia y otros atributos de respuesta, como la actividad fotosintética y la conductancia estomática, están restringidos a la estación húmeda (Pataki et al. 2000, Zha et al. 2017, Yan et al. 2018), principalmente a eventos de precipitación grandes que recargan la humedad en el suelo (Zeppel et al. 2008a). Debido al estrés hídrico prolongado en las plantas provocado por estos periodos intra-estacionales de sequía, es de esperar una disminución en los flujos de savia y la productividad al cerrar estomas y limitar la asimilación de CO2 (McDowell 2011, Martínez-Vilalta et al. 2014b). En nuestro estudio encontramos que este patrón, aunque generalizable, presentó diferentes dinámicas entre las tres especies.
En la especie perennifolia O. tesota, la densidad de flujo de savia se pudo observar durante todo el año. Aun cuando sus valores de flujo se incrementan con las primeras lluvias del monzón de verano, fue la especie que mostró la menor disminución durante los períodos secos y bajas correlaciones con la humedad en el suelo (Tabla 2). Las bajas correlaciones sugieren que todas estas variables interactúan con el flujo de savia en la especie, pero la afectan de forma moderada. En especies perennifolias se ha encontrado una menor sensibilidad de la gs al VPD (Klein 2014, Grossiord et al. 2020), similar a lo que encontramos en días secos en el estudio. La estrategia de O. tesota es la apertura prolongada de estomas lo que disminuye el potencial hídrico de la planta, aunque permite una menor inanición de carbono y productividad sostenida durante mayor parte de la estación de crecimiento. Una desventaja de la apertura prolongada de estomas durante una sequía es la vulnerabilidad del xilema y el rompimiento de la columna de agua (cavitación), aunque la presencia de madera muy densa y pequeños vasos conductores en la especie, la hacen menos vulnerables a la cavitación (Hacke et al. 2001, Rosner 2017, de Guzman et al. 2021), al mismo tiempo que parece disminuir su eficiencia hidráulica (Song et al. 2022).
Los patrones diarios de flujo de savia en O. tesota se mantuvieron durante toda la estación de crecimiento, los cuales disminuyen poco entre períodos de condiciones de humedad mayor (Figura 4A) respecto a los de condiciones más secas (Figura 4B). La tendencia a la disminución estacional en Fd parece seguir el patrón estacional de menor disponibilidad en agua en la superficie ya que esta especie puede emplear un sistema radical dimórfico (Gou et al. 2018), con un perfil de absorción superficial y otro profundo (Nilsen et al. 1984, Zeppel et al. 2008b, Castellanos et al. 2016). Conforme disminuye la disponibilidad de la humedad del suelo superficial, el sistema radical más profundo parece mantener la actividad del flujo de savia, al tiempo que el potencial hídrico disminuye. La disminución en el potencial hídrico en la especie está asociada a la anisohidria y a la absorción de agua a niveles más profundos (Ding et al. 2020). Esta especie absorbe agua de niveles más profundos (Castellanos et al. 2016), a los que ha infiltrado el agua de lluvias antecedentes, lo que permite mantener el flujo de savia y la transpiración todo el año (Figura 3).
El flujo de savia en las especies caducifolias (I. arborescens y J. cordata), aunque con ciertas coincidencias en su respuesta a los pulsos de precipitación, mostraron diferencias importantes. Cuando se observa la reducción del flujo de savia por el tallo puede atribuirse al cierre estomático al disminuir el potencial hídrico en respuesta a la sequía, lo que sugiere un uso conservativo del agua cuando se encuentra limitando (Cavaleri et al. 2014). Esta estrategia causa limitación en la entrada de carbono y la fotosíntesis, generando condiciones de inanición de carbono (McDowell et al. 2008, McDowell 2011, McDowell et al. 2011), de tal manera que su productividad se restringe a períodos relativamente cortos de humedad, posteriores a los pulsos de precipitación que se presentan en el sitio. Además, el acoplamiento existente entre la humedad en el suelo a 10 cm y el flujo de savia de I. arborescens se refleja en la inmediatez de la respuesta del F d a los eventos de precipitación. Este acoplamiento en F d sugiere que el suministro de agua de la especie es principalmente de niveles someros del suelo, lo que se ha asociado a la mayor densidad de raíces en perfiles superficiales (Sánchez-Costa et al. 2015, Castellanos et al. 2016).
Por otro lado, en J. cordata, aun cuando existe una correlación significativa con la humedad somera en el suelo, la F d continúa decayendo durante toda la época de crecimiento a partir de un máximo inicial, lo que refleja su dependencia de la disponibilidad de agua a profundidades mayores que no están totalmente saturadas por los pulsos de precipitación que se presentan conforme la estación de crecimiento progresa, dada la mayor insaturación en la humedad superficial (Figura 3).
Es evidente que ambas especies caducifolias emplean distintas estrategias para utilizar los pulsos de precipitación y resistir a la sequía. Por un lado, I. arborescens puede sobrevivir a cortos periodos de sequía por medio del cierre estomático (Figura 5B) y la regulación de F d (Figura 3), sin embargo, presenta reducciones importantes en F d al ampliarse el número de días secos. La dinámica estacional sugiere que la absorción y el uso de agua de esta especie podría estar limitada solo a días húmedos y el uso de un fuerte control estomático, así como el uso de reservas internas de agua que serviría para mantener el F d y evitar embolismo excesivo en respuesta a la sequía atmosférica y del suelo. Se ha reportado que esta especie puede almacenar agua en el tejido interno del tallo en condiciones de sequía (Ceja-Romero & Pérez-Olvera 2016), permitiendo mayor regulación y menor efecto en F d (Figura 3). Esto es más notorio en los cortos periodos de sequía durante la estación de crecimiento, donde se observó una reducción gradual en el flujo de savia de esta especie (Figura 4), posiblemente en respuesta al VPD y la disminución del agua disponible en el suelo. Las reservas de agua podrían funcionar para regular el flujo de agua durante los periodos cortos de sequía entre diferentes pulsos de precipitación, aunque pueden ser importantes también, para la supervivencia de la especie durante los largos períodos en que los individuos se mantienen sin hojas. También se observó que esta especie mantuvo valores muy similares del Ψmd y del Ψpd en condición seca, en comparación al Ψmd en días húmedos (Figura 6), lo que refuerza la idea sobre el rango de operación tan estrecho de esta especie y su mayor vulnerabilidad hidráulica (Powers et al. 2020).
En cambio, J. cordata emplea mecanismos diferentes para mantener su Fd durante periodos cortos y largos de sequía intra-estacional. Esta especie tiene fuerte regulación estomática (Figura 5C) y redujo su flujo de savia en días secos en respuesta a la poca disponibilidad de humedad en el suelo y VPD alto (Figura 3). La especie posee un tallo semi-suculento con alta concentración de ácido fenólico y flavonoides (Vega-Ruiz et al. 2021), sin embargo, no se han reportado grandes reservas de agua en sus tallos. J. cordata tiene un acoplamiento alto entre el flujo de savia y el VPD en días secos. Se han documentado ajustes osmóticos en raíces de algunas especies de Jatropha (J. curcas), conforme disminuye la humedad en el suelo, principalmente por tetra- y trisacáridos (estaquiosa y rafinosa), aumentando la turgencia radical y foliar (Silva et al. 2010, Winaya et al. 2020) y la conductividad hidráulica aún a pesar del cierre estomático. En este estudio se encontró que el Ψmd fue menos negativo en días secos en comparación con los días húmedos, lo que sugiere mecanismos diferentes de compensación y de conductividad hidráulica inmediatamente después del cierre estomático, aunque mantiene tasas similares en Fd al iniciar condiciones de limitación en la disponibilidad de agua en el suelo (Figura 4).
Diferentes estrategias hídricas en árboles coexistentes. La larga estación de sequía presente en el Desierto Sonorense representa condiciones de estrés hídrico prolongado para las especies de estudio. Las especies caducifolias I. arborescens y J. cordata, reducen el periodo de actividad foliar a la temporada de crecimiento del monzón de verano, y evitan la sequía utilizando mecanismos de pérdida total de hojas, que limita la superficie de transpiración y pérdida de agua (Lambers & Oliveira 2019).
En especies perennifolias, la menor densidad de flujo de agua se ha asociado con una mayor densidad en la madera (Wheeler & Baas 1993), su conductancia estomática y capacidad fotosintética (Lapa et al. 2017), y la humedad en el suelo que se modifica inter- e intra-estacionalmente. Por ejemplo, la especie perennifolia O. tesota, disminuyó su conductancia estomática durante la sequía intra-estacional (entre pulsos de precipitación, Noy-Meir 1973), aunque mantuvo tasas de flujo de savia similares durante toda la estación de crecimiento del verano. Bajo condiciones de sequía inter-estacional el resto del año, empleó mecanismos diferentes para mantener el flujo de agua y evitar el daño por el mayor estrés hídrico. Estudios previos en el mismo sitio, muestran que durante la sequía inter-estacional, esta especie modifica el intercambio gaseoso y la pérdida de agua al reducir el índice de área foliar (Hinojo-Hinojo et al. 2019).
Olneya tesota puede también desacoplar su actividad fisiológica de la estación de precipitación de verano y mantener el flujo de savia (Fd) utilizando su sistema radical doble que le permite extraer humedad de perfiles de suelo de hasta 2 m de profundidad (Castellanos et al. 2016, 2022). Una estrategia similar se ha reportado para otras freatofitas como el mezquite (Prosopis velutina) en Norteamérica que realiza intercambio de agua, carbono y energía en la estación seca (Scott et al. 2004, Yepez et al. 2007), así como en eucaliptos (Eucalyptus parramattensis) de zonas semiáridas en Australia (Zeppel et al. 2008b).
Es de esperar la existencia de distintas estrategias de uso de agua en árboles coexistentes, dadas las diferentes respuestas fisiológicas de las plantas a variables ambientales (Bovard et al. 2005, Zeppel et al. 2008b, Martínez-Vilalta et al. 2014a, Wu et al. 2018, Yan et al. 2018). Una hipótesis importante es la segregación de nicho hidrológico (Silvertown et al. 2015, Rodríguez-Robles et al. 2020), que describe cómo plantas coexistentes pueden obtener y usar agua debido a diferencias morfológicas y funcionales, generando nichos espacial- y temporalmente distintos. Esto aún no ha sido suficientemente estudiado en las especies de plantas del Desierto Sonorense, en particular, al integrar variables ecofisiológicas de sus adaptaciones hídricas.
Por ejemplo, las diferencias en conductancia estomática y potencial hídrico nos dan idea de la posición de las especies en el continuo iso - anisohídrico, lo cual se relaciona con la regulación estomática, el flujo de agua y la tolerancia a la sequía (Meinzer et al. 2016, Fu & Meinzer 2018, Álvarez-Maldini et al. 2021). En este estudio, el comportamiento de O. tesota se relacionó con una especie anisohídrica (Figura 7A). La magnitud del área de hidroescape se registró en previos estudios, y se encontraron valores similares que clasifican a Olneya tesota como una anisohídrica (González-Rebeles et al. 2021). O. tesota mostró menor regulación estomática, cambios importantes en su Ψ, y mayor área de hidroescape. En cambio, las especies caducifolias, I. arborescens y J. cordata, se comportaron como isohídricas por su regulación estricta de la conductancia estomática, cambios mínimos en Ψ, y menores áreas de hidroescape.
En este estudio, la regulación de la conductancia estomática sobre el potencial hídrico y el flujo de savia jugó un papel clave en la resistencia a la sequía. Esto se observa en días donde las plantas reducen su conductancia estomática y por ende se reduce el flujo de savia, donde se evidencia que las plantas regulan la apertura estomática para seguir captando CO2 y modular la pérdida de agua en las hojas (Wu et al. 2020). Además, los estomas cierran en respuesta al alza en la demanda evaporativa de la atmósfera, utilizando tanto señales de la disponibilidad de agua en el suelo (retroalimentación - feedback), como de respuestas anticipatorias en las células guarda (protoalimentación - feedforward) para reducir la pérdida de agua en respuesta a una atmósfera seca y evitar estrés hídrico (Lambers & Oliveira 2019). Es posible que ambos tipos de respuesta incidan de manera diferenciada en las respuestas de las especies estudiadas. Por ejemplo, en el caso de las especies caducifolias I. arborescens y J. cordata, parecería que la mayor regulación de la conductancia estomática es en respuesta a cambios en el VPD (protoalimentativa), lo que limita la pérdida de agua y reduce el flujo de savia en el tallo. Es posible que en J. cordata también ocurra una fuerte retroalimentación con la humedad relativa disponible en el suelo. La mayor sensibilidad a la humedad relativa disponible en el suelo (retroalimentación), podría ser la principal estrategia de la especie perennifolia O. tesota, para mantener flujos de savia muy similares durante gran parte de la estación de crecimiento durante el monzón de verano.
En este estudio analizamos la dinámica estacional y diurna de la densidad de flujo de savia en tres especies coexistentes Olneya tesota, Ipomoea arborescens y Jatropha cordata en un ecotono entre el matorral desértico y el matorral subtropical en el Desierto Sonorense. Las especies más sensibles a la sequía fueron I. arborescens y J. cordata, debido a su control estomático estricto, su comportamiento isohídrico y una mayor disminución en su ganancia de carbono por inanición. Por otro lado, la especie menos vulnerable es O. tesota, que mostró rasgos de anisohídria, dado su menor control estomático, mayor variabilidad en el control de su potencial hídrico, dependencia de la humedad en suelo con mayor profundidad y menor variación, y períodos mayores de ganancia de carbono.
En conclusión, no hay una estrategia única para sobrevivir en zonas áridas. Las tres especies emplearon estrategias diferentes en el uso de agua, que están relacionadas con diferentes atributos que determinan sus nichos hidrológicos. Los mecanismos del nicho evaluados en el estudio están determinados por diferencias en la profundidad de las raíces, distinta disponibilidad y temporalidad de humedad en el suelo y uso de agua, diferentes respuestas de los estomas en las hojas al VPD, y de la planta al potencial hídrico del suelo. Estos resultados podrán ayudar a la estimación confiable de la transpiración y la variabilidad en la productividad estacional e interanual en estos ecosistemas del Desierto Sonorense, pues considera los mecanismos fisiológicos de las especies más representativas en este ecosistema características del matorral desértico y subtropical. Este estudio contribuye también a mejorar los escenarios de las posibles consecuencias e incremento de la mortalidad de algunas de las especies estudiadas, dado la modificación de los pulsos y la menor precipitación esperados debido al cambio climático en la región.











 nova página do texto(beta)
nova página do texto(beta)