Agave potatorum Zucc. (Asparagaceae), “maguey tobalá”, endémico de México, se distribuye solo en dos estados del país (Oaxaca y Puebla) en ambientes áridos y en bosque tropical caducifolio. Esta especie cumple con valiosos servicios ecológicos, ya que evita la erosión, ayuda a la recarga de mantos freáticos, es refugio para otros organismos y es fuente de agua y alimentos empleados por el ser humano. Sus flores se utilizan en la alimentación, al igual que el pedúnculo floral cuando éste ha comenzado su desarrollo; tiene aplicaciones medicinales, las hojas se usan para disminuir inflamaciones y para el tratamiento de lesiones internas tanto de humanos como de animales domésticos. Sin embargo, su uso principal es para la elaboración de mezcal, bebida con reconocimiento nacional e internacional. Esta actividad es prioritaria debido a la derrama económica en diferentes comunidades del país (García-Herrera et al. 2010, Narváez-Suárez et al. 2016, García-Mendoza et al. 2019, Martínez-Jiménez et al. 2019). Es por dicha actividad que la especie enfrenta una seria problemática que amenaza su sobrevivencia, ya que, para la elaboración de mezcal, se corta el pedúnculo floral inmaduro, impidiendo la formación y polinización de flores, lo que al mismo tiempo imposibilita el desarrollo de semillas, de las cuales A. potatorum depende para sobrevivir pues se considera que no se propaga vegetativamente. Esto es crucial puesto que A. potatorum alcanza su madurez a una edad de entre 8 a 12 años, y al ser monocárpica, los individuos tienen un solo evento reproductivo y posteriormente mueren. Pese a su importancia, poco o nada se cultiva y es saqueada de sus poblaciones silvestres, las cuales han disminuido (Illsley-Granich & Torres-García 2004, Michel-Cuello 2010, Delgado-Lemus et al. 2014, Godínez-Hernández et al. 2016, García-Mendoza & Franco-Martínez 2018).
En el año 2021 se reportó que “el director de la Reserva de la Biósfera Tehuacán-Cuicatlán, Fernando Reyes Flores, advirtió del saqueo de A. potatorum asociado a la producción de mezcal y que su extracción ilegal ha aumentado hasta un 300 % en la zona” (Hernández 2021).
La extracción de A. cupreata y A. potatorum para la producción de bebidas ha provocado una disminución de las poblaciones silvestres, por lo que hay preocupación por la conservación de estas especies. Esta situación afecta seriamente a los ecosistemas, agravando los efectos del cambio climático, erosionando, debilitando el terreno y poniendo en serio riesgo a las comunidades por el desgajamiento de las colinas que habitan (Aguirre-Dugua & Eguiarte 2013).
Ante la urgente necesidad de producir plantas con la mayor diversidad genética posible con fines de reforestación y económicos, una alternativa es el cultivo de tejidos vegetales, rama de la biotecnología a través de la cual, una vez superada la fase experimental, se ha demostrado que es posible propagar in vitro numerosas plantas en menor tiempo que por métodos convencionales (Good-Avila et al. 2006, Robert et al. 2006, Davies & Gan 2012).
Para el género Agave, existen diferentes estudios que reportan la regeneración de brotes y plantas completas en medio MS (Murashige & Skoog 1962): Vía organogénesis: A. sisalana, a partir de hojas con 6-Bencilaminopurina (BAP) 26.6 μM (Hazra et al. 2002). A partir de tallos de A. karwinskii con BAP 1.0 mg/L; A. cupreata: BAP 1.5 mg/L; A. potatorum con kinetina (KIN) 3.0 mg/L (Domínguez-Rosales et al. 2008). Por embriogénesis somática a partir de tallos: A. victoriae-reginae con ácido 2,4-Diclorofenoxiacético (2,4-D) 2.26 μM (Martínez-Palacios et al. 2003); y A. fourcroydes, con Dicamba 2.26 μM (Monja-Mio & Robert 2013); a partir de hojas A. tequilana con 2,4-D 3 mg/L complementado con BAP 0.3 mg/L (Rodríguez-Sahagún et al. 2011).
Respecto a la propagación in vitro de A. potatorum, Ramírez-Mosqueda et al. (2022) obtuvieron 9.87 brotes por explante con 3 mg/L de BAP en combinación con 3 mg/L de AIA (ácido indol-3-acético). Bautista-Castellanos (2019) regeneró 15.3 brotes por explante con 3 mg/L de BAP. Enríquez-del Valle et al. (2016) llevaron a cabo la regeneración in vitro de A. potatorum obteniendo de 6-12 brotes por explante con 1 mg/L de BAP. Mientras que Domínguez-Rosales et al. (2008) regeneraron 6.9 brotes por explante con 2 mg/L de KIN. En dichos estudios la regeneración fue vía organogénesis, emplearon tallos como fuente de explantes y usaron medio de cultivo MS. A pesar de las citadas investigaciones, subsiste la falta de plantas por lo que es urgente definir y aplicar sistemas eficientes de propagación a partir de semillas que permitirían la conservación de su variabilidad genética intrínseca. En el presente estudio se describe la propagación de A. potatorum a través de secciones obtenidas de plántulas germinadas in vitro.
Materiales y métodos
Semillas maduras de A. potatorum fueron colectadas en 2019 en el municipio de Santa María Sola de Vega, Oaxaca; fueron almacenadas en bolsas de papel estraza y refrigeradas (5 °C) por 6 meses hasta su uso.
Desinfección del material vegetal. Bajo condiciones asépticas en una campana de flujo laminar (CFL), se desinfectaron 182 semillas en agitación constante en una solución de detergente durante 10 min, para después sumergirlas en SoluVet®️ por 30 min, posteriormente se desinfectaron en etanol 70 % v/v por 1 min y se sumergieron en una solución de hipoclorito de sodio 30 % v/v, con dos gotas de Tween 20 en 100 mL, durante 30 min y se realizaron tres enjuagues con agua destilada esterilizada.
Germinación in vitro. Bajo condiciones asépticas, fueron sembradas 91 semillas (una semilla por tubo de ensayo, 25 × 150 mm) en medio de cultivo MS con 50 % de la concentración de sus componentes inorgánicos, suplementado con sacarosa 30 g/L y bacto-agar 8.5 g/L, pH 5.7 (MS50).
Todos los medios de cultivo, agua y cristalería necesarios fueron esterilizados en autoclave a 1.5 kg/cm2, 15 min a 121 °C. Los cultivos in vitro fueron incubados a 25 ± 2°C en un fotoperiodo de 16 h luz fluorescente blanca fría, 50 µmol·m-1·seg-2.
Germinación ex vitro. Bajo condiciones de invernadero, se sembraron 91 semillas previamente desinfectadas, en un sustrato de tepojal, tierra negra y lombricomposta en proporciones 2:1:1, contenido en dos charolas de plástico. Se aplicaron riegos semanales.
Inducción morfogenética a partir de cotiledones, hojas y tallos. A partir de plántulas germinadas in vitro, 1-5 cm altura (parte aérea), se disectaron tres tipos de explantes (3-7 mm longitud): tallos, parte proximal de cotiledones y de las hojas, que fueron establecidos (uno por frasco de 120 mL) en MS50 adicionado de 100 mg/L de ácido cítrico, 100 mg/L de ácido ascórbico, y suplementado con los reguladores de crecimiento vegetal (RCV): BAP 0, 1, 1.5 y 2 mg/L con 2,4-D 0 y 0.5 mg/L (Tabla 1). El tiempo de inducción fue de 30 días, posteriormente, los cultivos fueron transferidos cada 30 días a medio MS50 sin RCV. Las condiciones de incubación fueron las mismas que para la etapa de germinación de semillas.
Tabla 1 Tratamientos para el cultivo in vitro de tallos, cotiledones y hojas de Agave potatorum.
| Tratamiento | BAP (mg/L) | 2,4-D (mg/L) |
|---|---|---|
| T1 | 1 | 0.5 |
| T2 | 1.5 | 0.5 |
| T3 | 2 | 0.5 |
| T4 | 0 | 0.5 |
| T5 | 1 | 0 |
| T6 Control | 0 | 0 |
Para cada tratamiento se realizaron diez repeticiones, a excepción de los tratamientos cuatro y cinco, los cuales consistieron en cinco repeticiones cada uno. Cada explante se consideró como una repetición y se colocó uno por frasco de cultivo.
Aclimatización. A 12 meses de iniciados los cultivos, se extrajeron de los frascos 45 plantas que presentaron más de tres raíces y cuya longitud fue de 1-3 cm. Para llevar a cabo la aclimatización los frascos permanecieron destapados durante 24 horas. Posteriormente se sacaron las plantas, se lavaron las raíces con agua corriente con el fin de retirar el medio de cultivo y se secaron durante 24 horas sobre papel periódico. Luego de esto se sembraron en un sustrato de tepojal, tierra negra y lombricomposta en proporciones 2:1:1 respectivamente en macetas de 10 cm de diámetro (tres plantas por maceta), éstas se colocaron dentro de bolsas de plástico transparentes durante 2 semanas, las cuales posteriormente se retiraron. Los riegos se realizaron cada 3 días las primeras 2 semanas, después el riego se realizó de manera semanal. Durante este proceso las plantas permanecieron en condiciones de invernadero bajo luz natural.
Análisis estadístico. Por medio del software R (R Core Team 2022) usando RStudio se aplicó la prueba de Shapiro-Wilk para determinar si los datos de germinación y regeneración tenían una distribución normal. Posteriormente se realizó una prueba de Kruskal-Wallis para revelar si existían diferencias significativas entre los grupos evaluados. Después, se llevó a cabo una prueba de U de Mann con la finalidad de conocer dónde se encontraban dichas diferencias.
Resultados
Para las condiciones in vitro y ex vitro, las primeras semillas germinaron dentro de los primeros cuatro días. Se consideró que la germinación ocurrió cuando el cotiledón emergió de la testa. Dicho órgano se caracterizó por tener una apariencia blanca y opaca que pronto se elongó y adquirió color verde (Figura 1A). La radícula emergió después, ésta fue una estructura delgada y blanca.

Figura 1 Semillas de Agave potatorum en diferentes etapas de germinación in vitro y desarrollo de la plántula a los 27 días de la siembra. A) cotiledón, fue la estructura que emergió primero y pronto se volvió verde; B) cotiledón elongado; C) plántula con cotiledón, raíz y la primera hoja verdadera. T: testa; C: cotiledón; R: raíz; Hv: hoja verdadera.
Germinación in vitro. Las 91 semillas se establecieron asépticamente in vitro, germinaron de manera asincrónica. Los registros a los 8, 27 y 54 días después de la siembra, indicaron respectivamente que habían germinado 23 (25.28 %); 45 (49.46 %) y en total 51 semillas (56.04 %) (Figura 1); 12 meses después no había germinado ninguna otra. En el día 27 después de la siembra, las plántulas más desarrolladas presentaron un cotiledón (1-5 cm), una hoja (0.5-4 cm) aún sin expandir su lámina y una raíz (1-3 cm) (Figura 1).
A 12 meses de la siembra, las plantas presentaron raíces de 4-5 cm de largo, de 2-4 hojas verdes, expandidas de una longitud de 4-5 cm, en los márgenes de las hojas se observaron espinas (Figura 2).

Figura 2 Planta de Agave potatorum cultivada in vitro a 12 meses de la siembra de semillas, fue notoria la presencia de espinas y con pequeñas “manchas” en las hojas, más abundantes o más concentradas en las hojas centrales. Es: espinas.
Germinación ex vitro. Los registros a los 8, 27 y 54 días después de la siembra, indicaron respectivamente que habían germinado 15 (16.49 %); 27 (29.68 %) y en total 29 (31.87 %) semillas (Figura 3). Posteriormente y hasta 12 meses después no germinó ninguna otra semilla. Las plántulas más desarrolladas presentaron un cotiledón de 3 cm (Figura 3A); y de 1 a 3 hojas expandidas de 1-4 cm de largo (Figura 3B); con una apariencia grisácea-azulada y con espinas en sus bordes (Figura 3C). Por otro lado, el análisis estadístico llevado a cabo indicó que existen diferencias significativas entre la germinación en condiciones in vitro y ex vitro (valor de P = 0.0029).

Figura 3 Plántulas de Agave potatorum en condiciones ex vitro a 12 meses de la siembra de semillas. A) el cotiledón permanece verde como un órgano fotosintético; B) hojas verdaderas sin la presencia del cotiledón, el cual se degradó; C) espinas en los bordes de una lámina foliar. C: cotiledón y Hv: hoja verdadera.
Inducción morfogenética a partir de cotiledones, hojas y tallos
Oxidación.- Dentro de las primeras dos semanas de iniciados los cultivos, se observó en los distintos tratamientos un ligero oscurecimiento en la zona de corte en algunos de los explantes. A los tres meses, los cotiledones presentaron el mayor número de explantes con signos de oxidación, 35 (70 %), seguidos por 27 explantes de hojas (54 %) y 25 tallos (50 %). Seis meses después de la siembra se mantuvo esa secuencia; los cotiledones, seguidos de las hojas y los tallos, presentaron 44, 32 y 28 explantes con oxidación, respectivamente.
El control fue el tratamiento donde se presentó el mayor número de explantes con oxidación (24 explantes); los tratamientos T4 (2,4-D 0.5 mg/L) y T5 (BAP 1 mg/L) presentaron las menores cantidades de explantes con algún grado de oxidación. En general para todos los tratamientos, el oscurecimiento fue pardo claro y se observó en ≤ 10 % de la superficie de los explantes, no fue un problema que impidiera el crecimiento y desarrollo; en ningún caso la oxidación fue letal. De acuerdo al análisis estadístico, los diferentes tratamientos no tuvieron un efecto significativo en la respuesta de oxidación (valor de P = 0.0529).
Crecimiento de callo y organogénesis directa e indirecta.- El callo que se formó en los diferentes tratamientos y tipos de explantes se caracterizó por ser compacto, de una coloración de hialina a amarillenta y con regiones de color verde. El desarrollo de órganos a partir de callo inició con la presencia de pequeños nódulos (≤ 1 mm) de color blanco opaco. En la formación de raíces, esos nódulos se alargaron y formaron numerosos pelos radicales, esas raíces individuales crecieron entre callo, no se observó que estuvieran unidas a otra estructura organizada (Figura 4A). Para la formación de hojas, los nódulos adquirieron un color verde, se elongaron como una pequeña lámina foliar que se expandió evidenciando la identidad de una hoja; al paso del tiempo emergieron una segunda y tercera hojas y fue notorio que emergían de un brote inmerso entre el callo. Es posible que, en el callo, inicialmente se haya desarrollado una zona meristemática con el posterior desarrollo de un tallo y primordios de hojas (Figura 4B). A 10 meses después de la inducción se registraron 113 brotes regenerados vía organogénesis indirecta, la mayoría (81) se presentaron en el T3 de BAP/2,4-D 2.0/0.5 mg/L (Tabla 2). El explante con mayor número de brotes fue el de tallo (100 brotes) (Tabla 3).
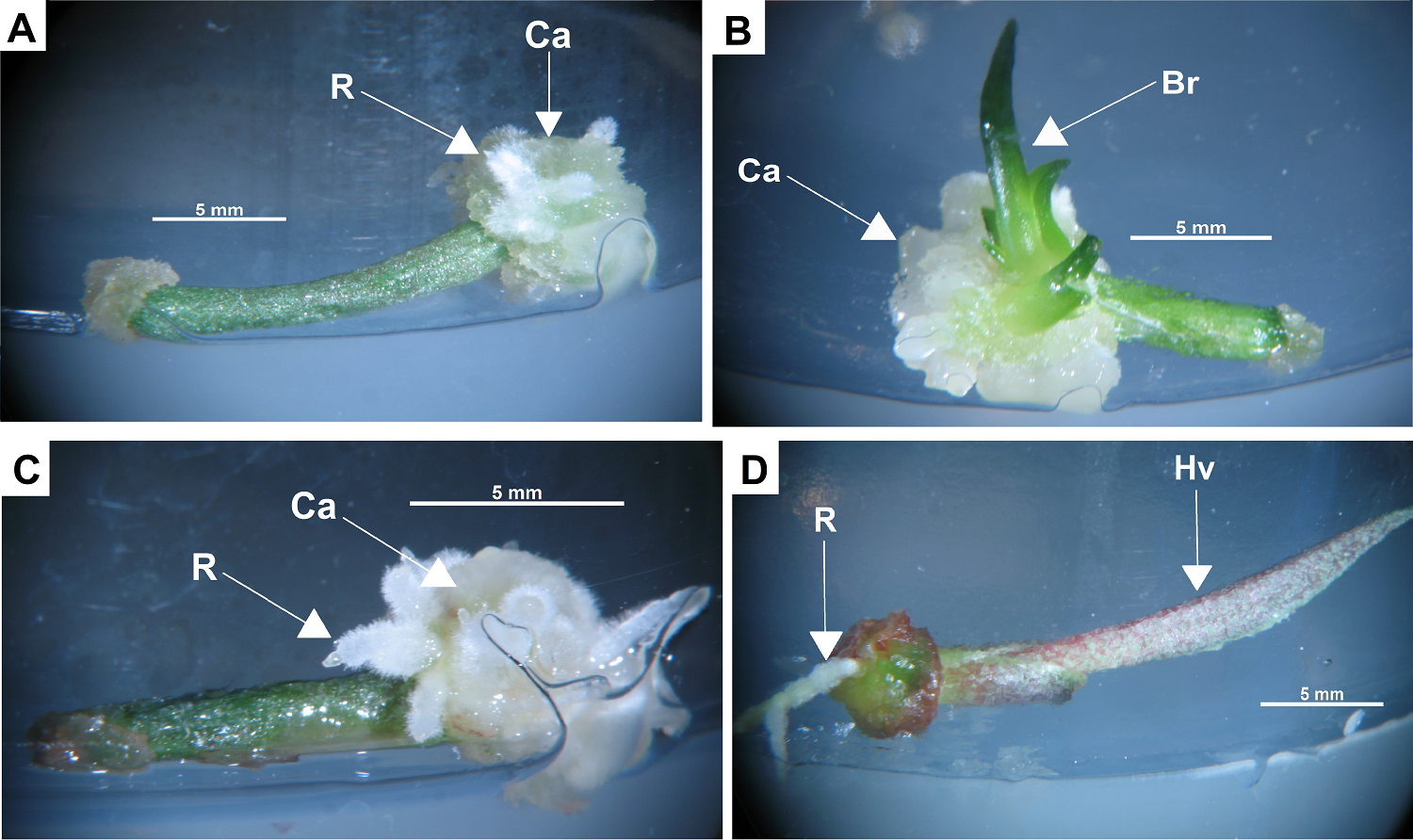
Figura 4 Respuestas a 30 días después de la inducción. Tratamiento 2 (BAP 1.5 mg/L con 2,4-D 0.5 mg/L): A) callo y raíces emergiendo de un explante de cotiledón; B) callo y brotes emergiendo de un explante de tallo. Tratamiento 3 (BAP 2 mg/L con 2,4-D 0.5 mg/L); C) explante de tallo con callo y raíces en uno de sus extremos. Tratamiento control: D) explante de tallo con raíces y una hoja. R: raíz; Ca: callo; Br: brote; Hv: hoja
Tabla 2 Número de brotes por tratamiento. Resultados al término de 10 meses después del periodo de inducción.
| BAP/2,4-D (mg/L) | Número de brotes | Vía indirecta | Vía directa |
|---|---|---|---|
| T1 (1.0/ 0.5) | 17 | 1 | 16 |
| T2 (1.5/ 0.5) | 81 | 31 | 50 |
| T3 (2.0/ 0.5) | 125 | 81 | 44 |
| T4 (0.0/ 0.5) | 0 | 0 | 0 |
| T5 (1.0/ 0.0) | 0 | 0 | 0 |
| T6 (0.0/0.0) | 5 | 0 | 5 |
| Total | 228 | 113 | 115 |
Tabla 3 Número de brotes obtenidos por el tipo de explante. Resultados al término de 10 meses después del periodo de inducción.
| Explante | Brotes | Vía indirecta | Vía directa |
|---|---|---|---|
| Hoja | 13 | 13 | 0 |
| Tallo | 215 | 100 | 115 |
| Cotiledón | 0 | 0 | 0 |
| TOTAL | 228 | 113 | 115 |
El desarrollo de órganos vía directa inició con la formación en la superficie de los explantes de estructuras nodulares en forma de domo, que crecieron y gradualmente fueron diferenciándose en raíces o brotes de hojas. A 10 meses después de la inducción se registraron 115 brotes regenerados por medio de organogénesis directa, todos regenerados a partir de explantes de tallo (Tabla 3). En el T2 se registró el mayor número de brotes obtenidos por esta vía (BAP/2,4-D 1.5/0.5 mg/L) (Tabla 2).
En el Control, cinco de los explantes de tallo desarrollaron las hojas y raíces que inicialmente les habían sido disectadas, restableciéndose la condición inicial de las plántulas. Las únicas respuestas observadas ocurrieron en el cultivo de tallos. En los tratamientos T1, T2 y T3 a partir de tallos solamente en un explante de hoja ocurrió la formación de brotes. En los explantes de tallo, es probable que los brotes se hayan desarrollado por activación de yemas axilares y/o por la formación de yemas adventicias.
A 10 meses del periodo de inducción, en el tratamiento T3 fue donde se registró la mayor regeneración de brotes (125), seguido del T2 con 81 brotes (Tabla 2). En el tratamiento control sólo los explantes de tallo regeneraron hojas y raíces constituyéndose en plántulas individuales (Figura 4D); los menos regenerativos fueron los tratamientos T4 y T5 que incluían solo uno de los dos RCV (BAP o 2,4-D) en donde no hubo formación de órganos.
Fue evidente que, de los tres tipos de explantes empleados en esta investigación, los de tallo fueron los que presentaron la mayor cantidad de estructuras organizadas (Tabla 3), en contraste, los explantes de cotiledones, solo siete formaron callo y eventualmente algunas raíces vía indirecta (Figura 4).
Al analizar el efecto de cada tratamiento en la formación de brotes dependiendo del tipo de explante, se encontró que los datos no tuvieron una distribución normal. La prueba de Kruskal-Wallis indicó que existen diferencias significativas entre los tratamientos, las cuales fueron evidenciadas a través de la prueba U de Mann que señaló que para la generación de brotes en los explantes de hoja, el tratamiento T1 fue significativamente diferente del resto de los tratamientos; al fue el que regeneró un mayor número de brotes. Para los explantes provenientes de tallo se obtuvo que el tratamiento T3 fue el único que tuvo diferencias significativas y que además presentó un número mayor de brotes regenerados; en cambio los tratamientos T4 y T5 tienen cierta similitud con los tratamientos T1 y T2 (Tabla 4).
Tabla 4 Brotes por explante y tratamiento*.
| Tratamiento (mg/L) | Tallo | Hoja |
|---|---|---|
| T1 (1.0/ 0.5) | 0.5 ± 0.670a | 1.2 ± 1.932a |
| T2 (1.5/ 0.5) | 8.0 ± 9.333b | 0.1 ± 0.316b |
| T3 (2.0/ 0.5) | 12.5 ± 21.417c | 0.1 ± 0.316b |
| T4 (0.0/ 0.5) | 0ab | 0b |
| T5 (1.0/ 0.0) | 0ab | 0b |
| T6 (0.0/0.0) | 0.5 ± 0.527a | 0b |
*Media ± SE con superíndice diferente son significativamente diferentes (P ≤ 0.05).
Aclimatización. Después de 2 meses de establecimiento en condiciones de invernadero, se registró 71.11 % de supervivencia de las plantas regeneradas in vitro. Éstas se caracterizaron porque sus raíces proliferaron, se engrosaron; presentaron dos a cinco hojas con 2-6 cm de longitud y 1-2 cm de ancho (Figura 5). La apariencia de las hojas y en general de los individuos fue similar al de las plantas obtenidas a través de germinación de semillas en condiciones ex vitro.
Discusión
Germinación. En el presente estudio, a los 54 días de haber iniciado los cultivos, se obtuvo la germinación de 29 (31.87 %) semillas bajo condiciones ex vitro y 51 (56.04 %) in vitro en medio MS50. Para la presente investigación se redujo al 50 % la concentración de sales minerales en virtud de asegurar la disponibilidad de agua libre que favoreciera la imbibición de las semillas, ya que, según la definición de ósmosis, el flujo de agua ocurrirá desde la zona con la solución más diluida a la más concentrada (Fathi & Tari 2016, Jiao et al. 2015).
En medio MS al 100 % de su concentración se han reportado altos porcentajes de germinación in vitro en otras especies (Asparagaceae), como en Yucca aloifolia, la germinación comenzó el día 9 después de la siembra y en el día 152 todas las semillas habían germinado (Karpov 2004); para A. victoriae-reginae, 90 % de las semillas germinaron después de dos semanas de incubación (Martínez-Palacios et al. 2003), A. guiengola, 88.9 % de germinación 12 días después de la siembra (Vargas-Valencia 2017). El incremento en la concentración de solutos reduce el potencial hídrico y en consecuencia disminuye la disponibilidad de agua libre para el proceso de imbibición de la semilla (Fathi & Tari 2016).
Los resultados apuntan a que el mayor porcentaje de germinación ocurre entre la segunda y tercera semana de cultivo, asimismo, ha sido reconocido que la germinación asincrónica, es una adaptación al hábitat donde podrían mantenerse en el suelo semillas que eventualmente podrían germinar y con ello no se pondría en riesgo la sobrevivencia de todas las plántulas (Rabenda 1990, Mata-Rosas et al. 2001, Dávila-Figueroa et al. 2005).
Oxidación. No obstante, la adición de antioxidantes al medio de cultivo (ácido cítrico, ácido ascórbico), la oxidación en los tres tipos de explantes y en los seis tratamientos se presentó a los pocos días de iniciada la siembra y a los 3 meses de cultivo alcanzó porcentajes entre el 50 % (hojas, tallos) hasta 70 % (cotiledones) del número de explantes. Además, puede señalarse que los RCV empleados en esta investigación no fueron los factores que iniciaron la oxidación (aunque posiblemente pudieron promoverla), éste fue un problema que se presentó incluso en el tratamiento control. Investigaciones previas sugieren que la oxidación es un problema común en el cultivo in vitro del género Agave.
Todos los explantes de tallo y yemas axilares en un estudio llevado a cabo con A. salmiana presentaron oxidación (Flores-Morales et al. 2021). La misma problemática se presentó con A. victoriae-reginae: 66 y 73 % de los explantes de bases y ápices foliares respectivamente presentaron oxidación, aun cuando fueron sembrados en medio MS con PVP (polivinilpirrolidona) (Rivera-Fuentes 2015). Por otro lado, se observó la oxidación del 100 % de embriones cigóticos de A. atrovirens en el grupo control, así como en los tratamientos con auxinas y citocininas. Los callos obtenidos de explantes de hojas presentaron una rápida oxidación, así como necrosis celular (Ayala-Guerrero 2012).
Formación de brotes. Bajo las condiciones de cultivo ensayadas (con BAP 1-2 / 2,4-D 0.5 mg/L) se promovió el desarrollo de órganos sólo de los explantes de hoja y de tallo, tanto a partir de callo como por vía directa. Los explantes de cotiledones, no fueron regenerativos. Por vía indirecta células del callo adquirieron y expresaron su capacidad morfogenética; y por vía directa la interpretación es que células competentes, presentes en los explantes, se desarrollaron en órganos en respuesta a los tratamientos con RCV; al mismo tiempo, debieron tener participación en esta respuesta el estado fisiológico de los explantes y la variabilidad genética de las semillas. El empleo de estructuras inmaduras procedentes de semillas germinadas ha sido una útil herramienta en la multiplicación de especies amenazadas no solo por su potencial regenerativo sino por la conservación de variabilidad genética (Dávila-Figueroa et al. 2005).
En el presente estudio, a partir de tallos y hojas, al término de 10 meses después del periodo de inducción se obtuvieron de 8.0 a 12.5 brotes por explante, dando un total de 228 brotes, los cuales, una vez individualizados, enraizaron de manera espontánea constituyéndose en plántulas completas en 20-30 días (Tablas 2, 3 y 4). A partir de secciones de hoja se obtuvieron 13 brotes, esta respuesta observada es el primer reporte para la especie; será recomendable consolidar y optimizar este tipo de cultivo al considerar las ventajas al incrementar el número y tipo de explantes regenerativos. Resultados similares han sido reportados para otras especies, ejemplo de ello es el estudio de Hazra et al. (2002) quienes lograron inducir organogénesis de A. sisalana empleando BAP. Mientras que Vargas-Valencia (2017) observó la formación de 842 brotes a partir de 15 explantes provenientes de hojas de A. guiengola sembradas en medio MS suplementado con ácido 1-naftalenacético (ANA) 0.5 mg/L con BAP 2.0 mg/L.
Respecto al uso de tallo como fuente de explantes, Enríquez-del Valle et al. (2016) reportaron para A. potatorum, 6 a 12 brotes/explante en el cultivo de Tallos en MS con BAP 1 mg/L y con un tiempo inducción de 50 días. Domínguez-Rosales et al. (2008) cultivaron tallos de distintas especies, con 90 días de inducción: A. potatorum: KIN 3.0 mg/L, obteniendo 5.7 brotes/explante; A. obscura: 11 brotes/explante; A. cupreata: BAP 1.5 mg/L, 10.5 brotes/explante; A.difformis: TDZ (Thidiazuron) 0.2 mg/L, 8.5 brotes/explante; A. karwinskii: BAP 1.0 mg/L, 6.1 brotes/explante. Por otro lado, Vargas-Valencia (2017) cultivó secciones de tallos de plántulas germinadas in vitro de A. guiengola, el mayor número de brotes se obtuvo en el tratamiento de BAP 1.5 mg/L con ANA 0.5 mg/L. En la presente investigación con menores concentraciones de RCV y un menor tiempo de inducción (30 días), se obtuvieron cantidades semejantes de plantas regeneradas.
Un número de estudios in vitro sobre agaves han sido realizados a partir de semillas (e.g., A. victoriae-reginae, A. guiengola), esta acción deberá aplicarse a los agaves que con mayor urgencia requieren de ser propagados por su interés para conservación y/o producción comercial (A. cupreata, A. karwinskii, A. lurida, A. marmorata), para tratar de encontrar individuos que se adapten a las exigencias y que permitan hacer frente a los eventos del cambio climático, además que pudieran tener características comercialmente deseables. Sin embargo, estas medidas que ya deberían estar siendo aplicadas son limitadas porque la disponibilidad de semillas es muy baja para la cantidad de plantas que son requeridas. Los productores de magueyes y aquellos que se benefician de estas plantas deberán comprometerse seriamente a permitir que al menos un 20 % de sus plantas lleguen a producir semillas. El CTV es una útil alternativa no solo para lograr la propagación vegetativa de individuos seleccionados y para la multiplicación de la variabilidad genética presente en las semillas germinadas, sino también para el desarrollo y aceleración de nuevos métodos de fitomejoramiento.
Los planteamientos experimentales de la presente investigación demostraron que las condiciones de cultivo ensayadas hicieron posible el desarrollo de plantas completas vía directa, así como vía indirecta a través de la reprogramación genética de las células hacia una ruta morfogenética. Las combinaciones de BAP 1.5-2 mg/L con 2,4-D 0.5 mg/L indujeron los mayores números de regenerantes, con la formación de 8.0-12.5 brotes por explante dando un total de 228 brotes a 10 meses después del período de inducción. El tallo fue el órgano más eficiente para lograr la regeneración de A. potatorum.
El CTV ha sido reconocido como una útil herramienta biotecnológica para la propagación de una amplia variedad de especies comercialmente cultivadas así como de especies silvestres con fines de conservación, para su aprovechamiento sustentable y con fines de reforestación, lo cual es recomendable y urgente para el caso de A. potatorum y de las distintas especies de agaves, de las que se obtienen diversos productos, se comercializan pero que poco o nada se cultivan y sus poblaciones silvestres están desapareciendo. Es urgente poder establecer procedimientos de cultivo in vitro y conjuntarlos con los procesos de su cultivo convencional en virtud de que tienen la capacidad de subsistir en suelos pobres, ambientes de alta temperatura y escasa disponibilidad de agua ya que con plantas como éstas podríamos tener una oportunidad y tratar de hacer frente a los cada vez más devastadores efectos cambio climático.











 nueva página del texto (beta)
nueva página del texto (beta)




