Es mundialmente reconocido que la apicultura es una actividad productiva sostenible (FAO 2021). Su impacto en la vegetación se limita a la extracción de néctar, polen y resina, de los cuales se generan productos de alto valor económico, medicinal y nutricional (Vandame & Palacio 2010, May 2015, FAO 2021). Al mismo tiempo, favorece servicios ecosistémicos como la polinización de plantas silvestres y cultivadas (May 2015, Sosenski & Domínguez 2018, FAO 2021). Además, constituye una alternativa para la conservación socialmente inclusiva de los bosques (Skewes et al. 2018).
En México, en especial en las regiones tropicales, la apicultura representa una fuente importante de empleos e ingresos en el medio rural y de divisas (Magaña et al. 2007). El país se coloca en noveno lugar como productor de miel en el mundo (SADER 2022) y décimo lugar como exportador (SE 2022). Aunque existen abejas nativas del género Melipona (46 especies) manejadas desde épocas prehispánicas (Quezada-Euán 2018), en la actualidad la especie más empleada en la producción de miel es Apis mellifera (L.), una abeja europea introducida, actualmente africanizada en más del 95 % de las regiones apícolas del país, debido a la llegada accidental de A. mellifera scutellata (Lepeletier) en 1986 (Guzmán-Novoa et al. 2011).
La alimentación de las abejas junto con la producción de miel y polen, depende en gran medida de la conservación de la flora melífera (FM), también denominada flora apícola: plantas que en conjunto producen o segregan sustancias o elementos que las abejas recolectan para su provecho, principalmente néctar y polen, así como propóleos y mielada (Silva & Restrepo 2012, Montoya-Bonilla et al. 2017, Real-Luna et al. 2021). Como primer requisito para asegurar el éxito de la producción apícola, es importante conocer la FM de la zona donde se desarrolle esta actividad (Porter-Bolland 2003, Silva & Restrepo 2012, May 2015), ya que forma parte tanto de ambientes naturales, como de ambientes manejados (Villegas-Durán et al. 2003, May 2015).
Los estudios de FM incluyen diversos métodos de muestreo: melisopalinológicos (Araujo-Mondragón & Redonda-Martínez 2019), palinológicos (Ramos-Díaz et al. 2015), mediciones de secreción de néctar en las flores (May & Rodríguez 2012), observación directa o colecta de especímenes en campo, y entrevistas con los apicultores (Porter-Bolland 2003, May 2015, Coh-Martínez et al. 2019). Estos dos últimos métodos, implican realizar muestreos de especies melíferas en los radios de acción o área óptima de pecoreo de las abejas (May & Rodríguez 2012, Silva & Restrepo 2012, Montoya-Bonilla et al. 2017). Algunos autores consideran que los recursos florales más relevantes para un buen desarrollo de las colmenas y la producción de miel, deben estar a menos de un kilómetro de distancia del apiario (Lecomte 1960, Silva & Restrepo 2012, Montoya-Bonilla et al. 2017), aunque, el área de pecoreo, puede ser mayor a cinco kilómetros (Clermont et al. 2015).
En México se han realizado estudios sobre la FM y de interés apícola en: Yucatán (Villegas-Durán et al. 1998, Briseño-Santiago 2018), Michoacán (Villegas-Durán et al. 1999), Chiapas (Villegas-Durán et al. 2000a), Guerrero (Villegas-Durán et al. 2002), Colima (Santana-Michel 1998, Román & Palma 2007), Jalisco (De la Mora-González 1988), Hidalgo (SAGARPA 2012), Tamaulipas (Villegas-Durán et al. 2003, González-Suárez et al. 2020) y Veracruz (Villegas-Durán et al. 2000b, Real-Luna et al. 2021). Otros estudios regionales abarcan: la región de la montaña en Campeche (Porter-Bolland 2003, Coh-Martínez et al. 2019), la Costa chica de Guerrero y municipios aledaños de Oaxaca (Librado-Carranza 2016) y la región centro-este de Pátzcuaro, Michoacán (Araujo-Mondragón & Redonda-Martínez 2019). Para el estado de San Luis Potosí, que ocupa el 14avo lugar como productor de miel en México (INEGI 2022), solo se conocen los estudios de Cabrera (1966) en Villa de Arriaga y Balderas-González (2018) en las Zonas Media y Altiplano.
Un correcto manejo apícola, implica conocer la temporada de floración de las especies y los tipos de vegetación correspondientes (May & Rodríguez 2012, Silva & Restrepo 2012, González-Suárez et al. 2020). Son pocos los estudios que analizan la riqueza y composición de especies melíferas entre tipos de vegetación (May & Rodríguez 2012, May 2015, Montoya-Bonilla et al. 2017, González-Suárez et al. 2020), pero en ninguno se compara la riqueza de FM entre áreas de vegetación conservada y perturbada. Incluso en la península de Yucatán (región con más estudios de FM en México), no se cuenta con esta información (Cetzal-Ix et al. 2019), la cual es importante para los apicultores que buscan una certificación orgánica, cada vez más demandada por el mercado internacional y para lo cual, es fundamental la conservación de las áreas naturales de pecoreo (Baena-Díaz et al. 2022).
La Reserva de la Biósfera Sierra del Abra Tanchipa (RBSAT) alberga grandes extensiones de bosques tropicales estacionalmente secos (BTES) (según clasificación de Villaseñor 2016), con sus variantes de vegetación: selva baja caducifolia, subcaducifolia y selva mediana subcaducifolia, subperennifolia (de acuerdo con Miranda & Hernández-X 1963) (De-Nova et al. 2018). Si bien, al interior del área protegida no existen asentamientos humanos o actividades productivas, en su zona de influencia se desarrollan actividades agropecuarias de gran importancia como la apicultura (Reyes-Hernández et al. 2018).
El área de influencia de la RBSAT presenta condiciones favorables para la producción apícola convencional y orgánica, debido a que: 1) presenta un heterogéneo paisaje donde se entremezclan áreas de vegetación natural y diferentes usos del suelo (Reyes-Hernández et al. 2018), que beneficia a la diversificación de plantas de interés apícola y a los polinizadores (Garibaldi et al. 2011, May 2015, Sosenski & Domínguez 2018); 2) las zonas aledañas a las áreas protegidas son ideales para la apicultura, debido a que están escasamente pobladas y mantienen una vegetación natural (May 2015); 3) los BTES y sus variantes de vegetación, son considerados áreas de producción óptima a buena, con 50 a 75 kilogramos de miel por colmena al año (SAGARPA 2014); 4) en estos ecosistemas, las especies de árboles de interés apícola suelen ser mayores que en otros (Román & Palma 2007, May 2015, González-Suárez et al. 2020).
Si bien, en el área de influencia de la RBSAT la apicultura es una alternativa productiva, no existen antecedentes de trabajos acerca de su FM. El objetivo de este estudio fue identificar las especies nectaríferas y poliníferas del paisaje aledaño a esta área natural protegida, definir su época de floración, su presencia en los diferentes tipos de vegetación, así como comparar la riqueza y composición de especies melíferas entre áreas de vegetación natural y vegetación perturbada.
Materiales y métodos
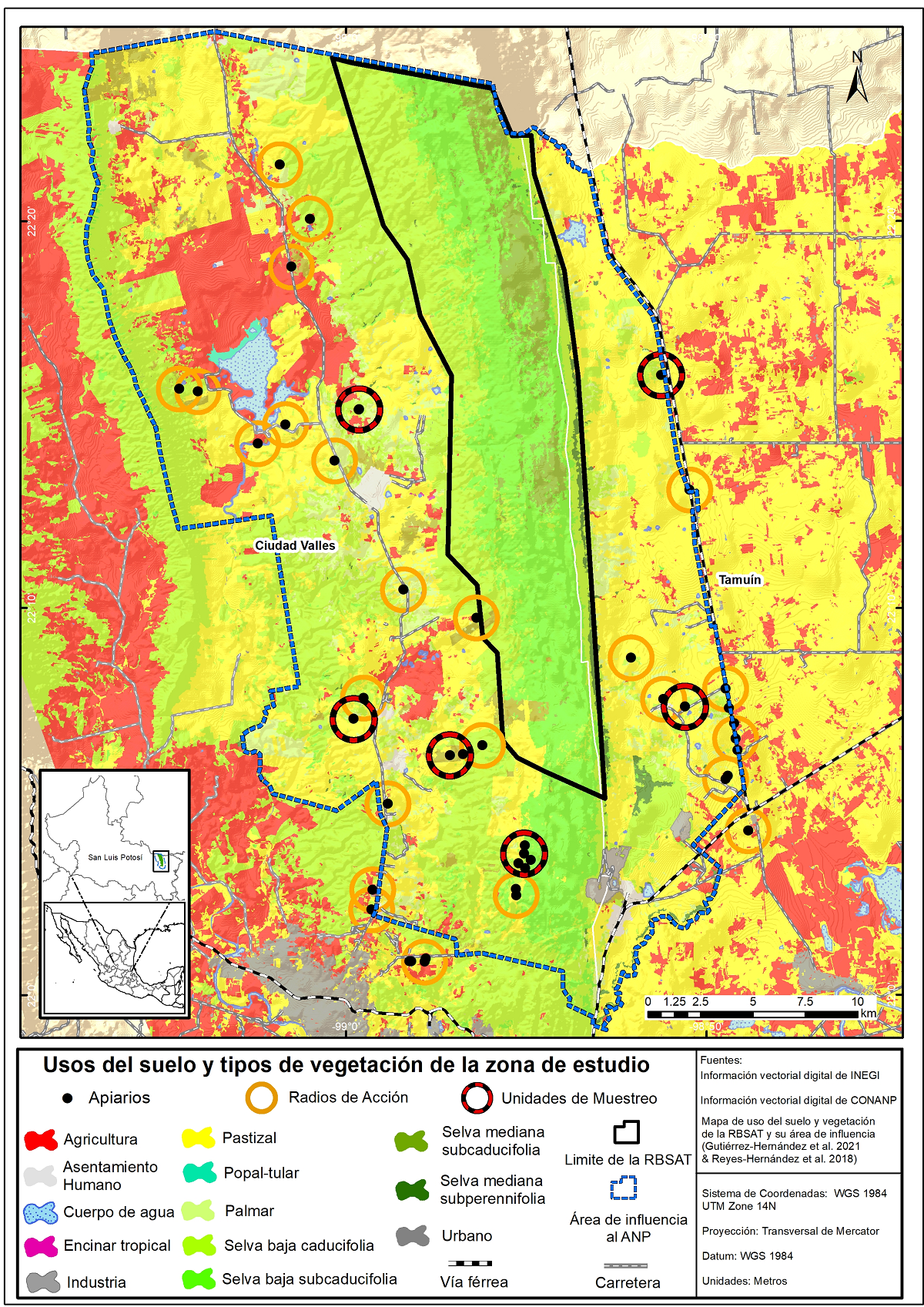
Zona de estudio. La RBSAT se localiza en los municipios de Tamuín y Ciudad Valles (22° 05’ 00’’ y 22° 24’ 22’’ LN y 98° 52’ 46’’ y 99° 01’ 00’’ LW), en la Huasteca Potosina y tiene una superficie de 21,464.44 ha (Figura 1). Está ubicada en un gradiente altitudinal que va de100 a 820 metros sobre el nivel del mar, forma parte de la región fisiográfica de la Sierra Madre Oriental y colinda en su vertiente este con la Llanura Costera del Golfo (CONANP 2014, Durán-Fernández 2018). Presenta un clima cálido subhúmedo con lluvias en verano y una temporada seca prolongada (Aw), con dos subtipos: Aw1 en la vertiente oeste y Aw0 en la vertiente este. La temporada de lluvias inicia a finales de mayo y se extiende hasta octubre, con una marcada disminución en agosto (canícula) y la mayor precipitación en septiembre. La temporada seca es de noviembre a mayo, los meses más secos son febrero y marzo (García 2004, INEGI 2008).
Fuentes: Información vectorial digital de INEGI
Información vestorial de CONANP
Mapa de uso del suelo y vegetación de la RBSAT y su área de influencia (Gutiérrez-Hernández et al. 2021 & Reyes-Hernández et al. 2018)
Figura 1 Localización de la Reserva de la Biósfera Sierra del Abra Tanchipa (RBSAT), límite del área de influencia al área natural protegida (ANP), apiarios, radios de acción y unidades de muestreo en los diferentes usos del suelo y vegetación (USV).
En la RBSAT y su zona de influencia, además de los BTES existen rodales muy reducidos de encino tropical (Quercus oleoides Schltdl. & Cham), pequeñas áreas de popal-tular, vegetación secundaria leñosa y palmar (De-Nova et al. 2018, Reyes-Hernández et al. 2018, Gutiérrez-Hernández et al. 2021). La zona núcleo de la RBSAT está cubierta en su totalidad por vegetación nativa, mientras que, en las zonas de amortiguamiento e influencia, se intercalan áreas de vegetación nativa y perturbada (Reyes-Hernández et al. 2018) (Figura 1).
Trabajo de campo y gabinete. Se ubicaron los apiarios localizados a menos de 10 km con respecto al polígono de la RBSAT, debido a que las abejas pueden desplazarse hasta más de 5 km en busca de alimento (Clermont et al. 2015). La distancia coincidió en gran medida con su área de influencia (Figura 1). Se georreferenciaron un total de 44 apiarios (pertenecientes a 22 apicultores) y se agruparon en “buffers” de 1 km de radio de acción (Figura 1). En estos se determinaron atributos como uso de suelo y vegetación (USV), clima, altitud y tipos de suelo, considerados los principales factores que influyen en la distribución y composición de la vegetación (Rzedowski 2006). Los sitios fueron sobrepuestos en imágenes satelitales Sentinel-2 (ESA 2020 earthexplorer.usgs.gov) en falso color y capas de edafología (INEGI 2004, 2006), clima (INEGI 2008) y USV (Reyes-Hernández et al. 2018, Gutiérrez-Hernández et al. 2021). El análisis espacial se realizó en el programa Arc-Gis 10.3 (ESRI 2015 www.esri.com).
Para el muestreo de FM se seleccionaron seis radios de acción, denominados unidades de muestreo (Figura 1). Los criterios de selección fueron: 1) representatividad de los diferentes tipos de vegetación; 2) heterogeneidad en los usos del suelo; 3) subtipo de clima; 4) gradiente altitudinal; 5) distancia a la RBSAT; 6) disponibilidad del apicultor y accesibilidad al sitio; 7) número de colmenas (al menos 15) (Tabla 1). Este último criterio es importante debido a que, a mayor número de colmenas, aumenta la probabilidad de observar abejas en pecoreo (May & Rodríguez 2012).
Tabla 1 Atributos de las unidades de muestreo (UM).
| UM | Localidad | Altitud | Clima | USV en transectos | Categoría disturbio | Suelos | Número Apiarios | Número Colmenas |
|---|---|---|---|---|---|---|---|---|
| 01 | Laguna del Mante, Ciudad Valles | 238 m | Aw1 | Sbc, Vsar, Vsab, Vshe, Pa, Ca, Mi y Cv | ACR, ADSUI y ADUI | Rendzina | 1 | 62 |
| 02 | Gustavo Garmendia, Ciudad Valles | 266 m | Aw1 | Smsp, Vsar, Vsab, Vshe, Pa, Ca, Cv y Ah | ACR, ADSUI y ADUI | Rendzina | 1 | 37 |
| 03 | Los Sabinos, Ciudad Valles | 309 m | Aw1 | Sbsc, Vacu, Vsar, Vsab, Vshe, Pa y Mi | ACR, ADSUI y ADUI | Rendzina | 2 | 30 |
| 04 | La Aguaje, Ciudad Valles | 420 m | Aw1 | Smsc, Vsar, Vsab, Vshe, Pa, Mi y Ah | ACR, ADSUI y ADUI | Leptosol | 5 | 150 |
| 05 | La Tima, Tamuín | 74 m | Aw0 | Sbc, Vacu, Vsar, Vsab, Vshe, Pa y Cv | ACR, ADSUI y ADUI | Rendzina | 1 | 40 |
| 06 | Ciento cuatro, Tamuín | 98 m | Aw0 | Sbc, Vacu, Vsar, Vsab, Vshe, Pa, Cv y Ah | ACR, ADSUI y ADUI | Rendzina y Vertisol | 1 | 18 |
En virtud del nivel específico requerido para fines del presente estudio y acorde a lo observado en campo, los USV obtenidos de la cartografía de Reyes-Hernández et al. (2018) y Gutiérrez-Hernández et al. (2021), fueron reclasificados en trece tipos: 1) Selva baja caducifolia (Sbc); 2) Selva baja subcaducifolia (Sbsc); 3) Selva mediana subcaducifolia (Smsc); 4) Selva mediana subperennifolia (Smsp); 5) Vegetación acuática-semiacuática (Vacu); 6) Vegetación secundaria arbórea (Vsar); 7) Vegetación secundaria arbustiva (Vsab); 8) Vegetación secundaria herbácea (Vshe); 9) Pastizal (Pa); 10) Caña de azúcar (Ca); 11) Milpa (Mi); 12) Cerco vivo (Cv); y 13) Asentamiento humano (Ah). Los USV resultantes, se agruparon en tres categorías de acuerdo con su grado de disturbio: áreas conservadas o regeneradas (ACR), áreas con disturbio sin uso intensivo (ADSUI) y áreas con disturbio de uso intensivo (ADUI) (Tabla 2). En las seis unidades de muestreo se presentaron USV muy heterogéneos y las tres categorías de disturbio (Tabla 1).
Tabla 2 Categorías de áreas con diferente grado de disturbio y los usos del suelo y vegetación (USV) correspondientes.
| Categoría | Definición | USV correspondientes |
|---|---|---|
| Áreas conservadas o regeneradas (ACR) | Vegetación natural clímax o vegetación regenerada casi en su totalidad. | Sbc, Sbsc, Smsc, Smsp, Vacu y Vsar |
| Áreas con disturbio sin uso intensivo (ADSUI) | Vegetación de terrenos que tuvieron algún uso antropocéntrico y que actualmente están abandonados o sin actividad aparente. | Vsab y Vshe |
| Áreas con disturbio de uso intensivo (ADUI) | Vegetación en terrenos de uso agropecuario o habitados por el hombre | Pa, Ca, Mi, Cv y Ah |
Para el muestreo de FM, se diseñaron transectos de 2 km de largo en cada unidad de muestreo. Su trazo partió del apiario central de la unidad de muestreo, siguiendo direcciones opuestas (de 1 km), en función de la accesibilidad y buscando abarcar los diferentes tipos de USV presentes. A partir de los métodos propuestos por Román & Palma (2007), Silva & Restrepo (2012), May & Rodríguez (2012) y González-Suárez et al. (2020), se recorrieron los transectos de forma participativa con los apicultores; en donde se recolectaron las plantas que presentaban Apis mellifera libando néctar o colectando polen, durante las diferentes épocas del año.
Intensidad de muestreo y riqueza de especies melíferas en la zona de estudio. El muestreo se realizó de forma mensual, de febrero del 2021 a enero del 2022. Las especies recolectadas se depositaron en el Herbario SLPM (Herbario Isidro Palacios, Instituto de Investigaciones de Zonas Desérticas, Universidad Autónoma de San Luis Potosí). Para medir el esfuerzo del muestreo y la riqueza total de especies melíferas, se elaboró una curva de acumulación de riqueza de especies (Jiménez-Valverde & Hortal 2003), en el programa estadístico XLSTAT (Addinsoft 2018).
Taxonomía y características de las especies melíferas. La identificación taxonómica de las especies se realizó a través de la revisión de la lista de especies de flora de la RBSAT (De-Nova et al. 2019, CONABIO 2019), mediante consulta de la plataforma World Flora Online (WFO 2021 www.worldfloraonline.org) y con apoyo del curador del Herbario SLPM. Los criterios para definir las especies como melíferas, incluyeron: reconocimiento por parte de los apicultores, presencia de Apis mellifera en pecoreo y reportadas previamente como melíferas en otras regiones del país con afinidades florísticas (De la Mora-González 1988, Santana-Michel 1998, Villegas-Durán et al. 1998, 1999, 2000a,b, 2002, 2003, Porter-Bolland 2003, Román & Palma 2007, SAGARPA 2012, Ramos-Díaz et al. 2015, Librado-Carranza 2016, Balderas-González 2018, Briseño-Santiago 2018, Araujo-Mondragón & Redonda-Martínez 2019, Cetzal-Ix et al. 2019, Coh-Martínez et al. 2019, González-Suárez et al. 2020, Real-Luna et al. 2021).
Además de asignárseles el nombre común proporcionado por los apicultores, se caracterizaron con base en: su forma de crecimiento general (Font Quer 1953, De-Nova et al. 2019), el origen de su distribución (Villaseñor 2016), presencia en USV (de los transectos), recurso que proveen (néctar o polen) y fenología (meses de floración). Finalmente, se elaboró una lista de especies melíferas con las características mencionadas.
Riqueza de especies melíferas y diversidad beta en los diferentes USV. Para comparar la diversidad de especies melíferas en los diferentes USV, primeramente, se obtuvo la riqueza específica de especies, considerando únicamente su presencia o ausencia en los USV con sus diferentes categorías de disturbio. Posteriormente, se utilizó el programa estadístico XLSTAT (Addinsoft 2018), para analizar la similitud de composición de especies entre USV, mediante la obtención del Índice de diversidad beta de Jaccard (1912) o Coeficiente de Jaccard = c / (a + b - c). Adicionalmente, se realizó un Análisis de Componentes Principales (ACP) para diferenciar a los USV con base en la composición de especies, e identificar aquellas que son exclusivas a un tipo de USV y las que son comunes a dos o más tipos. Por último, se comparó la riqueza y composición de especies exclusivas de áreas naturales (ACR) con respecto a áreas perturbadas (ADSUI y ADUI).
Resultados
Intensidad de muestreo y riqueza de especies melíferas en la zona de estudio. Se obtuvo un total de 191 especies melíferas. La intensidad del muestreo, representada con una curva de acumulación de riqueza de especies “asíntota” (R2 = 0.957), indica que se colectó un 95 % del total de especies que se esperarían encontrar en las unidades de muestreo durante ese periodo de tiempo (Figura S1). En el primer mes de muestreo (febrero), se recolectó el mayor número de especies melíferas nuevas (55 especies), seguido por junio y septiembre con 24 y 20 especies nuevas respectivamente y agosto con el menor (4). A partir de diciembre, no se encontraron nuevas especies.
Taxonomía y características de las especies melíferas. Las 191 especies de FM identificadas, pertenecen a 44 familias y 159 géneros (Apéndice 1). La familia Fabaceae es la mejor representada, seguida de Asteraceae, Malvaceae, Verbenaceae, Euphorbiaceae, Convolvulaceae y Rubiaceae (Figura S2A). El 6 % de las especies son introducidas y 94 % son nativas, de estas últimas, 18 especies son endémicas de México (9 %). La mayor proporción de especies son hierbas y árboles, seguidas de arbustos y trepadoras; mientras que las crassicaules y epífitas son escasas (Figura S2B). En relación con el recurso floral que ofrecen, 47.6 % son especies proveedoras de néctar, 8.3 % de polen y 43.9 % de ambos compuestos.
Existe un marcado aumento en el número de especies en floración durante la temporada de lluvias (junio-octubre) y su cúspide es septiembre con 89 especies registradas. Durante la temporada de seca y “nortes” (noviembre-enero), disminuye la floración y enero presenta el menor número de especies (33). Se detectaron dos picos de floración: en el mes de junio, que coincide con la transición de la temporada seca a lluvias; y de septiembre a octubre, en la transición de temporada de lluvias a seca y “nortes” (Figura 2).
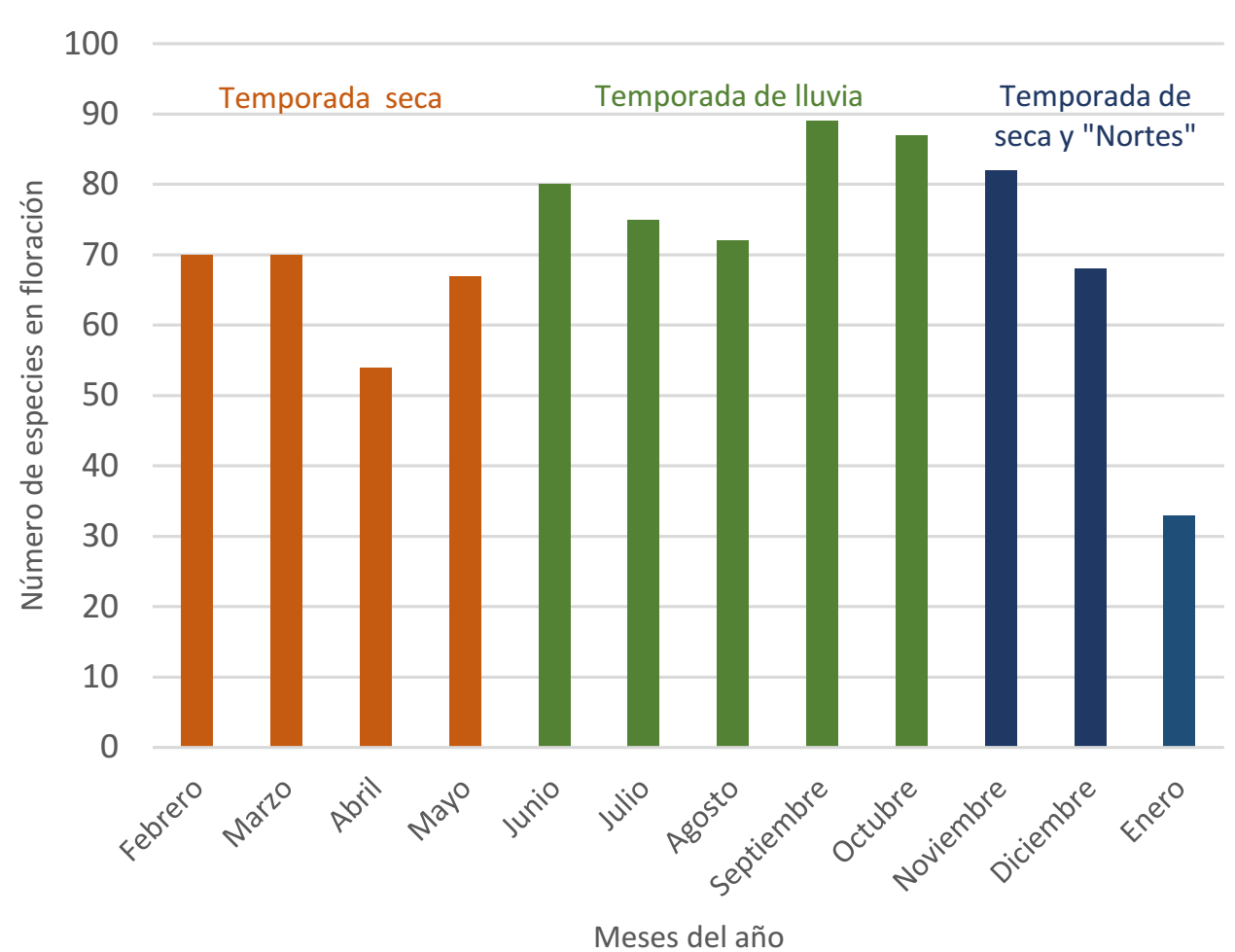
Figura 2 Especies melíferas en floración en el paisaje aledaño a la Reserva de la Biósfera Sierra del Abra Tanchipa (RBSAT), durante los diferentes meses y temporadas del año.
Riqueza de especies melíferas y diversidad beta en los diferentes USV. Los usos de suelo y vegetación con mayor riqueza de especies melíferas son Vshe (75 especies) y Vsab (70 especies). La menor riqueza se observó en Mi (4 especies) y Cv (3 especies). La cobertura de caña de azúcar no presentó ninguna especie melífera (Figura 3). Con relación al grado de disturbio, las ADSUI, presentan la mayor riqueza de especies melíferas (115 especies), las ACR registraron 98 especies y las ADUI únicamente 24 especies (Figura 3).

Figura 3 Riqueza de especies melíferas en los diferentes usos del suelo y tipos de vegetación (USV) y en sus respectivas categorías de disturbio.
El grado de similitud más alto se presenta entre Sbsc y Smsc (coeficiente 0.439) y entre Smsc y Smsp (0.432). Le siguen en menor grado de similitud la Vsar y Vsab (0.370); así como la Sbc y Vsar (0.364), junto a Vsab y Vshe (0.261). Mientras que los otros tipos de USV presentan una similitud muy baja, menor al 12 %, o nula (Tabla S1).
El ACP muestra que los primeros dos ejes F1 y F2, explican el 53.07 % de la variabilidad total de las especies entre los diferentes usos de suelo y vegetación (Figura S3). Cada cuadrante muestra los USV con más especies en común, así como los grupos de especies de distribución común y distribución exclusiva. El eje F1 explica el 32.49 % de la variabilidad, la cual, acorde a los valores propios, se atribuye a 62 especies. En este eje se representan los USV con mayor número de especies de distribución común y de distribución exclusiva, que son: Vshe con 24 % de la variación y Vsab con un 10 %. El eje F2 explica el otro 20.58 % de la variabilidad, la cual se atribuye a 39 especies. En este eje, la Vsab representa un 16 % de la variación, la Vsar un 10 % y la Sbc un 2 %.
En el paisaje aledaño a la RBSTA, el 49 % de las especies son de distribución exclusiva a un tipo de USV (93) y 51 % son de distribución común (98). La Vshe presenta el mayor número de especies de distribución exclusiva (40), seguida por la Vsab, Ah, Smsc y Vacu. Los otros usos del suelo y vegetación presentan menos de cuatro especies (Figura S4, Tabla S2). De acuerdo al número de especies de distribución común, destacan: la Vsab y Vsar con más de 50 especies; seguidas por la Vshe, Sbc, Smsc, Smsp y Sbsc. Los otros usos del suelo y vegetación presentan menos de siete especies (Figura S4).
Con respecto al número y porcentaje de especies melíferas observadas en ACR, ADSUI y ADUI, el 49 % se encuentra exclusivamente en áreas perturbadas, el 29 % en áreas naturales y el resto en ambos espacios. En las áreas naturales todas las especies son nativas y la mayoría son árboles (70 %). En las áreas perturbadas el 14 % son introducidas, 86 % nativas y la mayoría son hierbas (57 %). De las especies presentes en ambos espacios, también el 100 % son nativas y la mayoría son árboles (38 %) (Figura 4). Las Figuras 5, 6 y 7, muestran algunas de las especies melíferas colectadas en el paisaje aledaño a la RBSAT.

Figura 4 Número y porcentaje de especies presentes en áreas naturales y perturbadas, junto con su respectiva proporción (%) de especies, en cuanto a formas de crecimiento y origen.

Figura 5 Algunas especies melíferas del paisaje aledaño a la Reserva de la Biósfera Sierra del Abra Tanchipa (RBSAT). A) Adelia barbinervis; B) Beaucarnea inermis; C) Bignonia potosina; D) Bursera simaruba; E) Caesalpinia mexicana; F) Calea urticifolia; G) Chromolaena odorata; H) Citharexylum berlandieri; I) Cnidoscolus aconitifolius; J) Coccoloba humboldtii; K) Colubrina elliptica; L) Cordia dentata; M) Croton niveus; N) Ebenopsis ebano; O) Eugenia capuli. Fotos: B.Y. González Avilés.

Figura 6 Algunas especies melíferas del paisaje aledaño a la Reserva de la Biósfera Sierra del Abra Tanchipa (RBSAT). A) Euphorbia schlechtendalii; B) Exostema caribaeum; C) Eysenhardtia polystachya; D) Forchhammeria longifolia; E) Gouania lupuloides; F) Harpalyce arborescens; G) Havardia pallens; H) Hechtia mexicana; I) Jacquemontia pentanthos; J) Jacquemontia nodiflora; K) Lantana hirta; L) Leucaena pulverulenta; M) Ludwigia octovalvis; N) Melochia tomentosa; O) Neopringlea integrifolia. Fotos: B.Y. González Avilés.

Figura 7 Algunas especies melíferas del paisaje aledaño a la Reserva de la Biósfera Sierra del Abra Tanchipa (RBSAT). A) Opuntia engelmannii subsp. lindheimeri; B) Oxyrhynchus volubilis; C) Parmentiera aculeata; D) Piscidia piscipula; E) Pithecellobium dulce; F) Pithecellobium lanceolatum; G) Pseudobombax ellipticum; H) Robinsonella discolor; I) Sabal mexicana; J) Sideroxylon palmeri; K) Urvillea ulmacea; L) Varronia bullata; M) Xylosma flexuosa; N) Yucca treculeana; O) Zuelania guidonia. Fotos: B.Y. González Avilés.
Discusión
Intensidad de muestreo y riqueza de especies melíferas en la zona de estudio. Se considera que el esfuerzo de muestreo realizado mensualmente es adecuado, logrando colectar el 95 % de las especies melíferas que se esperarían encontrar a lo largo del año en las unidades de muestreo (Jiménez-Valverde & Hortal 2003). Se observó que ciertas especies como Casearia aculeata y Ageratina hyssopina, presentan un tiempo de floración muy corto, por lo que un ritmo de muestreo quincenal sería recomendable, tal y como lo señalan May & Rodríguez (2012), para estudios de FM en BTES. No obstante, la intensidad del muestreo depende en gran medida, de los objetivos de investigación, de la cercanía y acceso a los sitios de estudio, del tiempo requerido y los recursos disponibles.
Puede afirmarse que los BTES de la RBSAT concentran una gran riqueza de FM, superior a la reportada para otras zonas del estado y del país. El número de especies melíferas localizadas en la zona de estudio, es mayor a las especies registradas en las Zonas Media y Altiplano en San Luis Potosí (66) (Balderas-González 2018). También superan a las 170 especies registradas en Guerrero (Villegas-Durán et al. 2002), a las 154 de Michoacán (Villegas-Durán et al. 1999) y a las 64 de Hidalgo (SAGARPA 2012). Esto es relevante considerando que al sur del país se atribuye una mayor riqueza de FM debido a su diversidad florística y condiciones climáticas favorables. Lo documentado en el presente estudio corresponde al 51 % de la FM reportada en la península de Yucatán (Cetzal-Ix et al. 2019), que podría explicarse por la afinidad en los tipos de vegetación de ambas regiones y por la gran diversidad de especies de plantas vasculares reportadas para la RBSAT (De-Nova et al. 2019).
Taxonomía y características de las especies melíferas. La familia Fabaceae destaca como la más rica en especies melíferas seguida de Asteraceae y coincide con lo reportado en otros lugares del país (Santana-Michel 1998, Román & Palma 2007, Librado-Carranza 2016, Araujo-Mondragón & Redonda-Martínez 2019, González-Suárez et al. 2020, Real-Luna et al. 2021). Esto se explica porque Fabaceae es la familia más representada en los bosques secos del neotrópico (Gentry 1995) y junto con Asteraceae, son las familias de plantas vasculares más grandes en México (Villaseñor 2016) y en la RBSAT (De-Nova et al. 2019), con numerosas especies nectaríferas y poliníferas (Quiroz-García & Arreguín-Sánchez 2008).
La gran cantidad de especies melíferas nativas es similar a lo reportado en Tamaulipas (González-Suárez et al. 2020) y Veracruz (Real-Luna et al. 2021). Las extensiones de vegetación natural en buen estado de conservación en la RBSAT y su área de influencia, previamente señaladas por Reyes-Hernández et al. (2018), De-Nova et al. (2019) y Gutiérrez-Hernández et al. (2021), sin duda favorecen su presencia. Las especies en su mayoría hierbas y árboles, coinciden con la proporción general de las formas de crecimiento de plantas vasculares reportadas para la RBSAT (De-Nova et al. 2019) y con lo reportado para FM en el estado de Veracruz (Real-Luna et al. 2021).
Las especies nectaríferas fueron las más abundantes, seguidas de las néctar-poliníferas y muy pocas son exclusivamente poliníferas. Estudios previos también reportan que las especies proveedoras de néctar o de néctar y polen, son las más abundantes, en contraste con las poliníferas que son más escasas (Santana-Michel 1998, Román & Palma 2007, Librado-Carranza 2016, González-Suárez et al. 2020). Independientemente del recurso floral que ofrecen, todas las especies melíferas son importantes, ya que, mientras las nectaríferas favorecen la producción de miel, las poliníferas son necesarias para el mantenimiento de la colmena (Villegas-Durán et al. 2003, Silva & Restrepo 2012, Montoya-Bonilla et al. 2017).
En los BTES la disponibilidad de agua y la capacidad de almacenamiento de humedad de las especies, son los principales determinantes en su fenología, además de otros factores endógenos, exógenos, bióticos y abióticos (Borchert 1994, Bullock 1995). Esta relación entre humedad y eventos de floración se observó en las especies melíferas de la zona de estudio, donde septiembre, el mes con mayor precipitación, presentó mayor número de especies en floración. En contraste, los meses con menos especies en floración, corresponden a la temporada más seca y fría del año. El patrón en los picos de floración es parecido al descrito en Colima (Santana-Michel 1998) y al de La Montaña en Campeche (Porter-Bolland 2003), que también se caracterizan por presentar BTES con una marcada temporada seca. Estos eventos de floración durante la transición de un periodo seco a húmedo y húmedo a seco son comunes en este tipo de ecosistemas (Borchert 1994).
Riqueza de especies melíferas y diversidad beta en los diferentes USV. La riqueza de especies melíferas en el paisaje aledaño a la RBSAT es mayor en los USV de vegetación secundaria en sus diferentes estadios sucesionales, similar a lo reportado en otros estudios (Montoya-Bonilla et al. 2017, González-Suárez et al. 2020). Lo cual demuestra que la vegetación secundaria derivada de BTES favorece la presencia de un mayor número de especies, sobre todo cuando la perturbación es reciente (Heinrich & Hurka 2004, Zamora-Crescencio et al. 2018). No obstante, la escasez o abundancia de las especies depende de la intensidad e impacto de las actividades humanas, que afectan la estructura y composición florística (Zamora-Crescencio et al. 2018).
La menor riqueza de FM corresponde a los USV con actividades antrópicas, además de presentar la mayoría de las especies introducidas y cultivadas, con poblaciones muy pequeñas o escasos individuos, como Citrus sinensis, Azadirachta indica, Delonix regia, Aloe vera y Mangifera indica (Apéndice 1). Esto difiere con otras regiones del país, donde los monocultivos especialmente de cítricos (Citrus spp.), ocupan grandes superficies y constituyen una fuente importante de recursos florales para la apicultura (Santana-Michel et al. 1998, Villegas-Durán et al. 2000a, Balderas-González 2018, González-Suárez et al. 2020, Real-Luna et al. 2021).
La mayor similitud en la composición de especies melíferas ocurre entre las selvas. Ejemplos de algunas especies en común entre las selva baja y mediana subcaducifolias, son, Cascabela thevetia, Beaucarnea inermis, Cordia alliodora, Hylocereus undatus, Harpalyce arborescens, Lysiloma acapulcense y Pseudobombax ellipticum Entre las selvas medianas subcaducifolia y subperennifolia, se tienen especies compartidas como Ceiba pentandra, Cedrela odorata, Ficus cotinifolia, Maclura tinctoria y Zuelania guidonia. Además, los cuatro tipos de selvas comparten especies como Bignonia potosina, Bursera simaruba, Sideroxylon palmeri, Acacia californica subsp. pringlei, Randia obcordata y Piscidia piscipula, entre otras (Apéndice 1). Estos resultados se explican, por la gran similitud de especies leñosas que tienen las variantes de vegetación natural de BTES en la RBSAT (Gutiérrez-Hernández et al. 2021).
Las similitudes entre la selva baja caducifolia, la vegetación secundaria arbórea, la vegetación secundaria arbustiva y la herbácea, son resultado del reemplazo consecutivo de especies en las etapas de sucesión vegetal de BTES (Heinrich & Hurka 2004). En contraste, existe una muy baja similitud entre la mayoría de los USV, lo cual indica una tasa alta de cambio de especies entre comunidades (Calderón-Patrón et al. 2012). Esto indica que la región presenta mosaicos de vegetación muy heterogéneos.
En áreas perturbadas, especialmente con vegetación secundaria herbácea, el número de especies exclusivas fue mayor comparado con las áreas de cobertura natural. La mayoría son hierbas y pertenecen mayormente a las familias Asteraceae, Malvaceae y Verbenaceae, con especies como Lantana hirta, Melochia nodiflora, Parthenium hysterophorus, Phyla nodiflora, Tridax procumbens y Waltheria indica (Apéndice 1). Esto se debe a que en áreas perturbadas la riqueza de especies resultó ser mayor y son zonas de vegetación abierta que favorecen el crecimiento de especies de sucesión primaria, en su mayoría hierbas (Heinrich & Hurka 2004).
Contrario a esto, en áreas naturales se documentó la mayor presencia de especies exclusivas arbóreas. Las familias más representativas fueron Boraginaceae, Euphorbiaceae, Fabaceae, Malvaceae, Meliaceae y Moraceae. Destacan especies como: Bauhinia divaricata, Brosimum alicastrum, Cordia dentata, Croton niveus, Robinsonella discolor y Trichilia hirta (Apéndice 1). Diversos autores consideran que en BTES los árboles son las especies más importantes para la apicultura (Román & Palma 2007, Porter-Bolland 2003, May 2015, Coh-Martínez et al. 2019). El mejor periodo de cosecha de miel en la región de la RBSAT, a mitad de la temporada seca y principios de la de lluvias, coincide con la época de floración de la mayoría de las especies arbóreas, lo cual refrenda la relevancia de estas especies como un insumo importante para la producción de miel.
Importancia del paisaje aledaño a la RBSAT como área natural de pecoreo. La riqueza de especies melíferas en el área de influencia de la RBSAT es superior a la encontrada en regiones del centro y sur del país, mostrando su relevancia en la región noreste. La mayoría de las especies son nativas y pertenecen a la familia Fabaceae, al igual que en otras regiones de México. La floración es constante a lo largo del año, con fluctuaciones que dependen de la disponibilidad de humedad. La riqueza es mayor en áreas perturbadas, pero el mayor porcentaje de especies arbóreas se encuentra en áreas naturales.
Los BTES son considerados los más propicios para el desarrollo de la apicultura, por las condiciones ambientales y la riqueza de especies melíferas que presentan (Román & Palma 2007, May 2015 y González-Suárez et al. 2020). El paisaje heterogéneo que rodea a la RBSAT, favorece una FM muy diversa, que además de beneficiar a Apis mellifera, también favorece la presencia de polinizadores nativos, cuya función es fundamental para mantener este servicio ecosistémico, razón por la cual es necesario promover su conservación (Garibaldi et al. 2012).
Es indudable que la RBSAT y su zona de influencia tienen un valor ecosistémico de gran relevancia para la apicultura en el estado y el país. La información generada en el presente estudio provee las bases para diseñar acciones que permitan a los apicultores hacer más eficiente el manejo de sus colmenas, contribuir a la valoración de la flora melífera nativa y de la biodiversidad. Los futuros análisis, deberán considerar la importancia que tienen las especies melíferas para los apicultores, sus diversos usos y las decisiones sobre cuales favorecer, de acuerdo con sus necesidades. Es importante también, determinar los índices de valor apícola de las especies (May & Rodríguez 2012) y precisar cuáles ofertan una mayor cantidad de néctar o polen mediante análisis melisopalinológicos.
Material suplementario
El material suplementario de este artículo puede ser consultado aquí: https://doi.org/10.17129/botsci.3206











 nueva página del texto (beta)
nueva página del texto (beta)



