Los manglares son un humedal costero con vegetación adaptada a desarrollarse en suelos inundados, salados y anóxicos (Kathiresan & Bingham 2001). Son uno de los ecosistemas más productivos e importantes por los bienes y servicios ecosistémicos que proveen a las comunidades costeras (Barbier 2000), como la regulación (control de inundaciones, tormentas y erosión, prevención de la intrusión de agua salada) y hábitat para la biodiversidad. Además, brindan servicio de aprovisionamiento (madera, leña y carbón vegetal) y culturales (recreación, estética, y no uso) (Barbier 2016).
Los manglares están condicionados principalmente por el hidroperíodo (la frecuencia, el nivel y la duración de las inundaciones), por la disponibilidad de nutrientes en el suelo (Twilley & Rivera-Monroy 2005) y por las variaciones de salinidad, temperatura, potencial de óxido-reducción y concentración de sulfuro, que actúan como reguladores del crecimiento (Lewis et al. 2015). Por otra parte, se reconoce que los manglares almacenan más carbono que otros ecosistemas, principalmente en el suelo. Se han registrado valores promedio entre 241 Mg C ha-1 en los bosques tropicales y 408 Mg C ha-1 en pantanos de turba (Alongi 2014). Sin embargo, no todos los manglares almacenan carbono de igual forma. Los manglares estuarinos presentan un almacén de carbono superior a 1,074 Mg C ha-1 (Donato et al. 2012), en contraste con los sistemas cársticos que almacenan 663 Mg C ha-1 (Kauffman et al. 2013). En México se ha estimado un valor promedio general de 434 Mg C ha-1 para los almacenes de carbono, donde los manglares del Golfo de México almacenan 244 Mg C ha-1 y los de la Península de Yucatán hasta 353 Mg C ha-1 (Herrera-Silveira et al. 2020).
Actualmente los manglares están siendo amenazados por la acelerada urbanización, dando como resultado la fragmentación, la degradación y la pérdida de estos ecosistemas (Naylor et al. 2021). La pérdida de manglares en áreas urbanas hace más vulnerable a las ciudades costeras al aumento del nivel del mar y las tormentas tropicales, así como la pérdida de playas por erosión y la drástica reducción de los recursos pesqueros que sustentan a una parte importante de la población (Baltz & Yáñez-Arancibia 2013). En México se pueden localizar manglares urbanos en las principales ciudades costeras del Golfo de México, el Caribe y el Pacífico (Yáñez-Arancibia et al. 2014, Kumagai et al. 2020).
En el Golfo de México, se localiza el Área de Protección de Flora y Fauna de Laguna de Términos (APFFLT), que contiene 107,880 ha de manglar que es de los más representativos del Golfo de México y el Caribe. Dentro del APFFLT se localiza Isla del Carmen, donde se distribuyen 5,600 ha de manglar, de las cuales el 45 % tiene algún grado de degradación ocasionado por factores naturales (frentes polares, tormentas tropicales y huracanes) y antrópicos, específicamente por el aumento del crecimiento urbano (Pérez-Ceballos et al. 2010).
Isla del Carmen, es la región insular más poblada de México. Se ubica en la región adyacente a la Sonda de Campeche, donde se extrae la mayor parte del petróleo del país y en la que se encuentra Ciudad del Carmen. Habitan 184,300 personas, lo que corresponde a una alta densidad en la población, llevando a un desarrollo urbano descontrolado (Martínez-Beberaje et al. 2019). La industrialización de la Isla del Carmen por el petróleo ha generado la formación de asentamientos humanos informales en diferentes áreas, principalmente dentro o colindantes con remanentes de manglar, los cuales han sido definidos como humedales urbanos (Zedler & Leach 1998). El proceso para invadir los manglares en Ciudad del Carmen ha sido deforestar, rellenar con basura y escombro (piedra y tierra) para después instalar una vivienda rústica (con techo de lámina, piso de tierra y sin servicios), con la esperanza de que luego se regularice su posesión y se provean servicios de alumbrado, pavimentación y agua potable, entre otros.
Este incremento de la urbanización informal en áreas de manglar es una de las principales causas de la pérdida de cobertura de este ecosistema en Isla del Carmen. Además, los habitantes que se establecen en estas áreas de manglar se vuelven más vulnerables a embates meteorológicos, poniendo en riesgo su vida (Escudero et al. 2014). La urbanización de la costa tiene consecuencias en la degradación del paisaje, la alteración de procesos naturales de flujos de nutrientes y energía, la degradación de hábitats y la pérdida de biodiversidad, cuyas consecuencias alteran funciones ecosistémicas que se asocian a conflictos ambientales y sociales (Sekovski et al. 2011). Una estrategia para la conservación de los manglares urbanos consiste en la adaptación basada en ecosistemas, la cual es definida como “la utilización de la biodiversidad y los servicios del ecosistema, como parte de una estrategia más amplia de adaptación, para ayudar a las poblaciones humanas a contrarrestar los efectos adversos del cambio climático” (Lhumeau & Cordero 2012).
Dentro de Ciudad del Carmen se localiza el Estero La Caleta, donde los manglares representan uno de los últimos relictos de este ecosistema en la zona urbana. Estos manglares urbanos han estado sometidos una intensa presión por la tala clandestina y relleno para el establecimiento de viviendas (Villalobos-Zapata et al. 1999). El deterioro de los manglares está provocando la pérdida de los beneficios ambientales para la ciudad, poniéndola en una situación de riesgo y alta vulnerabilidad a la contaminación (Celis-Hernandez et al. 2020). Sin embargo, aún se pueden encontrar pequeñas zonas que no presentan afectaciones.
Para lograr que las comunidades locales valoren el recurso del manglar y apoyen activamente su conservación, es necesario aplicar vigilancia y la normatividad correspondiente. Asimismo, se requiere promover el conocimiento de los bienes y servicios que los manglares brindan a las poblaciones locales. Por otra parte, los manglares forman parte de los objetos de conservación en el programa de cambio climático del APFFLT; por lo que, conservar y mantener saludables los manglares es una prioridad para la adaptación y mitigación ante el cambio climático (CONANP & PNUD 2020). Con base en lo anterior, el objetivo de este trabajo fue contrastar el almacén de carbono aéreo y subterráneo del humedal urbano La Caleta en dos zonas con diferente grado de impacto mediante la modificación del suelo. En una zona se encontró evidencias de relleno de escombro y basura, mientras que en la otra no se registró modificación del suelo. Sobre esta base, se propone que el almacén de carbono puede ser una herramienta para destacar la importancia ecológica de los manglares y, con ello, establecer la línea de base para su conservación.
Materiales y Métodos
Área de estudio. Es un manglar urbano, llamado el Estero La Caleta, se ubica dentro de Cd. del Carmen, Campeche, hacia el norte-noroeste de la Isla del Carmen (Figura 1). Se localiza entre las coordenadas 18º 39’ 29.10” N, 91º 49’ 2.00” W y 18º 39’ 39.45” N. 91º 48’ 36.92” W.

Figura 1 A) Localización de la Cd. del Carmen dentro del sistema de Laguna de Términos (polígono azul), B) Ubicación del Estero La Caleta en Cd. del Carmen, C) Delimitación del área de manglar en estudio (polígono en color rojo), los cuadros en color amarillo representan los sitios de muestreo en la zona 1 y los de color naranja los sitios de la zona 2.
El Estero La Caleta es un cuerpo de agua natural paralelo a la línea de costa, con una longitud total de 7.5 km y ancho variable entre 70 y 3 m. Su profundidad promedio es de 1.5 m. Colinda con 21 áreas urbanas, algunas de ellas formadas como asentamientos irregulares (IMPLAN 2009). Presenta diversos aportes de agua de escurrimientos dulceacuícolas de la isla, provenientes de zonas urbanas y drenaje pluvial. Por otra parte, recibe un aporte de agua marina que ingresa por mareas diurnas y semidiurnas a la Laguna de Términos a través de la boca del Carmen (IMPLAN 2012). Las mareas tienen un intervalo medio de 0.4 a 0.7 m. El clima es húmedo y tropical, con precipitación media anual de 1,100-2,000 mm y temperatura media entre 17 y 35 ºC (Ruiz-Marín et al. 2014).
La vegetación dominante en la Isla del Carmen es manglar, con árboles entre 5 y 10 m de altura, de tipo cuenca y franja considerando la topografía y la inundación (Lugo & Snedaker 1974). La densidad de árboles reportada para los manglares de la Laguna de Términos es 1,670 árboles ha-1 en manglares de cuenca y 3,095 árboles ha-1 en manglares de franja (Coronado-Molina et al. 2012). El Estero La Caleta forma parte de un ecosistema de manglar con presencia de Rhizophora mangle L. (mangle rojo), Avicennia germinans L. (mangle negro), Laguncularia racemosa Gaertn f. (mangle blanco) y Conocarpus erectus L. (mangle botoncillo). Otras especies de la flora asociada son Coccolova uvifera L. (uva de playa) y Sabal mexicana Mart. (palma de guano), y especies exótica como Cocos nucifera L. (coco) y Terminalia catappa L. (almendro). También hay frutales introducidos, como plátano y variedades de mango. La fauna asociada al manglar de La Caleta contiene varias especies enlistadas en alguna categoría de riesgo en la NOM-059 (SEMARNAT 2010), como Ardea herodias L. (garza azul), Crocodylus moreletti Duméril y Bibron (cocodrilo de pantano), Iguana iguanas (iguana verde) y Boa constrictor L. (boa). El Estero La Caleta se ha convertido en un manglar relicto afectado por la presión que genera la zona urbana de Ciudad del Carmen.
Estructura forestal. Para la determinación de la composición y estructura forestal se establecieron dos zonas de acuerdo con la presencia de material de relleno en el suelo, como piedras y escombro. En una zona no se encontró evidencia de relleno, mientras que en la otra se evidenció el relleno y la modificación del terreno. El área total del manglar estudiado fue de 6.7 ha. En cada zona, cuatro sitios de manglar fueron establecidos (Figura 1) y dentro de cada uno se establecieron tres unidades de muestreo de 10 ×10 m (100 m2) distribuidas en forma perpendicular a la línea de costa, dando un total de 24 unidades (2,400 m2) para ambas zonas. Los muestreos fueron realizados en los meses de julio y agosto del año 2017.
Los datos de vegetación y estructura del manglar fueron la especie y el diámetro a la altura del pecho (DAP) de todos los árboles, siempre que DAP ≥ 2.5 cm (Cottam & Curtis 1956, Cintrón & Novelli 1984). Para la especie R. mangle el DAP se midió a 0.30 m desde la última raíz aérea. También se registró la altura máxima de los árboles (m). En cada unidad se calculó la densidad (árbol ha-1), el área basal (m2 ha-1) y el valor de importancia (Cintrón & Novelli 1984, Dahdouh-Guebas & Koedam 2006). El promedio y el error estándar para todas las variables de la estructura forestal fueron calculados por sitio y, posteriormente, por zona. Se realizaron gráficas de frecuencia de tallas del DAP (cm) para cada zona de manglar.
Estimación del almacén de carbono aéreo. La cuantificación del carbono de los árboles vivos se determinó mediante la estimación de la biomasa (en kg) de cada árbol a partir de la ecuación de Day et al. (1987) para las especies R. mangle, A. germinans y L. racemosa para los manglares de Laguna de Términos (Tabla 1). Para el caso de C. erectus se utilizó la ecuación Y = 10,097.06 × (DAP/100)2.33 propuesta por Abohassan et al. (2010), que también estima la biomasa (Y, en kg) en función del diámetro a la altura de pecho (DAP, en cm). La biomasa estimada de cada árbol se multiplicó por un factor de 0.46 y, posteriormente, se sumó el carbono de cada árbol dentro de cada parcela (m2) para determinar el contenido de carbono total aéreo. Los valores están reportados en Mg C ha-1 (Kauffman & Donato 2012, Howard et al. 2014).
Tabla 1 Coeficientes de regresión para estimar la biomasa arbórea de cada especie de manglar. La ecuación Y = A+B log_e X para la estimación de la biomasa (Y, en kg) de cada árbol según la especie se registró el diámetro a la altura de pecho (X, DAP en cm), donde A y B son constantes (Day et al. 1987).
| Especie | A | B |
|---|---|---|
| Avicennia germinans | -1.5852 | 2.3023 |
| Laguncularia racemosa | -1.5919 | 2.1924 |
| Rhizophora mangle | -1.5605 | 2.5072 |
Estimación del carbono en el suelo. Las muestras de sedimento se colectaron con un nucleador semicircular de acero inoxidable de 6.3 cm de diámetro y 100 cm de largo. Dos núcleos de suelo fueron colectados en cada sitio (16 núcleos en total) hasta una profundidad de un metro. Cada núcleo fue separado en segmentos de 0-15, 15-30, 30-50 y 50-100 cm. Las variables que se determinaron para cada segmento fue la densidad aparente, materia orgánica y carbono orgánico.
La densidad aparente se calculó mediante el método propuesto por Chen & Twilley (1999), donde las muestras se colocaron en una estufa a 70 ºC para su secado hasta alcanzar un peso constante (aproximadamente 72 horas). Las muestras secas se pesaron en una balanza y se calculó la densidad aparente dividiendo el peso seco entre el volumen de la muestra.
La materia orgánica (MO) se determinó por el método de ignición (Ouyang & Lee 2020). Las muestras fueron molidas y se colocaron en una estufa a 70 ºC durante 1 hora para eliminar la humedad y adquirir un peso constante. Una alícuota de 0.5 gr de muestra fue colocada en la mufla para calcinarla a 550 ºC durante 4 horas, provocando la oxidación de la materia orgánica, emitiendo CO2 y ceniza (Heiri et al. 2001). El porcentaje de MO se calculó mediante la diferencia de pesos antes y después de la calcinación.
La determinación del porcentaje de carbono orgánico del suelo se calculó utilizando la ecuación Corg (%) = (0.415 × MO) + 2.89 (Kauffman et al. 2011, Ouyang & Lee 2020). El carbono total del suelo fue determinado mediante la suma del carbono orgánico encontrado en cada segmento de cada núcleo (Kauffman et al. 2013, Howard et al. 2014).
Resultados
Caracterización de la vegetación. La zona sin evidencia de relleno en el suelo presentó un área basal de 25.4 ± 5.6 m2 ha-1. La especie de mangle A. germinans fue la que tuvo mayor densidad, con una media de 675 ± 142 árboles ha-1 y altura promedio de 5.5 ± 0.7 m, mientras que el DAP promedio fue de 13.4 ± 1.6 cm. Por otra parte, en la zona donde el suelo fue rellenado presentó mayor desarrollo de la estructura de la vegetación, con un total de área basal de 27.8 ± 4.6 m2 ha-1. En esta zona, la especie que tuvo mayor densidad de individuos también fue A. germinans, con una media de 731 ± 132 árboles ha-1, los que tenían una altura promedio de 5.0 ± 0.3 m y un DAP promedio de 15.2 ± 1.2 cm (Tabla 2).
Tabla 2 Variables de la estructura forestal por cada zona. Las especies registradas fueron: Avicennia germinans (Ag), Conocarpus erectus (Ce), Laguncularia racemosa (Lr) y Rhizophora mangle (Rm). Los datos indican el promedio ( error estándar para cada especie. En el caso de la fila total representa el promedio de cada zona.
| Zona | Especie | DAP (cm) |
Altura (m) | Densidad (árboles ha-1) |
Área Basal (m2 ha-1) |
Valor de importancia |
|---|---|---|---|---|---|---|
| Zona 1 | Ag | 13.4 ± 1.6 | 5.5 ± 0.7 | 675 ± 142 | 9.9 ± 1.9 | 44.1 ± 4.8 |
| Lr | 13.8 ± 0.3 | 6.1 ± 0.4 | 525 ± 51 | 9.4 ± 1.7 | 39.1 ± 1.6 | |
| Rm | 19 ± 7.1 | 8.2 ± 0.4 | 233 ± 88 | 8.1 ± 3.1 | 20.7 ± 4.7 | |
| Ce | 7 ± 1.1 | 5.0 ± 0.2 | 100 ± 10 | 0.4 ± 0.1 | 5 ± 1.0 | |
| Total | 14.4 ± 1.9 | 6.3 ± 0.5 | 1400 ± 162 | 25.4 ± 5.6 | ||
| Zona 2 | Ag | 15.2 ± 1.2 | 5.0 ± 0.3 | 731 ± 132 | 18.3 ± 4.3 | 62.8 ± 7.1 |
| Lr | 13.2 ± 0.7 | 4.3 ± 0.7 | 350 ± 50 | 5.6 ± 1.0 | 28.3 ± 5.2 | |
| Rm | 9.5 ± 0.4 | 3 ± 0.2 | 100 ± 5 | 0.7 ± 0.2 | 10 ± 1.4 | |
| Ce | 19.1 ± 1.7 | 6.2 ± 0.6 | 288 ± 37 | 10.4 ± 2.0 | 27.0 ± 6.0 | |
| Total | 12.1 ± 3.6 | 4.9 ± 0.3 | 1162 ± 147 | 27.8 ± 4.6 |
La distribución de las tallas se presentó en relación con el DAP (Figura 2). En la zona 1, el mayor número de individuos presentó una talla de 10-15 cm de DAP con 400 ± 84 árboles ha-1, y un menor número de individuos mayor a 20 cm en DAP y con 278 ± 64 árboles ha-1. En cuanto a la distribución de tallas, en la zona donde el suelo fue rellenado se presentó el mayor número de individuos con talla mayor 20 cm de DAP y densidad de 400 ± 100 árboles ha-1, en contraste con la talla menor de 5 cm y con densidad de 180 ± 37 árboles ha-1.

Figura 2 Distribución de las clases de DAP de los árboles en cada una de las zonas de manglar. Se presenta la media y el error estándar.
Caracterización del suelo. La densidad aparente del suelo fue estadísticamente significativa entre zonas. La mayor densidad se registró en la zona donde el suelo fue rellenado con 0.64 ± 0.02 g cm-3 con respecto a la zona sin evidencias de alteración del suelo con 0.31 ± 0.05 g cm-3 (P = 0.0001). La densidad aparente en el suelo del manglar en esta última zona fue menor en la profundidad de 0-15 cm, con una media de 0.10 g cm-3, y mayor en la profundidad de 50-100 cm, con 0.51 g cm-3. En contraste, en la zona donde el suelo fue rellenado, la densidad aparente fue menor en la profundidad de 50-100 cm, con una media de 0.57 g cm-3, y mayor en la profundad de 30-50 cm, con 0.70 g cm-3 (Figura 3, 1A-1B).
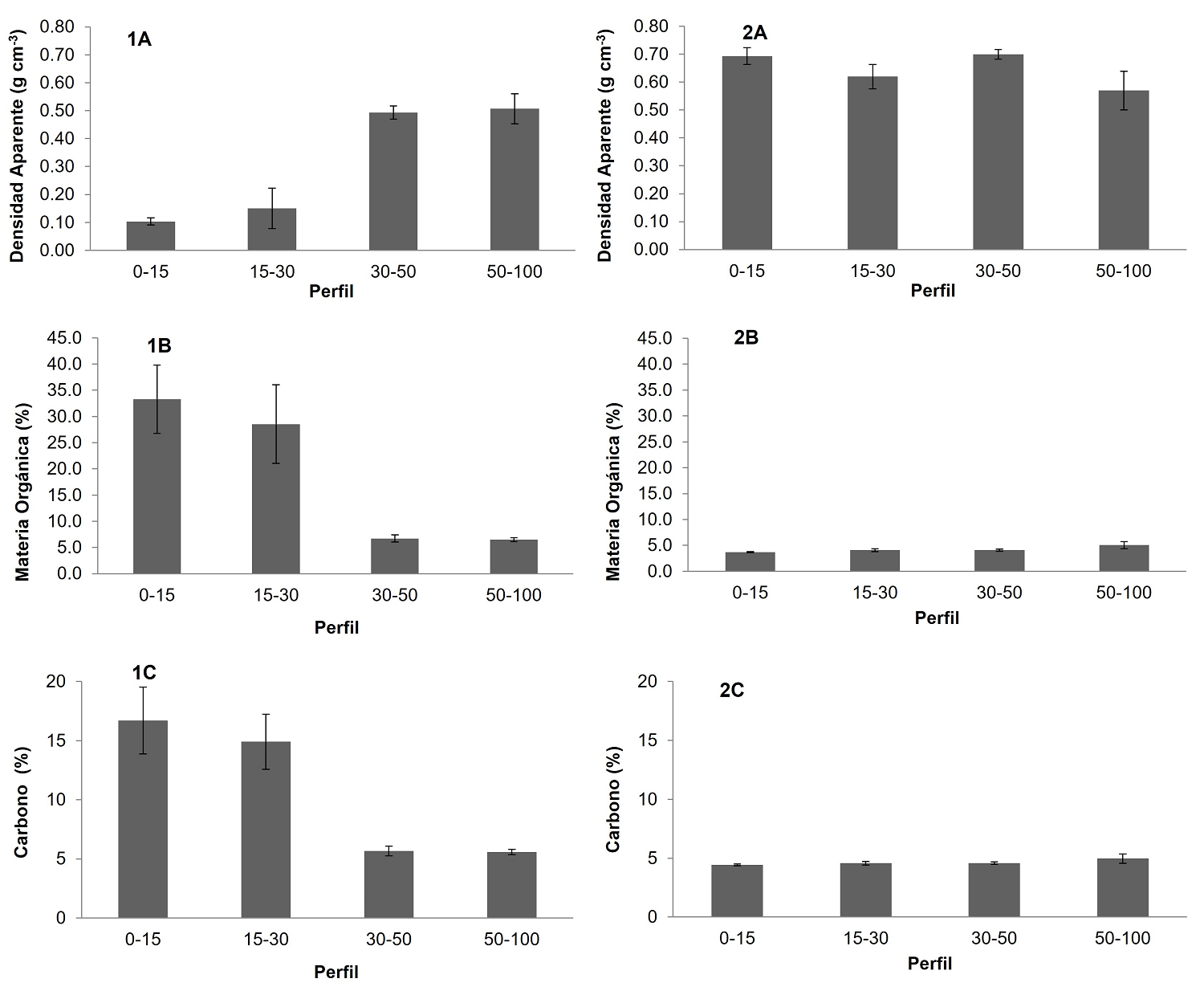
Figura 3 Densidad aparente (1A-1B), materia orgánica (2A-2B) y carbono del suelo (1C-2C) por cada profundidad y zonas de manglar. Se presenta la media y el error estándar. El número identifica la zona: 1 es la zona 1 y 2 es la zona 2; y las letras identifican a las variables
La MO fue estadísticamente significativa entre zonas (Figura 3, 1B-2B). La mayor cantidad de MO se presentó en la zona sin evidencias de alteración del suelo, con 18.8 ± 5.22 % (P = 0.01), respecto a la zona donde el suelo fue rellenado, con 4.21 ± 0.21 % (Tabla 3). Por otra parte, la MO en la primera zona fue menor en la profundidad de 50-100 cm, con 6.47 %, y mayor en la profundidad de 0-15 cm, con 33.30 %. En la segunda zona, la MO fue menor en la profundidad de 0-15 cm, con 3.70 %, y mayor en la profundidad de 50-100, con 5.03 %.
Tabla 3 Características del suelo y valores de carbono aéreo, subterráneo y total estimado para cada una de las zonas. Se presenta el promedio ± el error estándar, así como el resultado del análisis de varianza. Las negritas indican diferencias significativas (P ≤ 0.05).
| Componente | Zona 1 | Zona 2 | Valor F | P |
|---|---|---|---|---|
| Suelo | ||||
| Densidad del suelo (g cm-3) | 0.31 ± 0.05 | 0.64 ± 0.02 | 26.27 | 0.0001 |
| Materia orgánica (%) | 18.8 ± 5.22 | 4.21 ± 0.21 | 7.83 | 0.010 |
| Carbono orgánico (%) | 10.7 ± 2.16 | 4.63 ± 0.21 | 7.83 | 0.01 |
| Carbono Aéreo (Mg C ha-1) | 60.4 ± 10.0 | 84.2 ± 11 | 2.34 | 0.13 |
| Avicennia germinans | 28.6 ± 7.13 | 59.6 ± 7.47 | 8.97 | 0.007 |
| Laguncularia racemosa | 19.0 ± 4.08 | 21.6 ± 5.34 | 0.15 | 0.70 |
| Rhizophora mangle | 52.4 ± 5.50 | 3.69 ± 1.21 | 11.31 | 0.02 |
| Conocarpus erectus | 0.95 ± 0.20 | 14.6 ± 2.30 | 12.20 | 0.02 |
| Carbono Subterráneo (Mg C ha-1) | 245 ± 5 | 292 ± 14 | 9.71 | 0.03 |
| Carbono Total (Mg C ha-1) | 321 ± 20 | 383 ± 15 | 27.8 | 0.006 |
Carbono aéreo y subterráneo. No se encontraron diferencias significativas entre zonas respecto al carbono aéreo total. Los valores de carbono aéreo fueron de 76 ± 16 Mg C ha-1 y 91 ± 14 Mg C ha-1 para la zona sin y con alteración del suelo, respectivamente. Sin embargo, se encontraron diferencias entre zonas para tres especies de mangle (Tabla 2; P = 0.02). El carbono aéreo fue mayor en la zona con el suelo alterado, con 84.2 ± 11 Mg C ha-1, y la especie que más contribuyó al carbono aéreo fue A. germinans, con 59.6 ± 7.47 Mg C ha-1. En contraste, en la zona donde el suelo no fue perturbado fue R. mangle la especie que mayor carbono registró, con 52.4 ± 5.50 Mg C ha-1 (Tabla 3).
Respecto al porcentaje de carbono orgánico en el suelo, se encontraron diferencias significativas entre zonas (P = 0.01). El carbono orgánico en el suelo fue mayor en la zona sin evidencias de perturbación del suelo, con 10.7 ± 2.16 %, que en la zona donde el suelo fue rellenado, con 4.63 ± 0.21 % (Tabla 3). Además, en la primera de esas zonas se observó un decremento de la concentración de carbono con respecto a la profundidad, mientras que la segunda zona la concentración de carbono fue menor al 5 % en todas las profundidades (Figura 3, 1C-2C).
Respecto al carbono subterráneo, éste fue mayor en la zona con el suelo rellenado, con 292 ± 14 Mg C ha-1, en comparación con la zona donde el suelo no presentaba evidencias de relleno, con 245 ± 5 Mg C ha-1 (P = 0.03). Por último, el carbono total almacenado en la zona con suelo rellenado fue mayor que en la zona donde el suelo no estaba alterado (P = 0.006; Tabla 3).
Discusión
Isla del Carmen ha experimentado en las últimas décadas un crecimiento urbano progresivo, descontrolado y desordenado. Para el año 2010 se registró una población de 169,466 habitantes, incrementándose a 184,300 habitantes para el año 2014, lo que significó una tasa del incremento de la población de 2.12 % año-1 (Martínez-Beberaje et al. 2019). El crecimiento poblacional ha tenido consecuencias negativas sobre las áreas de manglar dentro de la ciudad, por lo que han disminuido la superficie de estos humedales por las invasiones de las urbanizaciones. Este proceso de invasión a los humedales se asocia directamente con una mayor presión por el cambio de uso de suelo que promueve la pérdida de servicios ecosistémicos (Rivera-De Jesús 2019), como la protección a eventos climáticos extremos (Ouyang et al. 2018, Hochard et al. 2019), la regulación del microclima y almacenamiento de grandes reservas de carbono (Atwood et al. 2017).
En los últimos años, se ha incrementado la atención sobre los manglares por su alta capacidad de almacenar más carbono que las selvas (Alongi 2014). Los manglares de La Caleta almacenan y secuestran carbono con un promedio de 352 ± 44 Mg C ha-1, el cual fue similar a lo reportado en otros manglares de la Península de Yucatán, con promedios de 348.9 ± 21 Mg C ha-1 (Herrera-Silveira et al. 2020). El carbono orgánico fue diferente únicamente en la parte subterránea, ya que el aéreo fue igual en las dos zonas. Sin embargo, los valores del carbono aéreo fueron más altos comparado con los reportados en la reserva de Yum Balam, con 64 ± 29 y 15 ± 9 Mg C ha-1 (Herrera-Silveira et al. 2018). Por otra parte, en un estudio realizado en el Pacífico Mexicano, reportaron que el almacén de carbono aéreo en el estero El Sargento varió entre 54.1 y 158.4 Mg C ha-1, mientras que en Bahía del Tóbari varió de 36.1 a 65.5 Mg C ha-1 (Bautista-Olivas et al. 2018). El valor más alto de carbono por especie en ambas zonas fue para Laguncularia racemosa, con 50.5 Mg C ha-1 en la zona sin perturbaciones en el suelo y 65.7 Mg C ha-1 en la zona con el suelo rellenado, respectivamente. Los valores de carbono aéreo reportados en estero El Sargento fueron similares a las estimaciones de L. racemosa, que fluctuaron entre 40.7 y 134.44 Mg C ha-1 (Bautista-Olivas et al. 2018).
La densidad aparente del suelo en la zona 2 evidenció el impacto antrópico en el suelo. Además, existió una relación inversa entre la densidad aparente de los sedimentos y el contenido de materia orgánica. Los valores de densidad aparente en la zona sin modificación del terreno fueron similares a los reportados por Gnanamoorthy et al. (2019) como valores normales para suelos de manglar (0.47 g cm-3) y también respecto a otros manglares de Isla del Carmen, que oscilan entre 0.23 y 0.62 g cm-3 (Echeverría-Ávila et al. 2019). La densidad aparente de la zona con el suelo perturbado tuvo valores altos que fueron similares a manglares que han sido rellenados con material de dragado en el norte de la Península de Yucatán (Pérez-Ceballos et al. 2017). Sin embargo, el porcentaje de carbono orgánico fue mayor en la zona donde el suelo no estaba alterado, pero los almacenes de carbono subterráneos no fueron mayores al de la zona con suelo rellenado, como se esperaba. Esto fue debido, a que se empleó la densidad aparente en la obtención del almacén de carbono, la cual fue mayor en la zona donde se rellenó con escombro. Por lo anterior, recomendamos no considerar piedras gruesas contenidas en el suelo para la cuantificación de la densidad aparente, ya que puede aumentar significativamente el peso y llevar a sobreestimar el almacén de carbono en los manglares urbanos que han sido rellenados con escombro.
Teniendo en cuenta la alta contribución de los manglares al secuestro de carbono, así como la posibilidad de convertirse en emisores de gases efecto invernadero por deforestación, es importante considerarlos en las estrategias de conservación y restauración. Esto porque la tala de estos ecosistemas disminuye la biomasa, liberando dióxido de carbono (CO2) y metano (CH4), lo que hace que los manglares reviertan su capacidad de captura de carbono y se transformen en emisores de gases de efecto invernadero (Troxler et al. 2015). Además, el almacenamiento de carbono en los manglares de La Caleta es similar a los reportados en otras partes de la Península de Yucatán; por lo que, deben ser prioritarios para la conservación (Adame et al. 2015), debiéndose también frenar su urbanización y procurar su restauración como medida de soluciones naturales de mitigación del cambio climático (Mazor et al. 2021).
Para fortalecer la conservación y la restauración del manglar urbano La Caleta, lo cual aún es posible de realizar, es necesario promoverlos en conjunto con beneficios ecosistémicos que proveen hacia los desarrollos urbanos, lo cual sería un incentivo para esas acciones. Además, en estos programas se deben considerar la adaptación basada en ecosistemas, que integra el manejo sostenible, la conservación y la restauración para proveer servicios que permitan aumentar la resiliencia y reducir la vulnerabilidad de ecosistemas y personas ante el cambio climático. En este sentido, los manglares juegan un papel muy importante en la adaptación basada en ecosistemas porque, dado los servicios ambientales que proveen, su restauración contribuirá a mejorar y/o mantener la salud ecosistémica, generando beneficios a mediano y largo plazo y favoreciendo el aumento de resiliencia territorial frente a los eventos ambientales actuales y futuros, como el aumento en el nivel medio del mar, el incremento de la precipitación y una mayor frecuencia e intensidad de huracanes asociadas con el avance del cambio climático. La conservación de los manglares urbanos de Ciudad del Carmen debe considerarse desde la perspectiva de la protección hábitats intactos y la restauración de hábitats degradados para ser más efectiva, ya que resultados óptimos de conservación requieren tanto restauración como protección (Possingham et al. 2015).
Los resultados de este trabajo brindan información importante sobre los manglares urbanos en el APFFLT, que han sido poco estudiados y valorados. Estos ecosistemas se encuentran en la Isla del Carmen y juegan un papel importante como protección ante los eventos hidrometeorológicos. Por otra parte, este estudio contribuye con información básica para el fortalecimiento de la estrategia de manejo del APFFLT que apunta a la recuperación y restauración de sus manglares urbanos (Zaldívar-Jiménez et al. 2017, Pérez-Ceballos et al. 2020). El estudio fortalece los conocimientos para el desarrollo de proyectos de recuperación y restauración de los manglares urbanos afectados por las actividades humanas y en proceso de desaparición. Por lo tanto, para conservar y restaurar los manglares urbanos es necesario establecer una estrategia que inicia con la caracterización del humedal para generar la línea de base de monitoreo. Por otra parte, frenar las invasiones antrópicas sobre los humedales urbanos también implica actualizar el Programa Director Urbano del Municipio de Carmen, alineado a la estrategia de conservación del Programa de Manejo del APFFLT. Por último, es necesario la participación social, con el propósito de tener una sociedad informada, consiente y participativa, conciliando las diferentes percepciones entre lo ambiental, social y económico.











 nova página do texto(beta)
nova página do texto(beta)



