Asteraceae es la familia más diversa de las angiospermas con una amplia distribución geográfica, presente en casi todos los hábitats del mundo, con predominancia en regiones tropicales y subtropicales (Liesenfeld et al. 2019). La amplia distribución de Asteraceae en diversos hábitats se atribuye a su capacidad de dispersión, variedad de estructuras secretoras y a la plasticidad genotípica y fenotípica, dando como resultado una gran diversidad de patrones morfo-anatómicos (Villaseñor 2018, Liesenfeld et al. 2019). En México la familia tiene aproximadamente 3,113 especies, incluidas en 26 tribus y 417 géneros (Villaseñor 2018).
Tagetes L. (Tageteae) es un género americano que incluye cerca de 50-55 especies, con distribución comprendida desde el suroeste de Estados Unidos hasta Argentina. El género está representado por plantas aromáticas, herbáceas anuales o perennes y subarbustos; con hojas opuestas en la base de la planta y alternas en la porción superior, simples, pinnadas o pinnatisectas. Diversos autores (Rzedowski 2001, Villarreal-Quintanilla 2003, Villarreal-Quintanilla & Villaseñor 2004, Villarreal-Quintanilla et al. 2008), describen a Tagetes con numerosas glándulas distribuidas en los nomofilos y en las brácteas de las cabezuelas. Presentan inflorescencias en forma de capítulos heterógamos, raramente homógamos, solitarios o agrupados en cimas. Flores marginales liguladas pistiladas, 0-21, flores del disco infundibuliformes a tubulosas perfectas, variables en número. Corolas amarillas, anaranjadas o blancas. México se considera el centro de diversificación de Tagetes con 25 a 35 especies, 15 de ellas endémicas (Díaz-Cedillo & Serrato-Cruz 2011, Villaseñor 2016).
Los pigmentos en las flores y los metabolitos secundarios sintetizados en los órganos vegetativos en la mayoría de las especies de Tagetes les han conferido importancia en la industria agrícola, alimenticia, cosmética y medicinal, entre otras. En este sentido las investigaciones sobre Tagetes se han dirigido principalmente a la caracterización de sus compuestos químicos debido a la actividad biológica sobre varios organismos patógenos (Tereschuk et al. 1997, Dharmagadda et al. 2005, Romagnoli et al. 2005, Céspedes et al. 2006, Pérez-Gutiérrez et al. 2006, Serrato-Cruz et al. 2008, Barajas-Pérez et al. 2011). Estudios etnobotánicos corroboran la importancia de al menos el 10 % de las especies de Tagetes en diferentes aspectos tradicionales de la cultura mexicana (García-Sánchez et al. 2012, Serrato-Cruz 2014, Pérez-Ortega et al. 2016).
Sin embargo, desde el punto de vista morfo-anatómico, el género ha sido poco estudiado. La anatomía foliar es considerada una importante fuente de evidencia taxonómica, que permite el reconocimiento y caracterización de las especies, estableciendo patrones en la identificación de los taxones (González et al. 2016).Hickey (1974) y Hickey & Wolfe (1975) señalan que los caracteres de la arquitectura foliar ayudan a esclarecer la taxonomía de las angiospermas. Al respecto existen diversos trabajos en angiospermas (Martínez 1984, Martínez-Millán & Cevallos-Ferriz 2005, Rodríguez-Rivera & Romero-Rangel 2007, Cervantes et al. 2009); para México, en Asteraceae son escasos (Rojas-Leal et al. 2014) y para Tagetes se resume en la inclusión de algunas especies en estudios comparativos sobre morfología y anatomía de la hoja (García-Sánchez et al. 2012, Martínez et al. 2013, Lizarraga et al. 2017, Rivera et al. 2019).
Estudios de anatomía foliar han comprobado su utilidad para aclarar la taxonomía de diversos grupos, especialmente en el nivel de especie (Oliveira et al. 2008, Gomes et al. 2009, Araújo et al. 2010, Gutiérrez et al. 2015). En Asteraceae, la anatomía foliar también ha contribuido a delimitar diferentes taxones (Lapp et al. 2004, Milan et al. 2006, Adedeji & Jewoola 2008, Bombo et al. 2012, Lapp et al. 2013, Rivera et al. 2017, 2019). En el caso particular de Tagetes se citan solo algunos estudios de anatomía de raíz, tallo y hojas para caracterizar sus especies con fines taxonómicos (Visintin & Bernadello 2005, García-Sánchez et al. 2012, Martínez et al. 2013, Lizarraga et al. 2017, Schiavinato & Bartoli 2018).
Dada la importancia biológica, económica y cultural de Tagetes en México, este estudio tiene el objetivo de contribuir al conocimiento del género, mediante la descripción de la arquitectura y anatomía foliar de ocho especies con distribución en México y una sudamericana, así como aportar caracteres de valor diagnóstico que contribuyan a la identificación de sus especies.
Material y métodos
Recolecta. T. lucida Cav. y T. lunulata Ortega, fueron recolectadas en campo (Apéndice 1); T. lacera Brandegee, T. lemmonii A. Gray, T. linifolia Seaton, T. micrantha Cav., T. parryi A. Gray, T. stenophylla B. L. Rob. y T. zypaquirensis Bonpl. se obtuvieron del Campo Experimental de Fitotecnia, Universidad Autónoma Chapingo (UACh), donde se propagaron a partir de material recolectado en campo por semilla. Se seleccionaron seis hojas adultas de tres individuos por especie, completamente expandidas correspondientes al quinto o sexto nudo contando desde el ápice del eje principal; posteriormente se fijaron en FAA (formaldehído, alcohol etílico, ácido acético y agua; 10:7:1:2; Ruzin 1999). Además, de forma paralela se prepararon ejemplares de referencia para ser depositados en el herbario JES (Apéndice 1).
Arquitectura. Tres hojas por especie, correspondientes a cada ejemplar, se sometieron a la técnica de diafanizado por inmersión en una solución de hidróxido de sodio (NaOH) al 5 % durante 24 h. Posteriormente, las hojas se lavaron con agua corriente, se colocaron en una solución de hipoclorito de sodio (NaClO) al 30 % hasta que se tornaron blanquecinas y se enjuagaron con agua corriente varias veces. Las hojas aclaradas, se deshidrataron en una serie de alcoholes (50, 70 y 96 %) y después se tiñeron con safranina O al 1 % durante 45 minutos. Se eliminó el exceso de colorante y el contenido de agua con lavados en alcohol al 96 y 100 %. Finalmente, se efectúo un cambio con xilol para ser montadas con resina sintética. Las descripciones de la arquitectura foliar se realizaron según Hickey (1974) y Ellis et al. (2009). El tipo estomático se definió de acuerdo con Dilcher (1974). Para la descripción de los tricomas se siguió la terminología propuesta por Rayamayya (1962).
Anatomía. De los individuos recolectados, se tomaron tres hojas por individuo. Para T. lucida, se disectó la parte media de la lámina obteniendo una muestra de 1 cm aproximadamente, respetando la vena media. Para las hojas pinnatisectas se tomó una muestra del segmento lateral y otro de la vena media de la hoja. Las muestras se deshidrataron en un procesador automático de tejidos Leica (TP1020) con alcohol etílico (50, 60, 70, 80, 90 y 100 %) y se incluyeron en paraplast con un punto de fusión de 56 ºC. Una vez incluidas las láminas, se realizaron cortes transversales con un grosor de 12-14 μm en un micrótomo rotatorio Leica (RM2125RT). Las secciones fueron teñidas con safranina-verde rápido y se montaron con resina sintética. La descripción anatómica se realizó siguiendo la terminología de Esau (1976), en tanto que la forma del perfil de la vena media vista en corte transversal se adaptó de la propuesta de Radford et al. (1974) para figuras planas. Las observaciones se realizaron en un microscopio óptico Olympus BX50 y las fotografías se obtuvieron de un analizador de imágenes acoplado (cámara Olympus, analizador Proimage plus).
Resultados
Arquitectura foliar. Hojas pinnatisectas excepto en T. lucida que presenta hojas enteras. Los segmentos son de forma lanceolada, linear, elíptica y obovada; lanceolada a elíptica en T. lacera, T. lemmonii, T. lucida y T. lunulata; linear a elíptica en T. linifolia y T. micrantha; elíptica en T. parryi y T. stenophylla; y obovada o ligeramente oblonga en T. zypaquirensis; ápice agudo en la mayoría de las especies, agudo-atenuado en T. lunulata, agudo-acuminado en T. micrantha y T. stenophylla y emarginado en T. zypaquirensis; margen serrado en la mayoría de las especies, entero en T. linifolia y T. micrantha y lobado en T. stenophylla.
La venación primaria es del tipo pinnado de recorrido recto, ligeramente ondulada hacia el ápice en T. lunulata y T. micrantha (Figura 1A, Tabla 1). Venación secundaria mayor eucamptódronoma tornándose reticulódroma distalmente en la mayoría de las especies (Figura 1A), broquidódroma simple en T. linifolia y T. micrantha (Figura 1B) y festoneada en T. lucida (Figura 1C). Venas secundarias basales de 6 a 8 en T. lucida (Figura 1G). La unión de las venas secundarias mayores con respecto a la vena media es del tipo decurrente, percurrente y excurrente (Figura 1A-D, Tabla 1) con ángulo de divergencia de angosto a moderado (Tabla 1). El espacio entre las venas secundarias es irregular, excepto en T. lacera, T. lemmonii, T. lucida, T. lunulata y T. zypaquirensis (Tabla 1). El recorrido de las venas secundarias mayores es recto a ligeramente curvado, con ligeras ondulaciones en T. lunulata y T. zypaquirensis. Las venas secundarias menores se presentan semicaspedódromas, simples broquidódromas en T. lucida y ausentes en T. linifolia y T. micrantha; en T. lunulata forman una vena secundaria intramarginal (Figura 1A). Venas intersecundarias se encuentran presentes en la mayoría de las especies a excepción de T. linifolia, T. lunulata y T. micrantha. Las intersecundarias tienen una frecuencia menor a una por área intercostal y son paralelas a las secundarias mayores en su curso proximal (Figura 1D), hacia el curso distal, paralelas en T. lacera, T. parryi y T. zypaquirensis, ramificadas en T. lemmonii y T. lucida y, en ocasiones, basiflexas en la unión con la vena secundaria subyacente en T. lemmonii y T. parryi (Figura 1D).
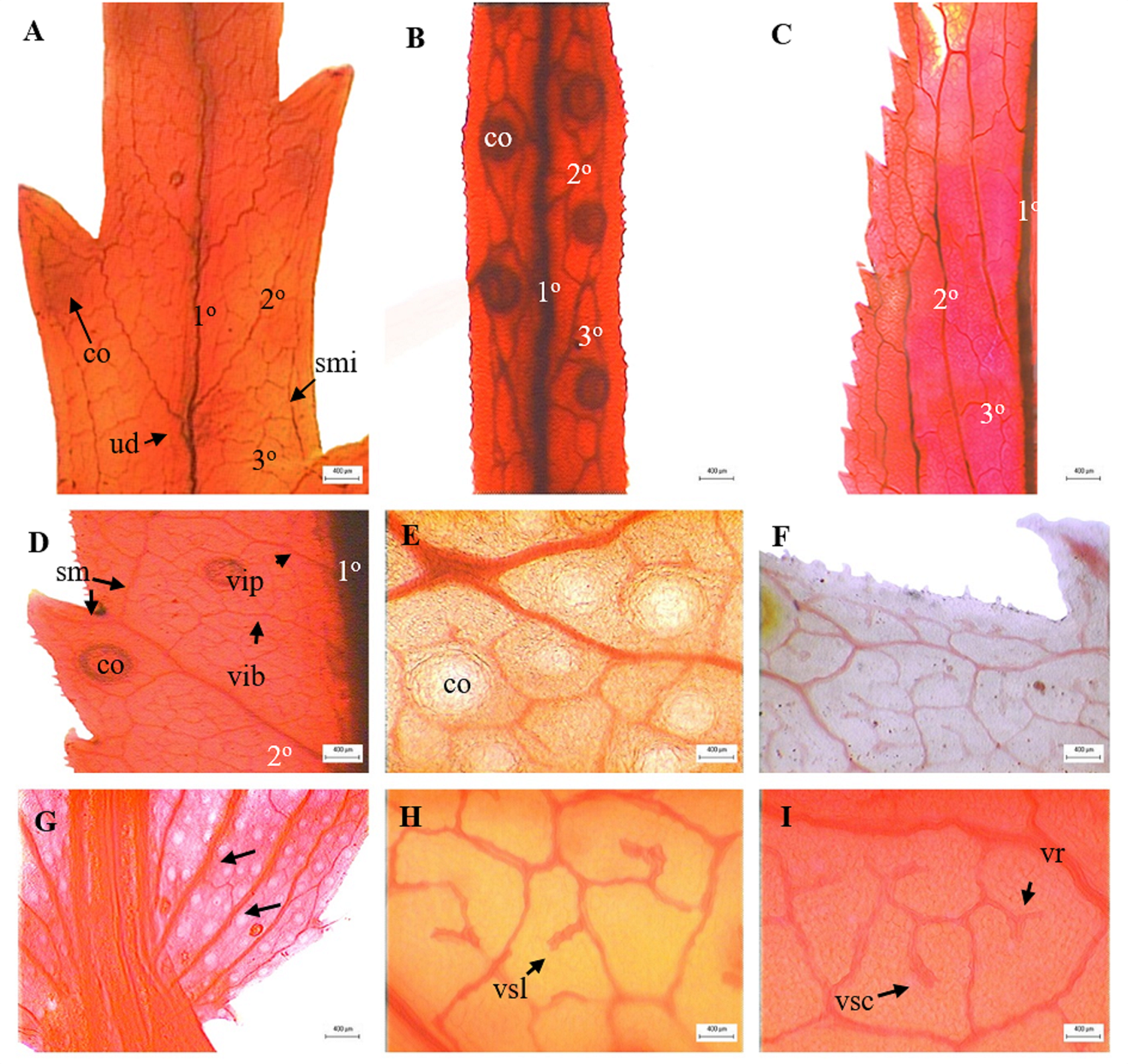
Figura 1 Arquitectura foliar en especies de Tagetes. A. Detalle de la venación eucamptódroma tornándose reticulódroma distalmente, T. lunulata. B. Detalle venación broquidódroma simple, T. linifolia. C. Detalle venación broquidódroma festoneada, T. lucida. D. Venas intersecundarias, T. lemmonii. E. Detalle de canales, T. lucida. F. Venación última marginal, T. lemmonii. G. Venas secundarias basales (flechas), T. lucida. H-I. Vénulas y areolas, T. lemmonii. co = canal, sm = vena secundaria menor, smi = vena secundaria menor intramarginal, ud = unión decurrente, vr = vénula ramificada una vez, vib = vena intersecundaria de curso basiflexo, vip = vena intersecundaria de curso paralelo, vsc = vénula simple curvada, vsl = vénula simple lineal.
Tabla 1 Caracteres del patrón de venación de orden superior en nueve especies de Tagetes. An = angosto, Au = ausente, Bd = bien desarrollada, Bf = broquidódroma festoneada, Bs = broquidódroma simple, C = curvado, Co = curvado con ligeras ondulaciones, Cu = curvas, D = decurrente, Dpp = decreciendo hacia la parte proximal, E = excurrente, Ec = eucamptódronoma tornándose reticulódroma distalmente, Ir = irregular, Li = lineales, Md = moderadamente desarrollada, Mo = moderado Pr = pinnado de recorrido recto, Pro = pinnado de recorrido recto y ligeramente ondulado hacia el ápice, R = recto, Rc = Recto a ligeramente curvado, Rco = Recto a ligeramente curvado con ligeras ondulaciones, Re = regular.
| Especie/carácter | Curso de venación 1a | Tipo de venación 2a | Unión de venas 2o con respecto a la vena media | Ángulo de divergencia | Espacio | Recorrido | Areolas | Vénulas |
|---|---|---|---|---|---|---|---|---|
| Tagetes lacera | Pr | Ec | D | Mo | Re | Rc | Bd | Li, Cu |
| T. lemmonii | Pr | Ec | D, E | An | Re | Rc | Md | Li, Cu |
| T. linifolia | Pr | Bs | E | An | Ir | Rc | Au | Li |
| T. lucida | Pr | Bf | D, E | An | Dpp | R | Md | Li |
| T. lunulata | Pro | Ec | D | An | Re | Co | Bd | Li, Cu |
| T. micrantha | Pro | Bs | D, E | An | Ir | Rc | Au | Li |
| T. parryi | Pr | Ec | E | An, Mo | Ir | C | Md | Li, Cu |
| T. stenophylla | Pr | Ec | D | An | Ir | Rc | Bd | Li |
| T. zypaquirensis | Pr | Ec | D | Mo | Dpp | Rco | Md | Li |
Las venas terciarias intercostales y epimediales constituyen el menor orden de venación y forman las areolas. Estas venas son del tipo reticulado irregular, intercostales opuestas en Tagetes linifolia y T. micrantha y mixtas en T. lucida y T. stenophylla. Las areolas se encuentran moderadamente desarrolladas a bien desarrolladas o ausentes en T. linifolia y T. micrantha. Las vénulas son simples, curvadas o rectas; ramificadas una vez o bien ausentes (Figura 1H-I, Tabla 1). La venación última marginal es incompleta (Figura 1F) o ausente en T. lunulata.
Adicionalmente en los diafanizados se aprecian los canales distribuidos a lo largo de la lámina (Figura 1B), los próximos a la vena media generalmente de menor tamaño y redondeados a elipsoides hacia el margen y base de los dientes (Figura 1D), en T. lucida son numerosos (Figura 1E, G).
Epidermis. En vista superficial, ambas superficies son similares, la cutícula es estriada en todas las especies (Figura 2D). Las células de la epidermis presentan forma tetragonal, poligonal o ligeramente alargadas con excepción de T. lemmonii, T. lucida y T. parryi. Las paredes anticlinales son rectas a onduladas en S (Figura 2C) o U y ligeramente onduladas en T. lemmonii y T. lucida (Figura 2B). Las hojas se observan anfiestomáticas con estomas prevalentes de tipo anomocítico (Figura 2A); T. lucida y T. micrantha con estomas de tipo anomocítico y anisocítico (Figura 2B).
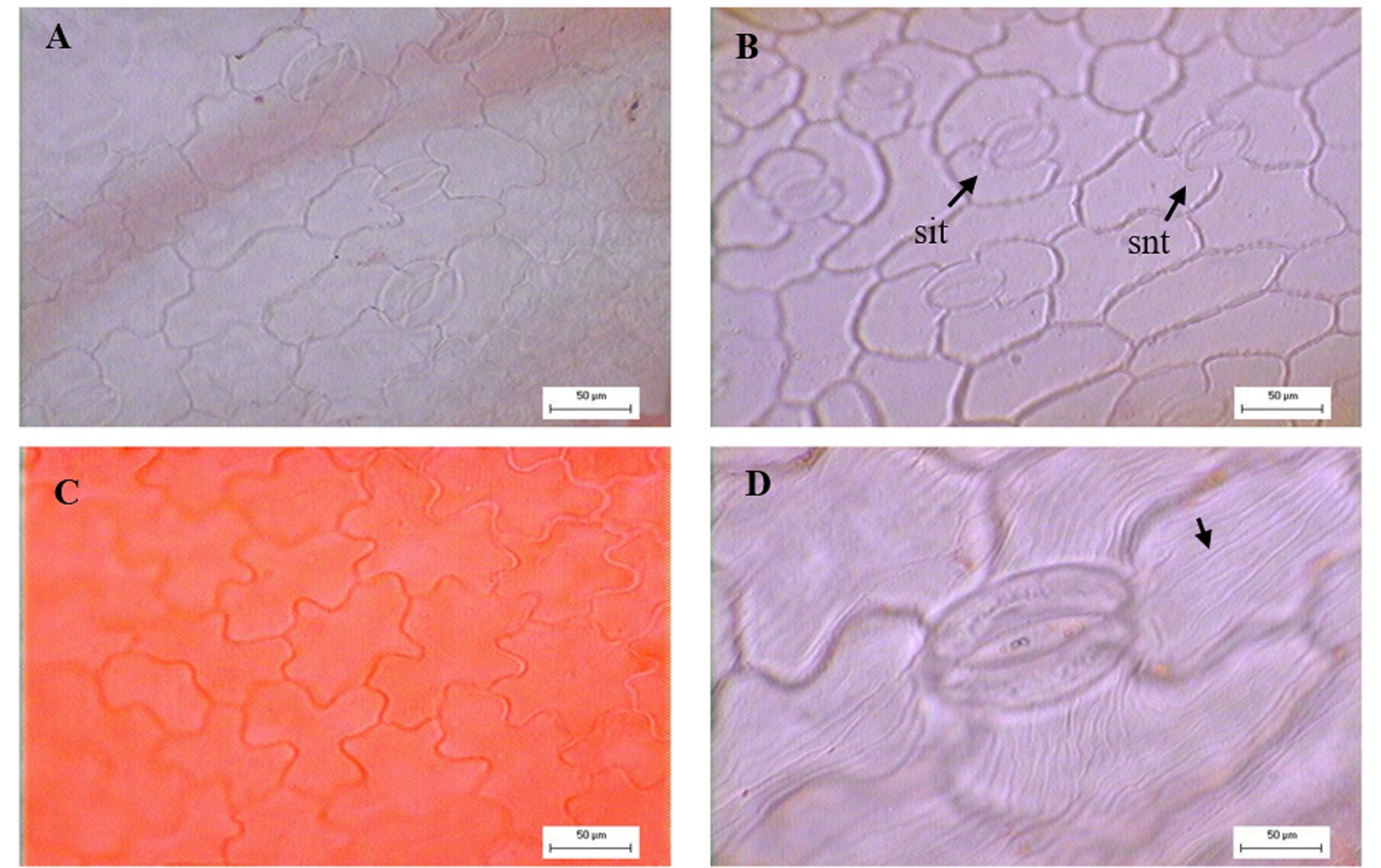
Figura 2 Vista superficial de la epidermis de Tagetes. A. Células epidérmicas y estomas anomocíticos, T. stenophylla. B. Estomas anisocíticos y anomocíticos, T. lucida. C. Células epidérmicas con paredes en forma de “S”, T. zypaquirensis. D. Cutícula estriada (fecha), T. stenophylla.
En ambas superficies epidérmicas se presentaron tricomas glandulares y eglandulares (Apéndice 2, Figura 3). Ocho tipos diferentes son descritos, el tricoma glandular presentó tres variaciones, (1) capitado (Figura 3A-B), (2) uniseriado (Figura 3C) y (3) cónico (Figura 3D). El eglandular presentó cinco formas, (1) cónico (Figura 3E-G), (2) tubular (Figura 3H), (3) de ápice sagitado (Figura 3I-J) (4) subesferoide (Figura 3K) y (5) papila (Figura 3L). Los diferentes tipos de tricomas glandulares y eglandulares presentes en las especies de Tagetes se resumen en la Tabla 2.

Figura 3 Tricomas en especies de Tagetes, secciones transversales. A-D. Tricomas glandulares. E-L. Tricomas eglandulares. A-B. Glandular capitado, T. parryi. C. Glandular uniseriado, T. lacera. D. Glandular cónico, T. parryi. E-G Tricoma cónico, T. zypaquirensis (E), T. lacera (F-G). H. Tricoma tubular, T. lemmonii. I-J. Tricoma de ápice sagitado, T. lemmonii. K. Tricoma subesferoide, T. zypaquirensis. L. Papila, T. linifolia.
Tabla 2 Tipos de tricomas glandulares y eglandulares presentes en nueve especies de Tagetes. As = ápice sagitado Au = ausente, Ca = capitado, Co = cónico, Es = esferoide, P = papila, Su = subesferoide, Tu = tubular, U = uniseriado.
| Especie/ Carácter | Tipos de tricomas | |
|---|---|---|
| Glandular | Eglandular | |
| Tagetes lacera | Ca | Co, Tu |
| T. lemmonii | Au | As, Tu |
| T. linifolia | Au | P |
| T. lucida | Ca | As, Co |
| T. lunulata | Ca | Co, Tu |
| T. micrantha | Ca | Co, Es |
| T. parryi | Ca, Co, U | Co, Tu |
| T. stenophylla | Au | Tu, Es |
| T. zypaquirensis | Au | Co, Tu, Su |
Anatomía. En corte transversal, la cutícula es estriada y la epidermis simple de células poliédricas rectangulares a cuadrangulares (Figura 4A). El mesofilo dorsiventral predomina en la mayoría de las especies analizadas (Figura 4B) y es isolateral en Tagetes linifolia, T. lucida, T. micrantha y T. stenophylla (Figura 4C). El parénquima en empalizada está constituido por un único estrato (Figura 4D) con excepción de T. linifolia y T. lucida que pueden presentar hasta dos estratos hacia la superficie adaxial (Figura 4E). El parénquima esponjoso presentó una variación de cuatro a siete estratos. En T. linifolia, T. lucida y T. micrantha se observó de dos a cuatro estratos; en contraste T. lacera, T. lemmonii, T. lunulata, T. parryi y T. zypaquirensis de cuatro a seis y T. stenophylla de seis a siete estratos. Canales de origen esquizógeno se presentan en las nueve especies (Figura 4E-F), hasta 18 canales en T. lucida (Tabla 3).

Figura 4 Anatomía de la lámina en especies de Tagetes, secciones transversales. A. Epidermis con cutícula estriada (flecha), T. parryi. B. Mesofilo dorsiventral, T. lemmoni. C. Mesofilo isolateral, T. stenophylla. D. Detalle del mesofilo dorsiventral, T. zypaquirensis. E. Detalle del mesofilo isolateral, con dos capas de parénquima en empalizada hacia superficie adaxial y dos canales, T. lucida. F. Haz vascular con extensión de la vaina y canal, T. micrantha. cv = células de la vaina, co = canal, ep = epidermis, hv = haz vascular, pap = parénquima en empalizada, pae = parénquima esponjoso, ti = tricoma.
Tabla 3 Caracteres anatómicos cuantitativos de lámina foliar en sección transversal de nueve especies de Tagetes.
| Especie/carácter | Número de canales | Número de estratos de parénquima en empalizada |
Número de estratos de parénquima esponjoso |
Número de haces por extremo medio |
|---|---|---|---|---|
| Tagetes lacera | 0-3 | 1 | 5-6 | 21-27 |
| T. lemmonii | 0-1 | 1 | 6-7 | 12-19 |
| T. linifolia | 0-1 | 1(2) | 2-4 | 2-5 |
| T. lucida | 6-18 | 1(2) | 3-4 | 14-21 |
| T. lunulata | 0-2 | 1 | 4-6 | 3-5 |
| T. micrantha | 0-2 | 1 | 1-3 | 0-2 |
| T. parryi | 1-2 | 1 | 6 | 12-17 |
| T. stenophylla | 0-3 | 1 | 5-7 | 4-7 |
| T. zypaquirensis | 0-3 | 1 | 5 | 9-20 |
El sistema vascular está representado por numerosos haces colaterales dispuestos a lo largo del mesofilo (Tabla 3), cada haz está rodeado por una vaina de células parenquimáticas, con extensiones hacia ambas epidermis principalmente en los haces de mayor tamaño (Figura 4C, F).
Vena media. El perfil general de la vena media varía en sección transversal, presentó siete formas diferentes que se ilustran y sintetizan en la Figura 5 y Tabla 4, predomina la forma depreso obovada en T. lacera, T. micrantha y T. parryi (Figura 5A, F-G). Se observa cutícula estriada, similar a la descripta en la lámina (Figura 6A). Epidermis uniestratificada, con células poliédricas cuadrangulares a rectangulares. Uno a tres estratos de colénquima subepidérmico adaxial y abaxial, el tipo lagunar es el más frecuentemente (Tabla 4). El parénquima fundamental asociado al sistema vascular presenta numerosos estratos de células clorofílicas isodiamétricas y un estrato de parénquima en empalizada en el segmento de lámina se asocia como pequeñas alas a la vena media (Figuras 6C).

Figura 5 Forma de la vena media en especies de Tagetes, en sección transversales. A. Depresa obovada, T. lacera. B. Cuadrada rómbica, T. lemmonii. C. Cuadrada, T. linifolia. D. Transversalmente oblonga, T. lucida. E. Oblonga, T. lunulata. F. Depreso obovada, T. micrantha. G. Depreso obovada, T. parryi. H. Obovada T. stenophyla. I. Anchamente obovada, T. zypaquirensis. Asterisco = canal.

Figura 6 Anatomía de la vena media en especies de Tagetes, cortes transversales. A. Cutícula estriada (flecha), T. lacera. B. Células esclerosadas, T. linifolia. C. Lámina asociada a la vena media, T. lacera. D. Haz vascular con fibras, T. lucida. E. Haz vascular con un casquete de fibras hacia floema y en menor número hacia el xilema, T. lacera. F. Canal, T. lacera. cc = células clorofílicas, co = canal, cs = células esclerosadas, f = floema, fb = fibras, hv = haz vascular, pep = parénquima en empalizada, pd = epidermis, x = xilema.
Tabla 4 Caracteres anatómicos de vena media en sección transversal de nueve especies de Tagetes.
| Especie/ carácter | Forma general | Número de canales en mesofilo | Canal asociado al floema | Número de estratos de células clorofílicas |
Número de estratos de colénquima |
Número de haces vasculares |
Número de fibras | ||
|---|---|---|---|---|---|---|---|---|---|
| Adaxial | Abaxial | Adaxial | Abaxial | ||||||
| T. lacera | Depreso obovada | 0-1 | Presente | 4-7 | 3-4 | 1-2 | 6-12 | 49-59 | 63-71 |
| T. lemmonii | Cuadrado romboica | 0-1 | Presente | 5-6 | 1 | 2-3 | 9-11 | 33-45 | 84-87 |
| T. linifolia | Cuadrado | 0-1 | Ausente | 2-5 | 1 | 2-3 | 5-6 | 31-38 | 19-25 |
| T. lucida | Transversalmente oblonga | 0-1 | Ausente | 3-4 | 1-2 | 1-2 | 3 | 50-76 | 21-35 |
| T. lunulata | Oblonga | 0-1 | Ausente | 4-5 | 2-3 | 1-2 | 7-8 | 12-17 | 0-2 |
| T. micrantha | Depreso obovada | 0-2 | Ausente | 2-5 | 1 | 1 | 2-7 | 14-24 | 3-7 |
| T. parryi | Depreso obovada | 0-1 | Presente | 4 | 2 | 2 | 3-7 | 47-78 | 55-68 |
| T. stenophylla | Obovada | 0-2 | Ausente | 3-7 | 3-4 | 1-2 | 6-9 | 43-56 | 76-85 |
| T. zypaquirensis | Muy anchamente obovada. | 0 | Presente | 5-6 | 3-4 | 3-4 | 6-14 | 34-49 | 51-89 |
El sistema vascular está constituido por un número diverso de haces colaterales de tamaño variable con alternancia de haces mayores y menores (Tabla 4, Figura 5). Los vasos xilemáticos se disponen radialmente en forma de semicírculo abierto hacia epidermis adaxial, y numerosas fibras o células esclerosadas se agrupan en casquetes prominentes hacia el floema y xilema de los haces de mayor tamaño (Tabla 4, Figura 6B, D-E). T. lucida presenta casquetes de fibras (Figura 6D), en tanto T. linifolia destaca la presencia de refuerzos en células esclerosadas asociadas al xilema hacia la superficie adaxial. La mayoría de las especies presentan un canal de origen esquizógeno en el parénquima, excepto en T. micrantha y T. stenophylla que desarrollan hasta dos (Figura 5F); están ausentes en T. zypaquierensis (Figura 5I). En T. lacera, T. lemmonii, T. parryi y T. zypaquirensis son comunes canales en los extremos próximos al floema (Figura 6E-F).
Discusión
Arquitectura. El tipo de hoja pinnatisecta fue común para la mayoría de las especies con excepción de T. lucida. Diversos autores, Rzedowski (2001), Villarreal-Quintanilla (2003), Villarreal-Quintanilla & Villaseñor (2004) y Serrato-Cruz (2014) hacen referencia al tipo de hoja compuesta (pinnado) para algunas de las especies estudiadas. Sin embargo, en este estudio se corrobora una reducción de la lámina cercana a la vena media (Figura 5) sin formar segmentos independientes, por esta razón es correcto referirse a hojas de tipo pinnatisecto como lo señalan García-Sánchez et al. (2012) para T. lucida, T. lunulata y T. micrantha y Rojas-leal et al. (2014) para especies de la tribu Senecioneae. La forma lanceolada a elíptica de los segmentos destaca entre la mayoría de las especies y al parecer es la forma que domina en el género. En Asteraceae es común el margen dentado (Bailey & Sinnott 1916, Rojas-Leal et al. 2014, Rivera et al. 2019); este carácter se presenta en la mayoría de las especies. Sin embargo, se observó la presencia de márgenes enteros en T. linifolia y T. micrantha, en tanto T. stenophylla presentó márgenes lobados.
Los órdenes de venación mostraron diferencias en las venas secundarias y categorías superiores. La venación primaria fue del tipo pinnado, carácter reportado por Rivera et al. (2019) para especies de Tageteae; T. lunulata y T. micrantha difieren del resto de las especies en el recorrido de la vena media hacia el ápice, por la presencia de ondulaciones. Los patrones de venación secundaria se disponen en tres diferentes tipos, este carácter podría contribuir a la sistemática del grupo. El tipo de venación eucamptódronomo fue la más frecuente y se ha reportado para T. minuta y T. terniflora (Lizarraga et al. 2017). Martínez et al. (2013) describieron la venación de T. lucida como reticulódroma y Garrido et al. (2013) como reticulada del tipo craspedódroma. Sin embargo, en nuestras observaciones Tagetes lucida se describe como broquidódroma festoneada (Figura 1C). Las venas secundarias basales permitieron reconocer a T. lucida, mientras que la vena intramarginal sólo se apreció en T. lunulata. La presencia o ausencia de venas intersecundarias podrían ser un carácter importante en la sistemática del género, particularmente entre T. linifolia, T. lunulata y T. micrantha. De igual manera resulta interesante el grado de desarrollo de las areolas, mismo que fue variable. Presentándose areolas moderadamente desarrolladas y bien desarrolladas, excepto en T. linifolia y T. micrantha en las cuales no se forman areolas.
Anatomía. La descripción anatómica foliar para las especies de Tagetes abordadas en este trabajo coincide con lo reportado en la familia Asteraceae. Por ejemplo, epidermis uniestratificada, estomas anomocíticos, tricomas glandulares y eglandulares, mesofilo dorsiventral, haces vasculares colaterales y otras estructuras secretoras (Metcalfe & Chalk 1950).
Al comparar entre sí la anatomía foliar en las especies de Tagetes, se observaron variaciones en algunos de los atributos que contribuyen a diferenciarlas como entidades taxonómicas, confiriéndoles el valor de caracteres diagnósticos.
La epidermis aporta información importante desde el punto de vista taxonómico y en esta destacan las ornamentaciones cuticulares, tipos de tricomas, tipos de estomas y su ubicación en la hoja (Fahn 1985, Adedeji 2004, Adedeji & Illoh 2004, Delbón et al. 2007, Adedeji & Jewoola 2008, Lapp et al. 2015). La presencia o ausencia de estriaciones cuticulares han sido utilizadas para aclarar la taxonomía entre especies y géneros en la familia Asteraceae (Adedeji & Jewoola 2008). Los taxones estudiados de Tagetes presentaron cutícula estriada. Sin embargo, las estriaciones son visiblemente heterogéneas entre las especies, en este sentido resultaría interesante evaluar la ultraestructura de la cutícula con microscopía electrónica de barrido. Lizarraga et al. (2017) reportaron para T. terniflora y T. minuta la presencia de cutícula estriada, mientras que López et al. (2008) indicaron que la cutícula estriada solo se presenta en la epidermis que cubre a la cavidad secretora en ambas superficies de la hoja y la cutícula lisa en el resto de la lámina de T. minuta, dicha diferencia en la distribución de las estriaciones no se observó en las especies estudiadas. Fahn & Cutler (1992), Lapp et al. (2013) y Rivera et al. (2019) señalan que la ornamentación cuticular puede ser catalogada como un rasgo xeromórfico, al interpretarse como un mecanismo contra la alta radiación solar y Rivera et al. (2017) señalan que las estriaciones cuticulares pueden ser útiles en la separación entre especies.
Los tricomas han sido relevantes en la taxonomía de diversas especies de Asteraceae (Lapp et al. 2004, Adedeji & Jewoola 2008, Redonda-Martínez et al. 2012, Rojas-Leal et al. 2017). En los taxones analizados de Tagetes, se describen diferentes tipos de tricomas que revelan la variación entre las especies. T. parryi presentó contenidos con tintes oscuros en las células del tricoma, al parecer esta coloración hace referencia a compuestos bioactivos, entre estos, lípidos, compuestos fenólicos, proteínas, alcaloides, mucílagos y pectinas, características de células apicales del tricoma o presentes a lo largo del mismo como lo señala Rikisahedew (2018). En este sentido resulta interesante efectuar estudios de histoquímica para conocer más sobre los compuestos bioactivos en los tricomas de Tagetes y evaluar su potencial biológico. La presencia de tricomas biseriado y uniseriado próximos a las venas principales de las hojas en las especies de Tagetes es un carácter que ya ha sido reportado por Lizarraga et al. (2017) para T. minuta y T. terniflora. Sin embargo, Martínez et al. (2013) no los describen para T. lucida ni García-Sánchez et al. (2012) para T. lucida, T. lunulata y T. micrantha. T. parryi al parecer es una especie que permite diferenciarse por desarrollar conjuntamente tricomas eglandulares y glandulares y de estos últimos las variaciones aquí descritas. La presencia de estos caracteres sugiere que la especie se ha diferenciado considerablemente al ser un taxón endémico y con distribución restringida.
Respecto a la ubicación de las estomas en la lámina foliar, se ha reportado su valor diagnóstico para algunas especies de Asteraceae (Lapp et al. 2004, 2013). Sin embargo, para los taxones aquí estudiados la distribución no mostró variación. La presencia de estomas anomocíticos es característico en Asteraceae como lo señala Metcalfe & Chalk (1979). En T. lucida y T. micrantha además de estomas anomocíticos se desarrollan estomas del tipo anisocítico. Ambos tipos de estomas son reportados por Rivera et al. (2019) para algunas especies de Tageteae. La presencia de hojas anfiestomáticas en Tagetes al parecer tienen un significado adaptativo xeromórfico como lo señalan Liesenfeld et al. (2019) dicha característica favorece la circulación de CO2, optimizando así el intercambio de gases en un periodo corto de tiempo, evitando la pérdida de agua por transpiración y aumentando la tasa fotosintética.
La presencia de hojas dorsiventrales en las especies analizadas ya había sido reportada para dos especies de Tagetes (Lizarraga et al. (2017). En general esta condición es común en la familia Asteraceae (Solereder 1908, Metcalfe & Chalk 1950). Nuestras observaciones muestran que T. linifolia, T. lucida, T. micrantha y T. stenophylla desarrollan hojas isolaterales, característica que también se relaciona con adaptaciones xeromórficas (Pyykkö 1966). La presencia de hojas isolaterales contrasta con lo reportado por García-Sánchez et al. (2012) quienes señalan que T. lucida y T. micrantha presentan hojas dorsiventrales. Las variaciones respecto a la distribución del parénquima en empalizada se interpretan como una adaptación estructural relacionada a las condiciones de radiación solar, una vez que esta influye en el desarrollo del parénquima en empalizada (Rôças et al. 2001, Guarnaschelli 2009, Jáuregui et al. 2012). Al parecer la estructura de la hoja puede verse modificada dadas ciertas condiciones ambientales como ocurre en Lippia turbinata, especie que adquiere una estructura dorsiventral en sus hojas jóvenes bajo ambientes mesofíticos y una estructura isolateral en condiciones xerófitas (Andersen et al. 2006). En este sentido la formación de dos estratos de parénquima en la cara adaxial en T. linifolia y T. lucida podría relacionarse con las condiciones de luz, falta de compuestos nitrogenados y retraso en el flujo de agua debido a la deficiencia hídrica como lo sugieren Shields (1950) y García-Sánchez et al. (2012). Por otro lado, las características del parénquima aquí descrito revelan la plasticidad fenotípica de las especies para adaptarse a diferentes ambientes como lo señala Rossatto & Kolb (2010), futuros estudios con un muestreo más amplio permitirán confirmar esta aseveración.
Algunos caracteres presentes en la vena media son interesantes taxonómicamente, entre estos, destacan la forma en sección transversal, la distribución de los haces vasculares y la presencia de esclerénquima en forma de casquetes de fibras o como células esclerificadas acompañando al floema y xilema (Lapp et al. 2013, Delbón et al. 2012, Lapp et al. 2015). García-Sánchez et al. (2012) observaron que las diferencias más significativas en tres especies de Tagetes se localizan en la vena media. En las especies aquí analizadas, la forma de la vena media en sección transversal fue heterogénea. La presencia de numerosos haces vasculares en la vena media es común en las especies evaluadas como ocurre en varios miembros de Asteraceae (Metcalfe & Chalk 1979), esta característica con seguridad se relaciona con la eficiencia para conducir nutrientes en la hoja y para generar mayor resistencia mecánica de este órgano. Los tamaños de los haces vasculares fueron heterogéneos como lo señaló Delbón et al. (2007), los haces de mayor tamaño se disponen principalmente en el centro de la vena, mientras que los pequeños se presentan hacia las extensiones foliares o alternándose como ocurre en T. lacera, T. lemmonii, T. parryi y T. zypaquirensis. La alternancia de haces pequeños con los mayores y centrales en la vena media podría considerarse como un rasgo característico de estas especies. Es común que los haces se distribuyan en forma de arco con excepción de T. lucida donde los haces se encuentran alineados de forma ligeramente paralela a la superficie epidérmica, aspecto que se relaciona con la forma del perfil de la vena media.
La presencia de vaina parenquimática es un rasgo común en la lámina de todas las especies estudiadas. T. lucida fue la única especie que presentó una vaina de esclerénquima en el haz de la vena media. Como lo mencionan García-Sánchez et al. (2012) y Martínez et al. (2013), la vaina lignificada es interpretada como una característica adaptativa al proporcionar una protección eficaz contra la alta radiación solar y la sequía fisiológica (Ferraro & Scremin-Dias 2018). Las vainas vasculares participan en diversas funciones metabólicas, de protección contra daños por condiciones de sequía y fuertes vientos (Lapp et al. 2013).
Por otra parte, T. linifolia se diferenció por la presencia de células esclerosadas próximas al xilema en la vena media, la presencia de este tejido siguiere la función de protección y soporte (Liesenfeld et al. 2019). En todas las especies es común la ocurrencia de más de dos estratos de células clorofílicas y el colénquima subepidérmico de tipo lagunar presente en seis de las nueve especies evaluadas, cuya función se relaciona con el soporte y flexibilidad (Liesenfeld et al. 2019).
Según Castro et al. (1997), en Asteraceae se han reconocido ocho tipos diferentes de estructuras secretoras. En las especies aquí evaluadas se reconocen los canales y los tricomas glandulares. Los canales se distinguen por tener diámetro de diferente tamaño. Los dispuestos hacia la superficie abaxial y próximos al floema en los haces de mayor tamaño de la vena media son más pequeños que los ubicados en la lámina. Esta disposición es similar a lo reportado para T. patulata (Poli et al.1995), T. terniflora y T. minuta (Lizarraga et al. 2017), en algunas investigaciones se sugiere que la cercanía de los canales al floema ayuda en el flujo de nutrientes (Inceer & Ozcan 2011, Bartoli et al. 2011). Los canales de mayor tamaño en el mesofilo en varios estudios morfológicos se denominan “glándulas oleíferas” (Rzedowski 2001, Villarreal-Quintanilla 2003, Villarreal-Quintanilla & Villaseñor 2004, Villarreal-Quintanilla et al. 2008); sin embargo, este término no es apropiado porque estos canales están en el mesofilo por debajo de ambas superficies y no observamos ninguna secreción hacia la superficie epidérmica.
La distribución de las estructuras secretoras en los órganos vegetales ha sido utilizada en distintos estudios anatómicos de Asteraceae por su valor en la delimitación de géneros (Castro et al. 1997) y especies (Lapp et al. 2004, Delbón et al. 2007, Oliveira et al. 2013). Por otro lado, la presencia de los tricomas glandulares, canales en el mesofilo y su proximidad a los haces vasculares se considera como una defensa contra el herbivorismo y patógenos, una vez que su secreción solo saldría a la superficie si la planta presenta algún daño mecánico (Monteiro et al. 1995, Ciccarelli et al. 2001, Tosoratto et al. 2016, Bombo et al. 2017). Guillet et al. (1997) observaron en Porophyllum gracile que la herbivoría disminuye significativamente a medida que aumenta el número de tricomas glándulas por hoja y sostienen que dichas estructuras proporcionan ventajas adicionales como la prevención de la autotoxicidad. La presencia de compuestos químicos en los canales y tricomas glandulares pueden ser responsables del gran valor fitoquímico reportado para varias especies de la familia (Delbón et al. 2007, Molares et al., 2009, Hulley et al. 2010, Bombo et al. 2012). En este sentido diversos estudios han identificado los compuestos de algunas especies de Tagetes, principalmente aceites esenciales. Por ejemplo, en T. lucida se ha identificado anetol, metileugenol y estragol (Bicchi et al. 1997), en T. parryi, canfeno, 3, 6, 6 trimetil-2-norpinanol y anisol (Diaz-Cedillo & Serrato-Cruz 2011); en T. terniflora, cis-tagetona y cis-β-ocimeno y T. minuta cis-tagetona, hidrotagetona y cis-β-ocimeno (Lizarraga et al. 2017). La composición fitoquímica de diversos compuestos y extractos de distintas especies de Tagetes son mencionados por Salehi et al. (2018).
Los caracteres anatómicos de las especies evaluadas son útiles en la taxonomía del grupo y pueden contribuir en la delimitación e identificación de especies poco estudiadas dentro del género aún en estado vegetativo. Destacan como caracteres de valor diagnóstico la arquitectura foliar, tipo de tricomas, tipo de mesofilo, canales de origen esquizógeno y la presencia de esclerénquima asociado a los haces vasculares. Desde el punto de vista ecofisiológico, resulta interesante evaluar la influencia del ambiente en el desarrollo de estructuras secretoras y otras características foliares como el tipo de mesofilo y estudiar su posible variación en condiciones ambientales diferentes. Se sugiere explorar la anatomía de otras especies de Tagetes, particularmente las que presentan distribución en México por concentrar su mayor diversidad.











 nueva página del texto (beta)
nueva página del texto (beta)



