En marzo del 2019, la asamblea general de la Organización de las Naciones Unidas declaró la década de la restauración de los ecosistemas del 2021 al 2030 (ONU 2020). La restauración ecológica es el proceso que ayuda a la recuperación de un ecosistema que ha sido degradado, dañando o destruido (SER 2004). En México, uno de los ecosistemas que presenta altas tasas de deforestación y degradación debido a las actividades agropecuarias es la selva estacionalmente seca (Trejo & Dirzo 2000, Dirzo et al. 2011). La última revisión de proyectos de restauración en México de 1979 al 2016 mostró que menos proyectos se han llevado a cabo en ese ecosistema en comparación con el bosque templado y la selva húmeda (revisado en Martínez-Garza et al. 2021).
Dependiendo de las condiciones iniciales de degradación se pueden llevar a cabo diferentes niveles de intervención de restauración (Martínez-Garza et al. 2016). Por ejemplo, sitios con bajos niveles de degradación pueden recuperarse si se detiene la perturbación, lo que es llamado intervención mínima o regeneración no asistida (Stern et al. 2002, Chazdon & Guariguata 2016). Sitios con altos niveles de degradación y alejados de fragmentos de vegetación conservada pueden requerir la modificación de las condiciones del suelo y la plantación de especies nativas, lo que es llamado intervención máxima (Vázquez-Yanes et al. 1999, Benayas et al. 2009). La ganadería extensiva es un disturbio de alta intensidad (Guariguata & Ostertag 2001) que predice bajo potencial de regeneración natural (Zermeño-Hernández et al. 2015), por lo que se sugiere el uso de plantaciones para la restauración de esos sitios (Martínez-Garza et al. 2021). Dado que la ganadería extensiva es una actividad muy común en la selva estacionalmente seca, para su restauración será necesario el establecimiento de plantaciones.
La selección de especies para plantaciones de restauración se puede basar en su estado sucesional. Las especies llamadas sucesionales tempranas son las primeras en colonizar los sitios perturbados; estas especies presentan ciclos de vida cortos, elevadas tasas de crecimiento y alta demanda de luz solar (Finegan 1984, Kennard 2002, Poorter et al. 2004). Por otro lado, las especies sucesionales tardías, que son las que conforman la selva más conservada, presentan ciclos de vida más largos, bajas tasas de crecimiento y tolerancia a la sombra (Finegan 1984, Kennard 2002). Los sitios degradados de la selva estacionalmente seca se caracterizan por presentar suelos altamente compactados debido a la ganadería extensiva (Gerhardt 1996), alta incidencia de luz y baja humedad resultado de la eliminación del dosel y a una extensa temporada de secas (Rzedowski 1978). Algunos atributos de las especies sucesionales tempranas, como la baja densidad de madera, alta tasa fotosintética y caracteres funcionales relacionados con la tolerancia a la sequía, predicen una mayor supervivencia en sitios con alta disponibilidad de luz y baja humedad (Poorter et al. 2010, Lohbeck et al. 2013). Esta predicción se ha comprobado en plantaciones en Costa Rica (Gerhardt 1996) y México (Carrasco-Carballido et al. 2019), aunque existe una alta variabilidad en el desempeño de las especies (Janos 1996, Khurana & Singh 2001, Bonfil & Trejo 2010). Otras características, como la capacidad de fijar nitrógeno, puede otorgar una ventaja adicional a las especies en suelos degradados; por ejemplo, en plantaciones de restauración establecidas en la selva estacional de Jalisco (González-Tokman et al. 2018), en Morelos (Carrasco-Carballido et al. 2019) y en Costa Rica (Piotto et al. 2004) se encontraron mayores tasas de supervivencia de especies leguminosas en comparación con las de especies no-leguminosas. Así, se espera que las especies leguminosas sucesionales tempranas presenten mejores niveles de supervivencia en áreas degradadas.
El objetivo de este trabajo fue evaluar la supervivencia inicial (28 meses) de 12 especies nativas por su estado sucesional (tempranas y tardías) y grupo funcional (leguminosas y no-leguminosas) en áreas de selva estacional degradada. Debido a sus características de historia de vida (e.g., altas tasas de crecimiento) y a la ventaja de fijar nitrógeno, esperamos que las especies leguminosas sucesionales tempranas tengan mayor supervivencia que las no-leguminosas de cualquier estado sucesional. Evaluar la supervivencia de especies nativas en áreas degradadas nos permite seleccionar aquellas exitosas para establecer plantaciones que permitan aumentar la velocidad de recuperación de uno de los ecosistemas más degradados de México. El uso de categorías que pueden asignarse fácilmente, como el estado sucesional y la capacidad de fijar nitrógeno, permitirá que los que practican la restauración puedan seleccionar especies de forma sencilla, mediante estos atributos.
Materiales y métodos
Sitio de estudio. El estudio se llevó a cabo en un terreno del Ejido de Quilamula, Tlaquiltenango, Morelos, México. El terreno ha tenido una historia de uso agrícola y ganadero por más de 20 años (Sr. Gilberto Quintero, dueño del terreno, com. pers.). Este terreno presenta una pendiente de 10° e inicialmente tenía una cobertura del 20 % de árboles dispersos de Mimosa benthamii J.F. Macbr. (Fabaceae) que fueron eliminados para establecer las plantaciones en condiciones abióticas similares (Figura 2A y B). El Ejido de Quilamula se encuentra al sur del Estado de Morelos, dentro de la zona de influencia y amortiguamiento de la Reserva de la Biosfera Sierra de Huautla (REBIOSH; Figura 1). El ecosistema original en la REBIOSH corresponde a la selva estacionalmente seca (sensuDirzo et al. 2011), también llamado bosque tropical caducifolio (sensuRzedowski 2006) o selva baja caducifolia (sensuMiranda & Hernández-X 1963). Este ecosistema es conocido por su riqueza florística y su alto endemismo a nivel de especie (Lott & Atkinson 2010); cerca del 60 % de las especies en este ecosistema son endémicas al país (Rzedowski 1991). La selva estacionalmente seca se caracteriza por su marcada estacionalidad, con una época de lluvias que va del mes de mayo a noviembre y una época de secas que dura de cinco a ocho meses, en la que la mayoría de los árboles pierden sus hojas (Rzedowski 1978). Las especies de árboles más comunes son las leguminosas Conzattia multiflora (BL Rob.) Standl., Lysiloma acapulcense (Kunth) Benth., L. divaricatum (Jacq.) JF Macbr., así como también varias especies de los géneros Bursera (Buseraceae) y Ceiba (Bombacaceae) (CONANP 2005). Los árboles tienen una altura promedio de 15 m con un diámetro a la altura de pecho > 50 cm, los troncos son regularmente retorcidos y se ramifican a corta altura (Rzedowski 1978, Trejo & Hernández 1996). Los suelos dominantes para la REBIOSH son feozem háplicos, regosoles éutricos y litosoles (INEGI 1981). El sustrato geológico está conformado por rocas ígneas del Oligoceno-Mioceno, sedimentarias del Cretáceo Inferior, litológicamente clasificadas como calizas y depósitos marinos interestratificados de areniscas y lutitas del Cretáceo Superior (Lugo-Hubp 1984).

Figura 1 Localización de la Reserva de la Biosfera Sierra de Huautla en el estado de Morelos México. Se muestra la ubicación del Ejido de Quilamula en la zona de influencia de la Reserva.

Figura 2 (A) Terreno en junio del 2017 antes de la plantación, se señala un árbol de Mimosa benthamii (Fabaceae) que fue cortado. (B) Plantación de Tabebuia rosea (Bignoniaceae) establecida en julio del 2017. (C) Plantación de Dodonaea viscosa (Sapindaceae) en la época seca del 2019. (D) Plantación en la época lluviosa del 2019. (E) Plantación de Dodonaea viscosa en la época de lluvias del 2019. (F) Plantación de Leucaena leucocephala (Fabaceae) en la época de lluvias del 2019, se señala el fruto.
Quilamula se encuentra a una altitud de 1,070 m snm; el clima está clasificado como cálido subhúmedo, el más seco de los subhúmedos, con lluvias en verano y presencia de canícula (Awo"(w)(i’)g). Para los últimos 15 años, la temperatura media anual promedio fue de 25.01 °C y la precipitación anual promedio fue de 971.4 mm (D. Valenzuela, com. pers.). El paisaje está formado por montañas escarpadas de alrededor de 1,000 m snm); los suelos dominantes (Leptosoles y Cambisoles) se derivan de granitos subyacentes poco profundos (< 30 cm de profundidad), con textura franco-arenosa; aproximadamente el 50 % del contenido de materia orgánica del suelo se concentra dentro de los primeros 10 cm de profundidad (Saynes et al. 2005). Los suelos de Quilamula con vegetación nativa tienen un pH cercano a neutro (6.9 a 7.3) y la densidad aparente del suelo varía de 0.88 a 0.96 g cm-3 (Saynes et al. 2005).
Diseño experimental. En julio de 2017 se estableció un proyecto de restauración ecológica experimental en un terreno de 1.2 ha que fue cercado con alambre de púas a cuatro niveles para excluir al ganado. En el terreno se establecieron 60 parcelas en un diseño de bloques completos al azar, cada bloque está compuesto por 20 parcelas. Cada parcela mide 11.5 × 10 m con pasillos entre ellas de 3 m hacia lo largo y 2.5 m hacia lo ancho (Figura 3). En 36 parcelas se establecieron monocultivos con 30 plantas de cada una de las 12 especies de árboles nativos de la selva estacional (N = 1,080 plantas; Tabla 1); para cada especie se establecieron tres réplicas. Las plantas fueron establecidas en una disposición de cinco filas por seis columnas con una separación entre plantas de 1.5 m. La edad de las plantas al momento del trasplante fue de aproximadamente un año, excepto las de Bursera linanoe (La Llave) Rzed., Calderón y Medina que tenía dos años (Tabla 1); las plantas provenían de los viveros forestales de las localidades de Huajintlán y Ajuchitlán pertenecientes a la Secretaría de Desarrollo Sustentable del Estado de Morelos. Las semillas de las especies utilizadas se colectaron de un mínimo de 12 árboles adultos; la mayoría de las especies se germinaron directamente en bolsas de 15 × 25 cm expuestas al sol con una mezcla de arena, tierra de limo, tepojal (piedra pómez) y hojarasca picada; Dalbergia congestiflora Pittier, Amphipterygium adstringens (Schltdl.) Standl. y B. linanoe se germinaron en semilleros dentro del vivero y las plántulas de entre 10-15 cm de altura se trasplantaron a bolsas de las mismas dimensiones antes mencionadas y también se expusieron al sol (A. Nicolás-Medina, trabajadora del vivero, com. pers.). Una vez en el sitio de estudio, las plantas no recibieron fertilización ni fueron regadas. La fertilidad del suelo se midió en las plantaciones en el 2019: las variables evaluadas fueron el pH (H2O, 5.9), la concentración de nitrógeno total (3.42 ± 0.19 mg N g-1) la concentración de NO3- (6.54 ± 1.25 µg N g-1) el NH4 + (15.06 ± 3.05 µg N g-1), el carbono orgánico (24.89 ± 6.53 mg C g-1), y la concentración de fósforo total (171 ± 20.20 µg P g-1) (H. E. Hernández-Jiménez datos no publicados). Los censos de supervivencia se realizaron en octubre del 2017, junio y octubre del 2018 y octubre del 2019 (Figura 2C, D-F). Las plantas se registraron como muertas cuando las ramas no presentaban hojas o el tronco estaba completamente seco.
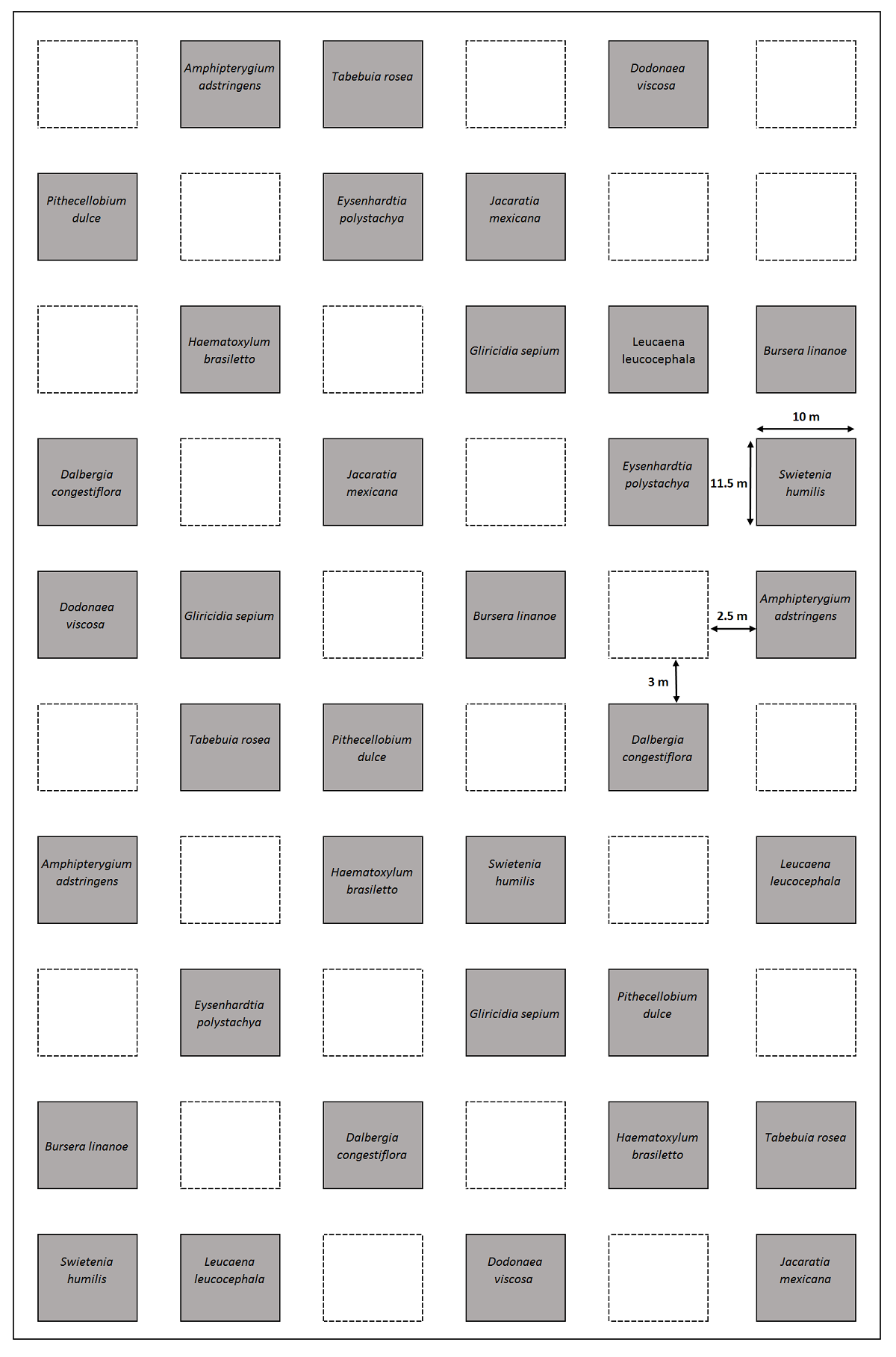
Figura 3 Diseño experimental de las parcelas de restauración ecológica en Quilamula, Morelos, México. Se muestra la localización de las parcelas de 12 monocultivos; los cuadros con línea punteada son tratamientos no incluidos en este estudio.
Tabla 1 Familia, estado sucesional y porcentaje de supervivencia de 12 especies arbóreas de la selva estacionalmente seca en plantaciones experimentales en Quilamula, Morelos, México; letras distintas después del porcentaje de supervivencia, indican diferencias significativas (P < 0.05).
| Especie* | Familia | Estado sucesional | Supervivencia (%) |
|---|---|---|---|
| Leguminosas | |||
| Dalbergia congestiflora Pittier | Fabaceae | Tardío | 27.78 c |
| Eysenhardtia polystachya (Ortega) Sarg. | Fabaceae | Tardío | 35.56 bc |
| Haematoxylum brasiletto H. Karst. | Fabaceae | Tardío | 34.44 bc |
| Gliricidia sepium (Jacq.) Kunth ex Walp. | Fabaceae | Temprano | 2.22 d |
| Leucaena leucocephala (Lam.) De Wit | Fabaceae | Temprano | 45.56 b |
| Pithecellobium dulce (Roxb.) Benth. | Fabaceae | Temprano | 4.44 d |
| No-leguminosas | |||
| Amphipterygium adstringens (Schltdl.) Standl. | Anacardiaceae | Tardío | 6.67 d |
| Bursera linanoe** (La Llave) Rzed., Calderón y Medina | Burseraceae | Tardío | 7.78 d |
| Tabebuia rosea (Bertol.) DC. | Bignoniaceae | Tardío | 6.67 d |
| Dodonaea viscosa Jacq. | Sapindaceae | Temprano | 73.33 a |
| Jacaratia mexicana A. DC. | Caricaceae | Temprano | 0 e |
| Swietenia humilis Zucc. | Meliaceae | Temprano | 36.67 bc |
*Los autores de las especies fueron tomados de www.tropicos.org
**Los individuos de esta especie presentaban dos años antes del trasplante.
Análisis de datos. La supervivencia se analizó con la función de supervivencia mediante el estimador no paramétrico de Kaplan-Meier (Pollock et al. 1989). Se realizó un análisis por especie (12 niveles), estado sucesional (dos niveles, tempranas y tardías), grupo funcional (dos niveles, leguminosas y no-leguminosas) y para la interacción estado sucesional × grupo funcional (cuatro niveles: temprana leguminosa, temprana no-leguminosa, tardía leguminosa y tardía no leguminosa). El parámetro de referencia de supervivencia fue expresado en días. La comparación entre curvas de supervivencia por grupo se analizó mediante la prueba Log-Rank. Los análisis estadísticos se realizaron con el programa STATISTICA 7.0 (StatSoft 2004) y el programa R (R Core Team 2020) en su versión 4.0.2. En la sección de resultados, las especies serán referidas por el género.
Resultados
La supervivencia para las 12 especies después de 850 días fue en promedio de 23.42 %. La especie temprana no-leguminosa Dodonaea (Sapindaceae) presentó la mayor supervivencia (73.33 %), mientras que todos los individuos de Jacaratia (Caricaceae) murieron (Tabla 1). El análisis estadístico reveló diferencias en la supervivencia entre especies (χ2= 252, g.l. = 11, P < 0.00001). Las comparaciones Log-Rank revelaron que Dodonaea presentó el más alto porcentaje de supervivencia y este fue estadísticamente diferente al de todas las demás especies. El porcentaje de supervivencia de Leucaena fue similar al de Swietenia, Eysenhardtia y Haematoxylum, estas tres últimas especies presentaron porcentajes de supervivencia similares a los de Dalbergia; por último, Jacaratia presentó el porcentaje de sobrevivencia más bajo que fue estadísticamente diferente al de todas las demás especies (Figura 4).

Figura 4 Curvas de Kaplan-Meier de 12 especies arbóreas nativas de la selva estacionalmente seca establecidas en plantaciones experimentales en Quilamula, Morelos, México. Letras distintas indican diferencias significativas en las pruebas de comparación.
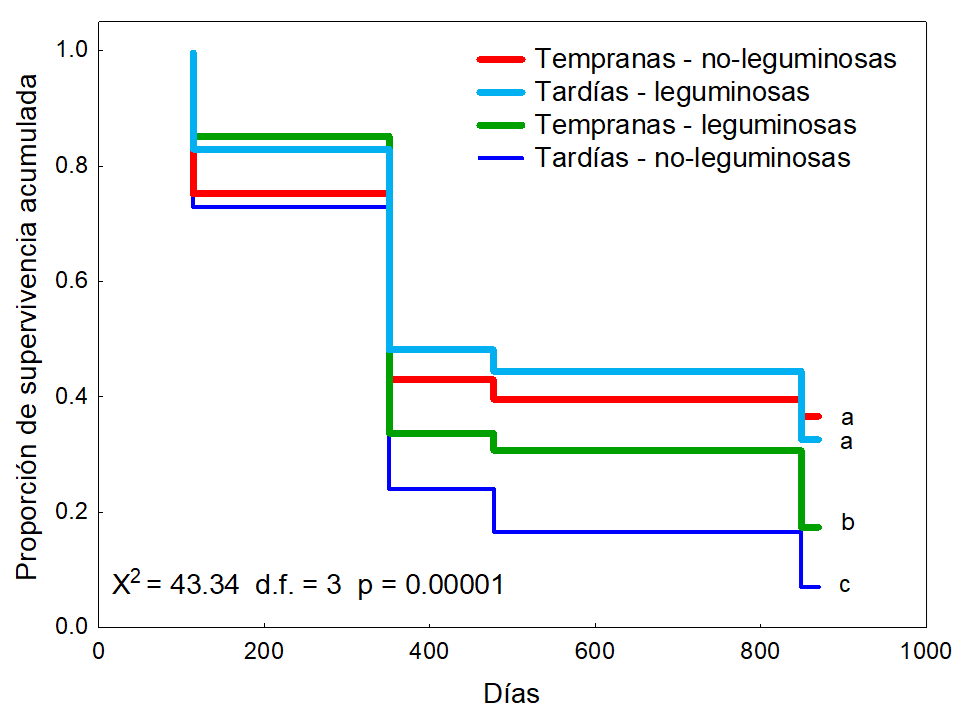
Las especies sucesionales tempranas mostraron significativamente mayor supervivencia (27.04 %) que las tardías (19.81 %) (Log-Rank = 2.39 P < 0.01, Figura 5). Además, las leguminosas mostraron significativamente mayor supervivencia (25 %) que las no-leguminosas (21.85 %) (Log-Rank = 2.88 P < 0.001, Figura 6). La interacción estado sucesional × grupo funcional fue significativa (χ2= 43.34 g.l. = 3 P < 0.00001), la comparación Log-Rank entre grupos reveló que el porcentaje de supervivencia de las especies tempranas no-leguminosas fue mayor (36.66 %), seguido del porcentaje de sobrevivencia de las tardías leguminosas (32.59 %); estos últimos dos grupos presentaron un porcentaje de supervivencia estadísticamente similar y mayor que el de las especies tempranas leguminosas (17.41 %) y que el de las tardías no-leguminosas (7.03 %) (Figura 7).

Figura 5 Curvas de Kaplan-Meier de seis especies arbóreas de sucesión temprana y seis tardías, establecidas en monocultivos en Quilamula, Morelos, México.

Figura 6 Curvas de Kaplan-Meier de seis especies arbóreas leguminosas y seis no-leguminosas, establecidas en plantaciones experimentales en Quilamula, Morelos, México.
Discusión
Debido a sus características de historia de vida (e.g., más alto crecimiento) y a la ventaja de fijar nitrógeno, esperábamos que las especies leguminosas sucesionales tempranas tuvieran una mayor supervivencia que las no-leguminosas de cualquier estado sucesional. En estas plantaciones, las especies tempranas no-leguminosas presentaron mayor supervivencia que las tempranas leguminosas probablemente debido a la herbivoría que sufrió este último grupo.
De acuerdo con lo esperado, las especies sucesionales tempranas tuvieron una mayor supervivencia que las tardías. Acorde con esto, en plantaciones de restauración en Morelos, México, tres especies sucesionales tempranas tuvieron mayor supervivencia que tres sucesionales tardías (después de 3 años; Carrasco-Carballido et al. 2019). De forma similar, en plantaciones en la selva estacional de Costa Rica, dos especies sucesionales tempranas mostraron mayor supervivencia que dos sucesionales tardías (después de 2 años; Gerhardt 1996). Las especies sucesionales tempranas presentan elevadas tasas de crecimiento bajo condiciones de alta disponibilidad de luz debido a sus hojas compuestas (Lohbeck et al. 2013) y una mayor área foliar específica (Poorter et al. 2004). Dado que en las áreas degradadas se han registrado altas temperaturas al nivel del suelo, la sobrevivencia de las plantas puede depender de que tan rápido crecen en altura; por ejemplo, si las hojas se alejan 3 cm del suelo, la transpiración causada por la temperatura disminuye considerablemente, aminorando el estrés térmico (Ehleringer & Sandquist 2006). En plantaciones de restauración en una selva estacional de Brasil, siete especies de crecimiento rápido presentaron mayor sobrevivencia (75.85 %) que seis especies de crecimiento lento (54.83 %; Sampaio et al. 2007). En este estudio, el rango de variación de la supervivencia para las sucesionales tempranas fue mucho mayor (0 a > 70 %) en comparación con el rango de variación de la supervivencia para las tardías (6 a 35 %; Tabla 1), lo que puede estar relacionado a los caracteres funcionales que confieren resistencia a la sequía (ver abajo). Aunque en promedio las especies sucesionales tempranas presentaron mayor sobrevivencia que las tardías debido probablemente a sus tasas de crecimiento, se observó una alta variabilidad en la supervivencia dentro de cada grupo.
De acuerdo con nuestra predicción, a nivel de grupo, las especies leguminosas tuvieron mayor supervivencia que las no-leguminosas. Nuestros resultados concuerdan con lo reportado en plantaciones en la selva estacional de Costa Rica, donde ocho especies leguminosas tuvieron mayor supervivencia que siete no-leguminosas (después de 5 años; Piotto et al. 2004). Algo similar ocurrió en la selva estacional de Morelos, México, donde tres especies de leguminosas tuvieron mayor supervivencia que dos especies de no-leguminosas (después de 3 años; Carrasco-Carballido et al. 2019). Por último, en plantaciones en la selva estacional en el Área de Conservación Guanacaste, Costa Rica, cuatro especies de leguminosas tuvieron los mayores niveles de supervivencia (después de 2 años; Werden et al. 2018). Además, en otros estudios con evaluaciones de supervivencia realizados a los seis meses de establecidas las plantaciones, las especies leguminosas presentaron mayor supervivencia que las no-leguminosas: en Chamela-Cuixmala, México (González-Tokman et al. 2018), y en el Chaco Árido, Argentina (Barchuk et al. 2006), lo que indica que esta ventaja en el desempeño de las leguminosas sobre las no-leguminosas, ocurre desde el inicio del establecimiento. En una revisión de cronosecuencias en 42 bosques neotropicales se encontró que el éxito ecológico de las leguminosas en sitios sucesionales tempranos, que se caracterizan por tener una baja disponibilidad de agua, se debe a caracteres funcionales como hojas compuestas con foliolos pequeños, y su habilidad para fijar nitrógeno, que les permiten tolerar la sequía y usar eficientemente el agua (Gei et al. 2018). También, en un estudio en la selva estacionalmente seca de Yucatán, se encontró que una parte importante de los árboles especialistas de selva secundaria son leguminosas que tienen pulvinos en las hojas (Sanaphre-Villanueva et al. 2016). Las especies leguminosas se han propuesto como especies clave para la restauración de ecosistemas áridos (ver Siddique et al. 2008, Padilla et al. 2009, Moreno et al. 2017) porque su capacidad de fijar nitrógeno es un elemento fundamental para su desempeño (Reich et al. 2009). Además, estas especies tienden a producir mayor biomasa aérea (Barchuk et al. 2006), lo que permite la incorporación de mayor hojarasca al suelo. Así, las especies leguminosas mejoran el suelo a su alrededor (Crespo et al. 2001, Castellanos-Barliza & León Peláez 2011) lo que genera una dependencia menor a los nutrientes existentes en suelos degradados (Carrasco-Carballido et al. 2019). Para acelerar la recuperación de la cobertura y los nutrientes en el suelo, se recomienda la plantación de muchos individuos de especies leguminosas, para compensar por su mortalidad.
Contrario a nuestra predicción, el grupo de las especies tempranas no-leguminosas tuvo una supervivencia tan alta como la del grupo de las leguminosas tardías. Este resultado se debe al alto y similar desempeño de las tres especies tardías no-leguminosas seleccionadas (Dalbergia, Eysenhardtia y Haematoxylum). Los caracteres funcionales que podrían explicar este alto desempeño son la plasticidad de las hojas (ver Martínez-Garza et al. 2011) y la presencia de hojas compuestas (ver abajo; Lohbeck et al. 2013). Acorde con nuestros resultados, en plantaciones de restauración en la Península de Nicoya, Costa Rica (Piotto et al. 2004), y en Los Tuxtlas Veracruz, México (Martínez-Garza et al. 2011), algunas especies leguminosas tardías presentaron los mayores niveles de supervivencia. En nuestro estudio, una especie temprana no-leguminosa (Dodonaea) presentó la mayor supervivencia (73 %) lo que contrasta con lo encontrado en otro estudio en México, donde esta especie presentó los menores porcentajes de supervivencia (Tabla 2). Dodonaea ha sido reconocida como una especie tolerante a la sequía (Vázquez-Yanes et al. 1999), lo que al parecer fue un factor importante en este estudio. Así, aunque a nivel de grupo se puede esperar una mayor supervivencia de las especies sucesionales tempranas y también de las leguminosas, hay una gran variación en la respuesta individual de las especies (Tabla 2).
Tabla 2 Supervivencia de 1 a 15 años reportada en este (28 meses) y otros estudios para las 12 especies sucesionales tardías de la selva estacionalmente seca.
| Especie | Supervivencia (%) | Fuentes | ||||||
|---|---|---|---|---|---|---|---|---|
| Este estudio |
< 12 meses |
12 meses |
16 meses |
24 meses |
7 años |
15 años |
||
| Leguminosas | ||||||||
| Dalbergia congestiflora | 27.78 | |||||||
| Eysenhardtia polystachya | 35.56 | 68-87 | 13-57 | 90 | Ayala-García 2008, Cervantes-Sánchez & Sotelo-Boyas 2002 | |||
| Haematoxylum brasiletto | 34.44 | 87 | Foroughbakhch et al. 2006 | |||||
| Gliricidia sepium | 2.22 | 68-80 | 64-96 | 90-100 | 95 | Ulloa-Nieto 2006, Cervantes-Gutiérrez et al. 2001, Vides-Borrell et al. 2011, Foroughbakhch et al. 2006 | ||
| Leucaena leucocephala | 45.56 | 46 | 80-93 | 46-77 | Ayala-García 2008, Núñez-Cruz & Bonfil 2013 | |||
|
Pithecellobium dulce |
4.44 |
|
52-76 |
|
|
99 |
98 |
Cervantes-Gutiérrez et al. 2001 , Ulloa-Nieto 2006, Foroughbakhch et al. 2006, Cervantes-Sánchez & Sotelo-Boyas 2002 |
| No-leguminosas | ||||||||
| Amphipterygium adstringens | 6.67 | 48 | Cervantes-Sánchez & Sotelo-Boyas 2002 | |||||
| Bursera linanoe | 7.78 | 23-30 | Castellanos-Castro & Bonfil 2010 | |||||
| Tabebuia rosea | 6.67 | 5.6 | Álvarez-Aquino & Williams-Linera 2012 | |||||
| Dodonaea viscosa | 73.33 | 8 | 32-52 | 55 | Ulloa-Nieto 2006, Núñez-Cruz & Bonfil 2013, Cervantes-Sánchez & Sotelo-Boyas 2002 | |||
| Jacaratia mexicana | 0 | 54 | Zulueta-Rodríguez et al. 2015 | |||||
| Swietenia humilis | 36.67 | 52-64 | Ulloa-Nieto 2006 | |||||
La supervivencia de las especies nativas de la selva estacional evaluadas en este estudio mostró una amplia variación que puede ser atribuida a las interacciones ecológicas. Por ejemplo, Jacaratia mexicana mostro 0 % de supervivencia en este estudio mientras que en otro presento más del 50 % de supervivencia (Tabla 2). La falta de asociaciones micorrícicas pudo haber disminuido la supervivencia de esta especie; por ejemplo, un estudio con Jacaratia mexicana en una selva estacional en Veracruz, mostró que las plántulas inoculadas con micorrizas presentaron un mejor desempeño (Zulueta-Rodríguez et al. 2015, Tabla 2), ya que esta interacción incrementa la habilidad de las plántulas para absorber agua y nutrientes, lo que resulta especialmente relevante en ecosistemas estacionalmente secos (Smith & Read 2008). También, el daño causado por herbívoros puede afectar el desempeño (Eichhorn et al. 2010); por ejemplo, en este estudio observamos severos daños por roedores de la familia Geomyidae y/o conejos del orden Lagomorpha en dos de las especies leguminosas sucesionales tempranas, Gliricidia y Pithecellobium. Otros estudios han registrado mayor herbivoría en las especies sucesionales tempranas que en las tardías en plantaciones de restauración (Mariano et al. 2018) y una mortalidad de hasta el 90 % debido a la presencia de herbívoros (Barrales-Alcalá 2013). Además, se sabe que las especies leguminosas, al tener más nitrógeno en sus hojas, pueden ser más afectadas por la herbivoría (Márquez-Torres 2016). Por otra parte, sembrar especies que alimentan a los herbívoros, asegura que después haya presencia de polinizadores para la reproducción exitosas de las especies plantadas, lo que involucra la recuperación de la función del ecosistema (Juan-Baeza et al. 2015). La falta de interacciones simbióticas, como las micorrizas y la presencia de antagónicas como la herbivoría, pudieron disminuir la supervivencia de los árboles en las plantaciones de restauración.
Los factores abióticos también generan una alta variación en el desempeño de las especies. El estrés hídrico, que se refiere al momento en que la demanda de agua de las plantas es superior a su disponibilidad, se incrementa con la temperatura (Seyed et al. 2012). Durante la época de secas, el estrés hídrico puede cambiar los patrones metabólicos y en casos severos, provocar la muerte de las plantas (Ceccon et al. 2003, 2004, Álvarez-Aquino & Williams-Linera 2012). En nuestro sitio de estudio, durante la primera temporada seca (noviembre-abril) se registró un aumento de 4.88 °C en la temperatura, en comparación con el registro histórico (Figura 8) mientras que, en la siguiente época de lluvias, la precipitación fue de 257 mm más que el promedio histórico; agosto y septiembre recibieron mayor precipitación mientras que en noviembre ya no hubo precipitación. En este primer ciclo de secas-lluvias que experimentaron las plántulas, se registró el 62 % de la mortalidad. Las especies, incluso dentro del mismo estado sucesional mostraron una sensibilidad diferencial; por ejemplo, la no-leguminosa sucesional temprana Dodonaea, no experimentó mortalidad en esta época, lo que confirma su resistencia a la sequía (Vázquez-Yanes et al. 1999), mientras que Gliricidia, también sucesional temprana y leguminosa, presentó una sobrevivencia de < 3 %. Para seleccionar especies exitosas para plantaciones de restauración también se podría seleccionar aquellas que tienen caracteres funcionales que otorgan resistencia a la sequía (i.e., foliolo pequeño, presencia de pulvinos, raíces largas); por ejemplo, un estudio en Bolivia con 13 especies mostró que, a nivel de grupo, las sucesionales tempranas fueron más vulnerables a la cavitación de sus tallos (Markesteijn et al. 2011a). Otro estudio, también en Bolivia, con 40 especies reveló que las sucesionales tempranas tuvieron una mayor conductividad hidráulica en sus tallos en comparación con las tardías, ya que sus altas tasas de crecimiento resultan en altas demandas de agua, lo que a su vez resulta en un mayor riesgo de cavitación en los tallos (Markesteijn et al. 2011b). Para 12 especies en México, no hubo diferencias en la resistencia a la sequía de las especies por estado sucesional, pero se identificó que los caracteres funcionales asociados a esta resistencia en las sucesionales tardías son la alta resistencia del xilema al embolismo y una gran capacidad de las especies para almacenar agua en sus tallos (Pineda-García et al. 2013). Además, para 55 especies de bosques Neotropicales, se reportó que las especies sucesionales tardías pueden desarrollar raíces más largas que las tempranas, lo que también confiere una mayor resistencia a la sequía (Paz 2003). La selección de especies mediante caracteres funcionales ya disponibles en la literatura o en bases de datos mundiales (i.e., Plant Trait Database, www.try-db.org) debe ser considerada, además de los criterios más fáciles de obtener, como el estado sucesional de las especies.
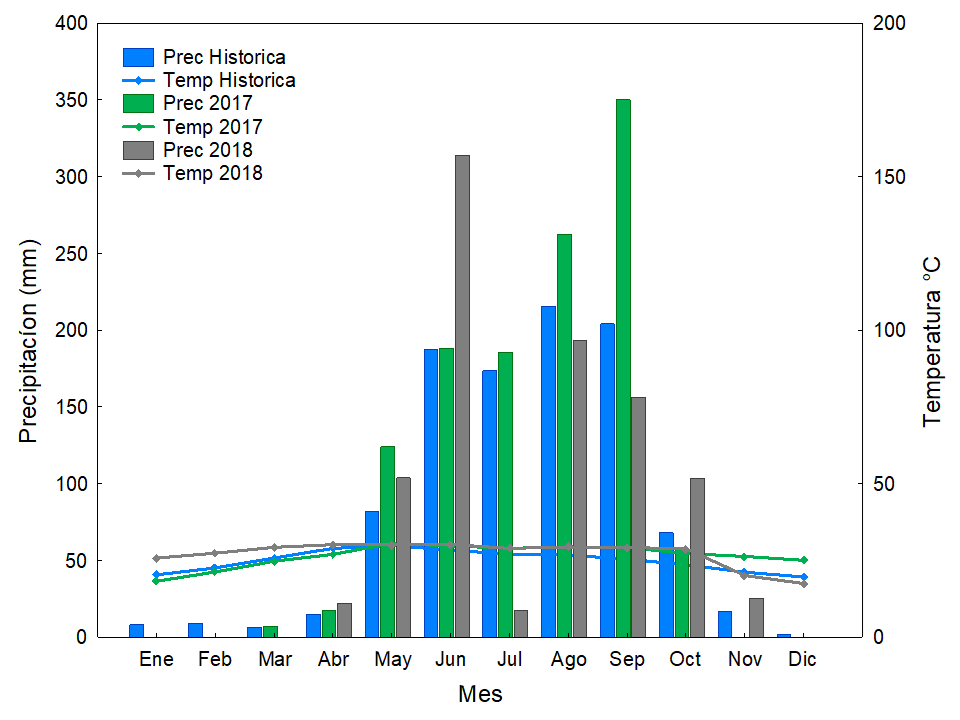
Figura 8 Climogramas del Ejido de Quilamula, Tlaquiltenango, Morelos, México. Histórico de 15 años: temperatura promedio 24.91 °C y precipitación 986.24 mm. 2017: temperatura promedio 26.44 °C y precipitación 1,192.5 mm. 2018: temperatura promedio 27.2 °C y precipitación 935.2 mm.
Para la selección de especies para proyectos de restauración es importante considerar que la precipitación y la temperatura serán más variables en el futuro debido al cambio climático global. Aunque en este estudio se evaluaron monocultivos para eliminar la variación por efecto de la competencia entre especies, para la restauración de los bosques siempre se propone establecer plantaciones mixtas y combinaciones de especies sucesionales tempranas y tardías (e.g., Rodrigues et al. 2009, Ratanapongsai 2020), ya que cada una responderá de forma diferencial a la variación ambiental. Por ejemplo, una mezcla podría incluir las especies sucesionales tempranas que presentaron la mayor supervivencia ante la sequía, como Dodonaea y Leucaena y tantas especies sucesionales tardías como sea posible (i.e., 20-30 especies, Ratanapongsai 2020), leguminosas y no-leguminosas que tengan hojas compuestas, foliolos pequeños y presencia de pulvinos para disminuir su vulnerabilidad a la cavitación y embolia. Las especies que se encuentran dentro de la lista roja de especies amenazadas de la IUCN en la categoría en peligro de extinción, como Dalbergia congestiflora deben ser especialmente consideradas para las plantaciones de restauración y plantar un mayor número de individuos para compensar su alta mortalidad; otra opción es incluirlas más adelante en la sucesión, cuando las condiciones ambientales sean más favorables. Para avanzar en la ecología de la restauración, es necesario poner a prueba varias mezclas de especies que simulen la heterogeneidad encontrada en las condiciones naturales (restauración experimental sistémica sensu Howe & Martínez-Garza 2014); las mezclas pueden incluir una variación en la riqueza de especies y su síndrome de dispersión para favorecer diferentes patrones de regeneración natural y velocidad de recuperación debajo de estas plantaciones.











 nueva página del texto (beta)
nueva página del texto (beta)