El reclutamiento de nuevos individuos en las poblaciones depende de numerosos aspectos reproductivos como la morfología floral y su fertilidad, y en especial los sistemas de cruza, los sistemas de apareamiento y la diversidad genética en una población (Charlesworth 2006). Estos atributos determinan el flujo de genes, tanto dentro como entre las generaciones, y son elementos clave para analizar la dinámica de las poblaciones en sus espacios naturales; además, exhiben los retos y alternativas para su propagación in situ y ex situ (Dudash & Murren 2008). Para comprender las consecuencias de estos elementos sobre el reclutamiento de nuevos individuos en las poblaciones, la biología floral explora los caracteres morfológicos y la separación espacial y temporal entre los verticilos sexuales que influyen en los sistemas de apareamiento (Mandujano et al. 2010, Opedal 2018). Asimismo, la biología reproductiva incluye el estudio de la dispersión y unión de los gametos masculinos y femeninos, la cual ocurre desde la autocruza hasta la entrecruza intra e interespecífica, así como de los mecanismos que podrían limitarlo, como los sistemas de autoincompatibilidad (Lipow & Wyatt 2000, Vogler & Kalisz 2001).
El género Echeveria DC. (Crassulaceae) es nativo del continente americano, constituido por alrededor de 170 especies descritas, de las cuales, cerca del 80 % crecen naturalmente en México (Reyes-Santiago et al. 2011). La mayoría existen como poblaciones pequeñas en hábitats áridos (Uhl 1992), donde juegan un papel importante en el funcionamiento de los ecosistemas al contribuir al proceso de sucesión primaria y pedogénesis, así como en el establecimiento de microambientes como plantas nodrizas (Reyes-Santiago et al. 2011). Este género es característico en México, debido al alto endemismo de especies, a su significado histórico-cultural y su importancia comercial como plantas de ornato (Uhl 1992, Reyes-Santiago et al. 2011). A la fecha, diez especies y variedades se han incluido en alguna categoría de riesgo de acuerdo con la NOM-059-SEMARNAT-2010 (SEMARNAT 2010); no obstante, debido a la limitada distribución natural, a la pérdida de hábitat por cambio en el uso de suelo y a la extracción ilegal, es posible que existan otras especies que ameriten su inclusión y para las cuales es necesario establecer estrategias de manejo que favorezcan su conservación (Pérez-Cálix 2008, Reyes-Santiago & Brachet 2009). Sin embargo, para la gran mayoría de las especies del género, aún se carece de estudios demográficos y reproductivos, por lo que se desconoce el estado actual en su hábitat y de sus poblaciones, atributos importantes para considerarlos dentro de alguna de las categorías de riesgo. La mayoría de las especies del género Echeveria que se han reportado se reproducen sexual y asexualmente, y como muchas otras crasuláceas, pueden reclutar nuevos individuos tanto por autopolinización como por polinización cruzada (Walther 1972, Uhl 1992, Carrillo-Reyes et al. 2009). Aunado a lo anterior, la hibridación interespecífica en Crassulaceae es frecuente y ocurre de manera natural (Uhl 1992), por lo que puede emplearse como una estrategia para la generación de nuevas variedades de interés a fin de abastecer el creciente mercado y su aprovechamiento en paredes y azoteas verdes (Reyes-Santiago et al. 2011, Rodríguez-Rojas et al. 2015). A pesar de esta aparente versatilidad, hay pocas investigaciones que aborden de manera sistemática los factores que pueden incidir sobre el éxito reproductivo en las especies de este género. Estudios de polinización en E. gibbiflora indican que la dispersión del polen y semillas es baja (Parra-Tabla et al. 1993), y que la fecundación depende de la carga de polen y por tanto de la actividad y eficiencia de los polinizadores (Parra-Tabla et al. 1998). Asimismo, la producción y germinación de semillas en E. elegans, E. perle, E. runyonii, E. pumila y E. agavoides es más eficiente cuando se obtienen a partir de cruzas intra e interespecíficas, que por autocruza (Rodríguez-Rojas et al. 2015).
Echeveria strictiflora A. Gray es una especie que se distribuye en regiones áridas del norte de México y el sur de Estados Unidos; los individuos son perennes, con hojas espatuladas dispuestas en rosetas, de las que emergen escapos donde se desarrollan los cincinos (Naturalista 2020a). Por su parte, E. subalpina Rose & Purpus es endémica de México y tiene una distribución restringida a los límites de los estados de Tlaxcala, Puebla y Veracruz; sus individuos son perennes, con hojas lanceoladas dispuestas en rosetas y las inflorescencias también son cincinos (Naturalista 2020b). Estas especies son bien cotizadas en el mercado y forman parte de las colecciones vivas del Jardín Botánico del Instituto de Biología de la Universidad Nacional Autónoma de México; por lo que son la base de diversos estudios encaminados a conocer su biología y establecer estrategias de propagación.
En general, la descripción de las flores para estas especies se limita a caracteres morfológicos esenciales para su clasificación taxonómica (Naturalista 2020a, b), pero no se han descritos atributos funcionales que inciden en la reproducción ni en el reclutamiento de nuevos individuos. La finalidad del presente estudio se centra en caracterizar la morfología floral, la fertilidad de los gametos, los sistemas de apareamiento y los sistemas de cruza en E. strictiflora y E. subalpina bajo condiciones de invernadero, los cuales son indispensables para conocer la eficiencia de la producción y germinación de semillas, que aporten al desarrollo de planes de propagación ex situ, así como programas de manejo para la conservación in situ.
Materiales y métodos
Material biológico. Se utilizaron diez individuos de E. strictiflora y diez de E. subalpina para todos los experimentos, que fueron donados por el Jardín Botánico del Instituto de Biología de la Universidad Nacional Autónoma de México. Para facilitar el seguimiento y descripción de los botones florales, el desarrollo preantesis se dividió en cinco etapas (1 - 5) de acuerdo con el tamaño del botón floral: en E. strictiflora 4 mm (1), 6 mm (2), 8 mm (3), 10 mm (4) y 14 mm (5), y para E. subalpina 2 mm (1), 2.5 mm (2), 3.5 mm (3), 5 mm (4) y 8.5 mm (5). Las etapas 6 a 9 en ambas especies se basaron en el nivel de apertura de la corola (preantesis tardía con corola cerrada, antesis temprana con corola semiabierta, antesis y post-antesis con corola abierta y semicerrada respectivamente), así como por la presencia de polen libre y la receptividad del estigma (Tabla 1).
Tabla 1 Clasificaciones de botones florales según tamaño y apertura de corola. Longitud promedio de las flores en cada una de las etapas del desarrollo floral, y nivel de apertura dentro de las etapas de antesis. bt: botón preantesis; sa: flor semiabierta; a: flor abierta; sc: flor semicerrada.
| Longitud de botón (mm) | Apertura de corola | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 (bt) | 7 (sa) | 8 (a) | 9 (sc) | |
| Echeveria strictiflora | 4 ± 0.2 | 6 ± 0.1 | 8 ± 0.2 | 10 ± 0.4 | 14 ± 1 | 21 ± 1 | 28 ± 2 | 33 ± 3 | 31 ± 2 |
| Echeveria subalpina | 2 ± 0.1 | 2.5 ± 0.1 | 3.5 ± 0.1 | 5 ± 0.2 | 8.5 ± 0.1 | 10 ± 0.5 | 13 ± 0.3 | 17 ± 0.2 | 16 ± 0.2 |
Observación macroscópica de las flores. Se caracterizó el número de elementos que conforman los verticilos florales, así como el tipo de placentación de los óvulos. Asimismo, se midió la longitud de los pistilos y los estambres con un Vernier para calcular la distancia que separa al estigma de las anteras y así determinar si existe hercogamia, según el criterio de Cruden (1977).
Morfología del polen. Se observaron los granos de polen de los estambres de diez plantas de E. strictiflora y diez de E. subalpina en un microscopio electrónico de barrido Jeol JSM-5310 (Jeol, Tokio, Japón). Se midieron las dimensiones de diez granos de polen con el programa Orion-Jeol (Jeol, Tokio, Japón).
Viabilidad del polen. Se disectaron la totalidad de anteras indehiscentes de diez flores preantesis de cada especie y se estimó el porcentaje de viabilidad de los granos de polen mediante la tinción de Alexander (Alexander 1969), a partir del número total de granos de polen con citoplasma teñidos de violeta (considerados como viables) presentes en diez campos aleatorios a 10X de aumento en microscopio óptico Zeiss Axiovert 200 MC80DX (Zeiss, Göttingen, Alemania).
Cuantificación del polen. Se colectaron las diez anteras indehiscentes de diez flores preantesis de cada especie. Las anteras de cada flor se maceraron suavemente en 500 μL de agua bidestilada para liberar los granos de polen y se agregó detergente en polvo comercial para romper la tensión superficial de la capa lipídica del polen (Márquez-Guzmán et al. 2016). Se contabilizó el número de granos de polen presentes en 100 μL en cámara de Neubauer. El conteo se realizó en tres muestras y el valor promedio se multiplicó por diez, equivalente al número de anteras, para estimar el número total de granos de polen por flor.
Micromorfología de gineceo y polen. Para la observación de estructuras en el microscopio electrónico de barrido se fijaron en FAA (formaldehído, etanol 96 %, ácido acético glacial y agua destilada, 10:50:3:5) el gineceo y las anteras de cinco flores en antesis. Las muestras se deshidrataron en una serie de etanol con concentraciones del 30 al 100 %, se colocaron en portamuestras metálicos para muestras con una cinta conductora de carbono; se secaron en una secadora de punto crítico CPD-030 Bal-Tec y se cubrieron con oro con una ionizadora Denton Vacuum Desk-II para que pudieran ser observadas y fotografiadas con un microscopio electrónico de barrido JSM-5310LV (Jeol, Tokio, Japón) a 15 kV.
Número de óvulos. Se utilizaron los pistilos de diez flores repartidas en diez individuos de cada una de las especies. Debido a que el gineceo de las crasuláceas es apocárpico, se separó cada carpelo (pistilo) y se contabilizó el número total de óvulos con ayuda de un microscopio estereoscópico Zeiss Stemi DV4 (Zeiss, Göttingen, Alemania). El valor obtenido se multiplicó por cinco (número de carpelos en el gineceo de cada flor) para estimar el número de óvulos promedio por cada flor.
Receptividad del estigma. Se utilizó la técnica de peróxido de hidrógeno (Rodríguez-Rojas et al. 2015), para lo cual se agregaron 5 µL de H2O2 al 8 % a los estigmas frescos de diez flores, repartidas en diez individuos de cada especie en las etapas de desarrollo de la 6 a la 9. La receptividad del estigma se evaluó semicuantitativamente del 0 al 3 de acuerdo con el burbujeo (donde cero indica la ausencia de receptividad y 3 es la mayor intensidad de burbujeo, indicando receptividad).
Crecimiento de los tubos polínicos. Se polinizaron dos flores al inicio de la antesis para cada uno de los tratamientos de autocruza y entrecruza. A las 36 h post-polinización se colectaron los pistilos y se fijaron en una solución de etanol 100 %: ácido acético glacial (3:1). Posteriormente, se incubaron en metabisulfito de sodio 0.5 N a 80 ºC por 60 min. Al finalizar, los pistilos se sumergieron en azul de anilina y se almacenaron en oscuridad a 4 ºC durante toda la noche. Para la observación, se separaron los carpelos y se realizó un “squash”. La observación de los tubos polínicos se realizó con un microscopio de fluorescencia Olympus-Provis modelo AX70 equipado con una cámara digital para tomar las fotomicrografías, con un sistema Evolution MP.
Evaluación del sistema de cruza. De cada especie se utilizaron un total de 20 flores distribuidas en diez plantas para cada uno de los siguientes tratamientos: apomixis, autocruza autónoma, autocruza asistida, entrecruza intraespecífica y cruza interespecífica (este último para evaluar si existe hibridación entre especies). A excepción de la autocruza autónoma, todas las flores se emascularon, retirando las anteras en la etapa 7 del desarrollo. Para limitar la posible interferencia de polinizadores, todas las flores se cubrieron con bolsas de tul de 4 × 3 cm desde la pre-antesis hasta el desarrollo total de los frutos, removiendo la bolsa únicamente durante la aplicación de los tratamientos de polinización. El polen se colectó de diversos individuos, dependiendo de la cruza, y se aplicó sobre el estigma con un pincel. Se consideraron frutos maduros cuando inició la apertura de los lóculos de las cápsulas.
Capacidad germinativa de las semillas in vitro. Para asegurar la disponibilidad suficiente de semillas, se sembraron 100 semillas obtenidas de cinco frutos, por triplicado, para un total de 300 semillas por tratamiento, en cajas petri con medio MS al 50 % (Murashige & Skoog 1962). La incubación se realizó a 25 ºC con un fotoperíodo 16 h luz. Cada dos días se registró el número de semillas germinadas por un período de 45 días. Se evaluó el porcentaje de germinación final (número de semillas germinadas/total de semillas sembradas × 100), así como la velocidad de germinación mediante la siguiente fórmula t50 (Saatkamp et al. 2011):
Donde ti se refiere al primer día de conteo; tj es el último día de conteo; N, es el total de semillas germinadas; ni es el número de semillas germinadas en el primer conteo y nj se refiere al número de semillas germinadas en el último conteo. Por último, se evaluó el coeficiente de velocidad de germinación (CVG), un valor que aumenta cuando el número de semillas germinadas es mayor, mientras que el tiempo de germinación es menor (González-Zertuche & Orozco-Segovia 1996, Al-Mudaris 1998):
Donde n indica el número de semillas germinadas en determinado día, mientras t indica los días transcurridos desde el inicio del experimento.
Potencial de reclutamiento. Para comparar la eficiencia en la producción y germinabilidad de semillas formadas en los diferentes sistemas de cruza, e inferir con ello su impacto potencial en el reclutamiento, se utilizó una modificación de la fórmula de eficiencia en la producción de semillas de Bramlett et al. (1977) y Flores-López et al. (2005). Para ello, se calculó la eficiencia de germinación (número de semillas maduras por fruto / el número promedio de óvulos por ovario) y se utilizó el porcentaje de semillas germinadas por tratamiento, en la siguiente fórmula:
Donde SM indica el número promedio de semillas maduras por tratamiento, O representa el número promedio de óvulos por ovario y PG el número promedio de semillas germinadas totales.
Índices del sistema reproductivo. Se utilizó el índice de entrecruza (OCI) (Cruden 1977), para determinar el sistema de apareamiento presente en ambas especies. Dicho índice se obtuvo a partir de la apertura de la corola, la maduración y la separación espacial entre las anteras y el estigma. Posteriormente se asignó el sistema de apareamiento a partir de los valores obtenidos con las características florales, donde cleistogamia corresponde a un valor acumulado de 0, autogamia obligada corresponde a 1, autogamia facultativa corresponde a 2, xenogamia facultativa corresponde a 3 y xenogamia corresponde a 4. Asimismo, se utilizó la tasa de entrecruza (Mandujano et al. 2010):
Donde W e es el número de semillas obtenidas por entrecruza y W a , el número de semillas por autocruza.
Con los resultados de la autopolinización y entrecruzamiento manual se calculó la depresión por endogamia (modificada de Lande & Schemske 1985, Mandujano et al. 2010), donde se usó una ecuación acumulativa que considera número de semillas maduras y número de semillas germinadas:
Donde a es la fase de semillas maduras y b la fase de semillas germinadas. En ambas fases se considera que s (selfing) es la producción por autocruza y o (outcrossing) es la producción por entrecruza.
Análisis estadístico. Se realizó la prueba de normalidad de Kolmogorov Smirnov en las comparaciones de la longitud de estambres y pistilos, números de granos de polen, viabilidad de polen, número de óvulos, número de semillas maduras, tamaño de semillas y porcentaje y velocidad de germinación de las semillas. En caso de haber normalidad, se empleó la prueba de t student para comparar dos muestras y MANOVA para más de dos muestras, dada la cantidad de variables a comparar. Cuando los datos no mostraron normalidad, se utilizaron los estadísticos de Mann-Whitney para comparar dos muestras y la prueba de Kruskall-Wallis para comparar más de dos muestras. Tanto las pruebas de normalidad como los estadísticos de prueba se realizaron con un 95 % de confianza en el programa Statistica v11.0
Resultados
Características florales y diferencias espacio-temporales: hercogamia y dicogamia. Las flores de E. strictiflora tienen corola tubular, formada por cinco pétalos rojizos-anaranjados con bordes amarillo brillante y cinco sépalos largos y suculentos de color verde rojizo. El tamaño de la flor en antesis es de 3 3 ± 3 mm de longitud, mientras que el diámetro del cáliz alcanza 42 ± 0.3 mm. Las flores de E. subalpina tienen pétalos con coloración anaranjada opaca y bordes amarillo pálido, además de que los sépalos son más pequeños y menos suculentos. El tamaño de la flor es menor que en E. strictiflora, con 17.1 ± 2 mm. de longitud y el cáliz tiene un diámetro de 17 ± 0.2 mm. (U = 13, P = 0.00094, gl. 19).
La separación del nivel de las anteras con respecto al estigma mostró que tanto E. strictiflora como E. subalpina son hercógamas. Sin embargo, el tipo de hercogamia difiere entre las especies. En E. strictiflora se observó hercogamia revertida, ya que la altura de las anteras (0.84 ± 0.2 mm) se encuentra por encima del nivel del estigma (0.8 ± 0.1 mm), mientras que en E. subalpina las anteras (0.52 ± 01 mm) se posicionan por debajo del nivel del estigma (0.55 ± 0.1 mm) (Figura 1).
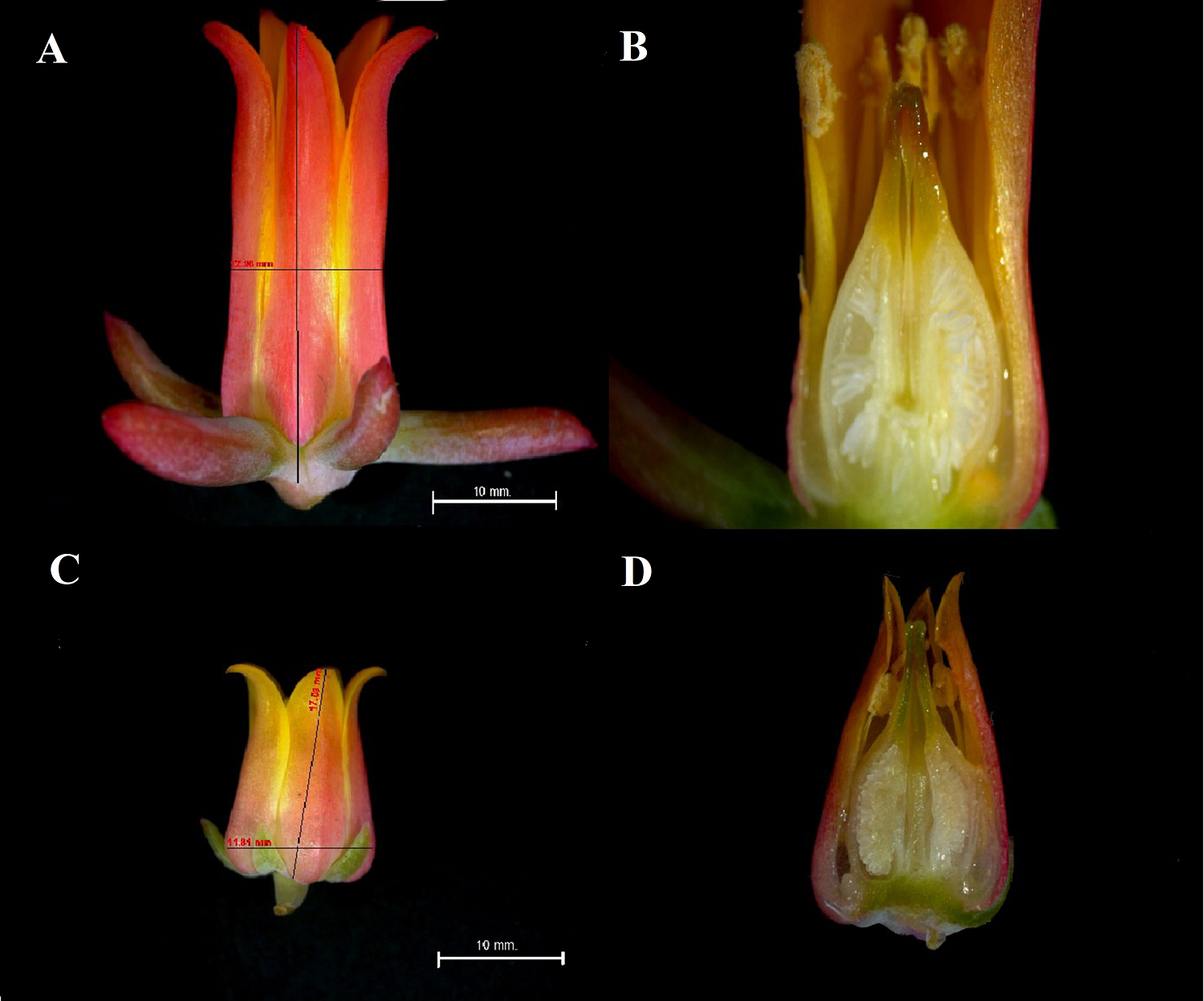
Figura 1 Vista general de las flores de Echeveria strictiflora y Echeveria subalpina. A-B. Vista panorámica y corte longitudinal de las flores de E. strictiflora. C-D. Vista panorámica y corte longitudinal de flores de E. subalpina.
Funcionalidad del androceo. Se encontró que tanto E. strictiflora como E. subalpina producen abundantes granos de polen viables. El número promedio de granos de polen fue mayor en E. strictiflora en comparación con E. subalpina, con aproximadamente 7,500 y 6,500 granos de polen, respectivamente (t = 25.32, P = 0.0001, gl. 19). A pesar de la diferencia en el número, la viabilidad fue cercana al 75 % para ambas especies (t = 1.346; P = 0.194, gl. 19). Los granos de polen son prolados-esferoidales, tricolporados, con un diámetro ecuatorial de aproximadamente 35 μm. No obstante, en E. strictiflora los granos de polen tienen una exina rugulada (Figura 2A, B), que contrasta con la exina psilada y el poro más grande con membrana laxa en los granos de polen de E. subalpina (Figura 2C, D).

Figura 2 Micrografías de granos de polen. A-B. Granos de polen de Echeveria strictiflora en vista ecuatorial y vista polar, respectivamente. C-D. Granos de Echeveria subalpina en vista ecuatorial y vista polar. cp, colpo; pr, poro.
Morfología del gineceo y producción de óvulos. En E. strictiflora y E. subalpina el estigma está compuesto por papilas estigmáticas pluricelulares que rodean al canal estilar ubicado en el centro de cada carpelo (Figura 3A, E). El gineceo es apocárpico y está formado por cinco carpelos unidos únicamente a nivel de la base del ovario; al interior de cada carpelo la placentación es parietal (marginal) y los óvulos son anátropos (Figura 3B, F). La pared del ovario tiene una cutícula más gruesa en E. strictiflora que en E. subalpina, mientras que la epidermis externa es uniestratificada y con taninos en ambas especies, con células más grandes en E. subalpina con respecto a E. strictiflora (Figura 3C, G). Las flores de ambas especies produjeron alrededor de 700 óvulos (t = 1.57, P = 0.13, gl. 19).
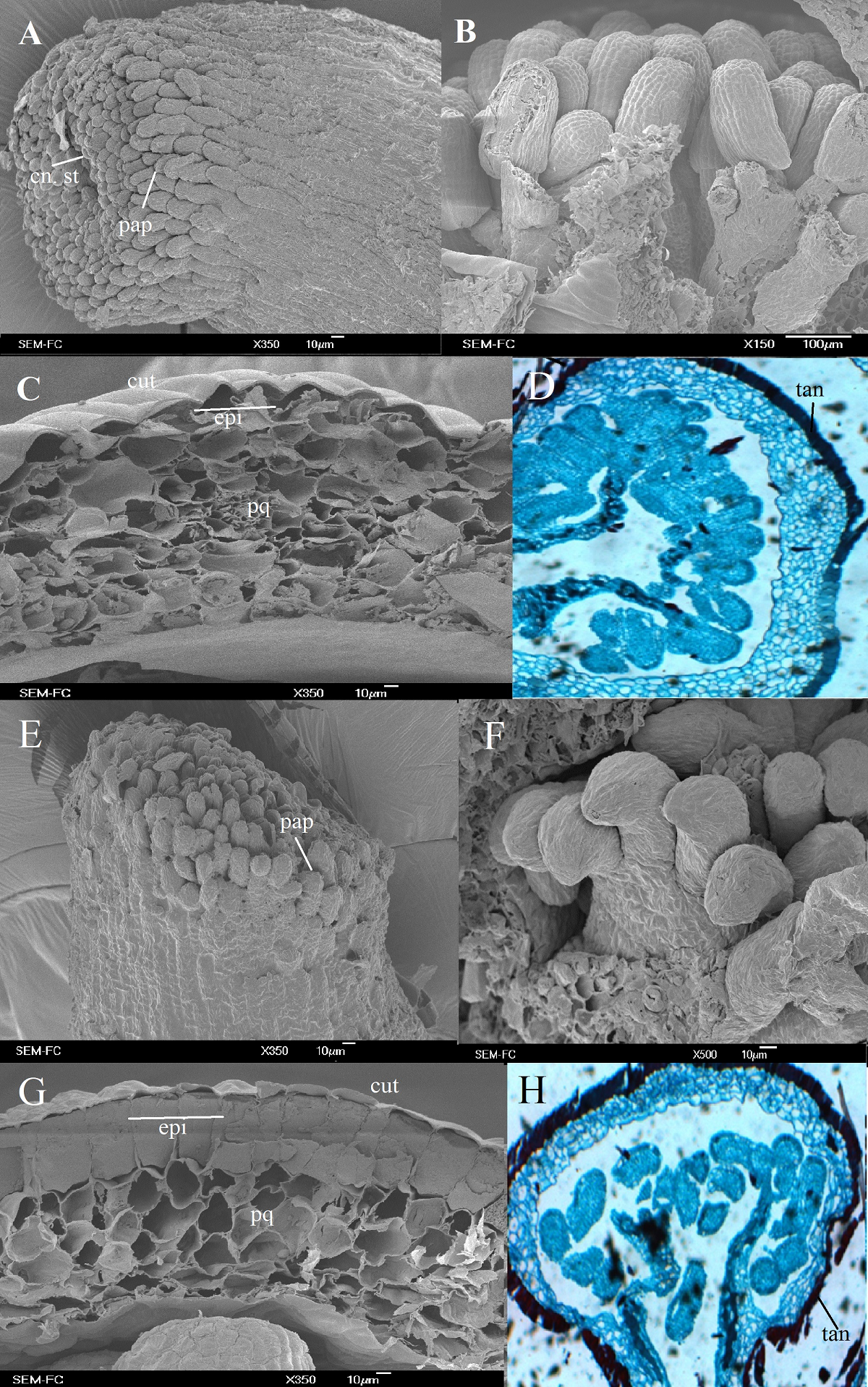
Figura 3 Micrografías de pistilo por MEB y microscopía óptica. A-D. Echeveria strictiflora. A. Papilas estigmáticas y canal estilar. B. Óvulos anátropos. C. Pared del ovario en fotomicrografías capturadas por MEB. D. Cortes transversales de cámaras ováricas vistos en microscopio óptico a un aumento de 10X. E-H. Echeveria subalpina. E. Papilas estigmáticas y canal estilar. F. Óvulos anátropos. G. Pared del ovario en fotomicrografías capturadas por MEB. H. Cortes transversales de cámaras ováricas vistos en microscopio óptico a un aumento de 10X. cn, canal estilar; cut, cutícula; epi, epidermis; pap, papilas estigmáticas; pq, parénquima.
Receptividad del estigma. El ensayo con H2O2 mostró que en E. strictiflora y en E. subalpina el estigma es receptivo previo a la apertura de la corola (etapa 6), pero alcanza su máxima receptividad en antesis (etapa 8); respecto a esto, existe un desfase en la liberación del polen, ya que en E. subalpina inicia cuando la corola está semiabierta (etapa 7), mientras que en E. strictiflora la dehiscencia de las anteras ocurre durante la antesis franca (etapa 8). Si bien en ambas especies se presenta una protoginia incompleta, la madurez sexual de ambos verticilos sexuales coincide en el tiempo, por lo que potencialmente pudieran autopolinizarse.
Crecimiento de tubos polínicos in situ. Se comparó el crecimiento de los tubos polínicos a lo largo del pistilo a fin de explorar la funcionalidad de los granos de polen y su capacidad para alcanzar el ovario. Tanto en los tratamientos de autocruza (Figura 4A-C, G-I) como de entrecruza (Figura 4D-F, J-L) los granos de polen germinan en el estigma (Figura 4A, D, G, J) y los tubos polínicos crecen por el estilo (Figura 4B, E, H, K) hasta llegar al ovario, donde alcanzan a los óvulos (Figura 4C, F, I, L). Esto indica que ni E. strictiflora ni E. subalpina exhiben un sistema de autoincompatibilidad precigótico funcional, ya sea esporofítico o gametofítico.

Figura 4 Crecimiento de tubos polínicos a lo largo del pistilo. A-C) Autocruza de Echeveria strictiflora. D-F) Entrecruza de Echeveria strictiflora. G-I) Autocruza de Echeveria subalpina. J L) Entrecruza de Echeveria subalpina. óv, óvulos; stg, estigma; stl, estilo.
Índice de entrecruza. Con los datos obtenidos de la apertura de la corola, dicogamia y hercogamia, se calculó el índice de entrecruza (OCI) de cada especie (Cruden 1977). Tanto en E. strictiflora como en E. subalpina, el OCI tuvo un valor de 3, lo que indica que son especies xenógamas facultativas, es decir, exhiben un sistema de cruza mixto, con mayor eficiencia en la entrecruza.
Sistemas de cruza. Los tratamientos de cruza en E. strictiflora y E. subalpina evidenciaron que no hay desarrollo de frutos ni semillas por medio de apomixis ni autocruza autónoma; en contraste, todos los tratamientos de polinización asistida produjeron frutos con semillas. A fin de evidenciar el número total de semillas que se forman por cada cruza, se contabilizaron las semillas maduras (con cubierta seminal oscura, con embrión y endospermo) y vanas (colapsadas, con cubierta seminal transparente, carentes de embrión y endospermo). En ambas especies se observó que la producción de semillas totales y maduras fue significativamente mayor (F = 31.22, P = 0.0001, gl. 359) en los tratamientos de cruza intraespecífica con respecto a la autocruza, una tendencia que fue similar en ambas especies, sin que hubiera mayor eficiencia de una especie sobre la otra. También se obtuvieron frutos y semillas maduras a través de las cruzas interespecíficas, los cuales fueron similares, independientemente de ser especie donadora o receptora del polen; aunado a lo anterior, el número de semillas maduras formadas fue similar a la entrecruza intraespecífica y mayor que la autocruza en cualquiera de las especies. Esto indica que no hay barreras para producir híbridos entre E. strictiflora y E. subalpina (Tabla 2).
Tabla 2 Producción de semillas totales (ST), semillas maduras (SM) y potencial de reclutamiento (PR) en cada uno de los sistemas de cruza en Echeveria strictiflora y Echeveria subalpina. Se representan valores promedio y desviación estándar. Letras mayúsculas indican diferencias significativas en una especie (MANOVA F = 31.22, P = 0.0001, gl. 359).
| Tipo de cruza | Echeveria strictiflora | Echeveria subalpina | ||||
|---|---|---|---|---|---|---|
| ST | SM | PR (%) | ST | SM | PR (%) | |
| Apomixis | 0 | 0 | 0 | 0 | 0 | 0 |
| Autocruza autónoma | 0 | 0 | 0 | 0 | 0 | 0 |
| Autocruza asistida | 506.6 ± 48.09A | 158 ± 24C | 10.72 ± 0.58E | 523 ± 58A | 173 ± 27.4C | 12.66 ±0.57E |
| Entrecruza intraespecífica | 620.4 ±28.5B | 374 ± 14.8D | 35.31 ± 0.701F | 639 ± 24.16B | 371 ± 11D | 35.56±0.57F |
| Entrecruza interespecífica | 615 ±26.45B | 360.2 ± 19.72D | 32.01 ± 1.61F | 630 ± 18.7B | 346 ± 19.3D | 33.16 ± 1.13F |
Germinación de las semillas. Las semillas de E. strictiflora comenzaron a germinar en el día cuatro, mientras que en E. subalpina a partir del día siete; no obstante, la velocidad fue similar, ya que ambas especies alcanzaron el 50 % de su germinación (t50) entre los días 23 y 25 respectivamente. Sin embargo, si esto se analiza a mayor detalle, el CVG muestra que en E. strictiflora los valores para autocruza y entrecruza son de 5.22 y 4.88, respectivamente; mientras que en E. subalpina son de 5.39 y 4.9, lo que muestra que la germinación en E. subalpina es ligeramente más veloz, particularmente en la autocruza (F = 286.44, P = 0.413-14; P < 0.05). Por otra parte, el porcentaje de germinación final en los tratamientos de entrecruza intra e interespecífica fue mayor que en los de autocruza, independientemente de la especie de la cual se tratara (F = 20.34; P = 0.001, gl. 17) (Figura 5).
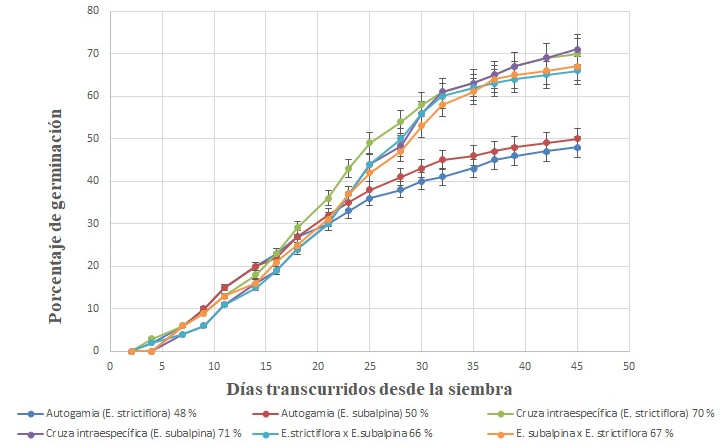
Figura 5 Porcentaje de germinación in vitro entre los diferentes tratamientos de cruza en Echeveria strictiflora y Echeveria subalpina (F = 20.34, P = 0.001).
Tasa de entrecruza y depresión endogámica. El índice de la tasa de entrecruza en E. strictiflora y E. subalpina fue de 0.705 y 0.668, respectivamente, lo que indicó que ambas especies se reproducen a través de un sistema mixto con tendencia a la entrecruza, lo cual concuerda con el índice de entrecruza (OCI) calculado a partir de las características morfológicas de las flores. Aunado a lo anterior, los valores del índice de depresión endogámica estimados en E. strictiflora son de 0.71 ± 0.09 con autocruza y de 0.08 ± 0.06 con entrecruza interespecífica, mientras que en E. subalpina son de 0.68 ± 0.06 y de 0.06 ± 0.08, lo que indica que cuando se compara la producción y germinación de semillas de las autocruzas con entrecruzas, existe un fuerte efecto por depresión endogámica, ya que su valor supera 0.5. No se observaron diferencias significativas entre las especies para los índices del mismo sistema de cruza (F = 105.2, P = 9.5x10-11, gl. 39).
Discusión
En este trabajo presentamos información acerca de las características morfológicas asociadas a la reproducción de E. strictiflora y E. subalpina que inciden sobre la polinización y producción de semillas bajo condiciones ex situ. Además, proporcionamos evidencia de los sistemas de cruza y apareamiento y su impacto en la formación de semillas viables. Finalmente discutimos cómo estos atributos pueden incidir sobre el reclutamiento de nuevos individuos y por tanto, en su conservación, manejo y aprovechamiento.
Características del androceo. Tanto E. strictiflora como E. subalpina producen abundantes granos de polen y con alto porcentaje de viabilidad. Los granos de polen son tricolporados y prolados-esferoidales, lo que es congruente con las descripciones en otras especies del género, como E. calderoniae, E. fimbriata, E. patriotica, E. pistioides y E. marianae (García-Ruiz & Costea 2014, García-Ruiz et al. 2016, González-Mancera et al. 2018). Debido a que el tipo de apertura tricolporado y la forma del grano de polen se asocia también con los géneros Villadia y Sedum (Arreguín-Sánchez et al. 1990, González-Mancera et al. 2018), pueden ser consideradas como sinapomorfías en estos tres grupos clasificados dentro del clado Acre (Carrillo-Reyes et al. 2009). La ornamentación psilada en E. subalpina y rugulada en E. strictiflora es un carácter distinguible entre las especies estudiadas; el tipo psilado difiere de otras especies del género descritas hasta la fecha, en tanto que el tipo rugulado es más común y coincide con las descripciones de especies como E. calderoniae, E. gracilis y E. gigantea (González-Mancera et al. 2018); no obstante, esta ornamentación presenta diferencias, como el patrón y el tamaño de las redes que están englobados dentro del tipo rugulado. La ornamentación de la exina es un carácter taxonómicamente útil dentro del género Echeveria, ya que se distingue entre las especies (Arreguín-Sánchez et al. 1990). A su vez puede explicar las características del hábitat en que se desarrollan y sus síndromes de polinización, donde la superficie más lisa de la exina se asocia a la transferencia por medios abióticos, mientras que las ornamentadas a vectores bióticos (Qaiser et al. 2015).
Ovario y óvulos. En E. strictiflora la pared de las cámaras ováricas está compuesta por más capas de parénquima y una cutícula más gruesa que en E. subalpina, aunque en esta última, el ovario está deimitado por una epidermis externa de una capa de células de mayor tamaño que E. strictiflora. Estas características pueden estar asociadas al tipo de ambiente en el cual se desarrollan estas especies; E. strictiflora crece naturalmente en un clima semiárido cálido (Bsh)- (INEGI 2017a), en el cual el desarrollo de cutículas más gruesas puede favorecer la retención de agua (Cushman 2001), a diferencia de E. subalpina que crece en un clima templado con lluvias en verano (Cw)-(INEGI 2017b), en los límites de Puebla, Tlaxcala y Veracruz. En la pared del ovario se observó también la acumulación de taninos, cuyo depósito en las células que constituyen la pared de los verticilos florales y el cuerpo primario se relacionan con la protección ante la herbivoría, lo cual se ha reportado como una generalidad dentro de la familia Crassulaceae (Johri et al. 1992, Evert 2006). En las cámaras ováricas se desarrolla una gran cantidad de óvulos, lo cual coincide con observaciones previas en el género (Rodríguez-Rojas et al. 2015); además tienen una placentación parietal y un óvulo curvado 180 grados y funiculado, lo que concuerda con sinapomorfías en la familia Crassulaceae (Sponberg 1978, Johri et al. 1992).
Sistemas de apareamiento. Ambas especies son hercógamas, lo cual sugiere una barrera espacial para reducir la autopolinización cruzada separando las anteras de los estigmas. No obstante, en E. strictiflora se observó hercogamia revertida, donde el nivel de las anteras se encuentra por encima del estigma (Jia & Tan 2012, Opedal 2018), lo cual podría favorecer la autopolinización por acción de la gravedad o por el acercamiento de los verticilos durante la antesis tardía, aun si la liberación de polen y la receptividad del estigma decaen en esta etapa.
Aunado a lo anterior, la evidencia de dicogamia incompleta en ambas especies, así como la ausencia de un sistema de autoincompatibilidad funcional, muestra que existe la posibilidad de autopolinización, ya que ambos verticilos sexuales expresan su máxima funcionalidad al mismo tiempo (Dai & Galloway 2011). Sin embargo, no se obtuvo el amarre de frutos ni la producción de semillas mediante autopolinización autónoma en E. subalpina ni en E. strictiflora, lo que sugiere una carga insuficiente de polen en los estigmas, algo que se reportó previamente en E. gibbiflora, donde la disponibilidad de polen pudo limitar la adecuación del gineceo, lo que corresponde a un efecto por el principio de Bateman (Burd 1994, Parra-Tabla et al. 1998). Esto no es impedimento para que un fruto contenga semillas de origen tanto autógamo como xenógamo (Moore & Panell 2011), no obstante, evidencia la importancia de vectores para transportar el polen de forma abundante a fin de lograr el desarrollo exitoso de frutos y semillas (Burd 1994).
Sistemas de cruza, depresión endogámica e hibridación. El índice de entrecruza calculado con caracteres morfológicos, así como la mayor producción de semillas obtenidas por polinización cruzada mostró que tanto E. strictiflora como E. subalpina son xenógamas facultativas (Cruden 1977). La autopolinización es un fenómeno frecuente en Echeveria (Walther 1972, Parra-Tabla et al. 1998); sin embargo, tanto en E. strictiflora como en E. subalpina se evidencia una menor eficiencia en la producción de semillas por autocruza, un fenómeno que se ha observado en otras suculentas como Opuntia rastrera (Mandujano et al. 1996). El crecimiento de tubos polínicos a lo largo del estilo hasta alcanzar el ovario permitió descartar el funcionamiento de un sistema de incompatibilidad esporofítico o gametofítico que afecte la producción mediante autocruza (Gibbs 2014), aunque no es posible excluir un mecanismo que opere posterior a la fecundación, como la autoincompatibilidad tardía (LSI) (Lipow & Wyatt 2000). Por otra parte, los valores (> 0.5) indican que la depresión endogámica tiene un fuerte impacto sobre la adecuación de la progenie, particularmente en etapas tempranas de desarrollo, en la producción de semillas y germinación, lo cual es congruente para taxa predominantemente xenógamos, donde mutaciones letales recesivas se purgan rápidamente de las poblaciones (Husband & Schemske 1996). El aumento en el número y calidad de semillas cuando se realizan entrecruzas, incluso interespecíficas, sugieren un impacto benéfico por heterosis (Charlesworth & Willis 2009). La hibridación recíproca entre E. strictiflora y E. subalpina refuerza que esta es un fenómeno frecuente en el género Echeveria, a pesar de que el número básico de cromosomas difiere entre las especies (Uhl et al. 2005). En este caso, E. strictiflora tiene un número n = 12 y E. subalpina de n = 34 (Uhl 1992), lo que pudiera sugerir una posible barrera para la fecundación interespecífica a nivel pre- y postcigótico (Johnson 2010); sin embargo, el número de semillas viables formadas por hibridación capaces de germinar fue similar a lo obtenido por medio de la polinización cruzada intraespecífica, por lo que las diferencias en número cromosómico no representaron un mecanismo de aislamiento. La cercanía filogenética entre E. strictiflora y E. subalpina (se agrupan dentro de un mismo clado, en las series Angulatae y Secundae, respectivamente) (de la Cruz-López 2019), permite la posibilidad de que las especies compartan regiones de sus cromosomas y que una proporción de los híbridos puedan ser fértiles (Uhl 1992), para lo cual se requiere un seguimiento a largo plazo.
La hibridación tiene importantes consecuencias para la evolución de las especies, al conducir al aislamiento reproductivo de los híbridos formados y por lo tanto a la especiación (Baack et al. 2015), o puede resultar en ventajas adaptativas por heterosis o vigor híbrido (Lippman & Zamir 2007), así como la incorporación de caracteres novedosos entre los híbridos y los progenitores, que pueden ser relevantes en el ámbito comercial (Uhl et al. 2005, Reyes-Santiago et al. 2011). Por ejemplo, introducir una mayor variabilidad morfológica y fisiológica mediante la hibridación entre E. strictiflora y E. subalpina, pudiera ser una meta factible para coleccionistas y viveristas que buscan mantener poblaciones ex situ e incorporarlos a esquemas de aprovechamiento (i.e., jardinería xerófita) (Reyes-Santiago et al. 2011).
Reclutamiento/conservación y propagación. En especies suculentas de zonas áridas, el reclutamiento de nuevos individuos a partir de reproducción sexual es bajo (Mandujano et al. 1996, Clark-Tapia & Molina-Freaner 2004). El cálculo del potencial de reclutamiento se deriva de las estimaciones para determinar la eficiencia de la producción de semillas (Tejaswini & Shaanker 2001, Vilas et al. 2006, Camacho-Velázquez et al. 2018) y se amplió para integrar además el porcentaje de germinación para evidenciar el efecto final de los sistemas de cruza en la producción de plántulas que tienen posibilidad de establecerse. Tanto E. strictiflora como E. subalpina producen una cantidad considerable de óvulos (~700); sin embargo, el número de semillas maduras producidas se reduce entre un 50 y 70 % para las entrecruzas y autocruzas, respectivamente. Si bien, no puede descartarse limitación en la polinización, o la competencia por recursos que existe dentro del ovario (Aizen & Harder 2007, Ghazoul & Satake 2009), la reducción en la producción de semillas por autocruza sugiere un efecto por depresión endogámica (Mandujano et al. 1996). Es importante señalar que en este estudio se utilizó un número reducido de plantas por especie (10 individuos), las cuales fueron escogidas al azar, por lo que se desconoce su nivel de parentesco, así como su posible origen a partir de reproducción vegetativa, lo que pudo influir en el marcado efecto de la depresión endogámica; no obstante, refleja cómo este fenómeno puede amenazar el reclutamiento de nuevos individuos en poblaciones in situ y ex situ.
Aunado a lo anterior, los sistemas de cruza tuvieron un impacto evidente sobre el porcentaje de germinación, aunque no sobre la velocidad, tanto en E. strictiflora como E. subalpina; si bien en esta última, fue ligeramente más rápida. En las semillas obtenidas por entrecruza (intra o interespecífica) la germinación final fue cercana al 70 % y significativamente más alta que lo obtenido en las semillas por autocruza. Esto se traduce en que menos del ∼12 y 32 % de los óvulos llegan a producir plántulas in vitro con autocruza y entrecruza intra e interespecífica, respectivamente. El comportamiento germinativo de las semillas formadas por hibridación fue similar a lo observado en las cruzas interespecíficas, lo que refuerza la hipótesis de que la heterosis puede ser un factor importante en mantener la adecuación de la progenie en esta etapa de desarrollo, aunque se desconozca aún el nivel de fertilidad de los híbridos o si existen ventajas o desventajas adaptativas que se expresen en etapas posteriores del ciclo de vida de la planta (Husband & Schemske 1996, Lipow & Wyatt 2000).
Los estudios ex situ proveen importante información de diferentes aspectos de la biología de E. strictiflora y E. subalpina a considerar en futuros estudios in situ. En particular, la producción de semillas y el reclutamiento observado con los distintos sistemas de cruza hacen evidente la relevancia de conservar las áreas de distribución natural con el fin de favorecer una mayor cantidad de individuos y mantener la diversidad genética a fin de promover una mayor adecuación en las poblaciones (Volis & Blecher 2010, Braverman 2014). Asimismo, la mayor abundancia de plantas incrementa el atractivo, para que los visitantes y polinizadores interactúen con distintos individuos, lo cual, aunado a la transferencia de una carga suficiente de polen, son necesarias para aumentar la descendencia en especies que son fuertemente impactadas por la depresión endogámica (Parra-Tabla et al. 1998). La conservación de E. subalpina representa un reto particular, ya que su reducida área de distribución natural, el desconocimiento del estatus de conservación de los individuos y de su hábitat, así como la pérdida en la capacidad regenerativa por causa de la depresión endogámica, implican una mayor posibilidad de que se encuentre dentro de una categoría de riesgo, que requiere de una evaluación in situ. Finalmente, los esfuerzos de conservación ex situ pueden fortalecerse a través del desarrollo de métodos de manejo y propagación que promuevan la diversidad genética por medio de las entrecruzas, así como la propagación de líneas por autocruza y reproducción asexual (Volis & Blecher 2010). De esa misma forma, es posible aprovechar las características morfológicas y fisiológicas de las líneas disponibles con el fin de producir híbridos que abastezcan el mercado y que disminuyan el interés por el saqueo ilegal y por consiguiente, la presión sobre sus poblaciones naturales (Reyes-Santiago et al. 2011, Emeterio-Lara et al. 2016). Estos planes de aprovechamiento ofrecen alternativas que pueden ser consideradas dentro de las estrategias de propagación y conservación de muchas especies del género Echeveria.











 nova página do texto(beta)
nova página do texto(beta)



