Los ambientes montañosos presentan una riqueza de especies muy alta en relación con el área que poseen (Rahbek et al. 2019), razón por lo cual son áreas muy importantes para la conservación de la biodiversidad (Perrigo et al. 2020). En estos ambientes las especies pueden presentar importantes rangos de distribución altitudinal (Gurvich et al. 2014, Bauk et al. 2015) variando su abundancia local a lo largo de los gradientes (Siebert 2005, Lynn et al. 2019). Entender los factores que regulan la abundancia de las especies a lo largo de gradientes altitudinales es importante tanto desde un punto de vista teórico (Lynn et al. 2019), como aplicado, ya que permiten evaluar como el cambio climático podría afectar la distribución y abundancia de las especies en estos ambientes (Illoldi-Rangel et al. 2012, Pacifici et al. 2015).
El rango altitudinal de una especie se relaciona con el nicho climático de la misma (Vázquez 2005, Polechová & Storch 2008), mientras que la abundancia a lo largo de dicho rango estará moldeada por diferentes factores, como los microambientes o el contexto biológico (Lynn et al. 2019). Si bien existen numerosos estudios que han analizado patrones de riqueza de especies en gradientes altitudinales (Guerrero et al. 2011, Gurvich et al. 2014, Gong et al. 2019), muy pocos se han detenido en analizar patrones de abundancia de especies particulares (Siebert 2005) y los factores que afectan dichos patrones (Lynn et al. 2019).
Las características reproductivas de las especies han sido señaladas de gran importancia para comprender la dinámica poblacional, y por ende la abundancia de las mismas (Baskin & Baskin 2001, Godínez-Álvarez et al. 2003, Fernández-Pascual et al. 2019). Particularmente en la familia Cactaceae se ha analizado como las características de las semillas, el peso, tamaño y forma de las plántulas (Bauk et al. 2015), la germinación (Bauk et al. 2017) y el crecimiento de las raíces (Martino et al. 2018) varían a lo largo de gradientes altitudinales. Sin embargo, ninguno de estos estudios analizó como estas variables se relacionaban a la abundancia de las especies. Sería de esperar que variables como el peso de las semillas y el porcentaje de germinación se relacionen positivamente con la abundancia (Lönnberg & Eriksson 2013). Semillas más grandes generan plántulas más grandes que pueden presentar mayores probabilidades de establecimiento (Leishman et al. 2000, Balogh & Toft 2007) y mayores porcentajes de germinación podrían suponer un mayor número de plántulas establecidas (Kempel et al. 2013). Por otro lado, Bauk et al. (2017) encontraron que el porcentaje de germinación se relacionó positivamente con la altitud. En el mismo estudio se analizó también la velocidad de germinación, que es una característica que puede afectar positivamente el establecimiento de las plántulas (Norden et al. 2009); sin embargo, el único estudio que analizó la velocidad de germinación en un gradiente altitudinal para una especie de cactus no encontró una relación entre el gradiente altitudinal y esta variable (Bauk et al. 2017). El tamaño de plántula es una característica importante, ya que puede afectar el establecimiento (Leishman et al. 2000, Seiwa et al. 2019). Sin embargo, esta característica ha sido poco estudiada en cactáceas (Sosa-Pivatto et al. 2014, Bauk et al. 2015). A nivel interespecífico se ha observado que especies con semillas grandes presentan plántulas más grandes y de forma más columnar (Sosa-Pivatto et al. 2014). A nivel intraespecífico y en un gradiente altitudinal, Bauk et al. (2015) encontraron que las plántulas son más columnares a mayores altitudes; una plántula más columnar sería más eficiente en la captación de luz (debido a una mayor relación superficie/volumen) pero más susceptible a la falta de agua.
La familia Cactaceae Juss. presenta una amplia distribución en las Américas y los centros de mayor diversidad se encuentran en áreas montañosas (Ortega-Baes & Godínez-Álvarez 2006, Gurvich et al. 2014). A pesar de esto, existen pocos estudios que han abordado como diferentes aspectos de la distribución y la biología de este grupo varían a lo largo de gradientes altitudinales (Hicks & Mauchamp 2000, Pavón et al. 2000, Ruedas et al. 2006, Guerrero et al. 2011, Gurvich et al. 2014, Bauk et al. 2015, 2017, Arroyo-Cosultchi et al. 2017, Martino et al. 2018). Gymnocalycium quehlianum (F. Haage ex Quehl) Vaupel ex Hosseus) es una especie endémica de las Sierras de Córdoba, Argentina, y se distribuye entre los 500 y 1,200 m snm, aproximadamente (Gurvich et al. 2006, 2014). Es una especie globosa y pertenece al subgénero Trichosemineum (Demaio et al. 2011) y está categorizada como de preocupación menor por la UICN. Si bien se han estudiado algunos aspectos de la biología de esta especie, particularmente su biología reproductiva (Giorgis et al. 2015); un solo estudio analizó el crecimiento determinado de las raíces en un gradiente altitudinal (Martino et al. 2018). El objetivo general del estudio es analizar como la abundancia se relaciona a características reproductivas en Gymnocalycium quehlianum (Cactaceae) a lo largo de un gradiente altitudinal. Particularmente se analizó la densidad poblacional y estructura de tamaños a lo largo de un gradiente altitudinal, y en los mismos sitios se analizó el peso de las semillas, la germinación total, la velocidad de germinación y el tamaño y la forma de las plántulas.
Materiales y métodos
Gymnocalycium quehlianum es endémico de la Provincia de Córdoba, Argentina y se distribuye a lo largo de las Sierras Chicas hasta las Sierras del Norte, y es abundante en ambientes serranos (Charles 2009, Gurvich et al. 2014). Se caracteriza por tener tallos cónicos enterrados, mayormente morados o verde grisáceos, de alrededor de 10 cm de diámetro. Con aproximadamente 11 costillas, formadas por 4 a 6 tubérculos redondeados que llevan una giba notable, aguda, que se proyecta hacia abajo, presenta cinco espinas radiales generalmente arqueadas sobre la giba. Las flores son blancas con garganta rojiza y los frutos subcilíndricos de 2 a 3 cm (Kiesling & Ferrari 2005).
El estudio se realizó en tres sitios donde G. quehlianum se encuentra a lo largo de un gradiente altitudinal que comprende desde San Marcos Sierras (30° 44’ 00” S 64° 34’ 16” O) hasta un sitio en la Ruta Provincial E-57, popularmente conocida como Camino del Cuadrado (31° 7' 51" S 64° 25' 07" O), en las Sierras de Córdoba, Argentina. Este gradiente representa prácticamente el rango altitudinal completo de la especie, no se ha registrado a mayor altitud, pero sí a unas altitudes un poco menores (500 m snm). Las poblaciones de estudio se encuentran a 615, 948 y 1,257 m snm. (Figura 1). Este intervalo de altitud implica importantes variaciones en la temperatura y precipitación media anual, siendo respectivamente 18.7 °C y 480 mm en las zonas más bajas, de 16.3 °C y 700 mm en las zonas intermedias y de 14.0 °C y 850 mm en el sitio más alto (De Fina 1992). La vegetación del sitio más bajo es un bosque seco de Schinopsis lorentzii (Griseb.) Engl. (orco quebracho), el sitio de altitud intermedia un bosque serrano de Lithraea molleoides Vell. (Engl.) (molle de beber), mientras que el sitio más alto son pastizales dominados por Festuca hieronymi Hack., una gramínea en mata (Giorgis et al. 2017). En todos los sitios la especie en estudio sólo habita afloramientos rocosos que presentan una baja cobertura vegetal (Gurvich et al. 2014). Los principales usos del suelo en la región y en los sitios de estudio son la ganadería extensiva y el turismo (Gurvich et al. 2006).
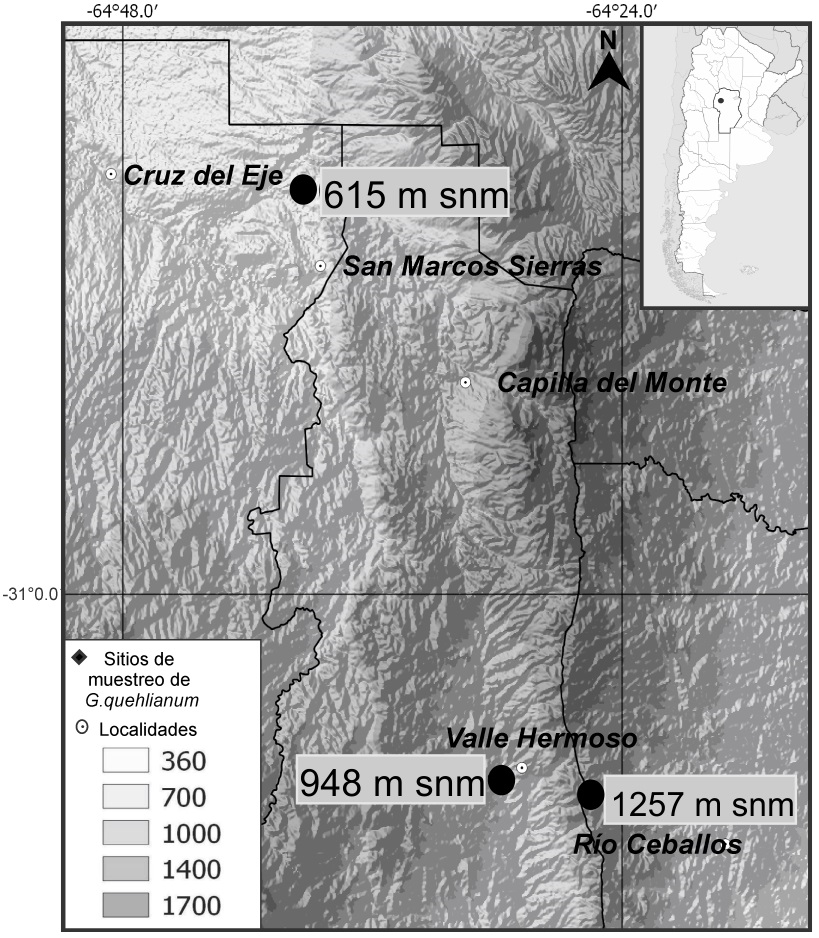
Figura 1 Ubicación de los sitios de muestreo a diferentes altitudes de Gymnocalycium quehlianum. San Marcos Sierras (615 m snm), Valle Hermoso (948 m snm) y Camino del Cuadrado (1,257 m snm).
Densidad poblacional. En cada una de las altitudes se ubicaron al azar 30 parcelas de 1 m² en los afloramientos rocosos donde se encuentra la especie (Gurvich et al. 2006, 2014). Las características de los afloramientos son similares en cuanto a orientación, pendiente, y características generales del suelo y la vegetación. En cada sitio se dispusieron las parcelas en un área de al menos cinco hectáreas a fin de que estuviera bien representada la densidad poblacional en cada altitud. Se tuvo presente que los sitios de muestreo fueran lo más parecido posible en sus características topográficas, de vegetación y de uso (ej. ganadería). En cada parcela se contó el número de individuos presentes y se midió el diámetro de cada uno. A partir de estos datos se calculó la densidad poblacional para cada altitud (ind/m2). Los individuos se dividieron en siete clases de tamaño y número aleatorio, que se utilizaron para realizar gráficos de frecuencias de tamaños.
Recolección de semillas y medición de su peso. Se recolectaron en campo frutos maduros de al menos 11 individuos (un fruto por individuo) de cada población durante los meses de enero y febrero del año 2015. Las semillas fueron removidas de los frutos, limpiadas y se dejaron secar a temperatura ambiente (Gurvich et al. 2008). Las semillas de las plantas de cada altitud se mezclaron en un pool de semillas, a partir del cual se utilizaron para los experimentos. Debido al bajo peso de las semillas se tomaron al azar 10 submuestras de 5 semillas de cada población, que fueron pesadas en una balanza analítica marca Ohaus (Pérez-Harguindeguy et al. 2013). El peso total se dividió entre cinco a fin de obtener un valor de peso por cada semilla. A partir de este mismo pool de semillas se realizaron los experimentos de germinación y las mediciones del tamaño (largo ancho) de las plántulas y se asignó la forma.
Experimentos de germinación. Se realizó un experimento de germinación donde se utilizaron 30 cajas de Petri (réplicas) de 5.5 cm de diámetro por cada población (réplicas) con papel filtro estéril humedecido con 10 ml de agua destilada (Gurvich et al. 2008). El experimento se realizó cinco meses después de haberse colectado las semillas. En cada caja de Petri se colocaron 20 semillas, que fueron mantenidas en una cámara de germinación a 15/25 °C y un fotoperíodo de luz de 12 hrs en oscuridad y 12 hrs de luz (Gurvich et al. 2021). Se registró la germinación cada 48 hrs durante 30 días, siendo la protrusión de la radícula el indicador de semilla germinada. Los experimentos se realizaron en los laboratorios del Instituto Multidisciplinario de Biología Vegetal, en la ciudad de Córdoba, Argentina. A partir de esta información se calculó el porcentaje de germinación y el tiempo medio de germinación (TMG), el cual expresa el tiempo de germinación del 50 % de las semillas incubadas. El mismo se calculó con la siguiente fórmula:
En la cual: 𝒏𝒊 es el número de semillas recién germinadas en el tiempo 𝑖 y 𝒕𝒊 es el período transcurrido desde el comienzo de la prueba de germinación, expresada en número de días (Ellis & Roberts 1980).
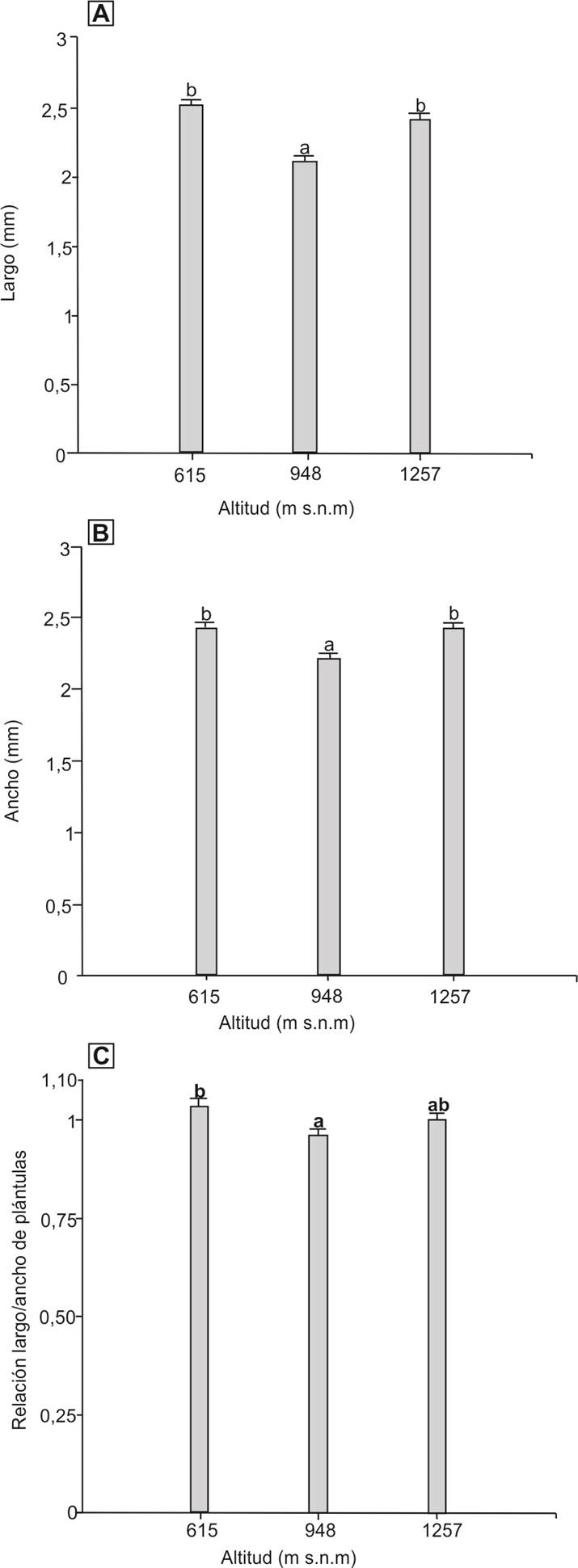
Tamaño y forma de las plántulas. Estas mediciones se realizaron utilizando las plántulas de los experimentos de germinación. Se utilizaron 30 plántulas por altitud (una por cada caja de Petri) las cuales fueron seleccionadas por estar en buenas condiciones. Se utilizaron plántulas de 35 días de edad por población estudiada, permaneciendo en las cajas de Petri (Sosa-Pivatto et al. 2014). Las mismas fueron medidas siguiendo el procedimiento utilizado en Sosa-Pivatto et al. (2014). A través de fotografías digitales a cada plántula se le midió el largo y ancho (mm), utilizando el software ImageJ® 1.43u (Rueden et al. 2017). Con el largo y ancho de las plántulas se calculó el índice de forma (relación largo/ancho), donde un valor de 1 indica que la plántula tiene una forma esférica, mientras que valores mayores indican una forma alargada y valores menores una forma aplanada (Sosa-Pivatto et al. 2014).
Análisis de datos. Debido a que los datos no presentaron distribución normal ni homogeneidad de las varianzas fue necesario realizar un análisis no paramétrico de Kruskall Wallis con una significancia de 0.05 para determinar las diferencias entre las altitudes. Como prueba a posteriori se realizó un análisis de pares. Los análisis se realizaron utilizando el paquete estadístico INFOSTAT (Di Rienzo et al. 2015).
Resultados
Tamaño poblacional. En total, sumando las tres altitudes, se registraron 70,
112 y 49 individuos en los sitios 1,257, 948 y 615 m snm respectivamente. En la
Figura 2 se muestran individuos sexualmente
maduros de cada población. La densidad de individuos varió significativamente
(Kruskal-Wallis K = 6.82, g.l. = 2, P = 0.027)
entre las poblaciones, siendo mayor a 948 m snm (
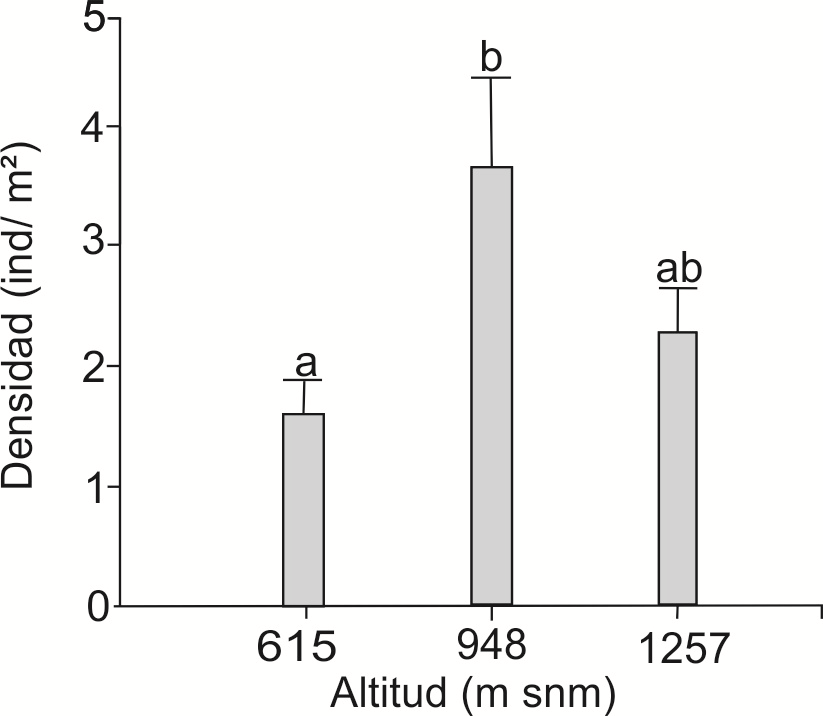
Figura 3 Número de individuos (media y error estándar) de G. quehlianum por m2 en cada sitio muestreado. Las letras diferentes sobre las barras indican diferencias significativas (Kruskal Wallis, P < 0.05) entre las poblaciones.
Las estructuras de las diferentes clases de tamaños variaron entre las altitudes. En la población a menor altitud (
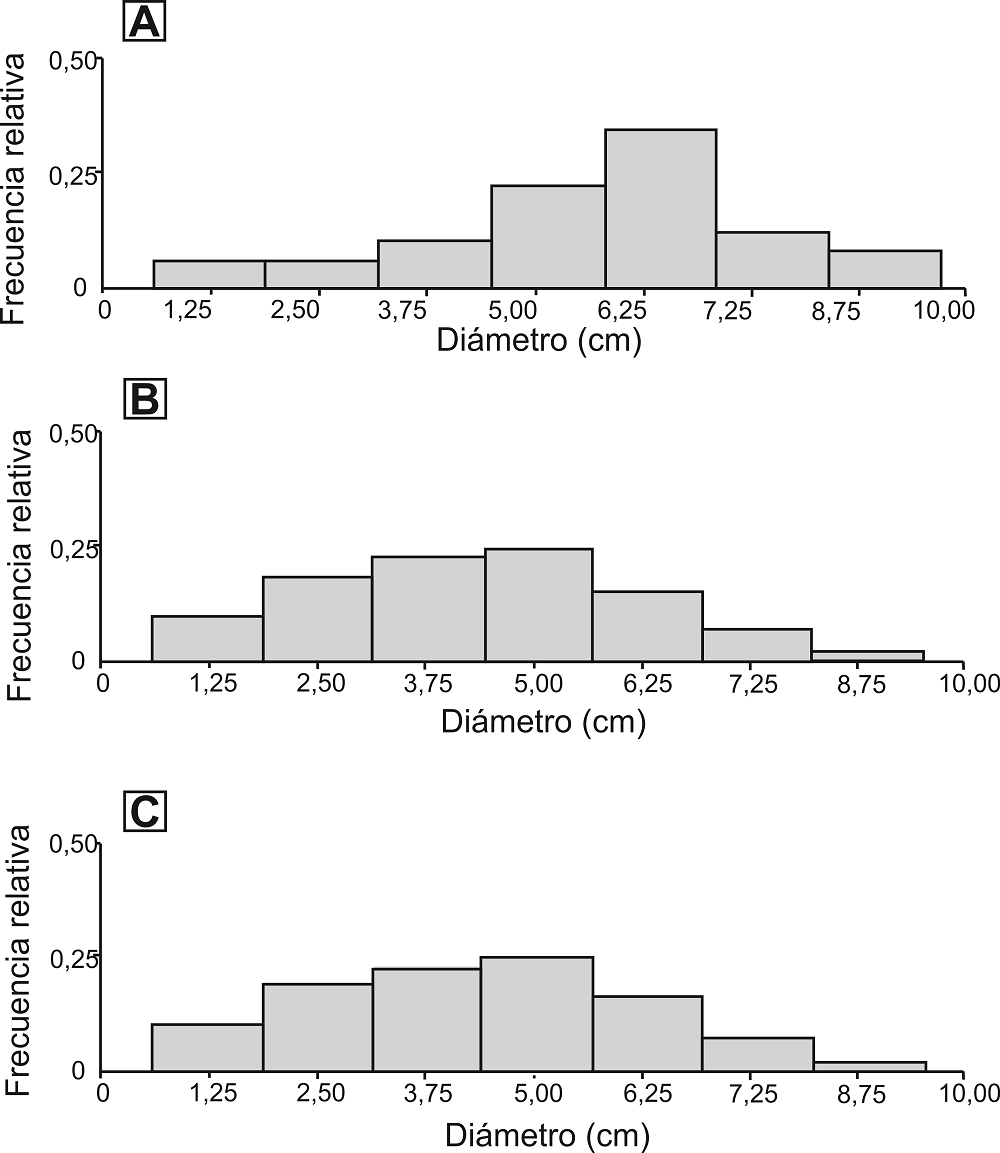
Figura 4 Estructura de tamaño de G. quehlianum a diferente altitud. A) Altitud de 615 m snm B) 948 m snm C) 1,257 m snm
Peso de las semillas. Los pesos promedios de las semillas variaron entre un mínimo de 0.14 y un máximo de 0.19 mg entre las diferentes altitudes (Figura 5). Se encontraron diferencias significativas en el peso de las semillas (Kruskal-Wallis K = 6.31,
g.l. = 2, P = 0.032), siendo las de la altitud intermedia las que presentaron semillas más livianas (

Figura 5 Peso de las semillas (media y error estándar) de G. quehlianum en las tres altitudes analizadas. Las letras diferentes sobre las barras indican diferencias significativas (Kruskal Wallis, P < 0.05) entre las poblaciones.
Germinación. El porcentaje de germinación varió entre 49.67 % (D.E. = 40.97) en semillas de la altitud a 1,257 m snm y 69.64 % (D.E. = 23.23) en semillas de la altitud a 615 m snm, pero no existieron diferencias significativas (Kruskal-Wallis K = 5.92, g.l. = 2, P = 0.298) entre las poblaciones de distintas altitudes. Sin embargo, existe una tendencia a una menor germinación en la población de mayor altitud (Figura 6A). El tiempo medio de germinación (TMG) varió entre 10 y 12 días, y tampoco hubo diferencias significativas entre las poblaciones de las distintas altitudes (Kruskal-Wallis K = 5.84, G.L. = 2, P = 0.145; Figura 6B).

Figura 6 Porcentaje y tiempo medio de germinación en G. quehlianum. A) Porcentaje de germinación (media y error estándar) final en las tres poblaciones. B) Tiempo medio de germinación (TMG). En ninguno de los dos análisis se encontraron diferencias significativas (Kruskal Wallis, P > 0.05) entre las altitudes.
Tamaño y forma de las plántulas. El largo, ancho y forma (índice de esfericidad) de las plántulas variaron significativamente entre las altitudes (Kruskal-Wallis K = 6.75, 5.93 y 6.2, respectivamente, g.l.=2, P < 0.05; Figuras 7 y 8). En las tres variables el patrón fue similar: menores valores (

Figura 7 Fotografías de plántulas típicas de 35 días de G. quehlianum de cada una de las altitudes estudiadas. Escala: 1 mm. A) 615 m snm B) 948 m snm C) 1,257 m snm
Discusión
Gymnocalycium quehlianum presentó una mayor abundancia en la altitud intermedia, lo que indica que allí se encuentra su óptimo ecológico. Si bien la población de la altitud intermedia presentó mayor frecuencia de individuos de menor diámetro, ésta fue muy similar a la estructura de la población de mayor altitud. Cabe señalar que la estructura de tamaños podría no estar relacionada a la edad de los individuos, ya que el crecimiento puede variar entre las altitudes (le Roux & McGeoch 2004). Por otro lado, los patrones encontrados indican que no existiría una relación entre la abundancia de la especie en el gradiente y las características reproductivas medidas. Algunas de las variables analizadas bajo condiciones de laboratorio, como el porcentaje y el tiempo medio de germinación no variaron entre las poblaciones, mientras que otras, como el peso de la semilla, sí variaron, pero de forma contraria al patrón esperado. Particularmente, se esperaba un mayor peso de las semillas en los sitios donde la especie fuera más abundante (Leishman et al. 2000). En este sentido, es posible que otras variables, como parámetros poblacionales (e.g., tasas de fecundidad, probabilidades de supervivencia de las plántulas), estén relacionadas a los patrones de abundancia (Lynn et al. 2019). Tampoco es posible descartar que algunas interacciones biológicas, tanto positivas como negativas, como la polinización, dispersión y competencia con otras especies, intervengan sobre los patrones de abundancia (Mangan et al. 2010, Lynn et al. 2019).
Todos los patrones observados en G. quehlianum difieren de lo encontrado en G. monvillei (Bauk et al. 2015, 2017). Por ejemplo, Bauk et al. (2015) encontraron que las plántulas son más columnares a mayores altitudes, y aquí encontramos que esto ocurre en ambos extremos altitudinales. Bauk et al. (2015) interpretaron que la forma de la plántula estaría regulada por un compromiso entre la tolerancia al estrés hídrico (produciendo plántulas más globosas, que presentan menor relación superficie/volumen) y la capacidad de crecimiento (las plántulas más columnares presentarían mayor superficie fotosintética). Bauk et al. (2017) encontraron que la germinación es mayor en las poblaciones de mayores altitudes y en el presente estudio no hay diferencias entre las poblaciones, incluso la tendencia es inversa, mayor germinación a menor altitud. El patrón de mayor germinación en poblaciones de mayor altitud también fue observado en el árbol Polylepis australis (Rosaceae; Marcora et al. 2008). Para G. monvillei y G. quehlianum no existió un patrón claro entre el peso de las semillas y la altitud (Bauk et al. 2015). Estos resultados indicarían que las relaciones entre las distintas variables, como el peso de semilla, el porcentaje de germinación y la forma de las plántulas, y la altitud serían especie específicas. Son necesarios otros estudios en especies tanto en cactáceas como en otros grupos de plantas, para poder comprender mejor estas relaciones. Estas respuestas podrían deberse tanto a la naturaleza compleja de los gradientes altitudinales (Körner et al. 2011) y a la variedad de respuestas por parte de las especies ante los cambios ambientales (Lynn et al. 2019).
A pesar de que los ambientes montañosos están en grave peligro debido a la actividad humana (Steinbauer et al. 2018), es notorio el poco número de estudios sobre los patrones de abundancia de las especies y que factores lo controlan (Lynn et al. 2019). Nuestros resultados indican que existe un patrón unimodal, donde la mayor abundancia se encuentra en la altitud intermedia. Estos resultados indican que el óptimo ecológico de la especie se encuentra a esta altura. Son necesarios más estudios en otras especies para analizar si estos patrones se repiten, o existen otros patrones. Particularmente en Cactaceae, familia con un alto número de especies en riesgo de extinción (Goettsch et al. 2015) y que habitan principalmente ambientes montañosos, muy pocos estudios han analizado aspectos de su ecología a lo largo de gradientes ambientales (Gurvich et al. 2014, Bauk et al. 2015, 2017, Martino et al. 2018). Los resultados encontrados pueden abrir nuevas líneas de investigación sobre las respuestas de las especies a gradientes ambientales. Particularmente para comprender como las características reproductivas de las plantas influyen sobre los patrones de abundancia (Arroyo-Cosultchi et al. 2017). Conocer los patrones de las especies en estos ambientes es el primer paso para comprender la respuesta de las especies ante cambios globales. Las cactáceas globosas presentan su mayor riqueza de especies en estos ambientes, y un gran número de éstas está bajo algún riesgo de vulnerabilidad (Goettsch et al. 2015).
La principal conclusión del presente estudio es que no existe una asociación entre la abundancia y algunos caracteres regenerativos a lo largo de un gradiente altitudinal en G. quehlianum, incluso encontrándose patrones opuestos a los esperados. Sin embargo, también es claro que la altitud ejerce una fuerte presión sobre las características de las plantas. En este punto resulta interesante separar los efectos de la altitud sobre las plantas, de las respuestas que las mismas desarrollan para poder hacer frente a estos cambios ambientales. El presente estudio es una primera aproximación para comprender las complejas relaciones entre la altitud, la densidad poblacional y los caracteres reproductivos en una especie de cactus globoso.











 nueva página del texto (beta)
nueva página del texto (beta)