Las plantas requieren diferentes elementos químicos para cumplir sus múltiples funciones biológicas y ecológicas (Peñuelas et al. 2019). Algunos se constituyen en nutrientes, de los cuales los más limitantes para la productividad son el nitrógeno (N) y el fósforo (P), pues están relacionados con la síntesis de proteínas, ácidos nucleicos, coenzimas, clorofila, fosfolípidos, moléculas de transferencia de energía, entre otras. La estequiometría ecológica estudia las proporciones entre los elementos y como afectan el funcionamiento biológico, sus interacciones y la biogeoquímica en las comunidades y ecosistemas (Sterner & Elser 2002). Así, muchos de los atributos de las plantas están relacionados con la concentración de N y P foliar, y sus cocientes estequiométricos. Es conocido que las plantas al realizar sus funciones básicas como crecer, fotosintetizar y reproducirse, utilizan los nutrientes más limitantes de manera eficiente para mantener un balance de carbono positivo (Bloom et al. 1985), y así modifican y afectan el tiempo de vida de las hojas, y la calidad de la hojarasca en la senescencia (Sterner & Elser 2002).
La senescencia es el último proceso de la ontogenia en el que ocurre el desmantelamiento celular, y con la reabsorción (redistribución) de nutrientes desde las hojas hacia otros órganos de la planta, culmina con la muerte celular (Martínez et al. 2008). Con ello podemos entender la eficiencia y la suficiencia de reabsorción; la primera refiere el porcentaje de nutrientes de la hoja que regresa a la planta mientras que la segunda, la concentración de nutrientes que queda en la hoja senescente después de la reabsorción (Killingbeck 1996). La eficiencia de reabsorción se ha relacionado con procesos fisiológicos como la maximización de la fotosíntesis durante el desarrollo foliar en el dosel (Franklin & Ågren 2002), su longevidad (Eckstein et al. 1999) o con los sumideros de carbono y nutrientes en frutos cercanos (Chapin & Moilanen 1991). Igualmente, se ha relacionado con la disponibilidad de nutrientes en el suelo (Killingbeck 1996, Côté et al. 2002, Tully et al. 2013, See et al. 2015, Yuan & Chen 2015) y factores ambientales como precipitación y temperatura (Gerdol et al. 2000, Yuan & Chen 2009, 2015, Zhao et al. 2017), afectando múltiples funciones biogeoquímicas y del ecosistema (Reed et al. 2012).
Los cocientes estequiométricos C:N y N:P en las hojas pueden o no modificarse por la reabsorción de nitrógeno (N) y fósforo (P) durante la senescencia foliar. Diversos estudios han encontrado eficiencias de reabsorción similares para N y P (Aerts 1996, Vergutz et al. 2012), mientras que otros, rangos muy amplios (Güsewell 2005, Zhao et al. 2017), posiblemente debido a las diferencias en sus reservorios solubles y estructurales (McGroddy et al. 2004). La disimilitud en la estequiometría de C:N y N:P como consecuencia de la reabsorción durante la senescencia puede estar relacionada con funciones de optimización nutrimental para la planta (Chapin & Kedrowski 1983), y al mismo tiempo con procesos tróficos y biogeoquímicos de los ecosistemas (Mooshammer et al. 2011, Zechmeister-Boltenstern et al. 2015). Sin embargo, ninguno se ha abordado suficientemente.
Un número importante de estudios han mostrado que la proporción N:P se incrementa en la hojarasca después de la reabsorción, particularmente bajo condiciones de mayor temperatura y aridez (Wright & Westoby 2003, Güsewell 2004, See et al. 2015, Prieto & Querejeta 2020), o en suelos pobres en P (Drenovsky et al. 2019). Las diferencias en la reabsorción entre especies y formas de vida sugieren que la composición de la vegetación y sus cambios, pueden tener efectos importantes en la biogeoquímica de N y P (Güsewell 2004, Güsewell & Gessner 2009). Por ejemplo, en el caso de las plantas fijadoras de nitrógeno se ha reportado que suelen reabsorber más P que N (Killingbeck 1996, Tateno 2003, Stewart et al. 2008, He et al. 2011), debido a que la fijación del nitrógeno es un proceso energéticamente costoso que requiere fósforo. Por otro lado, el hecho de tener hojas senescentes ricas en nitrógeno hace más fácil su degradación y asimilación por los microorganismos del suelo (Freschet et al. 2013, Mooshammer et al. 2014). Sin embargo, poco se conoce de la estequiometría N:P en la hojarasca y las posibles limitaciones o desbalances de P después de la reabsorción en especies de zonas áridas y semiáridas.
Aun cuando las zonas áridas son conocidas por una baja disponibilidad y gran heterogeneidad de N y P en el suelo (Schlesinger et al. 1996, Cross & Schlesinger 1999, Celaya-Michel et al. 2015), se han encontrado altas concentraciones de nitrógeno foliar en especies del Desierto Sonorense (Castellanos et al. 2018). En algunos estudios se han asociado con su mayor eficiencia de reabsorción en algunos estudios (Campanella & Bertiller 2011) y menor en otros (Yuan et al. 2005). Es claro que las diferentes correlaciones entre la concentración de N y P foliares, y su reabsorción sugiere estrategias fisiológicas y ecológicas, así como consecuencias biogeoquímicas contrastantes (Chávez-Vergara et al. 2015), las que son aún poco conocidas en las regiones áridas. Estudios previos en la región árida Sonorense, han mostrado que diferencias en los cocientes estequiométricos de N y P están relacionados con el potencial invasivo de las especies (Castellanos et al. 2018), aún cuando previamente se ha considerado el agua y no los nutrientes, como el principal factor selectivo en las estrategias ecológicas de plantas desérticas (Austin 2011).
Dado lo anterior, este trabajo contribuye a entender algunos de los procesos que determinan la concentración de N y P en tipos funcionales y comunidades del Desierto Sonorense. En particular cómo la eficiencia y suficiencia de reabsorción de N y P modifica la estequiometría foliar durante la senescencia y consecuentemente en la hojarasca. Se plantea que como estrategia de conservación, la eficiencia de reabsorción del nitrógeno será mayor en el extremo más árido, dada su importancia en la fotosíntesis, como se ha sugerido en otros estudios. Como consecuencia, en ese extremo del gradiente, las hojas senescentes tendrán menor concentración de nutrientes y mayores cocientes estequiométricos de C:N y C:P, no así de N:P. Se discuten las estrategias de reabsorción y estequiometría ecológica en diferentes tipos funcionales y leguminosas a la luz de nuestra hipótesis, así como las consecuencias en las dinámicas biogeoquímicas de la hojarasca en las comunidades vegetales del gradiente en donde son dominantes.
Materiales y métodos
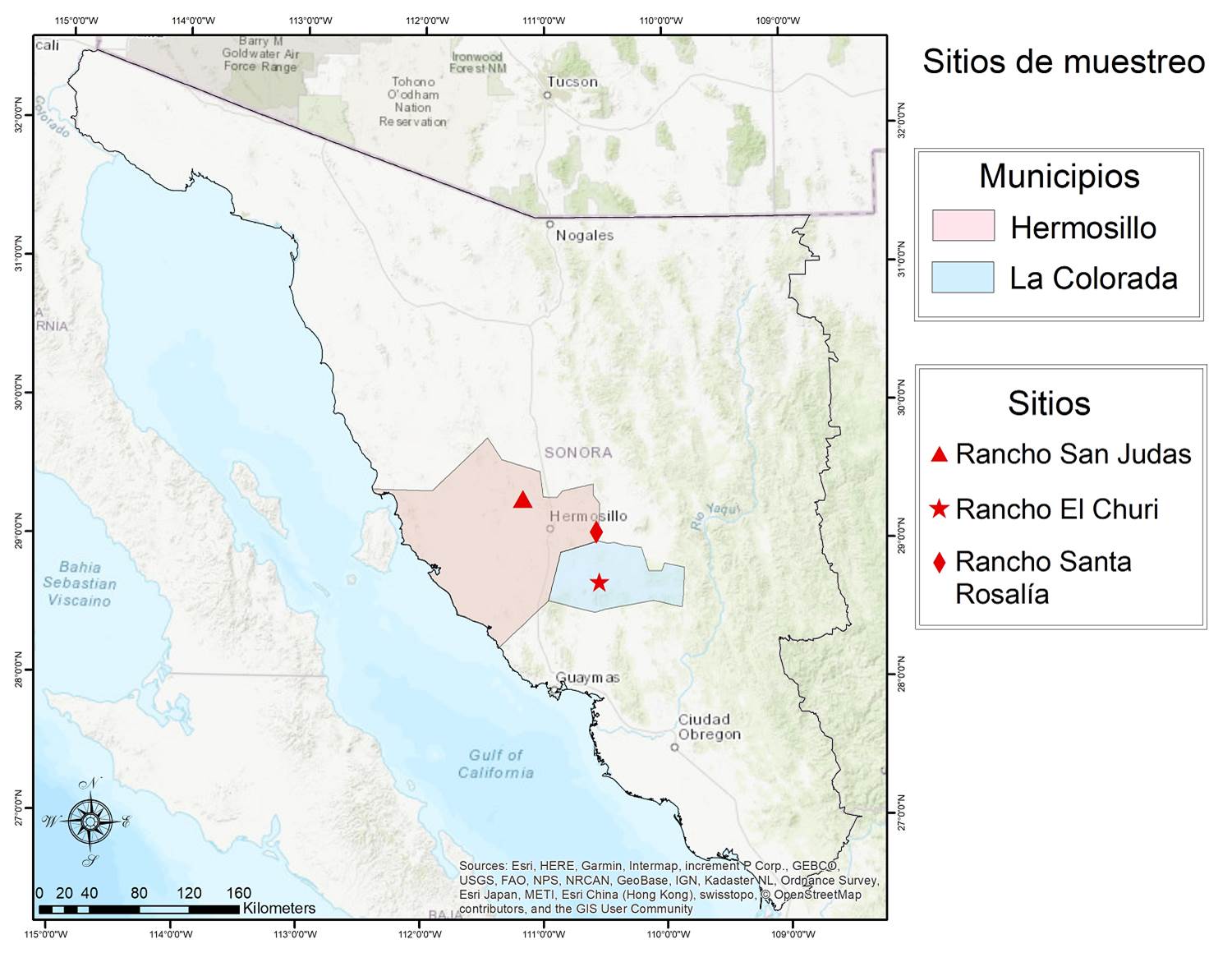
Sitios de estudio. Se seleccionaron tres áreas en la parte central de Sonora, ubicados dentro del Desierto Sonorense. El primero pertenece al municipio de La Colorada, donde se encuentra el Rancho El Churi (CH) ubicado a 28° 42' 6.77" N y -110° 32' 15.64" O, la precipitación media anual (PMA) es 476.0 mm y la temperatura media anual (TMA) 22.8 °C, el índice de aridez de Martonne (IA = P / T + 10 ) es de 14.51 (árido) y el tipo de vegetación es matorral subtropical y pastizal inducido (Hinojo-Hinojo et al. 2019; Figura 1). El segundo sitio corresponde al Rancho Shangai-Santa Rosalía (SR) ubicado a 29° 04' 11.94" N y -110° 34' 00.78" O, en el municipio de Hermosillo; la PMA es de 438 mm, la TMA de 24.1 °C (CONAGUA 2019), con un IA de 12.87 (árido), con vegetación de mezquital. El tercer sitio, el Rancho San Judas (SJ), se encuentra también en Hermosillo, a 29° 17' 50.1" N y -111° 10' 8.6" O. La PMA es de 385.2 mm, la TMA de 25.1 °C (CONAGUA 2019), el IA de 10.97 (árido) y vegetación de matorral desértico. Todas las muestras se colectaron entre agosto y noviembre de 2017 y 2018.
Sources: Esri, HERE, Garmin, Intermap, increment P Corp., GEBCO, USGS, FAO, NPS, NRCAN, GeoBase, IGN, Kadaster NL, Ordnance Survey, Esri Japan, METI, Esri China (Hong Kong), swisstopo, ©OpenStreetMap contributors, and the GIS User Community
Figura 1 Localización de los sitios de estudio en la región central de Sonora, Noroeste de México.
Las especies dominantes por sitio de estudio se obtuvieron mediante tres transectos de 150 m de longitud, utilizando un método al azar estratificado según su forma de vida en árboles y arbustos respectivamente. Posteriormente fueron identificadas y diferenciadas según su tipo funcional basado en sus atributos de perennación foliar (caducifolias o perennifolias) y la facilidad de adquisición de nitrógeno (fijadoras y no fijadoras). En el grupo de las especies fijadoras de nitrógeno se incluyeron también otras leguminosas no fijadoras, dadas sus características funcionales comunes como las altas tasas fotosintéticas y la concentración de nitrógeno foliar reconocidas para todo el taxón (Adams et al. 2016). Por lo tanto, a este grupo funcional lo denominamos como Leguminosas.
Para todas las especies estudiadas se obtuvieron muestras de hojas verdes de cinco individuos (en un par de especies solo cuadruplicado) durante el pico de su desarrollo a mediados de agosto y de sus hojas senescentes en los mismos individuos a finales de septiembre-octubre, para obtener los promedios en cada una de las determinaciones. Con el fin de facilitar las comparaciones de este estudio con otros realizados en la región, todos los nombres científicos siguen los establecidos en Shreve & Wiggins (1964), aún aquellos con modificaciones taxonómicas recientes (Tabla 1).
Tabla 1 Especies dominantes de los sitios de estudio. Las especies fueron diferenciadas por la persistencia de la hoja (caducifolias y perennifolias) y su forma de vida (árbol, arbusto y pasto) así como si son especies de leguminosas (*).
| Sitio | Tipo de hoja | Árbol | Arbusto | Pasto |
|---|---|---|---|---|
| El Churi | Caducifolia | Ipomoea arborescens | Encelia farinosa | Cenchrus ciliaris |
| Fouquieria macdougalii | Mimosa laxiflora* | |||
| Cercidium microphyllum* | Jatropha cardiophylla | |||
| Perennifolia | Olneya tesota* | |||
| Prosopis velutina* | ||||
| Santa Rosalía | Caducifolia | Cercidium microphyllum* | Fouquieria splendens | Cenchrus ciliaris |
| Jatropha cordata | Mimosa laxiflora* | |||
| Colubrina viridis | ||||
| Perennifolia | Olneya tesota* | Brongniartia minutifolia* | ||
| Prosopis velutina* | ||||
| San Judas | Caducifolia | Cercidium praecox* | Jatropha cardiophylla | |
| Mimosa laxiflora* | ||||
| Perennifolia | Olneya tesota* | Larrea tridentata | ||
| Prosopis velutina* |
Tratamiento de las muestras. En cada uno de los sitios se colectaron hojas verdes maduras y senescentes sin señales de herbivoría o enfermedad. Las hojas verdes provenían de la parte externa del dosel. En el caso de las hojas senescentes, se colocaron trampas de hojarasca, las cuales consistían en mallas de nylon amarradas entre las ramas del individuo, revisadas cada 7 a 15 días (Cornelissen 1996). Las muestras fueron depositadas en sobres de papel rotuladas (especie, número de individuo, fecha de colecta y tipo de hoja). En hojas senescentes, se limpiaron de posible contaminación (hojas de otras especies, ramas, partes de insectos, etc.) y en ambos casos se transportaron y almacenaron en frío hasta su análisis.
El muestreo de suelo se realizó solo en uno de los sitios de estudio (CH) durante el año 2017. Durante este muestreo se colectó el suelo bajo cinco individuos de las mismas especies arbóreas dominantes con ayuda de una pala, después de retirar la capa superficial de materia orgánica. Las muestras tomadas de los primeros 5 cm de profundidad se colectaron en bolsas de papel debidamente rotuladas. Las muestras de hojas se secaron en un horno FelisaR FE 243 durante 72 h a 60 °C y después se molieron en un molino Wiley; las muestras de suelo se tamizaron con una malla de 2 mm y luego secadas de igual forma que las hojas.
Área foliar. El área foliar se midió en hojas verdes y senescentes con un escáner HP Deskjet 2510 y el programa “Image-J” (NIH, EU), colocadas de manera individual junto a una referencia conocida, mantenidas dentro de sobres de papel debidamente identificados, y secadas por 72 h a 60 °C. Después se pesaron individualmente en una balanza analítica y se obtuvo el área foliar específica (AFE = Área foliar/Peso seco). Se midieron tres hojas por individuo de cada una de las especies.
Nitrógeno y carbono total. Se pesaron 3 mg para hojas y 20 mg para suelo; posteriormente en el analizador elemental PerkinElmer 2400 serie II mediante la combustión completa de la muestra (950-1300 °C y atmósfera de oxígeno puro) para convertir los elementos en gases simples (C y N), separarlos y medirlos, para obtener la concentración de cada elemento en la muestra.
Fósforo total. Para hojas se requirió de 150 mg y 10 g para suelo. Las muestras secas fueron digeridas en una mezcla de ácido sulfúrico y sulfato de potasio, mediante la reacción con molibdato de amonio y ácido ascórbico, y después medido a 660 nm en el analizador AA1 (SEAL) rápido de fluidos (Murphy & Riley 1962).
Eficiencia de reabsorción. Se determinó la reabsorción de nutrientes (N y P) mediante la fórmula (Van Heerwaarden et al. 2003):
donde Nusen y Nuver son las concentraciones de nutrientes en la hoja senescente y la hoja verde respectivamente. Los valores de reabsorción de nutrientes consideraron la corrección por pérdida de masa (FCPM), que puede inducir errores en el cálculo ante un cambio significativo de masa foliar en la senescencia (Vergutz et al. 2012). Sin embargo, otros estudios recientes no consideran dicho factor de corrección (See et al. 2015, Sohrt et al. 2018), por lo que es importante señalarlo para comparar los resultados con la mayor cantidad de estudios recientes.
Los cocientes estequiométricos se obtuvieron a partir de las concentraciones de nutrientes foliares totales, con los valores obtenidos en base a peso (g Nutriente g-1 hoja) de cada individuo por especie estudiada. Las relaciones de C:N, N:P y C:P se determinaron tanto en hojas verdes como senescentes.
Análisis estadístico. Las especies estudiadas se agruparon por sitio, los que se compararon a lo largo del gradiente para conocer las diferencias entre las concentraciones foliares promedio, sus cocientes estequiométricos en las hojas maduras verdes y las senescentes, así como su eficiencia y suficiencia de reabsorción. Los análisis estadísticos se realizaron utilizando el programa JMP v14.0.0 de SAS. Se realizaron pruebas de normalidad a los datos, sin que algunos pudieran ajustarse aún después de ser transformados con funciones logarítmicas, por lo que los datos se analizaron mediante pruebas no paramétricas y contrastadas con un intervalo de confianza al 95 %.
Se realizaron ANOVAs con la prueba de Wilcoxon / Kruskal-Wallis para muestras independientes y de Wilcoxon para mediciones repetidas, al comparar las concentraciones foliares de nutrientes, su eficiencia y suficiencia de reabsorción, los cocientes estequiométricos en hojas verdes y senescentes entre sitios, y luego entre los tipos funcionales. Para las correlaciones en el suelo en cuanto a la eficiencia de reabsorción de N y P con su concentración total en el suelo, se realizó una regresión lineal simple, con la estimación M de Huber de ajuste robusto.
Resultados
Relación de las concentraciones de nutrientes entre las hojas y el suelo. Se compararon las eficiencias de reabsorción de nutrientes foliares (N y P) de todos los individuos de las especies dominantes estudiadas con la concentración del nutriente en el suelo para el sitio CH y se encontró una relación inversa entre la eficiencia de reabsorción de nitrógeno (F (1,44) = 8.75, P = 0.005, R2 = 0.17) y fósforo (F(1,41) = 6.11, P = 0.017, R 2 = 0.12) de las hojas con la concentración total del mismo nutriente en el suelo (Figura 2).
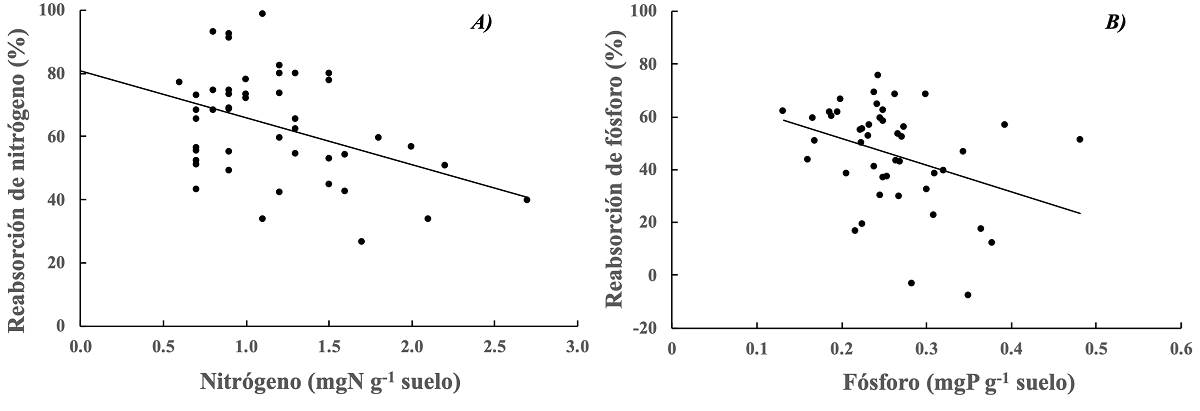
Figura 2 Relación de la eficiencia de reabsorción de A) nitrógeno (ERN) y B) fósforo (ERP) en hojas de diferentes especies y la concentración de N o P en el suelo (ERN = -4.836 × N + 80.826; R 2 = 0.17 y ERP = -101.16 * P + 71.881; R 2 = 0.12). Datos son para el sitio menos árido del gradiente de estudio (CH) en 2017.
Nutrientes en hojas verdes y senescentes. Se encontraron diferencias significativas en las concentraciones de nitrógeno foliar entre las hojas verdes y senescentes entre los sitios. En todos los casos las mayores concentraciones de nitrógeno (N) y de fósforo (P) correspondientes a San Judas (SJ), el sitio más árido en el estudio (Tabla 2). Por otro lado, la concentración de nitrógeno en hojas de árboles fue mayor que las de otras formas de vida en los tres sitios, tanto en hojas verdes como senescentes, aunque solo en San Judas las diferencias fueron significativas con arbustos (Tabla 2). En contraste, las concentraciones de P en hojas verdes fueron mayores en herbáceas y pastos, y menores en arbustos y árboles respectivamente. Sin embargo, los arbustos en SJ presentaron las concentraciones más altas en hoja verde (Tabla 2).
Tabla 2 Media de las concentraciones de N y P para hojas verdes y senescentes de diferentes tipos funcionales en cada sitio. Diferencias estadísticas (P <= 0.05) entre tipos funcionales en cada sitio se representan con letras (mayúsculas = diferencias de medias entre sitios; minúsculas = diferencias entre tipos funcionales). NA = No aplica, dada su ausencia en el sitio.
| Churi | Sta Rosalía | Sn Judas | Churi | Sta Rosalía | Sn Judas | |
|---|---|---|---|---|---|---|
| Nitrógeno (mgN g-1) | Fósforo (mgP g1) | |||||
| Hojas verdes | Hojas verdes | |||||
| Media | 26.7 ± 7.1 B | 26.5 ± 5.8 B | 33.6 ± 4.5 A | 1.9 ± 0.7 B | 1.3 ± 0.4 C | 2.0 ± 0.5 A |
| Árbol | 28.91 ± 5.7 a | 28.81 ± 4.4 a | 35.84 ± 3.9 a | 1.72 ± 0.5 b | 1.26 ± 0.2 b | 1.64 ± 0.2 b |
| Arbusto | 27.46 ± 5.6 a | 25.6 ± 6.5 ab | 31.58 ± 4.0 b | 1.78 ± 0.6 b | 1.13 ± 0.2 c | 2.28 ± 0.6 a |
| Pasto | 13.68 ± 0.6 b | 21.22 ± 3.9 b | NA | 3.38 ± 0.4 a | 2.29 ± 0.6 a | NA |
| Caducifolia | 24.91 ± 6.8 b | 24.09 ± 5.2 b | 35.31 ± 4.4 a | 2.03 ± 0.8 b | 1.31 ± 0.5 c | 2.23 ± 0.6 a |
| Perennifolia | 32.73 ± 4.1 a | 31.43 ± 3.6 a | 31.53 ± 3.7 a | 1.58 ± 0.3 b | 1.33 ± 0.2 c | 1.70 ± 0.2 a |
| Leguminosa | 31.26 ± 4.3 b | 29.67 ± 4.6 b | 34.38 ± 4.3 a | 1.61 ± 0.5 b | 1.26 ± 0.2 c | 1.80 ± 0.3 a |
| Otras | 25.30 ± 5.0 b | 23.1 ± 5.1 b | 32.07 ± 4.6 a | 1.82 ± 0.5 b | 1.08 ± 0.2 c | 2.33 ± 0.7 a |
| Hojas senescentes | Hojas senescentes | |||||
| Media | 12.8 ± 8.7 B | 13.4 ± 7.6 B | 21.8 ± 8.1 A | 1.0 ± 0.4 B | 0.6 ± 0.3 C | 1.5 ± 0.7 A |
| Árbol | 15.78 ± 10.42 a | 17.48 ± 8.33 a | 28.38 ± 6.53 a | 1.10 ± 0.48 a | 0.82 ± 0.39 a | 1.54 ± 0.54 a |
| Arbusto | 11.18 ± 3.59 a | 11.63 ± 4.45 b | 16.15 ± 3.78 b | 0.97 ± 0.37 ab | 0.54 ± 0.15 b | 1.54 ± 0.81 a |
| Pasto | 4.4 ± 0.65 b | 4.3 ± 2.16 c | NA | 0.63 ± 0.09 c | 0.39 ± 0.08 c | NA |
| Caducifolia | 9.16 ± 3.9 b | 10.02 ± 6.0 b | 19.2 ± 6.3 a | 0.88 ± 0.31 b | 0.54 ± 0.18 c | 1.74 ± 0.7 a |
| Perennifolia | 26.82 ± 7.6 a | 20.2 ± 5.5 b | 24.86 ± 9.1 b | 1.46 ± 0.52 a | 0.87 ± 0.42 b | 1.32 ± 0.7 ab |
| Leguminosa | 20.07 ± 9.2 b | 18.33 ± 6.2 b | 25.62 ± 7.5 a | 1.31 ± 0.5 b | 0.80 ± 0.4 c | 1.79 ± 0.7 a |
| Otras | 8.45 ± 1.7 b | 8.26 ± 3.4 b | 15.00 ± 2.9 a | 0.83 ± 0.2 a | 0.47 ± 0.1 b | 1.10 ± 0.4 a |
Según sus atributos funcionales, las concentraciones promedio de N en hojas verdes fueron mayores para especies perennifolias que caducifolias en los sitios CH y SR, pero no en el sitio más árido de SJ (Tabla 2). En contraste, la concentración de P en hojas verdes fue mayor en especies caducifolias de ambos extremos del gradiente, CH y SJ. Además, en SJ se encontraron las mayores concentraciones de P en hojas senescentes de especies caducifolias, es decir menor suficiencia, mientras que en los otros sitios, el P fue mayor en especies perennifolias (Tabla 2).
Las leguminosas definidas como tipo funcional (ver método) tuvieron mayor concentración de nitrógeno foliar (N) en hojas verdes y senescentes que las otras especies. Las concentraciones de N más altas en hojas verdes se presentaron en SJ, lo mismo que en las hojas senescentes, al igual que para las otras especies (Tabla 2). Las concentraciones foliares de P en hojas verdes y senescentes fueron menores en el sitio intermedio (SR) comparado con ambos extremos del gradiente, CH y SJ, en donde una diferencia importante fue que las leguminosas tuvieron significativamente menor concentración de P en hojas verdes (Tabla 2). De manera importante encontramos que las mayores concentraciones de P en hojas senescentes (menor suficiencia) correspondieron al tipo funcional de leguminosas en todos los sitios (Tabla 2).
Eficiencia de reabsorción. No se observaron diferencias significativas entre los promedios de las eficiencias de reabsorción de nitrógeno de las especies muestreadas en los sitios menos áridos (SR = 51.7 ± 0.7 % N y CH = 53.6 ± 22.8 % N), y solo fueron significativas al compararlas con el sitio más árido (SJ, χ2(2,102) = 10.21; P = 0.006) dada la menor reabsorción en SJ (35.1 ± 20.8 % N). Las diferencias en la reabsorción de fósforo apenas fueron significativas entre sitios (χ2(2,100) = 8.62, P = 0.01), por las diferencias entre el sitio con especies que presentaron el mayor promedio en su eficiencia de reabsorción del nutriente (SR = 48.7 ± 23.9 %) y el sitio con menor promedio en sus especies (SJ = 20.4 ± 33.9 %; Tabla 3).
Tabla 3 Eficiencia (%) y suficiencia (mgNutriente g-1) de reabsorción en tres sitios en un gradiente de menor (CH) a mayor (SJ) aridez. Valores representan la media ± d.s. Diferencias estadísticas (P <= 0.05) se señalan con letras.
| Sitio | Eficiencia de reabsorción | Suficiencia de reabsorción | ||
|---|---|---|---|---|
| N | P | N | P | |
| El Churi | 53.6 ± 22.8 a | 42.2 ± 30.7 a | 12.8 ± 8.7 b | 1.0 ± 0.4 b |
| Santa Rosalía | 51.7 ± 20.7 a | 48.7 ± 23.9 a | 13.4 ± 7.6 b | 0.64 ± 0.3 c |
| San Judas | 35.1 ± 20.8 b | 20.4 ± 33.9 b | 21.8 ± 8.1 a | 1.5 ± 0.7 a |
Las diferencias en la reabsorción de N y P entre sitios estuvieron fuertemente influenciadas por las tasas de reabsorción específicas. Hubo tendencias importantes entre las especies que conforman las comunidades vegetales en los tres sitios que fueron determinantes en la gran variabilidad encontrada. Por ejemplo, en SJ la diferencia entre la mayor (J. cardiophylla = 64.7 ± 8.1) y menor (O. tesota = 8.76 ± 17.7) eficiencia de reabsorción fue de casi un orden de magnitud (Tabla 4). En el extremo menos árido (CH) las diferencias en la eficiencia de reabsorción de nitrógeno (ERN) fueron también significativas entre las especies (χ2(7,34) = 22.28, P < 0.002), pero la variación en la eficiencia entre especies fue menor (solo cinco veces entre el valor más alto en I. arborecens y el menor en O. tesota). Esta variación fue similar a la encontrada en las especies en el sitio intermedio (SR), en donde la mayor ERN (J. cordata y F. splendens) fue casi cuatro veces la menor (P. velutina; Tabla 4).
Tabla 4 Eficiencia de reabsorción (%) considerando el factor de corrección de las especies estudiadas en cada uno de los sitios. Valores representan la media ± d.s y letras las diferencias estadísticas. # denota que la especie no fué incluida en los análisis estadísticos.
| Especie | San Judas | Santa Rosalía | El Churi |
|---|---|---|---|
| Eficiencia de reabsorción de nitrógeno | |||
| B. minutifolia | - | 56.64 ± 14.29 ab | - |
| C. ciliaris | - | 87.29 ± 5.26 # | 71.23 ± 3.01 # |
| C. microphyllum | - | 48.54 ± 24.74 abc | 58.65 ± 16.04 ab |
| C. praecox | 36.41 ± 15.02 abc | - | - |
| C. viridis | - | 57.74 ± 11.32 ab | - |
| E. farinosa | - | - | 67.37 ± 2.94 ab |
| F. macdougalii | - | - | 67.23 ± 7.64 ab |
| F. splendens | - | 69.28 ± 12.80 a | - |
| I. arborescens | - | - | 78.59 ± 3.56 a |
| J. cordata | - | 78.04 ± 2.83 a | - |
| J. cardiophylla | 64.72 ± 11.6 a | - | 43.86 ± 20.7 bc |
| L. tridentata | 61.65 ± 11.71 ab | - | - |
| M. laxiflora | 31.48 ± 17.81 bc | 58.88 ± 13.62 ab | 56.62 ± 17.45 ab |
| O. tesota | 8.76 ± 17.7 c | 27.7 ± 14.6 bc | 13.74 ± 9.79 c |
| P. velutina | 11.58 ± 15.5 c | 14.75 ± 30.5 c | 36.30 ± 27.13 bc |
| Eficiencia de reabsorción de fósforo | |||
| B. minutifolia | - | 58.2 ± 13.4 ab | - |
| C. ciliaris | - | 88.52 ± 3.70 # | 83.11 ± 2.20 # |
| C. microphyllum | - | 43.02 ± 26.4 abc | 31.29 ± 26.26 ab |
| C. praecox | 20.83 ± 19.17 bc | - | - |
| C. viridis | - | 54.85 ± 13.1 abc | - |
| E. farinosa | - | - | 53.47 ± 8.18 a |
| F. macdougalii | - | - | 56.43 ± 11.57 a |
| F. splendens | - | 58.71 ± 15.9 ab | - |
| I. arborescens | - | - | 65.22 ± 5.04 a |
| J. cardiophylla | 50.90 ± 9.63 ab | - | 38.69 ± 14.51 ab |
| J. cordata | - | 67.05 ± 2.9 a | - |
| L. tridentata | 73.69 ± 6.9 a | - | - |
| M. laxiflora | -25.28 ± 19.29 d | 56.56 ± 13.2 abc | 33.75 ± 27.12 ab |
| O. tesota | -1.99 ± 25.63 cd | -2.9 ± 37.38 c | 2.19 ± 6.55 b |
| P. velutina | -7.21 ± 16.5 cd | 3.7 ± 61.3 bc | 22.87 ± 36.50 ab |
De la misma manera, las variaciones en la eficiencia de reabsorción de fósforo (ERP) fueron aún mayores entre las especies de cada sitio; algunas con un aumento en la concentración del nutriente durante la senescencia y como consecuencia valores negativos. La mayoría de las especies que incrementaron su concentración durante la senescencia se ubicaron en el sitio de mayor aridez (SJ), destacando M. laxiflora en SJ como la especie con mayor incremento del nutriente en sus hojas senescentes, al igual que otras especies de leguminosas como P. velutina (SJ) y O. tesota (en SJ y SR) (Tabla 4).
Cocientes estequiométricos. Los cocientes C:N, N:P y C:P foliares fueron analizados entre los diferentes sitios del gradiente de aridez. El cociente C:N en hoja verde (χ2(2,103) = 20.86, P < 0.0001) y senescente (χ 2(2,103) = 19.94, P < 0.0001) mostró diferencias entre los sitios, pero en ambos casos fue significativamente menor en el sitio más árido (SJ = 13.59 ± 1.99 y 22.97 ± 7.7 en hojas verdes y senescentes respectivamente) (Figura 3a). En cambio, las diferencias en el cociente N:P en hojas verdes (χ 2(2,103) = 32.84, P < 0.0001) y senescentes (χ 2(2,101) = 26.42, P < 0.0001), mostraron mayor variabilidad y solo fueron diferentes entre el sitio intermedio, pero no entre los extremos del gradiente (Figura 3b). El cociente C:P mostró también gran variabilidad (Figura 3c), aunque las diferencias entre los sitios fueron estadísticamente significativas. Los cocientes estequiométricos C:N y C:P aumentaron en hojas senescentes, mientras que N:P disminuyeron.
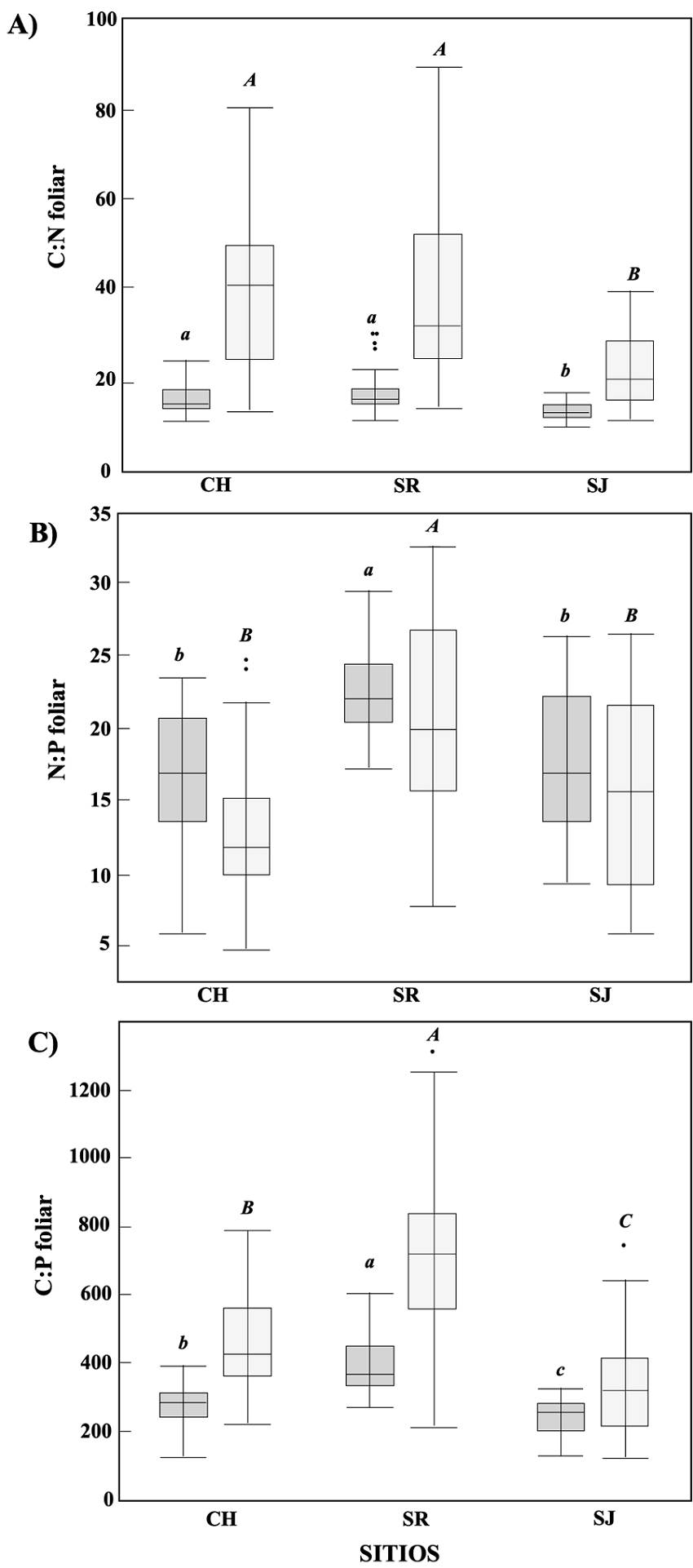
Figura 3 Gráficas de cajas mostrando los cuartiles y medianas de los cocientes estequiométricos de A) C:N, B) N:P y C) C:P en hojas verdes (gris oscuro) y senescentes (gris claro) para cada sitio de estudio. Letras muestran diferencias significativamente mayores a P = 0.005 entre sitios para hojas verdes (minúsculas) y senescentes (mayúsculas).
Discusión
En este estudio se buscó caracterizar las estrategias de conservación de recursos, mediante la eficiencia de reabsorción de nutrientes, entre los diferentes grupos funcionales de las especies vegetales dominantes en tres comunidades del Desierto Sonorense. El análisis de las concentraciones de N y P, su eficiencia y suficiencia de reabsorción, y las relaciones estequiométricas durante la senescencia de las hojas en diferentes grupos funcionales, se utilizó para entender algunas de las características que permiten prefigurar su nicho biogeoquímico (sensu Peñuelas et al. 2008, 2019). Nuestro estudio aporta mayores elementos al esclarecimiento de los procesos estequiométricos y ecológicos que afectan las relaciones biogeoquímicas e interacciones ecológicas por diferentes grupos funcionales en el Desierto Sonorense.
Concentraciones foliares en el gradiente de aridez. En el extremo más árido del gradiente (SJ), se encontraron las concentraciones más altas para N foliar de los tres sitios estudiados. Diversos autores correlacionan de manera positiva la concentración de N en las hojas y la aridez (West & Skujins 1978, Wright & Westoby 2002). De mayor a menor aridez, las concentraciones foliares de nitrógeno en hojas verdes fueron decreciendo y aumentando en su variabilidad. Las concentraciones foliares que se han reportado en metaanálisis globales, incluyendo 753 especies a lo largo de China, son cercanas a 18.4 ± 0.5 mgN g-1 (Han et al. 2005, Vergutz et al. 2012), lo que significan valores menores que los promedios encontrados para los tres sitios en este estudio. Al igual que en hojas verdes, también en senescentes encontramos una mayor concentración de N que el promedio global de 9.74 ± 0.33 mgN g-1 (Han et al. 2005, Vergutz et al. 2012), aún en el sitio menos árido que promedió la menor concentración (12.8 ± 8.7 mgN g-1 en CH).
Los patrones de concentración fueron diferentes con el P. En hojas verdes la mayor concentración promedio ocurrió en ambos extremos del gradiente, que resultaron mayores al promedio global de 1.4 ± 0.01 mgP g-1 (Han et al. 2005, Kobe et al. 2005, Vergutz et al. 2012). Una alta concentración de P se ha relacionado con hojas de rápido crecimiento y caducifolias (Drenovsky et al. 2019), tal como se presentó en el gradiente estudiado (Tabla 2). De manera similar, el P en hojas senescentes fue mayor en el extremo más árido (1.5 ± 0.7 mgP g-1 en SJ), también más alto al promedio global de 0.8 ± 0.01 mgP g-1 reportado previamente (Han et al. 2005, Kobe et al. 2005, Vergutz et al. 2012).
El hecho de que las concentraciones foliares sean altas en los grupos funcionales en un sitio puede deberse a una alta concentración inicial por diversos mecanismos de asignación de recursos, incluida una mayor eficiencia de reabsorción de nutrientes, mayor disponibilidad del nutriente en el suelo, o a mecanismos de incorporación que faciliten su absorción como puede ser el establecimiento con asociaciones simbióticas y/o micorrícicas (Bonfante & Genre 2010). Sin embargo, una mayor concentración de P en hojas senescentes, puede no resultar en mayor aprovechamiento por las comunidades microbianas o las mismas plantas, dadas las condiciones impredecibles de la precipitación. La estrategia de estas especies ante las condiciones ambientales en las que se desarrollan debe ser estudiada con mayor detalle, para comprender mejor los mecanismos que controlan las interacciones entre la concentración de nutrientes en la hojarasca, la eficiencia de reabsorción y las estrategias biogeoquímicas e interacciones ecológicas con los microorganismos en el suelo (Brant & Chen 2015).
Eficiencia de reabsorción. Se observó una disminución en la eficiencia de reabsorción de N y P en promedio para las especies en sitios con condiciones de mayor aridez. En lo que respecta a N, la menor eficiencia de reabsorción en condiciones de mayor aridez fue significativamente diferente (SJ = 35.1 ± 20.8 %; Tabla 3). De manera similar, la eficiencia de reabsorción de P fue menor en promedio en especies del sitio con mayor aridez (SJ = 20.4 ± 33.9 %; Tabla 3). Se ha reportado menor eficiencia de reabsorción de N con la aridez, mientras que la concentración en la hoja senescente aumenta (Bertiller et al. 2005), acorde a lo encontrado en este estudio (Tabla 3). Sin embargo, eso contrasta con las diferencias obtenidas en la eficiencia de reabsorción en otros estudios. Por ejemplo, especies de clima mediterráneo con diferentes ecotipos no mostraron cambios en la eficiencia de reabsorción, aun cuando los reservorios de nutrientes fueron diferentes entre sitios (Pugnaire & Chapin 1993), lo mismo que encontró Aerts (1996) incluso en perennifolias, sugiriendo que la eficiencia de reabsorción no representa una estrategia de conservación de recursos en las especies estudiadas. Lo anterior también coincide con este trabajo, dado que encontramos diferencias en la eficiencia de reabsorción para las mismas especies entre los sitios (Tabla 4).
La eficiencia de reabsorción de N y P se modifica en las especies y consecuentemente en los sitios a lo largo de un gradiente de aridez. Sin embargo, nuestros datos coinciden en que no hubo una tendencia hacia la mayor conservación de nutrientes en sitios de mayor aridez, dada la menor eficiencia de reabsorción de N y P. Es posible, que la menor eficiencia de reabsorción promedio de las hojas en el sitio de mayor aridez, se compense por su mayor concentración foliar inicial, lo que significa que la cantidad de nutriente reabsorbido (al menos en el caso del N), sería muy similar entre los sitios del gradiente, aun cuando los nutrientes que llegan al suelo a través de la hojarasca fueran disímiles.
Es claro que la eficiencia de reabsorción de nutrientes tiene implicaciones directas sobre la disponibilidad de nutrientes y la fisiología del individuo en las especies (Aerts 1996), mientras que la suficiencia y estequiometría de la reabsorción tendrá impactos en la tasa de descomposición del suelo (Killingbeck 1996, Chávez-Vergara et al. 2018) y los ciclos biogeoquímicos. Las especies más suficientes son aquellas que retienen las menores cantidades de nutrientes en sus hojas senescentes, comúnmente iguales o menores a 7 mgN g-1 para N y 0.5 mgP g-1 para P (Killingbeck 1996). Las altas concentraciones de nutrientes en hojas senescentes encontradas en este estudio, particularmente en las leguminosas que incluyen tanto fijadoras como no fijadoras (Tabla 2), sugieren la posibilidad de una reabsorción incompleta y consecuentemente una mayor concentración y disponibilidad regresando al suelo (Schlesinger & Pilmanis 1998). Una disponibilidad de nutrientes más alta en el suelo puede beneficiar a microorganismos, bacterias y/o micorrizas, que a su vez pueden incrementar las formas disponibles de N y P para las plantas en la comunidad (Bonfante & Genre 2010, Adams et al. 2016). Una característica relevante en el área de estudio y en general de la región más subtropical del Desierto Sonorense (Shreve & Wiggins 1964, Turner et al. 1995, Castellanos et al. 2010) es la abundancia de especies de leguminosas, lo que sugiere su importancia en la biogeoquímica de sus comunidades vegetales y muy probablemente de igual manera en otras regiones subtropicales y áridas del país donde abundan.
Al menos en algunas especies, la menor eficiencia de reabsorción de nutrientes pudo haber sido consencuencia de un mecanismo activo durante la senescencia. En algunas especies se observó un aumento en la concentración de P durante la senescencia. El incremento de nutrientes en la hoja senescente y la consecuente disminución en la eficiencia de reabsorción, particularmente en el caso del P, suele suceder en sitios donde hay una gran cantidad de formas disponibles en el suelo (Milla et al. 2006). Otros han sugerido que este puede ser un mecanismo de conservación del nutriente en sitios en donde su disponibilidad edáfica es escasa (Pugnaire & Chapin 1993). Es importante reconocer que al ser mayor la concentración de N y P en hojas senescentes de las especies y tipos funcionales en el sitio de mayor aridez, permitiría reforzar su papel e importancia como nodrizas y facilitadoras, tal como se ha propuesto con anterioridad (Bertness & Callaway 1994).
La menor eficiencia y suficiencia de reabsorción en el extremo más árido del gradiente pudiera considerarse como una estrategia de las plantas para mantener niveles de facilitación en el funcionamiento de la microbiota del suelo, su sobrevivencia y crecimiento, y mayores tasas de descomposición, mineralización y eventual disponibilidad (Zechmeister-Boltenstern et al. 2015). Como consecuencia, la hojarasca en este sitio, al ser rica en nutrientes, tenderá a descomponerse más fácilmente, aumentar la materia orgánica y la fertilidad del suelo, e impactar de manera positiva la biogeoquímica del ecosistema (Austin 2011). El papel facilitador (Callaway 1995, Franklin et al. 2016) y la posible diferenciación de nichos biogeoquímicos en las plantas (Peñuelas et al. 2008, 2019), deberá ser explorado con mayor detalle, pues aquí encontramos que esto puede estar sucediendo.
Estequiometría ecológica y reabsorción. El cociente estequiométrico foliar cambió durante el proceso de reabsorción. El cociente brinda una idea de la fisiología de las especies en el medio que habitan y de su nicho biogeoquímico (Peñuelas et al. 2008, 2019). El cociente C:N en la hoja verde hace referencia al tiempo de vida y la tasa fotosintética, mientras que la relación N:P y C:P están relacionadas al crecimiento (Vrede et al. 2004). Las diferencias en el incremento de las proporciones de C:N en las hojas senescentes, sugiere que una mayor concentración de N fue solubilizado y reabsorbido en los sitios menos áridos, mientras que el C, al formar parte de moléculas de difícil hidrólisis se reabsorbe en menor cantidad (McGroddy et al. 2004). Una consecuencia de las altas proporciones de C:N en las hojas senescentes es la baja calidad en la hojarasca (Aerts 1997, Melillo et al. 1982), lo que puede sugerir una lenta descomposición en los sitios menos áridos (CH y SR), así como mayor calidad y tasas de descomposición en el sitio más árido (SJ), dado su menor cociente.
En contraste, el cociente N:P disminuyó en las hojas senescentes respecto de las hojas verdes al compararse en todos los sitios. Las diferencias estequiométricas en N:P no fueron significativas entre los extremos del gradiente (SJ y CH), pero sí mayor en el sitio intermedio (SR) (Figura 3b). El menor promedio en N:P durante la senescencia indica que el N fue proporcionalmente más reabsorbido que el P, aun cuando su reabsorción aumentó en promedio en especies de los sitios menos áridos, como lo indica la mayor proporción C:P de hojas senescentes (Figura 3c). Una característica común fue la gran variabilidad en los cocientes estequiométricos en todos los sitios, lo que sugiere la diversidad en las respuestas que pueden ejercer los individuos y las especies sobre los procesos biogeoquímicos del suelo a lo largo de un gradiente de aridez.
La eficiencia y suficiencia de reabsorción modificaron los patrones estequiométricos que se ven reflejados en las concentraciones de la hoja senescente y posteriormente en la hojarasca, de manera destacada en las leguminosas (aquí diferenciada como tipo funcional), que parecen no responder a estrategias de conservación de recursos. Las diferencias encontradas durante la senescencia entre los tipos funcionales, en particular en las leguminosas, afectaron la estequiometría de la hojarasca, lo que deberá influir en los procesos biogeoquímicos de los sitios. Lo anterior significa que el comportamiento de los tipos funcionales dominantes en las comunidades, influirá de manera importante en la magnitud y dirección de futuros desacoplamientos estequiométricos de diferentes niveles tróficos, tal como ha sido descrito en relación al incremento de aridez regional debido al cambio climático global (Delgado-Baquerizo et al. 2017).
Apenas empezamos a vislumbrar la gran importancia de la integración entre las respuestas de reabsorción y la estequiometría ecológica en la porción verde (por encima del suelo, plantas y relaciones planta-herbívoros) y café (bajo el suelo, hojarasca-comunidades microbianas y micorrízicas-suelo), por lo que deberán ser prioritarios mayor número de estudios en estos temas, incluyendo a las especies, tipos funcionales y ecosistemas áridos y semiáridos subtropicales del país y el mundo.











 text new page (beta)
text new page (beta)



