Los fructanos son polímeros de fructosa que utiliza la industria alimentaria como ingrediente o como sustrato debido a sus propiedades físicas, químicas, tecnológicas y funcionales (Moreno-Vilet et al. 2017). Las aplicaciones de estos compuestos naturales dependen de sus cualidades como polímero. Estas cualidades se analizan por medio de métodos analíticos directos e indirectos para conocer su composición y concentración del perfil de carbohidratos de los fructanos, y estimar su grado de polimerización (GP). Estas propiedades y estructuras que desarrollan los fructanos son variables durante las diferentes etapas de desarrollo de cada especie vegetal (Pollock & Jones 1979). Así, es común que, al procesarse materia prima en estadios contrastantes de madurez, tanto en la investigación como en la industria, se imposibilita tener una composición homogénea entre lotes (Camacho-Ruíz 2016) y por ello se altera la reproducibilidad de los resultados (Pollock 1986, Ronkart et al. 2007). Con independencia del nivel tecnológico disponible sin tomar en cuenta la biología y fisiología de la planta utilizada como materia prima, los procesos de extracción de fructanos serán más caros y el producto será de menor calidad (Aires-Barros & Azevedo 2017).
Los fructanos que desarrolla cada especie de planta tienen estructuras diferentes debido a los enlaces que unen a sus monómeros fru-β (2-1), fru-β (2-6) y glu-β (2-6), a su eficiencia metabólica y a la capacidad de elongarse y ramificarse con la adición de residuos fructosil (Pollock & Cairns 1991, Livingston et al. 1993, Kaur & Gupta 2002, Olvera et al. 2007).
En el género Agave los fructanos son almacenados en el tallo durante el periodo vegetativo (Aguirre-Rivera et al. 2001, Babb & Haigler 2001), y la concentración máxima de fructanos almacenados se alcanza al iniciarse la fase reproductora, momento considerado como el estado de madurez fisiológico pleno (MFP) e ideal para su aprovechamiento (Aguirre-Rivera et al. 2001). Después de dicho estadio los fructanos acumulados son hidrolizados en monosacáridos (glucosa y fructosa) y removidos del tallo para cubrir las demandas energéticas de la reproducción, tanto asexual (producción de hijuelos) como sexual (inflorescencia o escapo floral, frutos y semillas) (Wang & Nobel 1998); así, la cantidad de mono y disacáridos en la planta dependerá del intercambio dinámico entre sus órganos, según la etapa fisiológica en que se encuentre (Claassen et al. 1991). La mayor cantidad de estos azúcares libres en la planta de maguey se registra en la etapa de crecimiento y durante la reproducción (Godínez-Hernández 2017); por lo tanto, el estado fisiológico y el órgano vegetal determinarán la concentración y la composición de los fructanos extraídos.
En los agaves la MFP y óptima para la extracción de fructanos se identifica en el campo por el adelgazamiento del cogollo, y porque las puntas de sus últimas pencas por desplegar se encuentran por debajo del ápice de las ya desplegadas (Aguirre-Rivera et al. 2001). Este estado fisiológico en el campo es reconocido como maguey “quiotillo” para el caso de Agave salmiana Otto ex Salm-Dyck, y como maguey “novillo” para A. tequilana F.A.C. Weber (Godínez-Hernández et al. 2016a).
Actualmente la industria de los fructanos de Agave utiliza como materia prima a las cabezas (conjunto del tallo y bases foliares) completas de la especie A. tequilana, con una madurez que depende principalmente de los años de establecida la plantación, con hijuelos de tamaño variable (Arrizon et al. 2010). Esta madurez fisiológica variable de la materia prima y los compuestos presentes en las bases de penca de la cabeza, contaminan los fructanos, y por ello requieren de ser refinados con solventes, filtración con carbón activado, con membranas de intercambio aniónico y catiónico (Alvarado et al. 2014), y con técnicas de ultra y nanofiltración con membranas de celulosa hidrofílica. Estos procesos de refinación se requieren también para separar mono y disacáridos (fructosa y sacarosa), para cumplir la normativa NOM-002-SAGARPA-2016 (SAGARPA 2016), que en suma no deben superar el 20 %, el doble de lo permitido para los fructanos comerciales de achicoria (Cichorium intybus L.) (Camacho-Ruíz 2016, Godínez-Hernández et al. 2016b), así como otros compuestos minoritarios (minerales, clorofilas, fibra, ceras, etc.), con la finalidad de incrementar su calidad y pureza (Moreno-Vilet et al. 2017, Reynoso-Ponce et al. 2017). Además con la finalidad de justificar dichos procesos de refinación se ha propuesto la separación de los fructanos íntegros en fracciones de alto o bajo GP para destacar las características físicas, químicas, tecnológicas y funcionales que aporta cada fracción para diversos propósitos en la industria alimentaria; así, los fructanos con GP > 10 son incorporados a diversos productos alimentarios como emulsificantes y sustitutos de grasa, y los fructooligosacáridos (FOS) con GP entre 3 y 10 se añaden como endulzante bajo en calorías (Olvera et al. 2007, García-Gamboa et al. 2018). Sin embargo, ya se ha documentado la extracción de fructanos íntegros con escasa variabilidad, de magueyes con MFP, es decir, con rendimiento máximo, extraídos de los tallos de manera simple y orgánica (Godínez-Hernández 2017), sin que se contaminen con otros compuestos presentes en las bases foliares, que tengan que ser eliminados posteriormente.
Así, el objetivo del presente trabajo fue conocer la composición y concentración del perfil de carbohidratos (GP) de los fructanos extraídos de tallos de Agave salmiana (ASE) y A. tequilana (ATE) con similar estado de MFP y proceso de extracción simplificado, así como de fructanos comerciales de A. tequilana (ATC) y de Cichorium intybus (IC).
Materiales y métodos
Diseño experimental. Se utilizó un diseño experimental completamente al azar con dos tratamientos (dos especies, A. salmiana y A. tequilana), y seis repeticiones (seis tallos utilizados como unidades experimentales de cada especie). Las variables evaluadas fueron, la composición de carbohidratos por HPLC y su grado medio de polimerización por HP-SEC. Además, como contraste complementario se analizaron fructanos comerciales de A. tequilana y de Cichorium intybus
Reactivos. Para la identificación cualitativa de carbohidratos por cromatografía en capa fina de alta resolución (HPTLC, por sus siglas en inglés), para la cuantificación de carbohidratos por cromatografía líquida de alta resolución (HPLC, por sus siglas en inglés) y para la estimación del GP por cromatografía de exclusión de tamaño de alta resolución (HP-SEC, por sus siglas en inglés) se utilizaron estándares de fructosa, glucosa, sacarosa, nistosa, 1-cestosa, inulina y FOS de achicoria y dextranos (Sigma-Aldrich®, San Luis Misuri, EE.UU.), maltopentosa, maltohexosa y maltoheptosa (Supelco, EE.UU.). Para contrastarlos, se utilizaron fructanos comerciales de A. tequilana (Inufib TM, Jalisco, México) (ATC) y fructanos comerciales de achicoria (Cichorium intybus) (Orafti® Synergy 1, Tienen, Bélgica) (IC) declarados como una mezcla de FOS e inulina (~ 92 %).
Extracción de fructanos de tallos de ASE y ATE. Se procesaron seis cabezas de cada especie de maguey, todas con MFP, esto es, con la máxima concentración de fructanos (Aguirre-Rivera et al. 2001). Las cabezas de maguey mezcalero potosino ASE en estadio quiotillo fueron recolectadas en agostaderos ejidales del municipio de Charcas, San Luis Potosí; las cabezas del maguey tequilero (ATE) se cosecharon en una plantación de Arandas, Jalisco. A todas las cabezas les fueron retiradas las bases foliares y solamente el tallo fue utilizado para la extracción del concentrado de fructanos (CF), el cual, está compuesto de 85 % fructanos mayores a 3 GP (Godínez-Hernández 2017) y en menor proporción cenizas, mono y disacáridos y saponinas.
El CF de los tallos de ambas especies se obtuvo de acuerdo con el método desarrollado por Godínez-Hernández et al. (2016c): a partir de trozos del tallo, con un extractor centrífugo comercial (International EXS, CD, México, México) se generó un jugo primario (JP), y por compresión del bagazo residual con una prensa hidráulica de 20 t (Urrea 2471, Jalisco, México) se generó un jugo secundario (JS); ambos jugos se estabilizaron independientemente en baño María (53 °C/1hr); posteriormente se eliminaron los minerales insolubles (rafidios de oxalatos de calcio) mediante centrifugación a 2,000 rpm/15 min/0 °C (DAMON PR-6000, California, EE. UU.) y el sobrenadante se evaporó parcialmente a 42 °C a baja presión (152 mm Hg) hasta alcanzar 50 ° Brix (J. P. Selecta Gastrovac, Barcelona, España). Finalmente, los jugos concentrados se secaron en un horno de aire forzado (36 h / 55 °C) (Shel-Lab FX-14, Oregón, EE. UU.) y el CF en escamas resultante de cada tallo se pulverizó y almacenó en recipientes herméticos libres de humedad a temperatura ambiente; este proceso se realizó de manera independiente para cada unidad experimental (tallo).
Contenido de cenizas totales del CF. Las cenizas totales se obtuvieron mediante calcinación de las muestras. Para ello se pesaron 5 g del CF libre de humedad y se calcinaron en una mufla (LINDBERG SB, 51844, Wisconsin, EE. UU.) a 550 °C por 2 h. Las muestras calcinadas se colocaron en un desecador para alcanzar la temperatura ambiente y posteriormente fueron pesadas para obtener el porcentaje de cenizas totales mediante la diferencia entre el peso inicial y final.
Identificación cualitativa de carbohidratos por HPTLC. Se prepararon soluciones de las muestras de fructanos (ASE, ATE, ATC e IC) y estándares de 20 mg/mL en agua destilada y se atomizaron 2 µL de forma semiautomatizada (CAMAG LINOMAT, 5 Muttenz, Suiza). Como fase estacionaria se utilizaron placas de sílica Nano-SIL NH2/UV254 de 20 ×10 cm (Macherey-Nagel, Alemania) y como fase móvil una mezcla de n-butanol, metanol, agua y ácido acético 50:25:20:1 (v/v/v/v) con tiempo de corrida de 2 h. Posteriormente la placa fue calentada a 180 °C /10 min (Corning™ PC-420, Nueva York, EE.UU.) y atomizada con una mezcla de etanol, ácido sulfúrico y anisaldehído, 18: 1: 1 (v/v/v); enseguida se calentó a 180 °C /10 min y se revelaron sus componentes a luz visible (400-700 nm).
Cuantificación de carbohidratos por HPLC. La cuantificación de carbohidratos se hizo en un HPLC (Agilent Technologies, serie 1100, California, EE. UU.) con un detector de índice de refracción a 50 °C. Como fase estacionaria se utilizó una columna de intercambio iónico HP-Aminex 87-C (7.8 × 300 mm) (Bio Rad, Philadelphia, EE. UU.) a 75 °C, y como fase móvil se utilizó agua grado HPLC (Fermont®, México) con flujo de 0.5 mL/min, y tiempo de corrida por muestra de 20 min. Los carbohidratos se identificaron por comparación con los tiempos de retención de los estándares de referencia (Godínez-Hernández et al. 2016c).
Estimación del GP por HP-SEC. El perfil de distribución del peso molecular de los carbohidratos y GP basado en su longitud de cadena fue estimado por medio de cromatografía de alta resolución por exclusión de tamaño, por medio de un equipo HPLC (Waters-E2695, Massachusetts, EE.UU.) acoplado a un detector con índice de refracción (RI-2414). Como fase estacionaria se utilizó una precolumna y una columna Ultrahydrogel™ DP 120 A (7.8 × 300 mm) a 61.7 ° C y amplitud de exclusión de tamaño de 100 a 5,000 KDa (Waters, Massachusetts, EE.UU.). La fase móvil fue agua HPLC tridestilada, filtrada (con membranas de polisulfona de 0.45 µm), y acidificada con ácido fosfórico hasta alcanzar pH = 4.5-5, con un flujo de 0.36 mL/min (Moreno et al. 2017). Para el control del funcionamiento del sistema y el análisis de datos se utilizó la ChemStation con el software Agilent OpenLAB. El cálculo del peso molecular promedio en número (Mn), del peso molecular promedio en peso (Mw), el índice de dispersión (D), el grado de polimerización de fructanos (GPn) y del peso promedio del grado de polimerización de fructanos (GPw) se realizó con las fórmulas detallas por Moreno et al. (2017). Todos los análisis fueron llevados a cabo por triplicado y los resultados se presentan en promedios con su desviación estándar (X ± DE).
Resultados
Rendimiento de fructanos. La morfología de las cabezas de ASE y ATE en MFP es muy diferente; la cabeza de ASE es de mayor tamaño (79.90 kg), con menor número de bases de penca y más suculenta; las cabezas de ATE son de menor tamaño (44.20 kg), con mayor número de hojas y menos suculentas (Tabla 1). La proporción de tallo en la cabeza fue 8.30 y 22 % para ASE y ATE respectivamente; de cada tallo se obtuvo en promedio 976.5 y 1611.60 g de CF, respectivamente.
Tabla 1 Rendimiento de fructanos extraídos en laboratorio de tallos de Agave en madurez fisiológica plena, n = 6.
| Variable | A. salmiana | A. tequilana |
|---|---|---|
| Peso de la cabeza fresca (kg) | 79.90 ± 21.30 | 44.20 ± 14.00 |
| Peso del tallo fresco (kg) | 6.70 ± 2.10 | 9.80 ± 3.30 |
| Concentrado de fructanos (g) | 976.50 ± 235.90 | 1,611.60 ± 630.50 |
Identificación cualitativa de carbohidratos. El perfil de bandas generado por el análisis cromatográfico de las muestras de fructanos y FOS (Figura 1) evidencia que todas tienen nistosa, 1-cestosa y sacarosa. En la parte inferior de la cromatoplaca se observan los fructanos con GP >10 como una banda oscura. Se confirmó que la muestra de inulina comercial (carril 8) es una mezcla de FOS y fructanos. En las muestras de fructanos de tallos de ATE (carriles 10-13) y de ASE (carriles 15-18) se observan componentes similares, como se esperaría al ser especies del mismo género y extraídos de la misma forma.
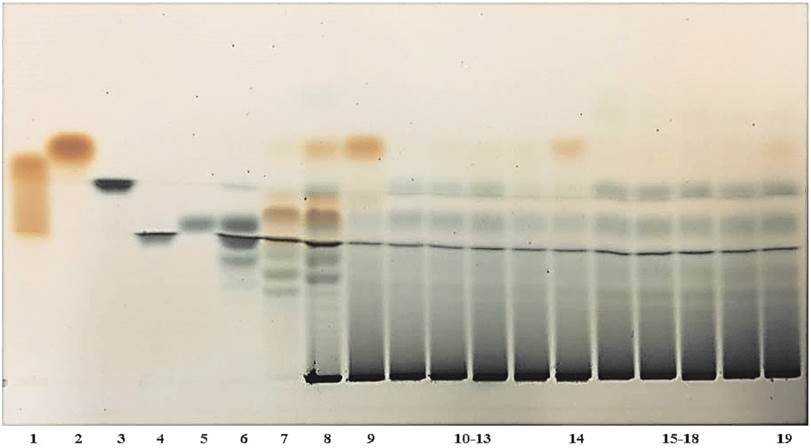
Figura 1 Cromatoplaca de estándares de referencia y de muestras de fructanos (1: glucosa, 2: fructosa, 3: sacarosa, 4: nistosa (GP = 4), 5: 1-cestosa (GP = 3), 6: FOS de A. tequilana, 7: FOS de inulina, 8: inulina comercial, 9: fructanos comerciales de A. tequilana, 10-13: fructanos de tallos de ATE , 14: fructanos de jugo secundario de A. tequilana, 15-18: fructanos de tallos de ASE, 19: fructanos de jugo secundario de A. salmiana).
Cuantificación de carbohidratos por HPLC. En la Tabla 2 se resumen los resultados de la cuantificación de cenizas totales y carbohidratos por HPLC. El contenido de fructanos > 4 GP fue de 943.31, 923.29, 889.92 y 805.65 mg /g CF para ATC, ATE, ASE e IC; todos los fructanos tuvieron fructosa pero en menor cantidad los ASE (5.50 mg/g CF) y ATE (3.93 mg/g CF), de igual forma la glucosa estuvo presente en todas las muestras pero en la IC se registró la mayor cantidad que las demás (25.89 mg/g CF).
Tabla 2 Composición (mg/g base seca) de carbohidratos del concentrado de fructanos (HPLC) y contenido de cenizas por calcinación.
| Compuesto | TR (min) | IC | ATC | ATE | ASE |
|---|---|---|---|---|---|
| ("Inulina") GP > 4 | 7.74 | 805.65 ± 72.89 | 943.31 ± 26.82 | 923.29 ± 37.01 | 889.92 ± 44.79 |
| 1-Cestosa | 8.62 | 112.64 ± 25.56 | 12.51 ± 5.79 | 14.08 ± 5.26 | 23.56 ± 4.72 |
| Sacarosa | 9.62 | 34.49 ± 3.10 | 6.39 ± 0.48 | 10.99 ± 5.28 | 32.63 ± 8.82 |
| Glucosa | 11.65 | 25.89 ± 7.21 | 2.34 ± 1.55 | 2.91 ±1.33 | 3.58 ± 0.72 |
| Fructosa | 15.85 | 18.45 ± 9.43 | 19.53 ± 9.44 | 3.93 ± 0.86 | 5.50 ± 1.98 |
| CH solubles | 997.12 | 984.08 | 955.20 | 955.19 | |
| Cenizas | - | 2.02 | 10.3 | 16.4 | 24.7 |
TR: tiempo de retención; CH: carbohidratos, Media ± DE; n = 6.
Estimación del GP por HP-SEC. La estimación del GP por HP-SEC (Tabla 3) y la caracterización del perfil de distribución (Figura 2A) evidencian que la inulina comercial es una mezcla de fructanos con GP > 10 (51.75 %) y de FOS con GP entre 3 y 10 (43 %), GP de 14.46 e índice de dispersión (D) de 1.63.
Tabla 3 Distribución del peso molecular (g/mol), grado de polimerización y contenido de azúcares de diferentes tipos de fructanos por HP-SEC.
| Fructanos | Mn | Mw | GP | GPw | D | GP > 10 (%) | FOS GP 3-10 (%) |
Mono y disacáridos (%) |
|---|---|---|---|---|---|---|---|---|
| IC | 2,362.13 ± 16.78 | 3,866.34 ± 17.99 | 14.46 ± 0.10 | 23.74 ± 0.11 | 1.63 ± 0.00 | 51.75 ± 0.34 | 43.00 ± 0.37 | 5.26 ± 0.04 |
| ATC | 2,976.58 ± 29.93 | 3,992.79 ± 14.71 | 18.25 ± 0.18 | 24.52 ± 0.08 | 1.35 ± 0.01 | 75.25 ± 0.76 | 16.19 ± 0.47 | 8.56 ± 0.30 |
| ATE | 3,439.32 ± 26.73 | 4,258.69 ± 22.99 | 21.11 ± 0.16 | 26.16 ± 0.14 | 1.24 ± 0.01 | 83.74 ± 0.92 | 14.12 ± 0.26 | 2.14 ± 0.77 |
| ASE | 2,651.10 ± 49.77 | 3,459.50 ± 135.91 | 16.20 ± 0.31 | 21.20 ± 0.84 | 1.30 ± 0.03 | 73.20 ± 0.47 | 26.10 ± 0.87 | 0.70 ± 0.41 |
Mn: peso molecular medio en número; Mw: peso molecular medio en peso; GP: grado de polimerización promedio; GPw: grado de polimerización promedio en peso; D: índice de dispersión. Media ± DE n= 4.
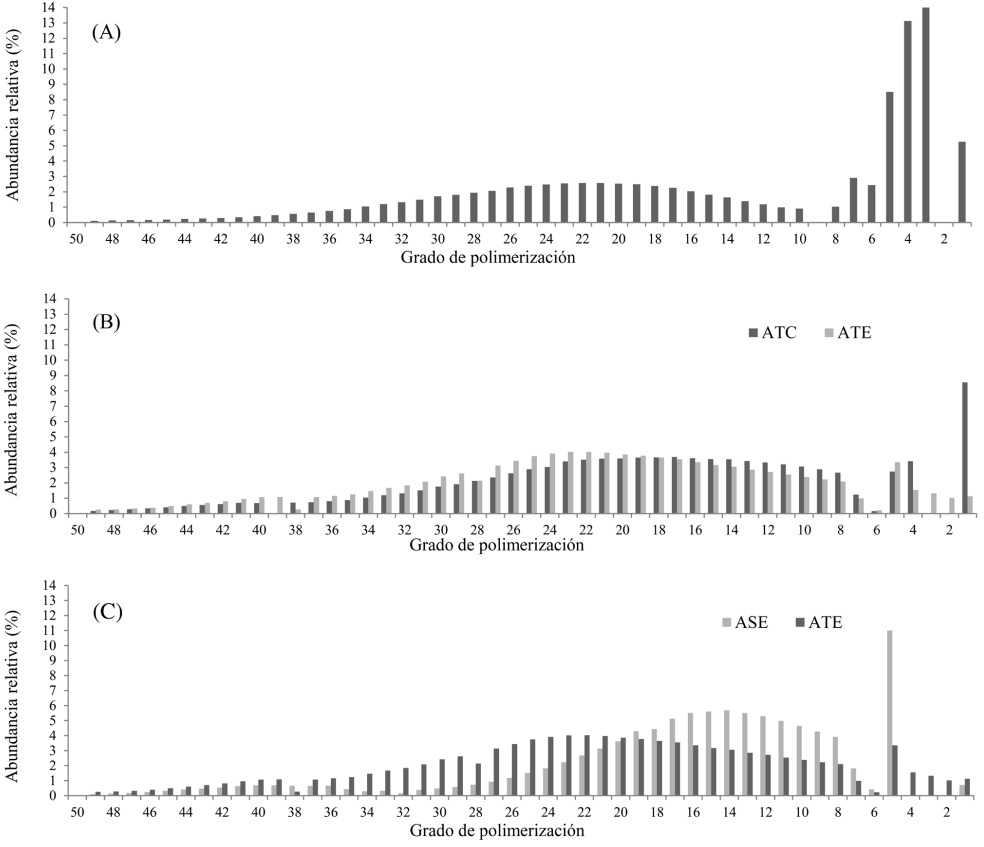
Figura 2 Distribución del GP obtenido con HP-SEC. (A) Inulina comercial (Sinergy 1®), (B) Fructanos comerciales de A. tequilana (ATC) y extraídos en el laboratorio (ATE); (C) Fructanos de A. salmiana (ASE) y A. tequilana (ATE) extraídos en el laboratorio.
En los fructanos de tallos con similar MFP (quiotillos) de ASE (Tabla 3) se registró el menor porcentaje (0.7 %) de sacáridos libres (sacarosa, glucosa y fructosa) de todos los fructanos evaluados, un GP de 16.2, proporción de fructanos con GP > 10 fue 73.2 % y 26.1 % de FOS.
En el presente estudio se documenta por primera vez que los fructanos extraídos sin refinamientos de los tallos de ATE con MFP tienen un GP (21.11), superior a ASE (16.20) bajo las mismas condiciones de extracción, y una proporción 83.74 % de fructanos con GP > 10 y 14.12 % de FOS; en contraste, los fructanos ATC presentaron GP de 18.25, la proporción de fructanos con GP > 10 fue de 75 % y de FOS 16.19 % (Figura 2B). Los fructanos ATC presentaron 8.56 % de mono y disacáridos.
Al comparar los fructanos obtenidos de tallos de ASE y ATE en MFP e igual proceso de extracción (Figura 2C), la proporción de fructanos con GP > 10 fue de 83.74 % y de 73.2 % para ATE y ASE respectivamente, y de FOS fue de 26.1 % y 14.2 % para ASE y ATE, respectivamente.
Discusión
Rendimiento de fructanos. Los resultados mostrados en el presente trabajo confirman los obtenidos por Godínez-Hernández et al. (2016c) sobre el rendimiento de fructanos extraídos de tallos de ASE y ATE en MFP y proceso de extracción similar, y también la estimación indirecta de que ASE contiene aproximadamente sólo la mitad de los azúcares fermentables que ATE (Aguirre-Rivera et al. 2001). Esta mayor riqueza en carbohidratos de ATE y su mayor proporción del tallo explican el rendimiento de CF totales mayor que el de ASE.
Identificación cualitativa de carbohidratos por HPTLC. En las muestras de fructanos obtenidos del JS de cada especie de maguey (carriles 14 para ATE y 19 para ASE) se presentó en la parte superior de la cromatoplaca una banda intensa color marrón (fructosa), en contraste con la muestra de fructanos extraídos del JP. Esto sugiere que en el proceso de extracción establecido por Godínez-Hernández et al. (2016c), la manipulación del bagazo podría hidrolizar una parte de los fructanos; sin embargo, la cantidad de fructosa que se registra en el JS es mucho menor que en los fructanos industriales de ATC (carril 9), extraídos normalmente de cabezas, con las bases foliares más ricas en sacáridos. En los carriles 7 y 8 correspondientes a FOS e inulina de achicoria, se observa una banda similar a la glucosa, lo cual se confirma con el contenido mayor de glucosa libre cuantificada por HPLC, pero no precisamente se debe a enlaces β 2-6 de glucosa residual en los fructanos, pues se sabe que los fructanos de inulina desarrollan enlaces fructosil β 2-1. La HPTLC es una técnica básica y rápida de barrido para discriminar entre fructanos de Agave y de achicoria, así como para evaluar su calidad comercial (Alvarado et al. 2014).
Cuantificación de carbohidratos por HPLC y cenizas. En los fructanos de Agave se encontró menor contenido de 1-cestosa que en IC. En estudios previos con la misma metodología se obtuvieron resultados por HPLC para ASE (Godínez-Hernández et al. 2016c) y para ATE (Godínez-Hernández et al. 2016a) concordantes con los obtenidos en el presente estudio, con lo cual se confirman estos resultados. En el CF de tallos de plantas en MFP y con el método simple de extracción los fructanos > 4 GP en ASE y ATE fueron superiores a 850 mg/g de MS (Tabla 2) y a los publicados por Mancilla-Margalli & López (2006) extraídos con etanol de distintas especies de maguey (360 a 740 mg/g MS), pero similares a los fructanos comerciales de IC y de ATC extraídos de manera industrial. En cuanto al contenido de fructosa, en ASE y ATE fue inferior al rango presentado por Mancilla-Margalli & López (2006) de 40 a 130 mg/g MS, para varias especies de maguey. Esta discrepancia seguramente se debe al indicador de madurez cronológico impreciso que usaron dichas autoras.
El contenido de cenizas por g de CF fue mayor en los fructanos de ASE y ATE (24.70 y 16.4 mg/g CF respectivamente) que en los de IC y ATC (2.02 y 10.30 mg/g CF, respectivamente), ya que los desmineralizan en su extracción industrial (Tabla 2); en cambio, a los fructanos de ASE y ATE sólo se le decantaron los cristales de oxalato de calcio por centrifugación. Por ello, el contenido de cenizas de ASE y ATE fueron inferiores a los publicados por Godínez-Hernández et al. (2016a) para muestras de fructanos de ambas especies, pero sin la separación de los cristales de oxalato de calcio.
Estimación del GP por HP-SEC. Los resultados de ATC (GP:18.25, fructanos > 10 GP: 75.25 % y FOS de 3-10 GP: 16.19 %) son similares a los encontrados por Moreno et al. (2017) para fructanos de cabezas de A. tequilana con 6 años de plantado (GP: 18.19, fructanos > 10 GP 76.48 % y FOS de 3-10 GP 3-10: 17.9 %); pero en cabezas de esta especie con 4 años de plantada el GP fue de sólo 14.48, el GP > 10, 58.95 %, con 33.58 % de FOS y 7.48 % de monosacáridos. Dichos autores (Moreno et al. 2017) también evaluaron dos fructanos comerciales y encontraron las siguientes diferencias entre ellos: GP de 14.98 y 19.49, GP > 10 de 64.94 y 76.62 %, y FOS de 26.36 y 17.52 %, y contenido de monosacáridos de 8.71 y 5.86 %. Estos resultados evidencian la heterogeneidad del GP que se puede encontrar en los fructanos comerciales de A. tequilana, debido a la fuerte variación en madurez fisiológica de la materia prima.
El GP del CF de tallos de plantas con MFP de ASE fue de 16, en concordancia con los resultados de Godínez-Hernández (2017) para la misma especie procesada con igual enfoque metodológico, pero discrepan de los resultados de Michel-Cuello et al. (2012) para esta misma especie (GP de 8); esta discrepancia es atribuible a las diferencias en el método de extracción y en el órgano utilizado para su extracción (cabeza completa y madurez variable).
El GP de los CF de tallo con MFP de ATE fue superior (21.11) al de ASE (16.20) bajo las mimas condiciones de extracción y análisis, incluso que ATC; además fue superior su rendimiento de fructanos por kg de materia prima que el de ASE. Estas dos especies son importantes en nivel nacional, ATE es la especie que mayormente se cultiva en México para la producción de tequila y ASE es la especie silvestre de mayor distribución en el territorio mexicano, y ambas se han estudiado para múltiples propósitos como aguardiente, jarabe de maguey, fructanos, etc. La ventaja de ASE sobre ATE es que sus productos tienen mayores posibilidades de certificarse como orgánicos por ser espontáneo las condiciones naturales en las que crece.
Según López et al. (2003), el GP de los fructanos de A. tequilana oscila entre 3 y 29 unidades. Por su parte, Mancilla & López (2006) estimaron el GP de diversas especies del género Agave distribuidas en México con edad cronológica similar (años de la plantación), y presentan valores para A. tequilana de Jalisco (18.12) y de Guanajuato (7.13), para A. angustifolia de Oaxaca (31.75) y de Sonora (13.07), para A. potatorum (15.34) y A. cantala (11.17) de Oaxaca, y para A. fourcroydes (6.66) de Yucatán. Estas diferencias sólo pueden atribuirse parcialmente a la especie, pues no se controló la edad fisiológica ni otras características de la materia prima analizada.
La estimación del grado de polimerización también depende de la metodología analítica utilizada (HP-SEC y MALDI-ToF-MS o Matrix-Assisted Laser Desorption/Ionization Time-Of-Flight Mass Spectrometry); Moreno-Vilet et al. (2019) contrastaron ambas metodologías con muestras de fructanos de Agave y encontraron que ambas metodologías son equivalentes. Sin embargo, los resultados del GP fue diferente entre las muestras de Agave pues oscilaron entre 5 y 16 GP debido a la madurez variable de Agave tequilana.
Los fructanos ATC presentaron mayor proporción de mono y disacáridos. En efecto, Alvarado et al. (2014), en tres marcas de fructanos comerciales de la misma especie, registraron entre 3.1 y 7.5 % de mono y disacáridos, lo cual evidencia la heterogeneidad al respecto en los fructanos del mercado. Cabe resaltar que, al utilizar exclusivamente el tallo del maguey de ATE como materia prima para la extracción de sus fructanos, se redujo el porcentaje de azúcares libres (2.14 %), sin necesidad de añadir etapas de purificación al proceso, como sucede con las marcas comerciales.
Ambos tipos de fructanos extraídos en laboratorio (ASE y ATE) presentaron menor proporción de monosacáridos que los fructanos de ATC, lo cual podría deberse a una menor hidrólisis con nuestra extracción en laboratorio, pero es más claro que este resultado se debió al uso exclusivo del tallo del maguey como materia prima para su extracción, pues con ello se evita incorporar sacáridos de las bases de penca al CF. La NOM-002-SAGARPA-2016 (SAGARPA 2016) establece un límite máximo de 5 % de sacarosa, 6 % de glucosa y 9 % de fructosa en los fructanos comerciales de maguey; así, se permite hasta 20 %, esto es, el doble de lo tolerado para los fructanos comerciales de achicoria (10 %).
Si bien la metodología HP-SEC había resultado adecuada para la obtención del GP y del perfil de distribución del peso molecular de diversas fuentes de fructanos (Moreno-Vilet et al. 2017), también resultó ser una herramienta robusta para distinguir los fructanos estandarizados de A. salmiana de los de A. tequilana, por lo que podría ser utilizada para caracterizar los fructanos de diversas especies de maguey, aunque su reproducibilidad analítica dependerá de que los magueyes sean elegidos con similar MFP, como lo realizado en este estudio.
En la actualidad hay gran interés por fraccionar los fructanos de acuerdo con su GP, para añadir las fracciones a diversos productos alimentarios, por sus diferencias físicas, químicas, tecnológicas y funcionales (García-Gamboa et al. 2018). Sin embargo, utilizar el concentrado de fructanos íntegro para evaluaciones analíticas y biológicas, es decir, sin separaciones ni purificaciones, puede ser un método práctico y escalable también válido para la industria alimentaria. A la vez, en las evaluaciones biológicas experimentales con los fructanos íntegros o naturales se tendría una mezcla compleja de diferentes longitudes de cadena, propias de la síntesis metabólica de la planta, las cuales podrían ejercer beneficios en el organismo complementarios entre sí, con la ventaja de ofrecer una mayor diversidad de sustratos fermentables para el amplio consorcio de bacterias colónicas, y posiblemente una mayor diversidad de respuestas fisiológicas en el organismo.
Las diferencias muy marcadas en el GP registrado en los fructanos de Agave por otros autores, fueron atribuidos a factores abióticos que repercuten en el crecimiento del maguey en las regiones propias de cada especie (Mancilla-Margalli & López 2006). Es razonable que existan diferencias entre especies, aunque compartan el mismo ambiente; sin embargo, los cambios en composición que tiene una planta de maguey durante un ciclo de vida son de mucha mayor magnitud que los que pueden deberse a factores climáticos estacionales o de más corto plazo. Por ello se debe recurrir al concepto de MFP para estandarizar la composición de la materia prima, y considerar como tal sólo a los tallos para evitar la contaminación de los extractos con mono y disacáridos y otras sustancias indeseables. Así, la supuesta edad de la planta, que en realidad se refiere al tiempo que ha estado plantada, debe descartarse como criterio de madurez, pues además es inaplicable a poblaciones silvestres (Aguirre-Rivera et al. 2001, Godínez-Hernández 2017).
La elección de magueyes en MFP, el uso exclusivo de sus tallos y la extracción orgánica, permiten la cosecha (cultivada) o recolección (silvestre) de materia prima estandarizada, para la producción de fructanos de Agave de mejor calidad, de composición y GP homogéneo, reproducible y propio de cada especie. Se confirmó que el GP de fructanos de tallos de plantas en MFP de Agave salmiana es 16 y se presenta por primera vez un GP de 21 para A. tequilana











 text new page (beta)
text new page (beta)



