Pouteria campechiana (Kunt) Baehni (zapote amarillo, canistel, k´anixté), pertenece a la familia Sapotaceae, es un árbol monopodial (tipo terminalia) perennifolio con altura comúnmente de 12 a 20 m. Los frutos son cosechados cuando adquieren tonalidad amarilla (Azurdia 2005), el epicarpio es delgado y la pulpa de color amarilla, de forma ahusada o redonda con una protuberancia en la parte distal; con semillas de color café oscuro brillante, con un hilo rugoso grande en la parte ventral, con tonalidad clara (Martín & Malo 1978, Awang-Kanak & Bakar 2018). En cuanto a su cultivo, los árboles provienen de semilla y es posible la propagación asexual mediante estacas (Chiamolera et al. 2014). Necesita un clima tropical o subtropical para crecer y se ha encontrado desde el nivel del mar hasta los 1,400 m snm. Con respecto al riego, debe ser moderado y puede tolerar una estación seca, larga y calurosa (Orwa et al. 2009, Lim 2013).
Se encuentra distribuida en regiones tropicales y subtropicales del mundo como en América, países del este de África y en el sur de Asia (Awang-Kanak & Bakar 2018, Pennington & Sarukhán 2016). En lugares como en Florida, EUA, el fruto se consume en fresco y procesado y se presenta en ferias locales en forma de helado, licuado y pan (Lim 2013).
Uno de los centros de origen de esta especie es México y América Central (Awang-Kanak & Bakar 2018); además, la familia Sapotaceae fue ampliamente conocida por la gran civilización Mexica de América, como lo han mostrado figuras de la fruta en ropajes y vasijas de barro (González 2004).
Dentro de los atributos alimenticio y medicinal encontramos que los metabolitos secundarios que contiene el fruto de P. campechiana presentan potente actividad antioxidante en correlación con su contenido de polifenoles (Aseervatham et al. 2019). Los frutos inmaduros son utilizados para controlar la diarrea y las semillas se utilizan como remedio para las úlceras; las hojas tienen propiedades antiinflamatorias y la decocción de la corteza del tronco se usa como antipiréticos en México, así como para tratar erupciones cutáneas en Cuba (Lim 2013). El árbol se ha manejado como cobertizo para la planta de café, y se puede explotar como madera y tablones o vigas en la construcción (Pennington & Sarukhán 2016). El adquirir materia prima (e.g. frutos, hojas, corteza y/o plantas) de P. campechiana es problemático debido a que no se reportan plantaciones, se localiza en cultivos de traspatio y debe ser estudiada en aspectos como la propagación.
La propagación por semilla es una alternativa para mantener la diversidad genética (Iriondo-Alegría 2001), la interpretación y estandarización de las pruebas de germinación son importantes para asegurar la calidad de la semilla, la germinación y el desarrollo inicial de la planta y de la raíz (Mourão & Beltrati 2000). La reactivación metabólica durante la germinación hasta la emergencia de la radícula y la plúmula (Forcella et al. 2000, Bewley et al. 2013), dependen del uso eficiente de los nutrientes de la semilla (Baskin & Baskin 2014), además esta respuesta es controlada por factores internos (reservas de la semilla, posición y condiciones del embrión) y por las condiciones del ambiente externo (humedad, temperatura, luminosidad, entre otras) (Melrose et al. 2015).
En las semillas que presentan testa gruesa la germinación puede retardarse, por lo que es necesario romper o eliminar la testa (escarificar). Por ejemplo, en P. campechiana, Amoakoh et al. (2017), reportan que la escarificación parcial aumenta el porcentaje de germinación en un 14 %.
Amoakoh et al. (2017) reportaron que la latencia de la semilla y la baja germinación de P. campechiana son los principales problemas para su uso en las prácticas agroforestales. Andrade et al. (2002), en la misma especie, evaluaron el efecto de la temperatura en el porcentaje de germinación, y la mayor germinación (89 %) la obtuvieron a 30 ºC.
Existen investigaciones en especies tropicales sobre la relación del tamaño de la semilla con la germinación y la emergencia, las cuales concluyen que las características físicas de las semillas pueden influir en la respuesta germinativa (Del Amo et al. 2002). En otras familias como Amaranthaceae, el tamaño de la semilla afecta la germinación y supervivencia de las plántulas (Kadereit et al. 2017), por lo tanto, las características físicas de las semillas tienen relación con la germinación. Además, la utilización de diferentes sustratos para el desarrollo de las plántulas es importante, debido a que cumplen funciones de soporte, aireación y retención de agua y pueden o no intervenir en el proceso de nutrición de las plantas (Franzmeier et al. 2016).
La agrolita (perlita) es un sustrato inerte, poroso y que retiene la humedad, el cual permite revisar la semilla durante el proceso de germinación; este tipo de sustrato también es utilizado en la industria de los alimentos, en la producción de microgreens (plántulas utilizadas en la cocina gourmet, por su alto contenido nutrimental) (Di Gioia et al. 2017). Valdés-Rodríguez et al. (2013) reportan que un sustrato altamente poroso mejora la aireación de las semillas, lo que favorece el porcentaje y la velocidad de germinación; Mondragón-Valero et al. (2017) mencionan que un sustrato poroso proporciona mayor desarrollo del tallo y un aumento del peso fresco total del sistema radical.
Pouteria campechiana por sus características ornamentales, medicinales y alimenticias, es un fruto tropical que puede tener un gran potencial en el mercado de exportación, por lo que es necesario conocer su comportamiento en la germinación y desarrollo para establecer las condiciones necesarias en la propagación de planta con calidad en longitud, diámetro del tallo y número de hojas. Por lo tanto, se planteó el objetivo de evaluar la relación entre el tamaño del fruto y las características físicas de la semilla, y si la combinación de escarificación y posición de siembra tiene impacto en el porcentaje y velocidad de germinación; además, si el uso de diferentes sustratos tiene efecto en el desarrollo de las plántulas (e.g. longitud de la planta, diámetro del tallo y número de hojas).
Materiales y métodos
Material vegetal. La colecta se realizó en un huerto localizado en el municipio de Jiutepec, Morelos, México (18° 52' 47.6" N 99° 10' 43.3" W); se colectaron 200 frutos semimaduros de un árbol de cultivo en condiciones de traspatio (Evangelista-Lozano et al. 2019) y se trasladaron en una hielera (Colleman, Modelo: 3000000152, material poliuretano, medidas: 66 × 37 × 36 cm) (26 ºC al interior de la hielera) al laboratorio donde se llevó a cabo la experimentación (vivero ubicado en Yautepec, Morelos, con coordenadas 18° 49' 29.1" N 99° 05' 45.8" W, a 1,106 m snm, temperatura promedio de 28 °C, humedad relativa (HR) 55 ± 10 % intensidad luminosa 2,000 ± 200 luxes). En este lugar se mantuvieron los frutos dos horas para su adaptación a las condiciones climáticas del vivero y para que perdieran el calor generado por el fruto dentro del embalaje (FAO 1993).
Los frutos se colocaron en una mesa, donde cada fruto fue enumerado y pesado (MediaDeta DS-5); se clasificaron arbitrariamente en tres grupos: chicos de 92.59 ± 21.48 g, medianos de 151.04 ± 24.08 g y grandes de 277.35 ± 79.71 g. Se obtuvieron las características físicas: el diámetro ecuatorial, el diámetro polar, la circunferencia y las diagonales 1 y 2 (González & Pita 2001) (Figura 1) y la resistencia a la penetración (firmeza), datos que brindaron una descripción sobre su forma y tamaño, para poder analizar la relación que pudiera existir entre el tamaño del fruto y las características físicas de las semillas.
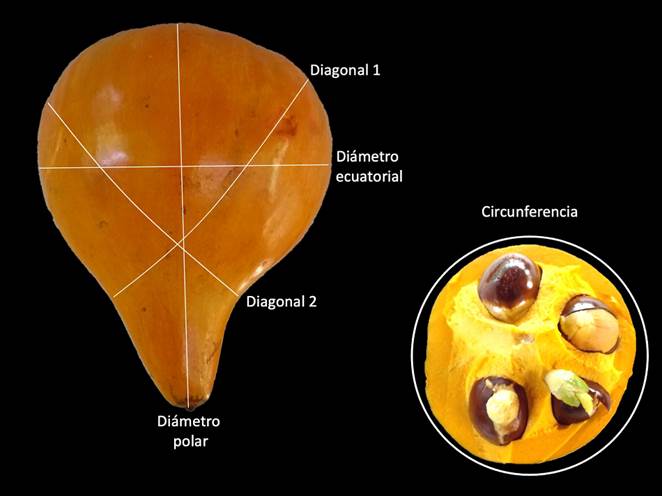
Figura 1 Fruto de Pouteria campechiana. Ilustración de la medición de diámetro polar y ecuatorial, diagonales y circunferencia.
Los frutos de cada grupo fueron diseccionados para separar las semillas de la pulpa y realizar el análisis de las características físicas de las semillas por fruto. Cada semilla fue pesada y enumerada con la misma nomenclatura del fruto que provenía, en caso de contener más de una semilla se separaba con guión y número sucesivo al número de semillas. Todas las semillas fueron lavadas y se les retiraron los restos de pulpa, de tal forma que la siembra se realizó a las 24 horas después de la cosecha.
Se seleccionaron 50 semillas de cada tamaño de fruto y se midieron en mm las dimensiones longitud (L), el ancho (A) y el espesor (E) con base en el supuesto de que las semillas son similares a un elipsoide donde L > A > E.
Germinación de las semillas. Se analizó el efecto de la escarificación y posición de la semilla en la germinación de los tres tamaños de frutos (chicos, medianos y grandes), y debido a que no hubo diferencia estadística significativa entre las dimensiones de las semillas, se mezclaron y se tomó el lote como un todo para la prueba de germinación. Cada tratamiento (escarificada-posición horizontal; escarificada-posición vertical; no escarificada-posición horizontal; no escarificada-posición vertical) incluyó 5 semillas con cuatro repeticiones en un diseño de bloques. Las unidades experimentales (una semilla por maceta) dentro de cada bloque fueron homogéneas, y los bloques fueron diferentes entre sí con el mismo número de repeticiones. Se utilizaron macetas negras de un litro de capacidad con sustrato agrolita calibre mediano (Agrolita, México) humedecido con 180 ml de agua potable cada 7 días y después de la germinación cada tercer día. La agrolita es un sustrato inerte, altamente poroso y retenedor de agua, lo que permitió observar el efecto de la escarificación y posición de la semilla durante la germinación, sin que otra variable interfiriera en el proceso.
La escarificación fue manual para cada semilla y consistió de un golpe con la parte opuesta al filo de un cuchillo (Victorinox Modelo 6.7833.B; mango negro ergonómico de polipropileno, navaja de acero inoxidable con punta ancha sin filo de 7.5 cm de largo y 1.2 cm de ancho, Switzerland, Suiza) en la zona basal y otro golpe en la zona distal de la semilla para romper la testa, y con la punta del cuchillo se desprendió sin maltratar los cotiledones. En la posición de siembra horizontal (Figura 2A) la región dorsal de la semilla quedó expuesta 1.5 ± 0.3 cm y la región ventral (zona del hilo) permaneció en contacto con el sustrato; en la posición de siembra vertical la región distal quedó expuesta 1.5 ± 0.3 cm (Figura 2D), el criterio para evaluar la germinación fue cuando la radícula midió 1 cm.

Figura 2 Semillas de Pouteria campechiana. A. semilla sin escarificar que muestra la testa (t) lisa de color café brillante, la zona dorsal (d) y zona ventral (v); B. semilla escarificada (es) en que se exponen los cotiledones (c); C. semilla sin escarificar en la que se muestra el hilo (h) de color café claro opaco y de textura porosa, la región basal (rb) y la región distal (rd); D. ilustración de la posición (horizontal y vertical) el hilo está por debajo del límite del sustrato (ls).
Las macetas se mantuvieron en una charola flexible plana sin perforaciones (56 cm largo × 26 cm ancho × 5 cm de profundidad) y se colocaron 7 macetas por charola. Las macetas se mantuvieron durante 48 días en invernadero a una temperatura de 25 ± 5 °C, 55 ± 10 % HR, intensidad luminosa 2,000 ± 200 luxes, el fotoperiodo fue de ≈ 13 h luz y 11 h oscuridad, éste último, fue por la época del experimento cuando el fotoperiodo es largo (marzo, abril, mayo y junio).
La germinación se evaluó mediante el porcentaje y velocidad de germinación. El primero es la germinación final de una población de semillas que han germinado en un momento dado (Bewley et al. 2013, Pariona et al. 2017), siguiendo la ecuación:
Porcentaje de germinación (%) = (Ga × 100) / M, donde Ga es la germinación acumulada para cada tratamiento hasta la última evaluación y M el total de semillas sembradas.
La velocidad de germinación se evaluó para calcular la rapidez en la germinación de semillas de cada tratamiento, para ello se contó diariamente la germinación de las semillas durante 48 días (hasta que no germinaron más) y se calculó con la ecuación:
Velocidad de germinación = ∑ (n/t), donde n es el número de semillas que germinaron en el tiempo t, y t son los días después de la siembra (dds) (Maguire 1962, Feizi et al. 2012).
Desarrollo de las plántulas. Una vez concluidos los experimentos de germinación (48vo día), se procedió con el experimento del desarrollo de las plántulas, para esto se pusieron a germinar paralelamente 180 semillas en agrolita con los mismos tratamientos especificados en el experimento de germinación, y permanecieron en las mismas condiciones. Estas fueron utilizadas para evaluar el desarrollo de las plántulas mediante el crecimiento de la longitud de planta, diámetro del tallo y número de hojas, en los sustratos agrolita y sustrato mezcla (mezcla de turba (Berger Serie BP, Canadá), vermiculita (ACCIMIN S.A. de C.V., México) y agrolita en relación 3:1:1 v/v, pH 5.8, porosidad 86 %).
Los tratamientos fueron, en sustrato agrolita: escarificada-posición horizontal, escarificada-posición vertical, no escarificada-posición horizontal, no escarificada-posición vertical, estas mismas condiciones de escarificación y posición de siembra fueron utilizadas en el sustrato mezcla. Por cada tratamiento se emplearon cinco plántulas, con cuatro repeticiones, en un diseño de bloques; el trasplante se realizó en bolsas de polietileno negras calibre 400 de 18 L de capacidad (Polietilenos del Sur, México), el riego fue con agua potable cada tercer día (400 ml); el último dato, que se utilizó para las comparaciones, se registró a los 90 ddt (días después del trasplante).
Análisis estadístico. Para cada variable de respuesta se realizó un análisis de varianza (ANDEVA) de una vía y posteriormente un análisis de comparaciones múltiples de Tukey (p ≤ 0.05). En todos los casos los datos siguieron una distribución normal y hubo homocedasticidad de los residuales. Se utilizó el software InfoStat (Di Rienzo et al. 2008).
Resultados
Características físicas de los frutos. Los frutos de P. campechiana tuvieron de 2 a 5 semillas. El peso promedio de los frutos chicos fue de 92.59 ± 21.48 g; los frutos medianos de 151.04 ± 24.08 g y los frutos grandes 277.35 ± 79.71 g. Entre los valores de tamaño (diámetro polar, ecuatorial, circunferencia y diagonales 1 y 2) hubo diferencias estadísticas significativas entre los tres grupos de frutos (p ≤ 0.05); la firmeza fue semejante entre los tamaños del fruto (5.5 N a 16 h después de la cosecha; Tabla 1).
Tabla 1 Algunas características físicas del fruto semimaduro de Pouteria campechiana.
| Características físicas | Tamaño del fruto | ||
|---|---|---|---|
| Chico | Mediano | Grande | |
| Diámetro ecuatorial (cm) | 9.0 ± 1 a | 10.6 ± 0.7 b | 12.9 ± 1.4 c |
| Diámetro polar (cm) | 10.9 ± 1.2 a | 13.2 ± 1.4 b | 15.5 ± 1.8 c |
| Circunferencia (cm) | 16.7 ± 1.6 a | 19.9 ± 1.3 b | 24.4 ± 3.1 c |
| Diagonales1 (cm) | 11 ± 2.9 a | 12.2 ± 0.8 b | 14.6 ± 1.6 c |
| Diagonales2 (cm) | 10.6 ± 2.2 a | 12.3 ± 0.8 b | 14.7 ± 1.4 c |
| Firmeza (N) | 5.5 | 5.5 | 5.5 |
| Peso promedio (g) | 92.59 ± 21.48 a | 151.04 ± 24.08 b | 277.35 ± 79.71 c |
Todos los resultados se expresaron como el valor medio ± desviación estándar. En filas las medias con una letra diferente son estadísticamente diferentes (p ≤ 0.05); del ANDEVA: diámetro ecuatorial (F = 55.74, p < 0.0001), diámetro polar (F = 46.24, p < 0.0001), circunferencia (F = 70.01, p < 0.0001), diagonal 1 (F = 65.95, p < 0.0001), diagonal 2 (F = 80.11, p < 0.0001)
Características físicas de la semilla. Las semillas de los frutos de los tres tamaños no presentaron diferencias estadísticas significativas (p ≥ 0.05), fueron semejantes en largo (48.5 ± 2.38 mm, p = 0.69), ancho (24.7 ± 1.64 mm, p = 0.73) y espesor (21.1 ± 1.44 mm, p = 0.82) (Tabla 2), la forma fue elipsoide (Figura 2).
Tabla 2 Algunas características físicas de la semilla de Pouteria campechiana.
| Características físicas de las semillas |
Tamaño del fruto | ||
|---|---|---|---|
| Chico | Mediano | Grande | |
| Largo (mm) | 48.82 ± 2.18 b | 48.5 ± 2.38 b | 47.5 ± 1.83 a |
| Ancho (mm) | 25.4 ± 1.86 a | 24.7 ± 1.64 a | 24.9 ± 1.34 a |
| Espesor (mm) | 21.68 ± 1.84 a | 21.1 ± 1.44 a | 22.48 ± 1.28 a |
| Peso (g) | 15.19 ± 1.78 a | 16.5 ± 1.1 a | 16.1 ± 1.89 a |
Características de las semillas con testa. Todos los resultados se expresaron como el valor medio ± desviación estándar. En filas medias con una letra común no son significativamente diferentes (p ≥ 0.05), del ANDEVA: Largo (F = 0.36, p = 0.6989), Ancho (F = 0.31, p = 0.7359), Espesor (F = 0.28, p = 0.8248), peso (F = 0.66, p = 0.5173).
Germinación de las semillas. La escarificación manual y posición de siembra tuvo efecto en el porcentaje y velocidad de germinación; la mayor germinación se obtuvo en las semillas no escarificadas-posición horizontal y el menor porcentaje en semillas escarificadas y no escarificadas sembradas en posición vertical (Figura 3).
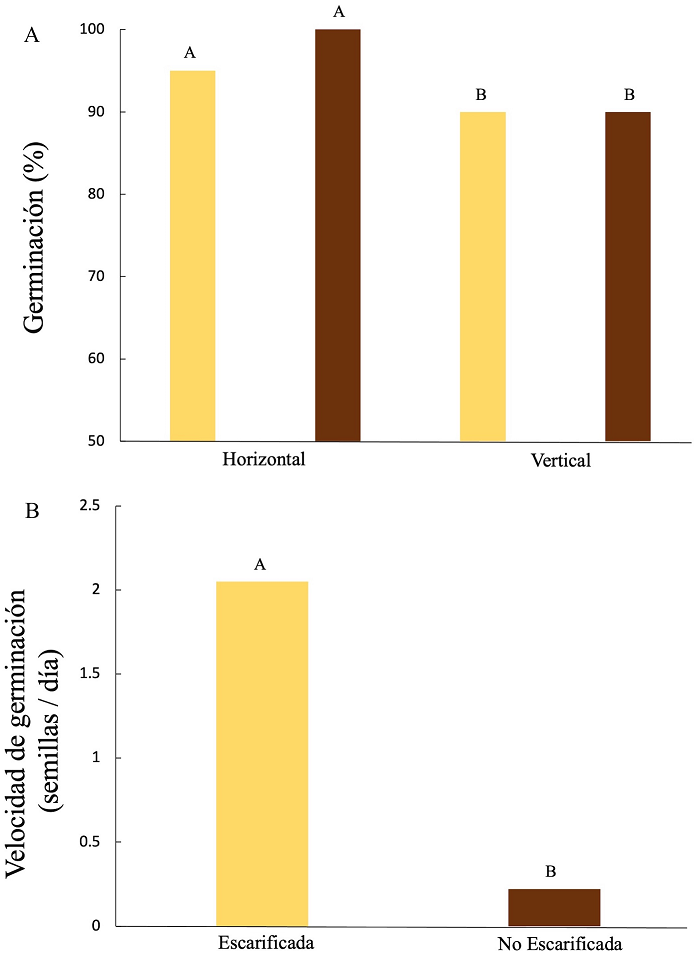
Figura 3. Porcentaje y velocidad de germinación de semillas de Pouteria campechiana con y sin escarificar en diferente posición. Letras diferentes arriba de las barras, significa que existe diferencia estadística significativa entre los tratamientos (p≤ 0.05). Del ANDEVA: A) Porcentaje de germinación, posición de siembra (F= 112.65, p< 0.001), Escarificación (F= 0.06,n p= 0.81); B) Velocidad de germinación, posición de siembra (F= 0.0012, p= 0.97), Escarificación (F= 4279.45, p< 0.0001).
La velocidad de germinación fue mayor en las semillas escarificadas, el número de semillas germinadas por día fue de 2.05 y hubo diferencia estadísticamente significativa con las no escarificadas (0.22 semillas germinadas/día) (p ≤ 0.05; Figura 3). Aunque la velocidad de germinación fue diferente, al final del experimento de germinación tanto las semillas escarificadas como las no escarificadas alcanzaron porcentajes de germinación entre el 90 y 100 %.
Respuesta de las plántulas al trasplante en la longitud, diámetro del tallo y número de hojas. La mejor respuesta de las plántulas después del trasplante, en cuanto a la longitud, fue en las que se trasplantaron en agrolita y que provenían de semillas escarificadas y sembradas en posición horizontal (19.68 cm), seguidas de las sembradas en posición vertical (19.65 cm), las que menor longitud tuvieron fueron las plántulas trasplantadas en sustrato mezcla, y que provenían de semillas no escarificadas y en posición vertical (15 cm) (p ≤ 0.05; Tabla 3).
Tabla 3 Análisis de varianza del desarrollo de las plántulas a los 90 después de la siembra (longitud de la plántula, diámetro de tallo, número de hojas) de Pouteria campechiana
| Condición de desarrollo | Longitud de la planta (cm) |
Diámetro del tallo (cm) |
Número de hojas | |||||
|---|---|---|---|---|---|---|---|---|
| Sustrato | Escarificación | Posición de siembra | ||||||
| agrolita | escarificada | horizontal | 19.68 a | 0.39 a b | 7.21 a | |||
| agrolita | escarificada | vertical | 19.65 a | 0.40 a | 6.70 a b | |||
| agrolita | no escarificada | horizontal | 17.6 a b | 0.34 b c | 6.0 a b c | |||
| agrolita | no escarificada | vertical | 16.1 b c | 0.30 c d | 5.0 c | |||
| sustrato mezcla | escarificada | horizontal | 18.65 a | 0.42 a | 6.85 a b | |||
| sustrato mezcla | escarificada | vertical | 17.74 a b | 0.37 a b | 5.74 a b c | |||
| sustrato mezcla | no escarificada | horizontal | 15.6 b c | 0.34 b c | 5.40 b c | |||
| sustrato mezcla | no escarificada | vertical | 15 c | 0.28 d | 6.2 a b c | |||
| Test: Tukey Alfa = 0.05, Medias con una letra común no son significativamente diferentes (p ≤ 0.05); e.e: error estándar | n = 20; e.e.= 0.59 | n = 20; e.e.= 0.35 | n = 20; e.e.= 0.01 | |||||
| FV | F | p | F | p | F | p | ||
| Modelo | 9.25 | < 0.0001 | 14.45 | < 0.0001 | 4.68 | < 0.0001 | ||
| Condición de desarrollo | 9.25 | < 0.0001 | 14.45 | < 0.0001 | 4.68 | < 0.0001 | ||
El mayor diámetro del tallo lo presentaron las plántulas trasplantadas al sustrato mezcla y que provenían de semillas escarificadas y sembradas en posición horizontal (0.42 cm); las de menor diámetro del tallo fueron las trasplantadas al sustrato mezcla y que provenían de semillas no escarificadas y en posición vertical (0.28 cm) (p ≤ 0.05; Tabla 3).
El mayor número de hojas lo presentaron las plántulas trasplantadas al sustrato agrolita, provenientes de semillas escarificadas y sembradas en posición horizontal (7.21 hojas), seguido de las sembradas en posición vertical (6.7 hojas), las condiciones con el menor número de hojas fueron las trasplantadas en agrolita y que provenían de semillas no escarificadas y sembradas en posición vertical (5 hojas) (p ≤ 0.05; Tabla 3).
Discusión
En la propagación de P. campechiana no es necesario separar los frutos por peso, ya que las características físicas de las semillas son semejantes, hecho que se demostró en este estudio. Atapattu et al. (2014) indican para esta especie un peso de 175 g (Sri Lanka, temperatura promedio de 29 °C) y Kong et al. (2013) un peso de 118.09 ± 35.48 g (Malasia, temperatura promedio de 28 °C), estos datos de peso del fruto están dentro de los clasificados como frutos medianos en este estudio (30 °C), teniendo en Morelos frutos de mayor tamaño.
De igual manera el diámetro polar y la circunferencia del fruto citado por Kong et al. (2013) fue semejante a lo que se reporta en este estudio como frutos medianos. Sin embargo, no hacen mención del tamaño y número de semillas por fruto, estos datos son importantes para la propagación, ya que con esta información se puede planear cuantos frutos colectar y el número de semilla que se puede obtener de ellos.
Con relación a la firmeza del fruto, en la familia Sapotaceae el ablandamiento de la pulpa del fruto está relacionada con la actividad de la enzima β-galactosidasa, y conforme el fruto pierde firmeza hay actividad de otras enzimas como la pectina-metilesterasa y la poligalacturonasa (Arenas-Ocampo et al. 2003), posiblemente estas enzimas estén relacionadas con la firmeza de P. campechiana y no están relacionadas con el tamaño del fruto. La firmeza es importante ya que facilita la manipulación para el transporte, el troceado de la pulpa y la extracción de semilla, contrario a la firmeza de los frutos maduros (0.76 N) (Evangelista-Lozano et al. 2019), en donde la cáscara y pulpa se vuelven blandos y el fruto se despedaza con la manipulación, por lo que los frutos semimaduros son recomendables para la obtención de semilla.
En cuanto al tamaño de la semilla, algunos reportes se podrían comparar con las semillas extraídas de frutos chicos de este estudio, tal es el caso de Lim (2013) que indica medidas de 20 - 53 mm de largo y de 12.5 - 32 mm de ancho, estas semillas derivan de frutos con diámetro polar de 7.0 - 12.5 cm y diámetro ecuatorial de 4.0 - 7.5 cm. Por otro lado, Awang-Kanak & Bakar (2018) informan un largo de semilla de 50.17 ± 4.70 mm y ancho de 16.50 ± 1.50 mm provenientes de frutos con diámetro polar de 7.4 ± 0.21 cm y diámetro ecuatorial de 5.4 ± 0.6 cm. Se puede deducir que existe un amplio intervalo en el tamaño del fruto (diámetro polar y ecuatorial); sin embargo, el tamaño de la semilla fue similar con lo que reportan estos autores.
En algunas especies forestales como en Terminalia ivorensis, Butea monosperma y Acacia mellifera es importante el tamaño y el peso de las semillas, ya que a mayor biomasa muestran altos niveles de nutrientes en los cotiledones, esto incrementa la viabilidad, germinación, supervivencia y crecimiento de las plántulas (Khurana & Singh 2001). Sakai & Sakai (1995) mencionan que el tamaño de la semilla posiblemente está relacionado con las condiciones ambientales favorables como la humedad que impera durante la polinización y fecundación; en el caso de P. campechiana la fructificación fue por autopolinización y las semillas tuvieron tamaños similares y presentaron alta germinación, posiblemente se debió a que se sembraron poco después de haber sido extraídas del fruto y conservaron la humedad (Tabla 2).
El porcentaje de germinación fue mayor en semillas sembradas en posición horizontal; sin embargo, la mejor respuesta a la velocidad de germinación estuvo relacionada con la eliminación de la testa, observándose diferencias estadísticamente significativas entre escarificadas y no escarificadas. Amoakoh et al. (2017) documentaron el mayor porcentaje de germinación en semillas parcialmente escarificadas de P. campechiana (67 %), comparado con las totalmente escarificadas (63 %), y en las no escarificadas 57 %; estos autores no mencionan qué tipo de fruto utilizaron para extraer las semillas, ni a los cuántos días de la cosecha sembraron. Estos resultados muestran un porcentaje de germinación menor a los documentados en esta investigación, donde la siembra se realizó a las 24 horas después de la cosecha y la escarificación justo antes de la siembra.
Las semillas escarificadas mostraron mayor velocidad de germinación, esto se podría explicar debido a que, al no presentar testa, seguramente embebieron agua más rápido, iniciando el proceso de germinación. Bewley (2013) explica que la fase I de la germinación se caracteriza por la rápida absorción de agua lo que provoca el hinchamiento y cambio de forma de la semilla; durante esta fase, se inicia la síntesis de proteínas a partir del mARN existente, y la reanudación de la actividad respiratoria. Como consecuencia, las semillas escarificadas alcanzaron una mayor velocidad de germinación que las semillas no escarificadas.
La latencia física es ocasionada por capas de esclereidas impermeables al agua localizadas en la cubierta de la semilla. Estas capas impiden el paso del agua y las semillas no se embeben. En esta investigación, las semillas sin escarificar presentaron alto porcentaje de germinación (≥ 90 %), lo cual indica que no presentan latencia física debido a que germinan sin escarificación. Según Baskin et al. (2000) son 15 familias de plantas las que presentan latencia física y la familia Sapotaceae no está incluida. El hilo estuvo en contacto con el sustrato ya sea en posición horizontal o vertical, y probablemente es el área de la semilla por donde se absorbió agua, pero a una velocidad menor que en las semillas escarificadas, ya que con o sin escarificación ocurrió la germinación.
La escarificación benefició el brote de la radícula, con lo que se pudo reducir el periodo de germinación y emergencia, de esta manera se podría producir mayor cantidad de planta en menos tiempo, para el beneficio de las prácticas agroforestales.
Después del trasplante, las plántulas con mayor longitud fueron las provenientes de semillas escarificadas (Tabla 3), los resultados indicaron que el uso de la escarificación produjo cambios estadísticamente significativos; la escarificación puede ser de beneficio para obtener plantas de calidad (mayor altura) antes de llevarlas al campo.
También la elección del sustrato forma parte importante en la calidad de las plántulas, reflejado en la longitud y en el follaje entre otras características (Di Gioia et al. 2017). La mayor longitud se obtuvo en las plantas cultivadas en agrolita (19.68 cm), posiblemente la porosidad del sustrato jugó un papel esencial en el desarrollo de la planta; por ejemplo, los suelos franco arenoso, que son porosos proporcionan una mejor aireación (Benvenuti 2003), y en el caso del sustrato agrolita además de ser poroso retiene humedad.
Al igual que en la longitud de la planta, las plántulas provenientes de semillas escarificadas presentaron mayor diámetro del tallo. La escarificación permitió que la radícula y la plúmula no tuvieran impedimento para emerger, lo que se reflejó en una alta velocidad de germinación, y en el diámetro del tallo y longitud de las plántulas. El número de hojas fue una variable que evidenció que el tratamiento de escarificación y posición de siembra fueron factores importantes para el crecimiento de la planta, esto les da potencial para ser trasplantadas en campo (Giuffrida et al. 2015). En el caso de P. campechiana las condiciones de desarrollo en donde se obtuvo el mayor valor de longitud de planta, diámetro de tallo y número de hojas podría ser un indicativo de las condiciones para la producción de plantas.
En la posición de siembra horizontal, la región del hilo y el micrópilo estuvieron en contacto con el sustrato, existe evidencia que el hilo y el micrópilo, entre otras estructuras anatómicas, están involucradas en la entrada de agua en semillas de algunas especies de la familia Fabaceae (Souza & Marcos-Filho 2001), mientras que Jaganathan et al. (2017) concluyeron que el hilo no está involucrado en la entrada de agua al interior de las semillas de Delonix regia (Fabaceae). Álvarez et al. (2009) en semillas de caimito (Chrysophyllum cainito L, familia Sapotaceae), indican que la posición con el micrópilo hacia el sustrato y la escarificación mejoran la germinación. Es probable que la entrada de agua en especies de la familia Sapotaceae y en particular en la semilla de P. campechiana se llevó a cabo a través del micrópilo (posición horizontal, región distal) y que esta de lado opuesto al lugar en el que se encuentra el embrión (región basal) (Figura 2C), mientras que en las sembradas en posición vertical, el área del hilo estuvo en contacto con el sustrato aproximadamente un 60 % y el micrópilo estuvo fuera del sustrato; sin embargo, no se realizó ninguna determinación anatómica experimental en este trabajo para llegar a esta afirmación.
Este estudio contribuye con información para mejorar la producción de plantas de P. campechiana, evidenciando que el tamaño del fruto no influyó en las características físicas de las semillas debido a que se encontraron semillas de tamaño similar en frutos chicos, medianos y grandes. Las semillas mostraron alto porcentaje de germinación con o sin escarificación. Sin embargo, la escarificación aumentó la velocidad de germinación; después del trasplante, esta acción se vio reflejada en un aumento en la longitud de la planta, diámetro del tallo y número de hojas. Además, la posición de siembra horizontal favoreció la germinación y desarrollo de la planta y los sustratos utilizados después del trasplante beneficiaron el crecimiento de las plántulas.











 text new page (beta)
text new page (beta)



