La domesticación es un proceso evolutivo que ocurre a través de la manipulación de la variación fenotípica de diferentes organismos mediante la selección artificial (Darwin 1859), entendiendo a ésta como evolución dirigida por los grupos humanos (Conner 2003). Es así que durante este proceso ocurren cambios morfofisiológicos, genéticos y de historia de vida, generados a través del manejo continuo (Casas & Caballero 1995, Casas et al. 1996, Rendón & Núñez-Farfán 1998, Pickersgill 2007, Purugganan & Fuller 2009).
La selección artificial implica un cambio relativamente rápido en los rasgos seleccionados y en la proporción de los fenotipos de la población que los portan, en comparación con lo que ocurre en condiciones naturales por la acción de la selección natural (Schwanitz 1966, Harlan 1975, Rindos 1984). Durante el proceso de selección humana, generalmente se favorecen muchos rasgos que bajo condiciones naturales no podrían ser mantenidos dentro de las poblaciones (Harlan 1975).
Los cambios en los rasgos seleccionados, sin embargo, no ocurren de manera independiente ya que el fenotipo guarda una compleja relación entre grupos de rasgos que describen módulos morfológicos y funcionales (Pigliucci & Preston 2004), posiblemente debido a la presencia de genes con efectos pleiotrópicos o por ligamiento genético (Murren 2002), evolucionando en conjunto a pesar de no ser intencionalmente favorecidos (i.e., selección inconsciente, Heiser 1988, Mauricio 2001, Burke et al. 2002, Gepts 2004, Futuyma 2005). Estos conjuntos de rasgos pueden identificarse en la medida en que expresen mayor correlación entre ellos que con otros grupos de rasgos dentro del organismo (Klingenberg 2008). Por lo tanto, la evolución de un rasgo en las plantas puede no ser completamente independiente de la evolución de otros, en particular cuando estos forman parte del mismo módulo. Durante la historia de la domesticación, tanto de plantas como de animales, se han seleccionado artificialmente grupos de rasgos de manera dirigida (i.e., selección consciente, Schwanitz 1966, Harlan 1975, Rindos 1984) y con ello, también los rasgos correlacionados que pueden afectar positiva o negativamente la expresión de los rasgos seleccionados (Mauricio 2001, Burke et al. 2002, Conner 2003, Ross-Ibarra et al. 2007). Estos rasgos, en conjunto, constituyen los síndromes de domesticación (Schwanitz 1966, Harlan 1975, Rindos et al. 1980, Rindos 1984, Gepts 2004, Pickersgill 2007), los cuales se han caracterizado para las especies más importantes a nivel mundial (v.g., gramíneas y legumbres). Uno de los síndromes más evidente es el gigantismo, en el cual se promueve un incremento alométrico del rasgo seleccionado en los cultivos, en comparación con los parientes silvestres. Esto se puede apreciar claramente en los frutos del aguacate (Persea americana Mill.), la calabaza (Cucurbita argyrosperma K. Koch), el jitomate (Lycopersicon esculentum Mill.), entre otros. Sin embargo, los rasgos correlacionados, como la disminución de los metabolitos secundarios. pueden acarrear un aumento en la susceptibilidad a patógenos o herbívoros. Al respecto, algunas especies domesticadas evidencian este patrón, tal es el caso del algodón (Gossypium hirsutum L.), el chile (Capsicum annuum L.) o la papa (Solanum tuberosum L.) (Sepúlveda-Jiménez et al. 2003). Precisamente como los síndromes dependen de las especies, el enfoque de integración fenotípica permite entender cómo evolucionan este conjunto de rasgos entre poblaciones sujetas a diferentes formas de manejo y con diferentes intensidades de selección.
La evolución bajo selección artificial de estos módulos morfológicos y funcionales dependerá entonces de la intencionalidad, pero también de la intensidad. En algunos casos, la intensidad de selección es baja y los pequeños cambios en el fenotipo podrían estar encubiertos por las condiciones microambientales, por lo que gran parte de la variación fenotípica estará determinada por factores ambientales, más que genéticos (Bye 1998, Rendón & Núñez-Farfán 1998, Rendón 2000) o también puede resultar del balance entre la intensidad de selección artificial y la magnitud del flujo génico entre las poblaciones silvestres y manejadas (Casas et al. 2007). Se esperaría entonces, que en poblaciones sujetas a una gran intensidad de selección artificial y/o amplio aislamiento entre las poblaciones con mayor y menor manejo, ocurrirá una mayor diferenciación fenotípica y genética entre las poblaciones reflejándose en un gradiente entre poblaciones de silvestres a domesticadas (Rindos 1984, Casas et al. 1994, 2007, González-Insuasti & Caballero 2007, Blancas et al. 2010, Parra et al. 2010).
El análisis del cambio en los rasgos blanco de selección artificial, así como de los rasgos correlacionados, ha sido poco abordado en los estudios de evolución bajo domesticación. Generalmente se analizan las diferencias en aquellos rasgos sujetos a selección artificial consciente entre poblaciones también sujetas a diferentes formas de manejo. Es común que en los análisis se incluyan diversos rasgos que no necesariamente son blanco de la selección artificial, pero son parte de la caracterización del proceso de domesticación (Harlan 1975, Rindos et al. 1980, Rindos 1984, Gepts 2004, Pickersgill 2007).
Para entender cómo cambia este grupo de rasgos en especies sujetas a domesticación, un sistema ideal sería aquel que involucre la coexistencia en simpatría de poblaciones sujetas a diferentes formas de manejo e intensidades de selección artificial y, por tanto, con diferentes grados de domesticación. En este sentido, Anoda cristata (L.) Schltdl. representa uno de esos sistemas de estudio adecuados ya que es una especie con domesticación incipiente y se encuentra distribuida ampliamente en nuestro país (Rendón et al. 2001, Bernal-Ramírez et al. 2011), pero es en la región centro-sur donde se reporta el uso comestible como quelite de las hojas, tallos y botones tiernos (Casas et al. 1994, 1996, Rendón et al. 2001, Rendón & Núñez-Farfán 2001). Particularmente en el Estado de México, Guerrero y Puebla se ha observado su mayor aprovechamiento e incluso comercialización y debido a las diversas formas de manejo que se ejercen sobre sus poblaciones, que ocurren en simpatría, se considera en proceso activo de domesticación.
En un estudio previo de Rendón & Núñez-Farfán (2001) en poblaciones ruderales y arvenses de A. cristata en el Estado de México, se encontró poca variación fenotípica a consecuencia de una baja intensidad de selección artificial. Sin embargo, también se reportaron cambios en los mecanismos de defensa en la respuesta al ataque por herbívoros y variación genética en rasgos reproductivos debidos a la poda, que es una práctica asociada al corte de los tallos tiernos para su consumo como quelite. A partir de estos resultados se sugirió un potencial evolutivo hacia los rasgos de interés de los seres humanos, siempre y cuando aumente la intensidad de la selección artificial.
Los estudios de Casas & Caballero (1995), Casas et al. (1996, 2007) y Bernal-Ramírez et al. (2011), reportaron una mayor intensidad de selección artificial en las poblaciones de A. cristata en el estado de Guerrero, lo que ha producido una divergencia morfológica evidente entre diversas poblaciones de la especie. En el municipio de Alcozauca, Casas et al. (1994, 1996) reportaron el uso y manejo diferencial de las poblaciones de A. cristata a través de la eliminación de individuos indeseados y el mantenimiento de individuos con los rasgos más deseables (i.e., hojas anchas, delgadas, con poco o nada de tricomas), dando como resultado el cambio en la frecuencia de los fenotipos en las poblaciones dentro de agrohábitats. La ocurrencia de un gradiente de domesticación permite examinar el efecto de dicho proceso no sólo sobre los rasgos de interés, sino también sobre aquellos rasgos correlacionados que explicarían la ocurrencia de síndromes de domesticación.
En el presente estudio se analizaron los cambios en rasgos blanco de selección humana (i.e., número de hojas, presencia de tricomas y tamaño de la lámina foliar), y su relación con algunos rasgos correlacionados como la defensa contra herbívoros, susceptibilidad al daño y el éxito reproductivo, entre otros, en poblaciones sujetas a distintas formas de manejo de A. cristata en la región de La Montaña de Guerrero. Debido a que la selección humana está dirigida al uso de la especie como quelite, se espera que las poblaciones con mayor intensidad de selección humana presenten una mayor cantidad de hojas anchas y con menor pubescencia. En cuanto a los rasgos correlacionados, se espera que entre mayor sea la intensidad de manejo, menor será la capacidad de defensa y adecuación individual, debido al costo asociado con una mayor inversión de biomasa foliar. Con el propósito de estimar el efecto de la selección humana en ambos grupos de rasgos, se utilizó el diseño experimental del jardín común, para eliminar los posibles efectos de los ambientes naturales a los que están expuestas las poblaciones consideradas en el presente estudio (Colunga-García Marín 1998, Rendón & Núñez-Farfán 2001, Valverde et al. 2001, Sánchez-Peña et al. 2006, Nuismer & Gandon 2008). Si la selección artificial ha provocado cambios en los rasgos blanco de selección en poblaciones sujetas a manipulación humana, ¿existen cambios en los rasgos correlacionados como son la defensa, susceptibilidad al daño (por herbívoros) y el éxito reproductivo entre poblaciones con diferente forma de manejo?, ¿los cambios en estos rasgos correlacionados corresponden al efecto esperado por la selección humana y consecuentemente, a los síndromes de domesticación?
Materiales y métodos
Especie de estudio. Anoda cristata (L.) Schltdl. Es una malvácea distribuida en todo México, conocida comúnmente como “alache” o “amapolita” (Rendón et al. 2001, Rzedowski & Rzedowski 2001, Bernal-Ramírez et al. 2011). Es una hierba anual o bianual, tiene hojas astadas, flores hermafroditas de pétalos lila a morados y raras veces son blancos (Rzedowski & Rzedowski 2001). Generalmente habita ambientes de vegetación secundaria o perturbada como ruderal y en agrohábitats como arvense (Rendón & Núñez-Farfán 2001). A pesar de su amplia distribución, sólo se reportan su uso alimenticio y medicinal, primordialmente, en el centro y sur del país (Rendón 2000, Rendón et al. 2001, Díaz-Guillén 2009, Bernal-Ramírez et al. 2011), siendo su consumo como quelite el principal. En la región de La Montaña de Guerrero el manejo de las poblaciones es intenso, al punto en el que la gente reconoce dos fenotipos: variante “hembra” y variante “macho” (Casas et al. 1994, 1996, 2007, Bernal-Ramírez et al. 2011). El fundamento de esta categorización radica en las características apreciadas para su consumo como quelite, es decir con hojas anchas, glabras y suaves, típicas de la variante “hembra”. En contraste, la variante “macho” presenta hojas astadas, gruesas y una gran pubescencia.
Sitio de estudio. El trabajo de campo se realizó en la Región de La Montaña de Guerrero, dentro de los municipios de Copanatoyac y Tlapa de Comonfort (Figura 1), a una altitud de 1,300 m snm, en donde predomina un clima cálido subhúmedo con lluvias en verano. El rango de precipitación oscila entre los 700 a 1,500 mm y la temperatura de 18 a 26 ºC (INEGI 2009), siendo la selva baja caducifolia el tipo de vegetación circundante.
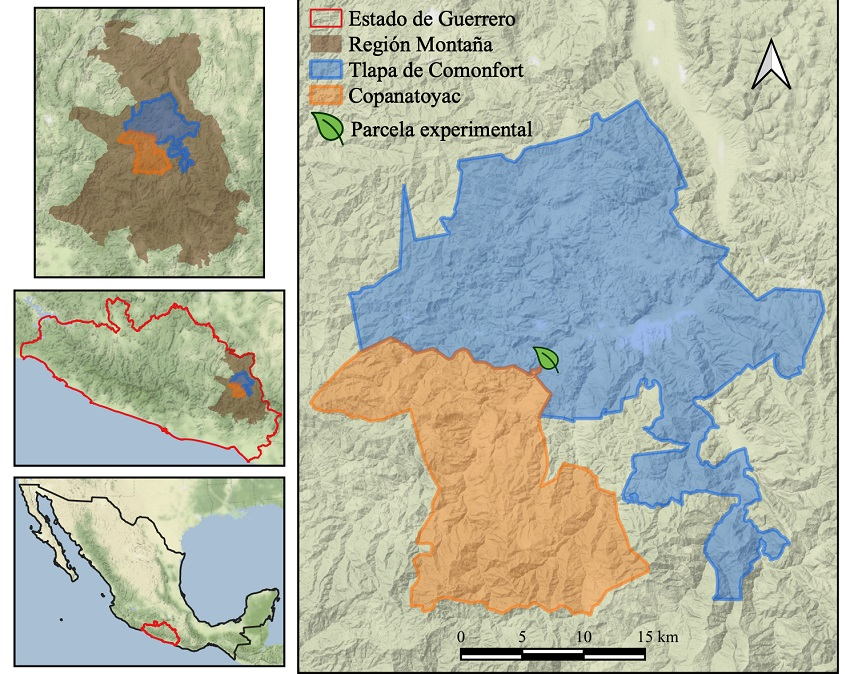
Figura 1 Localización del sitio de estudio y parcela experimental en la región de La Montaña de Guerrero, México.
Se definieron tres tipos de poblaciones, con base en la forma de manejo y la intensidad de selección artificial que ejercen los habitantes de la región de La Montaña sobre la especie: AF: arvenses fomentadas, plantas propagadas por semilla en pequeñas camas de cultivo a manera de hortaliza; AA: arvenses agrestes (i.e., arvenses toleradas), plantas no promovidas ni cultivadas pero que se les permite establecerse y desarrollarse para su aprovechamiento dentro del terreno donde se cultiva maíz; y R: ruderales, plantas que crecen silvestres a las orillas de los caminos, en vegetación perturbada y de las cuales sólo se recolectan los individuos con fenotipos cercanos a las plantas arvenses. Estas tres poblaciones son el reflejo de las formas de manejo en la región y representan un gradiente de domesticación de mayor a menor intensidad (i.e., fomentadas > agrestes > ruderales).
Diseño experimental. Se colectaron semillas de individuos pertenecientes a los tres tipos de poblaciones en el invierno del año 2008 (N = 15-20 individuos por población y entre 20-40 semillas por individuo). Las semillas fueron lavadas con una solución de hipoclorito de sodio al 5 %, escarificadas mecánicamente y sembradas en semilleros de poliestireno con suelo comercial (i.e., tierra preparada marca Vigoro), manteniéndolas separadas según su población de procedencia. La germinación de las semillas se dio al final de la temporada seca (i.e., mayo de 2009), bajo una malla sombra y aplicando riego cada tercer día dentro de la misma localidad del jardín común. Un mes después de la siembra (junio), cuando todas las plántulas habían producido el segundo par de hojas verdaderas se trasplantaron a una parcela experimental en Atlamajalcingo del Río, municipio de Tlapa, en la temporada de lluvias del año 2009 (Figura 1), siguiendo la metodología de un jardín común con el fin de reducir la variación ambiental exponiendo a los individuos de las diferentes poblaciones en un mismo ambiente (Colunga-García Marín 1998, Rendón & Núñez-Farfán 2001, Valverde et al. 2001, Sánchez-Peña et al. 2006, Nuismer & Gandon 2008). El diseño general de la parcela constó de 50 bloques, cada uno con tres plantas de cada población, ubicadas aleatoriamente y con una separación de un metro entre plantas (N = 450 = 50 bloques × 3 repeticiones × 3 poblaciones). Se realizaron deshierbes manuales con el fin de eliminar competidores y no se aplicó ningún control de plagas.
A lo largo del crecimiento de las plantas, entre julio y septiembre, se realizaron cuatro censos a los 14 (CI), 28 (CII), 52 (CIII) y 64 (CIV) días después del trasplante para contabilizar y registrar los rasgos fenotípicos. A partir de lo reportado por Casas et al. (1994, 1996, 2007), Casas & Caballero (1995) y Bernal-Ramírez et al. (2011), se identificaron los rasgos blanco de la selección artificial: el área foliar, la densidad de tricomas y el número de hojas. Por otra parte, los resultados de los trabajos previos de Rendón (2000) y Díaz-Guillén (2009), permiten considerar al resto de los rasgos fenotípicos como los posibles rasgos correlacionados.
Rasgos blanco de la selección artificial.- Durante cada censo, se contabilizó el número de hojas y se estableció una marca de color para continuar el conteo en censos posteriores. Al final del experimento, se colectaron 25 hojas de las ramas primarias de cada individuo y se obtuvo su área foliar directamente con un sistema analizador de imágenes de video (WinFOLIA® PRO, Québec, Canada). La densidad de tricomas se estimó a partir de una muestra de 900 hojas (i.e., 15 hojas × 20 individuos × 3 poblaciones). En cada una se establecieron cinco campos de observación de 0.6 cm2, relativizando la densidad como la proporción promedio de tricomas de las cinco observaciones en el área del campo visual (Valverde et al. 2001).
Rasgos correlacionados.- La altura fue medida desde el nivel del suelo hasta el ápice central de cada individuo. Al término del experimento, se cosecharon 20 plantas de cada población para obtener la biomasa aérea que se estimó como el peso seco de la región donde se tomó la altura, mientras que la biomasa radicular fue el peso seco de la raíz de cada planta. También, para cada individuo se obtuvieron los siguientes componentes de la adecuación: número de botones, flores y frutos, tamaño promedio de las semillas y tamaño promedio de las flores. El tamaño de la semilla se estimó como el cociente del peso total de las semillas entre el número total de semillas sólo en los frutos maduros. El tamaño de las flores se estimó a partir de muestras de 300 pétalos (i.e., 5 pétalos × 20 individuos × 3 poblaciones), con el programa SigmaScan PRO 5 (Systat Software, San Jose, California) se obtuvo directamente el área total, el largo y ancho de cada pétalo. Se realizaron regresiones lineales entre el largo y ancho de los pétalos con el fin de establecer las relaciones entre éstos y el área del pétalo. Dado que todas las regresiones fueron significativas (F
1,58 = 975.5; R 2 > 0.95; P < 0.001), el área floral de cada individuo fue considerada como el producto del promedio del área de los cinco pétalos muestreados por cinco flores. La adecuación relativa (wi) se estimó como
Debido a que la forma de manejo y la intensidad de selección artificial pueden generar un aumento en la susceptibilidad a patógenos o herbívoros, de acuerdo con los síndromes de domesticación propuestos, de entre los rasgos correlacionados se consideraron aquellos asociados a los mecanismos de defensa. Actualmente, se reconocen dos estrategias o mecanismos de defensa en plantas: la resistencia y la tolerancia (Núñez-Farfán et al. 2007). La resistencia está asociada con aquellas características físicas y químicas que evitan o reducen el daño o infección (Medel et al. 2002, Vivianco et al. 2005, Núñez-Farfán et al. 2007). Mientras que la tolerancia es la respuesta asociada con la reducción de los efectos negativos en el éxito reproductivo una vez que el daño ha ocurrido (Fornoni et al. 2004b, Fortes et al. 2004, Núñez-Farfán et al. 2007). Por consiguiente, para el estudio de la resistencia se estimó el daño foliar (i.e., herbivoría) directamente a partir de una muestra de 3,150 hojas (i.e., 15 hojas × 70 individuos × 3 poblaciones) con un sistema analizador de imágenes de video (WinFOLIA® PRO, Québec, Canada). Este sistema mide el total de área foliar consumida o infectada (AFH) y el área foliar total (AFT) (Valverde et al. 2003). El daño relativo (DR) de un individuo es igual a: DR = AF H/AFT. Así, el daño relativo de cada planta es el valor correspondiente al área dañada acumulada entre el área total acumulada por individuo expresado en términos relativos. La resistencia general por individuo se calculó como 1 - DR (Fornoni et al. 2004b). En el caso de la tolerancia, existen diferentes respuestas que dependen del tipo e intensidad de daño (v.g., subcompensación, compensación y sobrecompensación), por lo que existen diferentes componentes de la tolerancia. En el presente estudio, se consideró como componente de la tolerancia a la Tasa Relativa de Incremento (TRI) de las hojas, calculada como (log C IV - log CI)/(t1 - t0), donde CI y CIV representan el número de hojas del primer y último censos, respectivamente (Pearcy et al. 1989).
Al concluir el experimento, en el mes de octubre (después de la producción de semillas), se colectaron hojas de todas las plantas vivas (N = 411) para realizar un análisis bromatológico por separado para cada población con el propósito de medir algunos de los componentes químicos de las hojas siguiendo la metodología estándar según Tejada (1992).
Análisis estadísticos. Para probar la existencia de diferencias en los rasgos blanco de selección y aquellos rasgos correlacionados entre las tres poblaciones con diferente forma de manejo, se efectuaron análisis de varianza univariados (factor fijo con tres niveles). De resultar significativo para alguno de los rasgos, se aplicaron pruebas de Tukey para encontrar qué poblaciones eran significativamente diferentes (Zar 1999). Previamente, para cada una de las variables medidas se aplicaron transformaciones para cumplir con los supuestos de normalidad (Zar 1999). Además, se evaluó la categorización entre las tres poblaciones y se identificó a los rasgos biológicos que definen las diferencias entre ellas a través de un Análisis Discriminante (AD).
A fin de entender cómo interaccionan los cambios en los rasgos blanco de selección artificial con los rasgos correlacionados, se construyó una matriz de correlación fenotípica a nivel de especie y para cada una de las poblaciones que están sometidas a distinta intensidad de selección humana. De manera complementaria, se obtuvieron las correlaciones entre los rasgos correlacionados que no son blanco de selección artificial.
Asimismo, como parte de los cambios en rasgos biológicos correlacionados, se estimó la variación en la fenología de las poblaciones, mediante pruebas de bondad de ajuste nominal de la producción de estructuras reproductivas, contrastando las diferencias con pruebas de Chi-cuadrado (χ2) en una matriz de incidencia (presencia-ausencia) a partir de los cuatro censos realizados (Zar 1999).
Por último, con el propósito de evaluar cuál es la estrategia de defensa de A. cristata bajo diferentes formas de manejo en La Montaña de Guerrero, se compararon los patrones de selección entre poblaciones a nivel fenotípico. Para comprobar si la selección en el crecimiento (i.e., TRI como componente de la tolerancia) y la resistencia general difieren entre poblaciones, se realizó un análisis de covarianza (ANCOVA) con la adecuación relativa (wi) como variable de respuesta. En este análisis, el crecimiento y la resistencia general fueron incluidos como covariables y la población con tres niveles fue considerada como factor fijo. Una interacción Población × TRI y/o Población × resistencia significativa, indicarían que los patrones de selección sobre el crecimiento y/o la resistencia difieren entre poblaciones (Valverde 2001, Valverde et al. 2003). Subsecuentemente se elaboraron ANCOVAs para comparar pares de poblaciones para los gradientes de selección significativos detectados. Las variables resistencia y TRI fueron estandarizadas con el fin de obtener los resultados en unidades de desviación estándar (Zar 1999). Todos los análisis estadísticos se realizaron utilizando el programa SPSS Statistics (IBM, Charlotte, North Carolina).
Resultados
Diferenciación fenotípica entre poblaciones en rasgos seleccionados. Los resultados de los análisis de varianza mostraron la existencia de diferencias significativas entre los rasgos analizados (Tabla 1). Las dos poblaciones arvenses presentaron mayor área foliar (F 2,290 = 14.61, R 2 = 0.085, P < 0.0001, Tabla 1) y baja densidad de tricomas (F 2,84 = 6.42, R 2 = 0.112, P = 0.002, Tabla 1). Mientras que el número de hojas tuvo un valor decreciente de la población arvense fomentada a la ruderal (F 2,408 = 58.33, R 2 = 0.218, P < 0.0001, Tabla 1).
Tabla 1 Rasgos biológicos fenotípicos considerados en este trabajo. Se muestra la media y el error estándar de los rasgos en cada población (
| Rasgo | Ruderal | Arvense agreste | Arvense fomentada | N |
|---|---|---|---|---|
| Blanco de selección artificial | ||||
| Área foliar (cm2) | 165.381 ± 7.865B | 225.125 ± 9.831A | 224.013 ± 14.809A | 293 |
| Densidad de tricomas (cm-2) | 13.170 ± 1.093A | 9.380 ± 0.610B | 9.353 ± 0.610B | 87 |
| Número de hojas | 138.242 ± 4.235C | 181.109 ± 6.022B | 227.262 ± 5.789A | 411 |
| Correlacionados | ||||
| Adecuación relativa | 1.079 ± 0.057A | 1.169 ± 0.101A | 0.768 ± 0.051B | 411 |
| Altura (cm) | 84.015 ± 3.122B | 100.326 ± 2.485A | 81.745 ± 1.502B | 411 |
| Biomasa aérea (gr) | 150.583 ± 18.661 | 264.977 ± 42.882 | 176.114 ± 16.241 | 60 |
| Biomasa radicular (gr) | 6.441 ± 1.142C | 21.812 ± 3.131A | 13.793 ± 1.440B | 60 |
| Herbivoría (cm2) | 1.867 ± 0.290C | 4.873 ± 0.461B | 6.769 ± 0.831A | 293 |
| Número de botones | 32.429 ± 2.191A | 14.406 ± 1.111B | 7.648 ± 0.729C | 411 |
| Número de flores | 9.211 ± 0.773A | 6.761 ± 0.783B | 2.014 ± 0.339C | 411 |
| Número de frutos | 268.367 ± 14.236A | 290.594 ± 25.037B | 190.917 ± 12.552B | 411 |
| Resistencia | 0.988 ± 0.001A | 0.979 ± 0.002B | 0.969 ± 0.003C | 293 |
| Tamaño de la flor (cm2) | 2.353 ± 0.117B | 10.528 ± 0.413A | 10.038 ± 0.359A | 60 |
| Tamaño de la semilla (mgr) | 6.614 ± 0.194A | 2.525 ± 0.098B | 2.816 ± 0.084B | 86 |
| TRI | 0.067 ± 0.001B | 0.067 ± 0.001B | 0.069 ± 0.000A | 411 |
Diferenciación fenotípica entre poblaciones en rasgos correlacionados. La población arvense fomentada presentó los niveles más altos de herbivoría, seguida por la arvense agreste y en menor medida la ruderal (F2,290 = 43.71, R 2 = 0.226, P < 0.0001, Tabla 1). En cuanto a los rasgos asociados a los mecanismos de defensa, la población arvense fomentada mostró la mayor TRI (F2,408 = 3.13, R 2 = 0.01, P = 0.04, Tabla 1) y la menor resistencia general (F2,290 = 31.21, R 2 = 0.171, P < 0.0001, Tabla 1). Para los componentes de la adecuación, la población ruderal exhibió los niveles más altos de botones (F2,408 = 73.6, R 2 = 0.261, P < 0.0001, Tabla 1), flores (F2,408 = 51.03, R 2 = 0.196, p < 0.0001, Tabla 1), frutos (F2,408 = 8.37, R 2 = 0.035, P = 0.0003, Tabla 1), tamaño de la semilla (F2,83 = 227.7, R 2 = 0.842, p < 0.0001, Tabla 1) y adecuación relativa (F2,408 = 8.585, R 2 = 0.036, P = 0.0002, Tabla 1). Ambas poblaciones arvenses presentaron el mayor tamaño de flores (F2,57 = 414.13, R 2 = 0.933, P < 0.0001, Tabla 1). Respecto a otros rasgos relacionados con la arquitectura, la población arvense agreste presentó la mayor altura (F2,408 = 14.01, R 2 = 0.06, P < 0.0001, Tabla 1) y biomasa radicular (F2,57 = 13.31, R 2 = 0.294, P < 0.0001, Tabla 1).
El análisis discriminante con base en todos los rasgos fenotípicos mostró tres grupos estadísticamente diferentes con respecto a la forma de manejo e intensidad de selección artificial (Lambda λ de Wilks = 0.013, χ2 = 218.9, g.l. = 30, P < 0.001). El primer eje discriminó todas las plantas ruderales de las demás (97 % de varianza, corr. canónica = 0.986), siendo los rasgos correlacionados como la herbivoría y la resistencia general, así como el tamaño de la flor y de la semilla, los más relevantes para la discriminación. En el segundo eje, se separaron los individuos arvenses en agrestes y fomentados (3 % de varianza, corr. canónica = 0.731), explicado por las variables TRI, número de flores, altura y biomasa de la raíz. En general, el 93 % de las plantas fueron correctamente clasificadas. No hubo errores de clasificación para las poblaciones ruderal y arvense fomentada, mientras que cuatro individuos arvense agrestes no pertenecieron al grupo predicho (Figura 2).

Figura 2 Diagrama de ordenación de los individuos de las tres poblaciones a partir del Análisis Discriminante en relación con los rasgos fenotípicos de Anoda cristata. Puntos azules: arvenses fomentadas, estrellas verdes: arvenses agrestes y triángulos rojos: ruderales.
Matriz de correlación fenotípica. La mayoría de las correlaciones fenotípicas entre los rasgos blanco de selección artificial y los rasgos correlacionados a nivel de especie fueron significativas. La comparación entre poblaciones mostró cambios en los patrones de integración y sólo algunas correlaciones se mantuvieron, como la relación entre área foliar-herbivoría y el número de hojas-biomasa aérea (Apéndice 1). Algunas correlaciones significativas a nivel de especie se mantienen sólo en una de las poblaciones (v.g., área foliar-número de botones, especie: r = -0.554, P < 0.001; arvense fomentada: r = -0.713, P < 0.001). Por el contrario, algunas correlaciones significativas a nivel de especie se pierden cuando se prueban a nivel de población (v.g., número de hojas-herbivoría, especie: r = 0.3, P = 0.02; no significativo para ninguna población) (Apéndice 1). Asimismo, hay correlaciones exclusivas para una población, pero no para la especie, estas son las de área foliar-adecuación relativa (r = -0.461, P = 0.041) y área foliar-número de frutos (r = -0.494, P = 0.027) para la población arvense fomentada, el número de hojas-altura en la población arvense agreste (r = 0.643, P = 0.002) y el número de hojas-número de frutos en la población ruderal (r = 0.589, P = 0.006). Los coeficientes de correlación entre otros rasgos morfológicos que no son considerados blanco de selección o correlacionados, también fueron significativos para una gran proporción de éstos e, incluso, una mayor proporción de ellas se mantuvieron entre las poblaciones con diferente forma de manejo (Apéndice 1).
Variación en la fenología. Durante el primer censo (CI: 14 días), no se registró presencia de ninguna estructura sexual. La prueba de bondad de ajuste mostró que existen diferencias significativas en la aparición de estructuras sexuales reproductivas después del primer censo entre las poblaciones (CII, CIII y CIV: N = 411, g.l. = 2, P < 0.01) y todas las estructuras aparecieron primero en la población ruderal (Figura 3, Tabla 2). El resultado por censo y para cada estructura se presenta a continuación: CII (28 días): botones (χ2 = 68.985, C = 0.379), flores (χ2 = 11.191, C = 0.163) y frutos (χ2 = 13.462, C = 0.178). CIII (52 días): botones (χ2 = 95.784, C = 0.435), flores (χ2 = 86.848, C = 0.418) y frutos (χ2 = 148.069, C = 0.515). CIV (64 días): botones (χ2 = 29.411, C = 0.258), flores (χ2 = 35.128, C = 0.281) y frutos (χ2 = 65.949, C = 0.372). Adicionalmente, los resultados para conocer dónde están las diferencias entre pares de poblaciones se muestran en la Tabla 2.
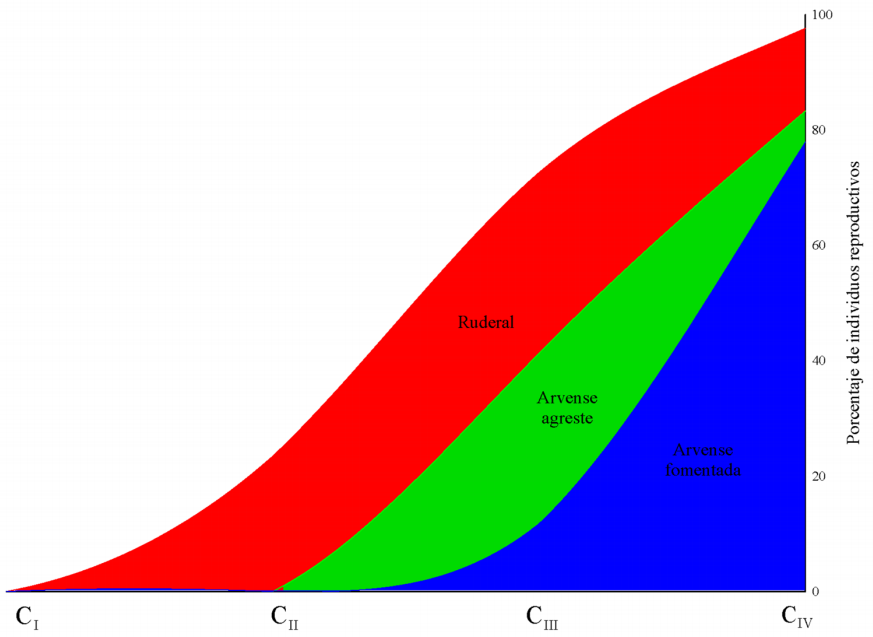
Figura 3 Variación de los porcentajes de aparición de estructuras reproductivas de las tres poblaciones con distinta intensidad de selección artificial en La Montaña de Guerrero. Las diferencias entre pares de poblaciones por cada estructura se muestran en la Tabla 2.
Tabla 2 Resultados de las pruebas de bondad de ajuste por pares de poblaciones en la aparición de estructuras sexuales reproductivas de A. cristata. Se muestran los parámetros estadísticos Chi-cuadrado de Pearson (χ2) y el coeficiente de correlación de Mathews (𝜑) para una tabla de contingencia de 2 × 2, a partir del segundo censo ya que durante el primero no se registró presencia de ninguna estructura. Para todos los casos g.l. = 1, P < 0.05.
| Pares de poblaciones | CII (28 días) | CIII (52 días) | CIV (64 días) | N |
|---|---|---|---|---|
| Botones | ||||
| Ruderal-Agreste | χ2 = 35.091, 𝜑 = -0.363 | χ2 = 25.852, 𝜑 = -0.312 | χ2 = 19.682, 𝜑 = -0.272 | 266 |
| Ruderal-Fomentada | χ2 = 36.756, 𝜑 = -0.367 | χ2 = 95.649, 𝜑 = -0.592 | χ2 = 30.334, 𝜑 = -0.333 | 273 |
| Agreste-Fomentada | - | χ2 = 27.038, 𝜑 = -0.309 | no significativo | 283 |
| Flores | ||||
| Ruderal-Agreste | χ2 = 5.494, 𝜑 = -0.144 | χ2 = 27.329, 𝜑 = -0.321 | no significativo | 266 |
| Ruderal-Fomentada | χ2 = 5.770, 𝜑 = -0.145 | χ2 = 81.119, 𝜑 = -0.545 | χ2 = 39.910, 𝜑 = -0.342 | 273 |
| Agreste-Fomentada | - | χ2 = 20.475, 𝜑 = -0.269 | χ2 = 15.683, 𝜑 = -0.235 | 283 |
| Frutos | ||||
| Ruderal-Agreste | χ2 = 6.618, 𝜑 = -0.158 | χ2 = 56.082, 𝜑 = -0.471 | χ2 = 37.107, 𝜑 = -0.373 | 266 |
| Ruderal-Fomentada | χ2 = 6.950, 𝜑 = -0.160 | χ2 = 125.935, 𝜑 = -0.679 | χ2 = 67.172, 𝜑 = -0.496 | 273 |
| Agreste-Fomentada | - | χ2 = 25.064, 𝜑 = -0.298 | χ2 = 6.527, 𝜑 = -0.152 | 283 |
Estrategias de defensa. A nivel fenotípico, se detectó un patrón de selección positivo sólo en el crecimiento (TRI) en las tres poblaciones (Tabla 3). Para este carácter, el ANCOVA reveló diferencias significativas en los patrones de selección entre poblaciones (Población × TRI: F2,283 = 4.791; P = 0.009), mientras que no se detectó selección sobre la resistencia general (Población × resistencia: F2,283 = 0.7473; P = 0.474) y tampoco diferencias en el efecto de la resistencia sobre la adecuación relativa. La comparación de los patrones de selección entre pares de poblaciones para el crecimiento indica que la población ruderal difiere de la arvense agreste (F1,185 = 4.704; P = 0.031), pero no de la arvense fomentada (F1,189 = 0.503; P = 0.479). Finalmente, se encontró que la población arvense agreste difiere de la arvense fomentada (F1,198 = 6.304; P = 0.013). Para ambos casos, el patrón fue mayor en la población arvense agreste.
Tabla 3 Parámetros estadísticos del análisis de covarianza fenotípico para la adecuación relativa. En negritas se señalan los valores estadísticamente significativos (P < 0.05).
| Fuente de variación | g.l. | SC | F | p |
|---|---|---|---|---|
| Población | 2 | 15.844 | 10.681 | < 0.001 |
| TRI | 1 | 5.149 | 6.943 | 0.009 |
| Resistencia general | 1 | 0.427 | 0.576 | 0.448 |
| Población × TRI | 2 | 7.107 | 4.791 | 0.009 |
| Población × resistencia general | 2 | 1.108 | 0.747 | 0.475 |
| Error | 283 | 209.893 | ||
| Total | 291 | 237.645 |
Contenido nutricional. Los resultados cualitativos obtenidos a partir del análisis bromatológico indican que existe variación de la composición nutrimental en las poblaciones de A. cristata. A pesar de que los resultados obtenidos son el promedio de dos muestras analizadas por población, se puede apreciar que el porcentaje de celulosa, lignina, y sílice son los componentes con mayor variación entre las tres poblaciones (Tabla 4). Si bien los datos no pudieron incorporarse al análisis de los coeficientes de correlación, se consideran un rasgo correlacionado al no haber una selección artificial directa sobre el contenido nutricional de las poblaciones.
Tabla 4 Composición bromatológica de las tres poblaciones de Anoda cristata con distinta intensidad de selección artificial en la región de La Montaña de Guerrero.
| Componente (%) | Ruderal | Agreste | Fomentado |
|---|---|---|---|
| Celulosa | 22.36 | 4.38 | 4.92 |
| Cenizas | 13.7 | 7.37 | 16.42 |
| Contenido celular | 58.66 | 60.46 | 53.53 |
| Extracto libre de nitrógeno | 49.2 | 53.47 | 40.14 |
| FDA | 31.67 | 13.43 | 14.39 |
| FDN | 41.34 | 39.54 | 46.46 |
| Fibra cruda | 10.78 | 9.11 | 9.26 |
| Grasa cruda | 3 | 3.67 | 4.34 |
| Hemicelulosa | 9.67 | 26.10 | 32.06 |
| Lignina | 21.91 | 8.24 | 8.82 |
| Materia seca | 1.21 | 1.68 | 1.49 |
| Nitrógeno | 3.54 | 3.95 | 4.53 |
| Proteína cruda | 22.11 | 24.71 | 28.32 |
| Sílice | 2.13 | 0.81 | 0.65 |
Discusión
El uso tradicional y el manejo de las poblaciones de Anoda cristata que la gente realiza en la región de La Montaña de Guerrero, ha derivado en una diferenciación morfológica de las mismas (Figura 4). Los reportes previos (Casas et al. 1994, 1996, 2007, Casas & Caballero 1995), así como la existencia de cambios estadísticamente significativos tanto en los rasgos blanco de selección artificial, como en los rasgos correlacionados obtenidos en el presente estudio sustentan esta premisa. En este sentido, la categorización de las plantas en el análisis discriminante corroboró la existencia de tres poblaciones diferentes (Figura 2). Si bien las variables de separación estuvieron primordialmente dictadas por rasgos correlacionados, esto podría deberse a que existe una compleja relación entre grupos de rasgos seleccionados y correlacionados que evolucionan en conjunto al formar módulos morfológicos y funcionales (Pigliucci & Preston 2004, Armbruster et al. 2014). Así, estos grupos de rasgos tienen un rol en el desempeño ecológico de los individuos en su hábitat correspondiente, pero la expresión fenotípica observada dentro del jardín común muestra el efecto que la selección artificial ha tenido para favorecer los rasgos de interés con una base genética (Rosenthal & Dirzo 1997, de Villemereuil et al. 2016).

Figura 4 Divergencia fenotípica entre poblaciones de Anoda cristata en la región de La Montaña de Guerrero. En la sección superior de la imagen se observan individuos de las tres poblaciones dentro del jardín común, mientras que en la parte inferior se muestra la variación en el tamaño de las flores de cada población. AF: arvense fomentada, AA: arvense agreste y R: ruderal.
Mondolot et al. (2008) señalan que la producción de hojas es un componente importante en la asignación de recursos cuando ocurre selección humana, esta tendencia y el manejo que ejerce la gente en A. cristata pudieran estar facilitando el incremento del número de hojas en la población arvense fomentada, al ser el rasgo que se consume (Mapes et al. 1996, 1997, 1998, Rendón et al. 2001, Blanckaert 2007, Casas et al. 2007). Sin embargo, nuestros datos indican que no hay ninguna correlación negativa con algún otro rasgo (Apéndice 1), por lo que no existen costos directos asociados al aumento de la cantidad de hojas. No obstante de que no existen trade-offs para el número de hojas, el aumento del área foliar (i.e., hojas anchas) tiene asociado un costo en la reproducción (r = -0.461), por lo que la disminución en la producción de estructuras reproductivas en ambas poblaciones arvenses (i.e., agreste y fomentada) respecto a la población ruderal, podría deberse a una inversión de energía a la parte vegetativa más que a la reproductiva (Mapes et al. 1996, 1997, 1998, Rosenthal & Dirzo 1997). Al respecto, Rendón & Núñez-Farfán (2001) encontraron mayores respuestas plásticas para rasgos vegetativos y reproductivos dentro del agrohábitat en comparación con un ambiente ruderal, por lo que la producción de hojas y la disminución de estructuras reproductivas en las poblaciones arvenses podrían estar ligadas al ambiente en el que crecen. La heterogeneidad del agrohábitat (v.g., pendiente, concentración de abonos, humedad del suelo) puede favorecer o limitar la expresión de la variación genética (Hermanutz & Weaver 1996, Leiss & Müller-Schärer 2001, Rendón & Núñez-Farfán 2001). Sin embargo, nuestros resultados dentro del jardín común sugieren que es más importante el papel que ha jugado la selección humana en la diferenciación de las poblaciones.
A nivel de especie existe una fuerte correlación entre el área foliar y la herbivoría (r = 0.7), es decir, la asignación de una mayor cantidad de recursos a la producción de biomasa vegetativa (i.e., hojas anchas) probablemente a expensas de los metabolitos secundarios y/o tricomas (Massei & Hartley 2000), resulta en un mayor ataque por insectos herbívoros. Esto concuerda con la correlación parcial negativa entre la densidad de tricomas y la herbivoría (r = -0.587). Entonces, podemos inferir que, si la intensidad de selección artificial continúa aumentando, las plantas arvenses fomentadas podrían llegar a un punto de dependencia para su protección y cuidado brindados por la gente, tal como ocurre en las especies cultivadas (Rindos et al. 1980, Rindos 1984, Pickersgill 2007).
Dentro de los rasgos correlacionados, la mayor altura en la población arvense agreste podría relacionarse con una mayor competencia por recursos (v.g., agua, minerales, luz, espacio) tanto con la especie cultivada (v.g., maíz, chile, frijol, calabaza, camote), como con otras especies de arvenses que pueden ser o no aprovechadas por la gente dentro de los sistemas agrícolas. Bajo condiciones de competencia, Hickman (1975) sugiere que una mayor asignación de recursos a producción de brotes de hojas y tallos es ventajosa para interceptar más luz, lo que provoca un decremento en las estructuras reproductivas (Weiner 2004). En efecto, la correlación positiva entre la altura y el número de hojas registrada para la población arvense agreste se ajusta muy bien a este modelo de competencia (Apéndice 1). También se registró la tendencia al aumento de la adecuación con altura y biomasa aérea mayores (r = 0.576 y 0.652, respectivamente). Estos patrones podrían confirmar que las arvenses tienen una mejor eficiencia en el uso de los nutrimentos disponibles y por ende que se desempeñan mejor en ambientes distintos aun cuando exista competencia (Li & Watkinson 2000).
Por otro lado, puesto que diferentes patrones de asignación son reflejo de distintas estrategias, resultado de diferentes presiones selectivas (Weiner 2004), inferimos que los sistemas radiculares podrían fungir como mecanismo reproductivo alterno a través de la propagación vegetativa a partir de las raíces. Esto debido a que los individuos de ambas poblaciones arvenses (i.e., agrestes y fomentadas) de A. cristata están sometidos a constantes podas para el consumo de la región apical, viéndose afectada la producción de estructuras reproductivas sexuales. Díaz-Guillén (2009) y Rendón (2000) mostraron que la mayor biomasa asignada a los sistemas radiculares podría estar sirviendo como mecanismo de tolerancia en las poblaciones arvenses de A. cristata en el Estado de México. Es decir, una compensación a través de raíces grandes a la reducción de reproducción sexual. Lo anterior concuerda con los reportes previos de Casas et al. (2007) sobre la propagación vegetativa de la especie a través de trozos de raíces durante el barbecho y con los patrones de correlación encontrados en este trabajo entre la biomasa radicular y la adecuación (Apéndice 1).
La variación en la fenología observada dentro del jardín común podría ser el resultado del manejo diferencial de las poblaciones en La Montaña de Guerrero (Figura 3). Burgess et al. (2007) encontraron que el tiempo de floración es una respuesta correlacionada a la selección artificial en Campanulastrum americanum (L.) Small, ya que plantas de floración tardía tuvieron más biomasa aérea que las plantas con floración temprana, tal como ocurre entre las poblaciones arvenses y la ruderal de A. cristata (Tabla 1). Adicionalmente, el ambiente en el que habitan las poblaciones también influye en los cambios fenológicos. Al encontrarse en agrohábitats, las plantas arvenses tienen mayor disponibilidad de recursos y desarrollan estrategias de almacenamiento en la asignación de biomasa vegetativa durante etapas tempranas del desarrollo, y esto genera un retraso en la producción de sus estructuras reproductivas (Mondolot et al. 2008, Figura 3). En contraste, en la población ruderal la producción temprana de flores sería la expresión de una adaptación local contenida a nivel genético (Nuismer & Gandon 2008), ya que al encontrarse históricamente en ambientes menos favorables que los agrohábitats (Leiss & Müller-Schärer 2001, Rendón & Núñez-Farfán 2001), existe una presión hacia la reproducción precoz para disminuir el tiempo en el que la planta es susceptible al daño por herbívoros (Rindos et al. 1980).
El tamaño de las flores también se consideró un rasgo correlacionado debido a que en ningún estudio previo se menciona como parte de los rasgos de selección humana, a diferencia de las especies domesticadas más importantes a nivel mundial y otras a nivel regional o local en las que se menciona un incremento en el tamaño de algunos componentes florales debido a la selección del fruto o semilla (Lush & Evans 1981, Bretting 1986, Casas & Caballero 1996, Gepts & Papa 2002, Alonso-Blanco et al. 2005, Casas et al. 2007, Blancas et al. 2009, Ortíz et al. 2010). Sin embargo, nuestros resultados concuerdan con el patrón encontrado en Campanulastrum americanum, donde plantas seleccionadas para una floración tardía produjeron flores más grandes que las plantas con floración temprana (Burgess et al. 2007). En el caso de A. cristata, son las plantas arvenses las que muestran flores menos abundantes, pero más grandes (Figura 4, Tabla 1). Estas diferencias probablemente se deban a que, una vez iniciada la etapa reproductiva, las plantas cambiarían su asignación a la producción de estructuras para la reproducción sexual (Mapes et al. 1997). Así, aunque la floración sea tardía, la asignación a flores más grandes permitiría atraer a polinizadores eficientes y elevar el éxito reproductivo (Vogel 1996). Incluso, otra posible explicación es que dentro del agrohábitat, los polinizadores han seleccionado flores más grandes. Además, el manejo diferencial de las poblaciones estaría acentuando la separación en los tiempos fenológicos, debido a que en las poblaciones arvenses es importante ampliar el tiempo de disponibilidad de hojas, reduciendo la probabilidad de entrecruzamiento. Sin embargo, se requieren estudios de la biología reproductiva para confirmar estas hipótesis.
Las mediciones del tamaño de las semillas en diversas especies de hortalizas muestran que la masa de las semillas ha aumentado durante la domesticación (Kluyver et al. 2017), a pesar de que este rasgo no es un determinante directo del rendimiento de los rasgos de interés (i.e., hojas, tallos o raíces comestibles). En las poblaciones de A. cristata, nuestros resultados muestran que las plantas ruderales presentaron semillas más grandes que las plantas arvenses (Tabla 1). En contraste, Rendón & Núñez-Farfán (2001) encontraron semillas mayores en las poblaciones arvenses en comparación con las ruderales del Estado de México. Estas discrepancias en el tamaño de la semilla podrían ser reflejo de varias razones no excluyentes. Primero, como resultado de una mayor asignación de recursos a las semillas dentro de entornos antropocéntricos en comparación con aquellas de ambientes ruderales (Leiss & Müller-Schärer 2001). Así, los beneficios indirectos brindados por el agrohábitat (v.g., abono, humedad, remoción de competidores) probablemente se observan en semillas grandes. Segundo, podría deberse al efecto pleiotrópico o un vínculo genético con la selección de plantas u órganos más grandes (Kluyver et al. 2017). Por ejemplo, plantas con hojas más anchas y numerosas (i.e., área foliar y número de hojas) tienen un costo en el tamaño de las semillas (r = -0.514 y r = -0.408, respectivamente). Tercero, puede ser la manifestación fenotípica de variedades locales originadas por las diferencias en la intensidad de selección artificial ejercida en distintas regiones geográficas. Al respecto, cuando el proceso de domesticación es incipiente, las poblaciones tienden a presentar estrategias muy cercanas con sus parientes silvestres (Harlan 1975, Rindos et al. 1980, Rindos 1984, Rosenthal & Dirzo 1997, Rendón & Núñez-Farfán 2001, Pickersgill 2007). Por lo que, si la tendencia de las poblaciones ruderales es una elevada asignación de recursos a la reproducción sexual y en las poblaciones arvenses el proceso de selección humana es tenue, el patrón se cumple para las poblaciones ruderales de A. cristata en La Montaña de Guerrero y para las arvenses en el Estado de México.
Los resultados encontrados en los rasgos correlacionados asociados a los mecanismos de defensa en A. cristata coinciden con la tendencia a su disminución en las poblaciones con un grado avanzado de domesticación (Schwanitz 1966, Harlan 1975, Rindos et al. 1980, Rindos 1984, Gepts 2004, Pickersgill 2007). De hecho, nuestros resultados sugieren que la disminución en la densidad de tricomas está relacionada con mayores áreas foliares y aumento de herbivoría en la población arvense fomentada (r = -0.508 y r = -0.541, respectivamente). Acorde a esto, diversos estudios muestran que una menor cantidad de tricomas genera susceptibilidad a la herbivoría o daño en las poblaciones con mayor intensidad de selección artificial (Sánchez-Peña et al. 2006, Alvarez 2007, Díaz-Guillén 2009). Sin embargo, es importante señalar que los niveles de herbivoría registrados en este trabajo son muy bajos. En contraste, Díaz-Guillén (2009) reporta niveles mayores de herbivoría en A. cristata en el Estado de México. En este sentido, Valverde (2001) registró niveles de herbivoría contrastantes entre poblaciones de Datura stramonium L. procedentes de sitios distintos en un experimento de trasplantes recíprocos y señala que estas diferencias se deben a adaptaciones locales. Así, los diferentes niveles de herbivoría registrados en A. cristata para el Estado de México y para Guerrero podrían estar originadas por las diferencias en la intensidad de selección artificial ejercida entre distintas regiones geográficas, acentuando las adaptaciones locales de la especie.
Las revisiones y estudios recientes indican que una misma especie vegetal generalmente expresa una estrategia mixta para la defensa (Valverde et al. 2003, Fornoni et al. 2004a, b, Restif & Koella 2004, Núñez-Farfán et al. 2007). Así, las diferencias en la estrategia seguida por cada población están dadas por la respuesta a cambios en los parámetros que afectan la inversión en la defensa en diferentes ambientes (Restif & Koella 2004). Los resultados de este trabajo sugieren que el manejo de las poblaciones de A. cristata en La Montaña de Guerrero es uno de los factores que ha llevado a la adopción de diferentes estrategias de defensa para cada población, ya que no solo la presencia de herbívoros da dirección a uno u otro mecanismo defensivo, sino también condiciones que generen estrés en el ambiente (Valverde et al. 2003, Fornoni et al. 2004b), en este caso es el ser humano a través de las podas. Además, la selección artificial altera la forma en que las plantas se defienden de los herbívoros (Turcotte et al. 2014), de modo que en A. cristata difiere en la respuesta como especie, ya que muestra una tendencia a la resistencia a través de una correlación positiva con una mayor cantidad de tricomas (r = 0.537). Análogamente, en Datura stramonium se ha demostrado que este rasgo es un componente de resistencia hereditario, pues en poblaciones silvestres la selección favorece a los individuos con altos niveles de tricomas foliares (Valverde et al. 2001, Kariñho-Betancourt & Núñez-Farfán, 2015).
Por otra parte, la población arvense agreste tiende a un mayor crecimiento (TRI) asociado con una mayor adecuación, a pesar de la herbivoría y las podas intencionales de la gente. Esta estrategia de tolerancia ante la defoliación parece deberse a diferentes patrones de asignación de biomasa en distintos ambientes (v.g., agrohábitat y ruderal, Messina et al. 2002, Stevens et al. 2007, 2008), y, como ya se discutió en párrafos previos, podría ser resultado de patrones de competencia (v.g., mayores alturas, producción de tallos y hojas). Como consecuencia, nuestros resultados sugieren que los patrones detectados para el crecimiento pueden contribuir a diferencias en reproducción entre poblaciones, en respuesta a la selección artificial de este rasgo. Sin embargo, debido a que las diferencias en el crecimiento entre poblaciones son pequeñas (pero significativas), es preciso tomar con cautela los resultados observados con respecto a la tolerancia. Sería importante realizar nuevos estudios que profundicen en las diferencias con respecto a las estrategias para de defensa en plantas en proceso activo de domesticación.
Finalmente, si bien los resultados del análisis bromatológico son cualitativos, estas restricciones son parte de la metodología para su obtención. A pesar de ello, se observan evidencias en el incremento del contenido nutricional dentro de las poblaciones con mayor intensidad de selección artificial de la especie. Los compuestos relacionados con mayor aporte de energía y valor nutricional en la dieta (i.e., cantidad de cenizas, proteínas, nitrógeno y grasa), se registraron en la población arvense fomentada (Tabla 4). Aunque es complicado establecer una relación directa entre los rasgos seleccionados y el perfil bromatológico, Bernal-Ramírez et al. (2011) reportan que existen propiedades organolépticas más apreciadas para el consumo como quelite y éstas son propias de las poblaciones arvenses de la especie de estudio. Inclusive, se ha comprobado que el consumo de A. cristata es eficaz para mejorar una condición hiperglucémica, lo que representa un valioso fitoterapéutico para el tratamiento de la diabetes mellitus tipo 2 (Juárez-Reyes et al. 2015). En contraste, la población ruderal obtuvo el mayor porcentaje de componentes que dan estructura, soporte y protección física a las plantas: celulosa, lignina y sílice (Tabla 4). De modo que, hojas con gran cantidad de estos elementos sugieren una mayor dureza, pues conforman tanto las paredes celulares como los tricomas, y junto con el bajo contenido de compuestos nitrogenados, representan un sustrato poco nutritivo, menos digestible e indeseable para el consumo humano y para los herbívoros (Damman 1987, Sagers 1992, Gonzáles et al. 2001, Lill & Marquis 2001).
Una comparación del contenido bromatológico de la población arvense fomentada con otras especies, tanto cultivadas como domesticadas, muestra que el aporte nutricional de A. cristata como complemento a la dieta humana es importante (Apéndice 2). Los datos obtenidos en este trabajo son similares a los reportados por Casas et al. (1994) y mayores a los encontrados por Rendón et al. (2001). Sin embargo, estudios comparativos del valor nutricional de especies con diferentes formas de manejo son escasos, lo cual nos permitiría confirmar el efecto de la selección humana en la diferenciación del contenido nutricional.
En conclusión, nuestros resultados sustentan el papel de la selección humana en la divergencia fenotípica entre poblaciones de Anoda cristata. El presente estudio destaca la utilidad de las estimaciones de las correlaciones entre rasgos para predecir la respuesta de la selección artificial a nivel fenotípico y demuestran cómo el manejo influye ecológicamente en las poblaciones de una misma especie. También contribuyen con la detección de cambios correlacionados (v.g., en la fenología, las estrategias para la defensa y las propiedades nutrimentales), ya que las correlaciones parciales permiten el análisis de una correlación entre dos rasgos manteniendo constantes a los demás, por lo que, si dos rasgos se correlacionan, se están considerando los efectos directos y también los indirectos. Todo esto, ayuda a entender el efecto que tiene el cambio en un rasgo blanco de selección con otros rasgos correlacionados y su influencia en los síndromes de domesticación. Así, el efecto de las correlaciones y los síndromes de domesticación observados (i.e., aumento en el tamaño y número de las hojas, menor capacidad de defensa), parecen estar asociados con compromisos de asignación de recursos, a través de las diferentes formas de manejo e intensidades de selección que ejerce la gente sobre las poblaciones de la especie. Asimismo, muestran que las plantas arvenses tienen un rol importante dentro de los agroecosistemas, tanto para las comunidades rurales que los manejan, usan y aprovechan, como para la comunidad científica que puede encontrar en ellas sistemas de estudio ideales para responder y probar teorías en cuanto a adaptaciones locales, genética cuantitativa, heredabilidad, trade-offs entre rasgos y adecuación, entre otras muchas interrogantes en la ecología evolutiva de especies sujetas a domesticación.











 nueva página del texto (beta)
nueva página del texto (beta)



