El Desierto Chihuahuense alberga una amplia gama de flora silvestre y una maleza con crecimiento agresivo llamada trompillo (Solanum elaeagnifolium Cav.) fue seleccionada para este estudio. Es una especie probablemente con origen en el noreste de México y suroeste de los Estados Unidos de América (Boyd et al. 1984) que se ha distribuido en muchas regiones semiáridas en el mundo (Mekki 2007, Singleton et al. 2020). En particular, esta maleza prospera con tal rapidez que llega a cubrir gran parte de tierras perturbadas y se ha convertido en una planta indeseable en las áreas urbanas y agrícolas (Khare 2007). El trompillo tiene efectos alelopáticos, es hospedero de varias plagas y contiene alcaloides que son tóxicos para el ganado (Mekki 2007). Estos atributos y las condiciones ambientales extremas que prevalecen en las zonas áridas la hacen una maleza muy competitiva y difícil de eliminar (Vigna et al. 1981).
Aslani et al. (2019) indican que las especies invasivas son una amenaza mundial porque ellas modifican la biodiversidad del ecosistema y que los mecanismos por los cuales las endomicorrizas contribuyen a su invasión están sin resolver. Es importante enfatizar que las investigaciones en plantas invasoras en áreas urbanas de zonas áridas y su relación con la microbiología del suelo son raramente investigados. Sin embargo, se ha observado que las plantas invasoras micorrizadas tienen mejores beneficios que las plantas nativas en la competencia por nutrientes, aunque esto ha sido evaluado en condiciones de invernadero (Awaydul et al. 2019, Xia et al. 2020). Las condiciones áridas de la zona urbana de Ciudad Juárez, Chihuahua, México, tales como la escasa precipitación, cambios drásticos de temperatura y pobreza de nutrientes en el suelo, albergan plantas con adaptaciones especiales capaces de establecer simbiosis con microbios (Ali et al. 2018). Por lo tanto, la investigación sobre el patrón de colonización de los hongos septados oscuros (HOS), sus similitudes y/o diferencias relacionada a la colonización fúngica aseptada en el ciclo de vida del trompillo en un ecosistema tan fragmentado por las zonas urbanas áridas no ha sido reportada. Por ejemplo, en el sureste árido de los EUA, los pastos y arbustos fueron más comúnmente colonizados por hongos septados de color obscuro (HOS) que por los hongos micorrízicos comunes (Barrow et al. 1997a, b, Porras-Alfaro et al. 2008). Investigadores reportan que los hongos micorrizógenos arbusculares (HMA) contribuyen a que las plantas sobrevivan en ecosistemas desérticos (Armenta-Calderón et al. 2019) y funcionan en suelos con bajos niveles de materia orgánica y fósforo (Bertolini et al. 2020). Por otro lado, hay reportes que los HOS son o no patógenos de las plantas (Mandyam & Jumpponen, 2005, Pryor et al. 2009) o tienen efectos negativos, neutral o positivos en la salud de las plantas (Newsham et al. 1995) y no está muy claro su función en los ecosistemas áridos. Se ha demostrado que estos hongos, producen sustancias tóxicas causando la muerte de los herbívoros al consumir las plantas de hierba loca (Braun et al. 2003) como también los pastos del género Festuca (Vázquez de Aldana et al. 2014, Petigrosso et al. 2019).
El trompillo presenta alcaloides tóxicos para el ganado (Boyd et al. 1984, Chowański et al. 2016) y con valores medicinales (Muthukumar & Sathya 2017) como la solasodina usado en las preparaciones anticonceptivos, asma o artritis (Maiti & Mathew 1967). Si el trompillo contiene sustancias tóxicas o medicinales y crece agresivamente en ecosistemas urbanos y agrícolas, entonces: ¿cuáles asociaciones fúngicas están relacionadas con cada etapa de crecimiento del trompillo? o ¿acaso los HOS y los HMA podrían estar simultáneamente compartiendo las células radiculares de su hospedero vegetal en cada estación del año? Para contestar estas preguntas, se propuso como objetivo analizar la dinámica de colonización de los hongos septados endófitos y de las micorrizas arbusculares formadas por HMA en cada etapa fenológica del trompillo a través de la microscopia en cuatro muestreos que corresponden a las cuatro estaciones del año.
Materiales y métodos
Recolección de raíz. Las muestras de raíz de S. elaeagnifolium Cav. y suelo fueron colectadas en una población de plantas creciendo naturalmente en un lote baldío del área urbana de Ciudad. Juárez, Chihihuaha, México en las coordenadas de 31° 45’ 0” N y 106° 27’ 0” O. Tres muestras de raíz y suelo se colectaron mensualmente por cada temporada a una profundidad no mayor a 15 cm. Las raíces secundarias más delgadas y cercanas de la raíz principal, fueron colocadas dentro de bolsas plásticas con zíper y transportadas en un contenedor con hielo para evitar su desecación. Al llegar al laboratorio las muestras de raíz se almacenaron dentro del refrigerador a 5 ℃ por un lapso no mayor a 10 días. El suelo libre de raíces se trasportó de igual manera que las raíces y fue usado inmediatamente para determinar el porcentaje de humedad por cada estación del año por medio del secado al horno (110 °C × 24 h). El laboratorio de climatología y calidad del aire, de la Universidad Autónoma de Ciudad Juárez proporcionó los datos del porcentaje de humedad relativa, temperatura ambiental, y precipitación total en milímetros en el año 2014. El muestreo inició en el año 2014 durante el invierno (5 de febrero) y se continuó en la siguiente estación de primavera (10 de mayo), verano (23 de julio) y concluyó en otoño con su fecha correspondiente de 10 de noviembre.
Preparación de doble tinción de la raíz. El procedimiento de tinción de raíz se realizó con el método de Phillips & Hayman (1970) y fue modificado para visualizar y evaluar la colonización de los hongos endófitos (HMA y HOS) quienes fueron teñidos con azul de tripano y sudan IV. El azul de tripano fue para teñir la pared celular de los hongos y el sudan IV para teñir de rojo a los lípidos contenidos en las vacuolas de los hongos en estudio. En hifas hialinas donde el hongo carece de pared celular, el color rojo de los cuerpos de lípidos ayuda a visualizar en forma lineal a lo largo de las hifas (Barrow 2003). La preparación de un litro de tinción con azul de tripano fue con 0.5 g de azul de tripano, 500 ml de glicerol, 500 ml de ácido láctico, se mezcló la solución y se conservó en un frasco ámbar a temperatura ambiente. La tinción de sudan IV, consiste en combinar 3.0 g de sudan IV, con 740 ml de etanol (C2H6O 96 %), aforar a un litro con agua destilada y agitarse para conservarse en un frasco ámbar a temperatura de cuarto. Para la solución de doble tinción se agregó 100 ml de cada solución de azul de tripano y 100 ml de sudan IV (Barrow & Aaltonen 2001). Todas las raíces fueron teñidas con esta dual tinción para observar a las estructuras de los hongos de los HMA y HOS.
Proceso de tinción de las raíces. Las raíces colectadas fueron lavadas con abundante agua corriente para eliminar el suelo de las raíces y fueron disectadas en fragmentos no mayores a 1 cm. Raíces sanas fueron seleccionadas al azar y se colocaron en un tubo de ensaye de vidrio con la solución de hidróxido de potasio (KOH) al 10 %, los cuales después se pasaron a baño maría a una temperatura de 32 ⁰C durante 15 minutos. Las raíces se enjuagaron con agua corriente para retirar el exceso de KOH, y después se clarificaron con peróxido de hidrógeno (H2O2) al 10 % por 10 minutos, seguido de un enjuague con agua, para removerlo (Phillips & Hayman (1970). Una vez clarificadas las raíces se sumergieron en la solución de la doble tinción y en baño maría a 32 ⁰C por un lapso de tres minutos. Después se enjuagaron con agua corriente y se dejaron reposar por 24 horas en ácido acético glacial (CH3COOH) al 5 %.
Cuantificación de colonización. Segmentos de raíces (8 segmentos, 1.0 cm de largo) con seis repeticiones con un total de 48 segmentos por temporada fueron colocados en un portaobjeto en varias gotas de medio para montaje (lacto glicerol). Un cubreobjetos fue colocado sobre las secciones de las raíces y presionado firmemente con un lápiz, para facilitar su observación. Se recorrieron cinco campos visuales de forma vertical por cada fragmento dando un total de 40 campos por laminilla. Se observaron las laminillas al microscopio realizando un recorrido de las raicillas en busca de estructuras que indicaban la colonización micorrízica: (hifas, vesículas y arbúsculos) o/y endófita: (microesclerocios, hifas septadas oscuras, hialinas y vesículas). Se evaluó el promedio de estructuras fúngicas de colonización por milímetro (mm) de longitud de raíz. La magnificación fue a 100x y fue realizado con microscopio Nikon Eclipse Ni-U (modelo: MQS32000. New York, EUA) usando óptico de contraste interdiferencial (DIC, por sus siglas en inglés) unido a una cámara digital tipo alta resolución DS-F12-U3 (modelo: MQA11020. New York, EUA) y el software ProScan III.
Análisis estadístico. Se realizó un análisis de varianza para un diseño completamente al azar y así detectar diferencias entre las estructuras de ambos hongos con su hospedero en las diferentes estaciones del año. Las variables dependientes fueron las estructuras de los hongos y los factores de estudio fueron cada estación del año. El tamaño de muestra (n) fue variable, ya que la aparición y detección de las estructuras fúngicas varió entre 12 a 32, con un promedio de n = 19. La comparación de medias fue con la prueba de Tukey al P ≤ 0.05 y fue utilizado para determinar la mejor respuesta en la colonización total de las estructuras y entre el número de estructuras por mm de longitud de raíz de los hongos ensayados. Los datos fueron analizados con el software SPSS v25.0 para Windows.
Resultados
Muestreo de raíces en la estación de invierno. Las células de las raíces del trompillo fueron colonizadas por estructuras de ambos hongos en forma inter e intracelular (Figura 1). Los HOS presentaron sus estructuras características, tales como hifas septadas melanizadas, hifas intracelulares hialinas, vesículas y microesclorocios, mientras los HMA mostraron hifas cenocíticas lineales intracelulares y enrolladas o en racimos además de cuerpos lipídicos. La colonización total de los HOS en las raíces mostró valores promedios de 50.9 ± 5.7 por mm de longitud de raíz, y los HMA fueron de 22.2 ± 3.4 mm (Tablas 1, 2). Los septos de las hifas que son típicas de los HOS fueron visibles (Figura 1 A). La tinción de la pared celular varió desde un azul fuerte, ligero o hialino al ojo humano. La hifa hialina indica la más mínima deposición de pared celular, casi a nivel de membrana, la cual fue considerada en su fase activa (Figuras 1B, C). Las vacuolas teñidas ligeramente de azul son observadas en forma lineal a lo largo de las hifas hialinas (Figura 1D). Las vesículas de forma circular estuvieron unidas a hifas hialinas dentro de la célula de la raíz (Figura 1E). La morfología de la hifa fue variable, ya que en ocasiones era de un diámetro continuo, uniforme y en otras tomaban formas atípicas, es decir amorfas con diámetros diferentes en algunas secciones (Figura 1F). El sudan IV tiñó los lípidos de color púrpura en lugar de rojos, contenidos en las vacuolas del micelio de los hongos (Figura 1G). En la Figura 1H, el micelio se observa apretadamente empaquetados dentro de la célula, formando así las estructuras de reposo o inactivas llamados microesclerocios. La imagen muestra cuerpos redondos llenos de lípidos en forma de racimos unidos a hifas pigmentadas con azul de tripano a quien se le registró como estructura de los HMA (Figura 1J).

Figura 1 Colonización simultanea de hongos micorrícicos y hongos septados endofíticos en raíces de S. elaeagnifolium en la estación de invierno. A) hifa septada de los hongos endofíticos mostrando leve tinción con azul de tripano de su pared celular. B y C) Hifa interna sin pared celular visible. D) hifa con pared hialina y arreglo en línea de vacuolas con lípidos. E) hifa intracelular hialino de HOS conectadas a vesículas llenas de lípidos. F) Micelio teñido de HOS mostrando su atípica forma cargada de lípidos. G) cuerpo de lípidos. H) Microesclorocio melanizado son llenados con formas irregulares de cuerpos de lípidos mostrando el color rojo de la tinción del sudan IV. J) Un racimo de hifas de HMA con cuerpos esféricos de lípidos. Fotografías: José Ángel Álvarez Olivares.
Tabla 1 Promedio del número de estructuras de asociación micorrízica arbuscular por milímetro de longitud de raíz de S. elaeagnifolium durante las cuatro temporadas del año
| Época | Estructuras de asociación micorrízica | |||
|---|---|---|---|---|
| Colonización total | Hifas | Vesículas | Arbúsculos | |
| Invierno | 22.2 ± 3.4b† | 9.8 ± 1.0b | 5.2 ± 2.4a | 5.1 ± 1.5a |
| Primavera | 31.5 ± 3.2a | 18.4 ± 0.9a | 4.0 ± 0.9a | 7.0 ± 2.0a |
| Verano | 17.4 ± 1.7bc | 17.4 ± 1.7a | 14.2 ± 3.8a | 14.3 ± 3.8a |
| Otoño | 12.5 ± 1.9c | 12.9 ± 1.9b | 8.9 ± 4.3a | 8.4 ± 4.1a |
†Las medias y error estándar con letras diferentes son significativamente diferentes para las épocas del año (Tukey 0.05)
Tabla 2 Promedio del número de estructuras de asociación de hongos endofíticos septados oscuros por milímetro de longitud de raíz de S. elaeagnifolium durante las cuatro temporadas del año.
| Época | Estructuras de asociación de hongos septados oscuros | |||||
|---|---|---|---|---|---|---|
| Colonización total | Hifas sep. | Vesículas | Hifas hialinas | Microesclorocios | ||
| Invierno | 50.9 ± 5.7ab† | 23.1 ± 2.4b | 13.0 ± 3.8b | 5.6 ± 1.3a | 3.7 ± 0.9c | |
| Primavera | 64.2 ± 7.2a | 24.7 ± 2.1b | 9.0 ± 3.2b | 9.8 ± 1.5a | 9.8 ± 2.3ab | |
| Verano | 32.1 ± 2.6b | 32.1 ± 2.6b | 11.8 ± 3.4b | 9.6 ± 1.1a | 5.0 ± 0.8c | |
| Otoño | 59.8 ± 10.8a | 59.8 ± 10.8a | 47.4 ± 9.1a | 4.3 ± 0.7a | 15.9 ± 3.9a | |
† Las medias y error estándar con letras diferentes son significativamente diferentes para las épocas del año (Tukey 0.05).
Muestreo de raíces en la estación de primavera. Se observó el inicio de estructuras activas de la colonización del tipo ‘Arum’ (Figura 2A) de los HMA y continúan las fases activas de los HOS en las células radiculares del trompillo en la estación de primavera. Las células adyacentes contienen rastros de arbúsculos (Figura 2B) mientras el tipo ‘Arum’ están activos justo en la formación de los nuevos brotes del trompillo. Esta etapa fenológica supera significativamente la asociación micorrízica total (31.5 ± 3.2 por mm de longitud de raíz) a la observada en la estación del invierno (22.2 ± 3.4 por mm; Tabla 1). Una amplia red de micelio coloniza rodeando todas las células vegetales y conectándose con el arbúsculo tipo ‘Arum’ (Figura 2C). Las asociaciones de los HOS fueron mayores significativamente en primavera, pero son estadísticamente similares con la estación de invierno (Tabla 2). Sin embargo, se observan sus estructuras como una hifa septada de los HOS fuertemente teñida con azul de tripano con corpúsculos de gránulos de lípidos (Figura 2D) o bien una densa red de hifas septadas hialinas en forma intra o intercelular con o sin lípidos en las células corticales de la raíz (Figuras 2E, F). La Figura 2G muestra una estructura parecido a la de un apresorio como la modificación de la hifa septada que hace contacto con la pared y membrana de la célula de trompillo. Simultáneamente hay deposición de melanina en las hifas cercanas que tiñe fuertemente con azul de tripano que caracterizan el color oscuro de los HOS (Figura 2H).

Figura 2 Estructuras de HOS y HMA colonizando inter o intracelular con el córtex de las raíces de S. elaeagnifolium en la temporada de primavera. A) Arbúsculos de HMA tipo ‘Arum’ocupando casi todo el espacio de las células de la raíz. B) Arbúsculo flácido, después de concluir su actividad fisiológica. C) Alta densidad de hifas aseptadas en forma de red, rodeando la pared celular vegetal, típico de la colonización Tipo ‘Arum’. D) Hifa mostrando la fuerte tinción de azul de tripano con cuerpos lipídicos. E) Lípidos teñidos con sudan IV contenidos en hifas hialinas septadas. F) Hifa hialina septada de los HOS en etapa activa. G) Hifa modificada parecido a un tipo apresorio. H) hifa típica melanizada de color oscuro de los HOS teñidos con azul de tripano. Fotografías: José Ángel Álvarez Olivares.
Muestreo de raíces en la estación de verano. Las microscopias realizadas en verano utilizando las muestras de raíces de trompillo (Julio 22) continúan con la presencia de ambos tipos de hongos en su hospedero. El promedio de longitud de raíz por mm de colonización total de los HOS fue de 32.1 ± 2.6 y para los HMA de 17.4 ± 1.7 (Tablas 1, 2). Los tres tipos de estructuras encontradas en HMA fueron las hifas cenocíticas, vesículas y arbúsculos. La hifa no septada típica de una colonización de arbúsculos tipo ‘París’ fue prominente dentro de una célula vegetal, quien tuvo la habilidad de empaquetarse ocupando casi toda la célula (Figura 3A). Otras hifas hialinas que escapan a la tinción colonizan intercelularmente conectando las células (Figura 3B). Vesículas prominentes en forma esférica acumulando lípidos (Figura 3C) y vesículas ovaladas-aplanadas (fuera de enfoque) son unidas a los extremos de las hifas (Figura 3D) consideradas como estructuras de HMA. Como evidencia de la presencia de los HOS se encontraron hifas septadas hialinas intracelulares con divisiones o intervalos irregulares por tabiques o paredes transversales que dividen a las hifas en células corticales de la raíz (Figura 3E). Aunque el micelio es hialino, se logra observar ligeramente una línea de lípidos donde los HOS acumulan fuentes de carbono (Figura 3F). Se requirió la tinción de sudan IV para teñir los cuerpos de lípidos y de esta manera con una examinación cuidadosa fue posible rastrear las redes finas de hifas como la continua asociación inter o intracelular. Fue común que las hifas tiñeran o no de color azul y se distinguiera las que rodeaban la pared celular fueran las no septadas (Figura 3G) y las intracelulares correspondían a las hifas septadas hialinas (Figuras 3 E-F, H).
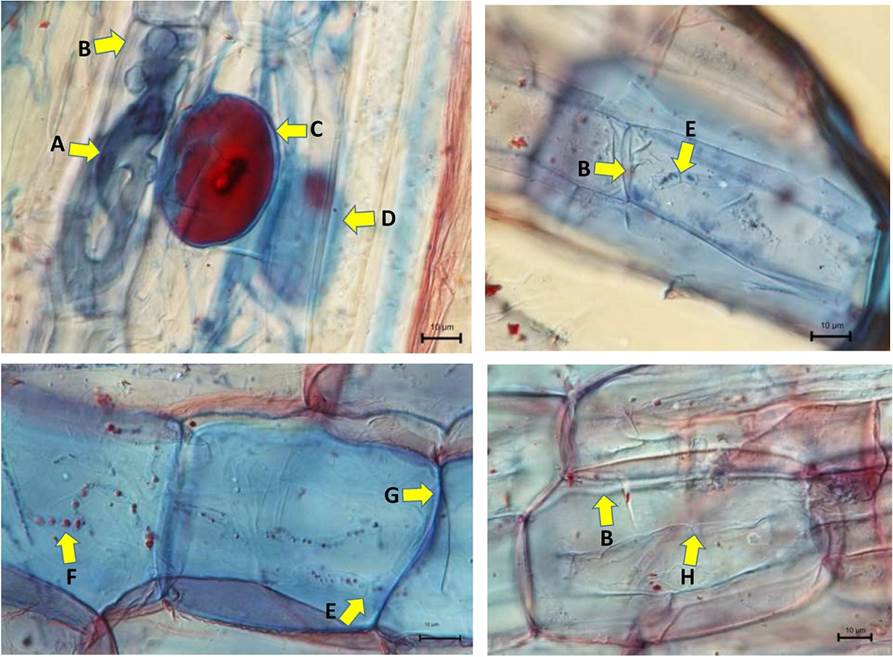
Figura 3 Presencia de ambas asociaciones fúngicas HMA y HOS en el córtex de las raíces de S. elaeagnifolium en la temporada de verano. A) Micorrizas arbusculares con colonización tipo ‘Paris’, ocupando casi todo el espacio de la célula vegetal. B) Hifas hialinas intercelulares conectando las células. C) Vesículas esféricas con lípidos y D) vesícula ovalada-aplanada formándose en el extremo de las hifas del hongo micorrícico. E) Hifas hialinas septadas intracelulares en la fase activa con corpúsculos de lípidos con respuesta positiva al colorante azul de tripano. F) Hifas septadas intracelulares distinguibles solamente como un arreglo lineal de cuerpos de lípidos teñidos con sudan IV en el córtex de la raíz. G) Hifas aseptadas teñidas con azul de tripano rodeando las células del córtex de la raíz. H) Hifas hialinas septadas intracelulares vacías de lípidos en la fase activa. Fotografías: José Ángel Álvarez Olivares.
Muestreo de raíces en la estación de otoño. En la estación de otoño, siguió consistente el tipo ‘París’ de las micorrizas arbusculares con micelio intracelulares en forma de espiral que ocuparon un gran espacio de la célula vegetal (Figura 4A). Aunque el micelio fue positivo para la tinción de azul de tripano, la tinción roja de lípidos con sudan IV no tuvo buena respuesta. Sin embargo, corpúsculos de lípidos sin tinción fueron observados a lo largo del micelio no septado (Figura 4B). Una hifa emergiendo entre dos células se conecta con la estructura tipo ‘Arum’, muy próxima a la célula de la raíz que contiene el tipo ‘París' (Figura 4C). Las mismas muestras de raíz demostraron las estructuras de arbúsculos del tipo ‘Arum’ (Figura 4D) asociada a una red intercelular rodeando cada célula vegetal (Figura 4E). En las muestras de las raíces en otoño, se observa que la colonización total de los HMA fue la más baja comparada con el resto de las estaciones (Tabla 1). Sin embargo, colonización total y la cantidad de hifas septadas, vesículas y microesclorocios de los HOS se incrementaron significativamente (Tabla 2). Los HOS hacen presencia en todas sus formas desde micelio melanizado (Figura 4F) conteniendo cuerpos de lípidos (Figura 4G), iniciando microesclerocios (Figura 4H), e hifas hialinas fisiológicamente activas (Figura 4J). No obstante, las tinciones positivas de la pared celular con azul de tripano de las hifas septadas dentro de las células (Figura 4K) podrían indicar el inicio de su dormancia. Al momento de la toma de la muestra de raíces, el suelo registró una humedad del 4.50 %, (Tabla 3). Las tinciones de las raíces mostraron las colonizaciones micorrízicas del tipo ‘Arum’ y ‘París’ y la decadencia de las fases activas (hifas hialinas) de los HOS.

Figura 4 Micorrizas arbusculares con colonización tipo ‘París’ y ‘Arum” y endófitos septados oscuros en la temporada de otoño. A) Colonización tipo ‘París’. B) Hifa no septada de HMA conteniendo cuerpos lipídicos. C) Hifa emergiendo entre dos células conectándose con arbúsculo tipo ‘Arum’. D) Colonización de arbúsculos intracelulares tipo ‘Arum’. E) Hifas típicas intercelulares de la colonización tipo ‘Arum’. F) Hifa septada melanizada oscuro típica de los HOS. G) Hifa de HOS conteniendo cuerpos de lípidos. H) Inicio en la formación de microesclerocios como un indicador de los principios de la dormancia de los HOS. J) Hifa hialina septada con trazas de cuerpos de lípidos. K) Hifa septada con tinciones positivas al azul de tripano. Fotografías: José Ángel Álvarez Olivares.
Tabla 3 Condiciones ambientales al momento de la toma de muestra de raíces de S. elaeagnifolium en la zona urbana en las cuatro temporadas de invierno, primavera, verano y otoño del 2014 en Ciudad Juárez, Chihuahua, México.
| Época | Fecha | T (°C) máxima |
T (°C) mínima |
Humedad relativa (%) |
Humedad suelo (%) |
Precipitación (mm) |
|---|---|---|---|---|---|---|
| Invierno | 5 febrero | 8 | 3 | 58 | 1.5 | 0 |
| Primavera | 10 mayo | 32 | 14 | 19 | 2.20 | 0 |
| Verano | 23 julio | 36 | 21 | 90 | 3.00 | 0.08 |
| Otoño | 10 noviembre | 26 | 11 | 63 | 4.50 | 1.55 |
En general, de acuerdo con el análisis de varianza para las micorrizas arbusculares, se detectó efecto significativo para hifas entre épocas del año (F = 8.036, P = 0.001). El efecto de la estación no fue significativo para el número de vesículas (F = 1.446, P = 0.242). También no se detectó efecto significativo para los arbúsculos entre estaciones (F = 1.581, P = 0.204). El resultado del análisis de varianza para los HOS, mostro diferencia significativa para hifas septadas entre épocas del año (F = 7.555, P = 0.001) como también para el número de vesículas se encontró efecto significativo (F = 8.024, P = 0.001). No se detectó efecto significativo para hifas hialinas entre estaciones (F = 1.321, P = 0.28). En contraste, para microesclerocio el efecto entre épocas del año fue altamente significativo (F = 6.172, P = 0.004) .
Discusión
Los resultados indican que la dinámica de estructuras desarrolladas tanto de los hongos septados oscuros (HOS) como de las micorrizas arbusculares fue variable en cada estación del año. Es evidente que los HOS y los HMA compartieron simultáneamente las células radiculares de su hospedero vegetal en cada estación del año en una zona urbana del Desierto Chihuahuense. En la estación de invierno, las estructuras de los HOS en las raíces inician con la transición de la etapa de estructuras en reposo (microesclorocios) a la activa (hifas hialinas) justo en la etapa de dormancia del trompillo mientras que los HMA están en la etapa de micelio. Las hifas hialinas de los HOS, indica que la pared celular de la hifa es muy delgada, debido a que la reacción del azul del tripano con los componentes de la pared celular es mínima. Resultados similares fueron observados en las raíces de Atriplex canescens (Pursh) Nutt. en la zona árida del sureste de los EUA (Barrow & Aaltonen 2001). Dentro de la célula, el hongo modifica su pared celular a muy delgada casi a nivel membrana, que podría indicar una evidencia de una colonización inter e intracelular en las raíces del trompillo. Las hifas hialinas, es la fase activa de los HOS que posiblemente le confiere cierta flexibilidad para contener diferentes tamaños de cuerpos de lípidos (Barrow 2003, Lucero et al. 2008).
En el presente estudio se registraron las variables dependientes de estructuras de los hongos por estaciones del año según los muestreos realizados, pero no se midieron a diferentes humedades relativas, humedad del suelo o eventos de precipitación pluvial variados dentro de cada estación del año. Por lo que la información climática y de suelo mostrada en la Tabla 3, es de apoyo en la explicación científica de la detección de estructuras fúngicas que es la relevancia del estudio. Por ejemplo, los valores de la temperatura en invierno con una máxima de 8 ℃ y una mínima de 3 ℃, la humedad relativa (58 %) y la humedad del suelo con 1.5 % puede especularse que esté relacionada con la actividad de ambos hongos y la fenología de la planta .
La presencia de la colonización dentro de las raíces de los MA tipo ‘Arum’ y el aumento de las hifas hialinas en los HOS demuestran que la asociación de estos hongos es simultánea con las raíces del trompillo en la estación de primavera. Los arbúsculos son estructuras activas típicas de la asociación micorrízica arbuscular. El micelio de los HMA y de los HOS son estructuras filamentosas características en la etapa vegetativa de la mayoría de los hongos que conectan la planta con el suelo y que parecen tener relevancia en la sobrevivencia de las plantas en condiciones de elevado estrés ambiental (George et al. 1992, Smith & Read 2008, Tahtamouni et al. 2016, De Oliveira et al. 2019, Quiroga et al. 2020). La acumulación de lípidos en el micelio hialino indica que los HOS están involucrados en la translocación del carbono con su hospedero (Barrow & Aaltonen 2001). La formación de un apresorio en la superficie de la célula de trompillo sugiere que es la forma de entrada o infección de los HOS tal como lo hacen los HMA. Muthukumar & Sathya (2017) observaron esta estructura como una forma común de colonización ‘peg’ de los HMA (Gigasporaceae) penetrando las células rizodermales de Solanum nigrum L. La colonización intracelular de los HOS invadiendo la célula radicular del trompillo, podría atribuirse a que no tiene funciones fitopatogénicos, ya que las plantas fenotípicamente están sanas. La falta de microesclorocios y el aumento de transición de las hifas melanizadas a las hialinas en los HOS pudo ser causado por el cambio de la fase dormante a la actividad fotosintética del trompillo. En esta estación de primavera se registraron 32 ℃ de temperatura, 19 % de humedad relativa y la humedad en el suelo en un 20 %.
Los arbúsculos en los HMA y la presencia de hifas hialinas en los HOS representan evidencias de asociación entre estos hongos y las raíces del trompillo en la estación de verano. Los HMA mostraron sus vesículas, micelio y colonización del tipo ‘París’. La colonización del tipo de ‘París’ es común en plantas silvestres y es caracterizada por hifas intracelulares empaquetadas sin hifas intercelulares (Smith & Read 1997, Fonseca et al. 2009). Los HOS con sus hifas hialinas septadas intracelulares contienen más cuerpos de lípidos alineados a lo largo de las hifas y ausencia de microesclorocios. La diversidad de la distribución de las estructuras fúngicas en las raíces coincide con la etapa pico de necesidades esenciales del trompillo. En las condiciones ambientales del verano, el trompillo está en plena multiplicación vegetativa con más actividad fotosintética, producción de flor y fecundación (Khare 2007). El alto nivel de colonización de los HMA (hifas, vesículas y arbúsculos) y de HOS (hifas septadas, melanizadas y numerosos esclorocios) son observados en la etapa de floración de Helianthus tubersosum L. en condiciones áridas del Argentina (Di Barbaro et al. 2017). En las temperaturas máximas de verano como la de primavera (36 °C y 32 °C respectivamente), fueron más notorias las hifas hialinas con gránulos de lípidos en los HOS y con la formación de vesículas prominentes en tamaño y morfología diversa en HMA. La morfología diversa de las vesículas en las raíces de Helianthus tuberosus L. se le atribuye a la colonización de diversas especies o géneros de HMA (Di Barbaro et al. 2017). Ray et al. (2019) concluyeron, por ejemplo, que los cambios en los contenidos de lípidos es una clave estratégica adoptada por los HOS de la familia de Serendipitaceae para aliviar la falta de fósforo.
Las condiciones ambientales de otoño indican que los HOS incrementan su colonización y sus estructuras inician sus fases de reposo, mientras que los HMA presentan aun estructuras activas en las raíces del trompillo en la etapa de maduración del fruto. Al momento de la toma de muestras de las raíces, la humedad del suelo fue 4.50 % y con la tendencia a la baja de la temperatura, la colonización simultanea del tipo ‘Arum’ y ‘París’ fueron observadas (Fisher & Jayachandran 2005, Smith & Read 2008). Armenta-Calderón et al. (2019) encontraron que la colonización de los HMA varía entre las estaciones del año y está relacionado a la temperatura, humedad del suelo y del genotipo de las plantas nativas en el desierto Sonorense. La colonización micorrízica arbuscular tipo ‘Arum’ es frecuente en cultivos agrícolas y se forma a partir de hifas que se dividen dicotómicamente, invaginándose por la membrana plasmática de las células corticales. La colonización tipo ‘París’ es observada en plantas silvestres y se empaqueta dentro de la célula donde ambas realizan su actividad simbiótica en el intercambio de nutrientes con la planta (Urcelay et al. 2005). La presencia de ambos tipos de colonización de los MA fue asociada con las etapas de maduración de los frutos y con el típico amarre fuerte de los frutos, aun cuando el trompillo esta senescente. Los cultivos inoculados con HMA incrementan significativamente la absorción de fósforo y otros minerales que contribuyen a la producción de frutos con nutrientes balanceados que evitan su caída prematura (Ortas 2018). Géneros de HMA son biofertilizantes potenciales como fuente de fósforo en campos agrícolas (Balestrini et al. 2020) y son proveedores de nitrógeno en diferentes ecosistemas (Ray et al. 2019) o micronutrientes en suelos marginados (Cardoso & Kuyper, 2006). En contraste, las fases activas de los HOS van disminuyendo e inician la formación de los microesclorocios. Esto es influenciado por las bajas temperaturas tanto en otoño como en invierno y coincide con la declinación gradual de la actividad en la planta de trompillo. Las hifas se oscurecen porque es algo característico de los HOS debido a la acumulación de melanina la cual las protege de la deshidratación (Jumpponen & Trappe, 1998, Barrow & Aaltonen, 2001, Di Barbaro et al. 2017).
En general, lo más sorprendente fue la colonización interna de múltiples estructuras tanto de hongos septados como aseptados en las células de las raíces durante el ciclo de vida de las plantas saludables de trompillo en las condiciones extremas de sequía y temperaturas en el Desierto Chihuahuense. La presencia también de los HOS en las plantas nativas de Colobanthus quitensis (Kunth) Bartl. juega un papel relevante en su adaptación a las condiciones de baja temperatura y extrema aridez en la Antárctica (Hereme et al. 2020). En las estaciones de primavera, verano y otoño, las plantas en campo no mostraron síntomas de enfermedad, lo cual sugiere que la red de micelio hialinos intracelular de los HOS tiene una función ecológica significativa con su hospedero (Mandyam & Jumponen 2005, Reyes-Jaramillo et al. 2020). Similarmente, plantas micropropagadas exitosamente in vitro de Atriplex spp. y Bouteloua eriopoda (Torr.) Torr. son asociadas con la colonización asintomática de HOS (Barrow & Osuna 2002, Lucero et al. 2008, Lucero et al. 2011).
Muthukumar & Sathya (2017), fueron los primeros en reportar que S. elaeagnifolium era una especie micotrófica. Ellos observaron que las raíces presentaban solo una colonización micorrízica tipo ‘París’, pero con la ausencia de la típica micorriza tipo ‘Arum’ en diferentes sitios de ecosistemas tropicales. Los arbúsculos capturados en nuestras imágenes valida que el trompillo es en efecto una especie micotrófica, pero es el primero en reportar la colonización tipo ‘Arum’ durante las estaciones de primavera y otoño en condiciones áridas. La dual colonización fúngica revelada por los resultados contrasta con sus observaciones en sus raíces teñidas solo con azul de tripano donde eran cuatro veces más colonizadas por los HMA que los HOS. Aunque Muthukumar & Sathya (2017) reportan que es una especie micorrízica, no muestran detalles de las estructuras morfológicas de los HMA en S. elaeagnifolium. Asimismo, este estudio revela la presencia de los HOS con hifas hialinas inter o intracelulares con o sin cuerpos lipídicos observadas mediante contraste interdiferencial y la doble tinción (azul de tripano y sudan IV), lo que podría indicar que los HOS fueron subestimados por Muthukumar & Sathya (2017). Esto coincide con lo reportado por Yu et al. (2001), quienes afirman que las hifas hialinas (perdida parcial o total de la pared celular) que ocurre en la colonización de los HOS puede ser ignorado, debido que son difícil de detectar. La presencia de microesclerocios en los HOS fue asociada más a la etapa dormante o relativamente inactiva del hospedero que podría indicar su fase inactiva y para las micorrizas sería la ausencia de arbúsculos. Las estructuras más activas de los hongos endofíticos como las hifas hialinas y los arbúsculos en los HMA fueron consistentes en todas las estaciones. La colonización de ambos hongos sugiere que podrían tener alguna función ecológica complementaria posiblemente relacionada con la fisiología del hospedero y con las condiciones ambientales en las que habita (Hereme et al. 2020). Los HOS pueden incrementar la absorción de minerales de las plantas tal como lo realizan los HMA (Gasoni & De Gurfinkel 1997) y hacer simbiosis con diferentes plantas que mejoran el crecimiento, su reproducción y las protegen contra factores abióticos y bióticos en diferentes ecosistemas (Saikkonen et al. 2016, Li et al. 2019, Zuo et al. 2020). Los resultados de este estudio se suman a los escasos estudios sobre la interacción conjunta de los HMA y HOS en plantas de zonas áridas.
En conclusión, este es el primer reporte en describir la dinámica estacional de las micorrizas arbusculares con la co-ocurrencia de hongos endofíticos septados oscuros en relación con la fenología de Solanum elaeagnifolium en lotes abandonados en una zona urbana del Desierto Chihuahuense. Además, es relevante mostrar el primer informe de la presencia de colonización tipo ‘Arum’ asociado a trompillo en una región árida. Las consistentes asociaciones fúngicas encontradas durante el ciclo de vida del trompillo sugieren que ellos tienen una función ecológica significativa. En futuras investigaciones estas asociaciones fúngicas podrían tener el potencial colonizar a cultivos agrícolas, plantas propagadas tradicionalmente o in vitro que podrían auxiliar en el establecimiento y desarrollo tanto en invernadero como en condiciones de campo de producción comercial orgánica. Debido a la importancia ecológica, las técnicas moleculares serian esenciales para detectar la diversidad de especies en los HMA y los HOS. Como posible perspectiva, sería importante determinar si los HOS están participando en la síntesis de varios alcaloides en el trompillo que son tóxicos para algunos herbívoros u otros metabolitos con propiedades medicinales en la región de Chihuahua, México.











 nueva página del texto (beta)
nueva página del texto (beta)



