La fragmentación del paisaje es un proceso presente prácticamente en todo el mundo y es uno de los principales factores ambientales que amenazan la conservación de la biodiversidad (Herrera & García 2010). Este proceso puede afectar diferentes aspectos de la ecología de un sistema, desde procesos ecosistémicos como la descomposición de la materia orgánica (Moreno et al. 2014) hasta aspectos como la dispersión de semillas (Condit et al. 2002, Bacles et al. 2006, Seifert & Fischer 2010) e inclusive la calidad de progenie de las plantas (Aguilar et al. 2019). Una de las principales consecuencias de las alteraciones que produce la fragmentación es una acelerada pérdida de especies de los ambientes fragmentados (Pardini et al. 2017).
La dispersión de semillas es el punto de partida de los procesos de reclutamiento de plántulas y renovación de poblaciones (Harper 1977, Herrera et al. 1994). Una vez que ocurre la dispersión, las fases de germinación de semillas y establecimiento de plántulas son de las más vulnerables en los ciclos de vida de las plantas, ya que dependen de condiciones ambientales específicas (Watson et al. 1997, Marañón et al. 2004). En ambientes áridos se considera que el establecimiento de plántulas ocurre con mayor frecuencia en microambientes que se forman debajo de plantas nodriza (Flores & Jurado 2003), por lo que éstas juegan un papel importante en el proceso de regeneración (Castillo-Landero & Valiente-Banuet 2010, Pérez-Sánchez et al. 2015). La importancia de plantas nodriza puede ser mayor en la recuperación de la diversidad de los paisajes fragmentados (Linares 2013).
La dispersión de semillas a sitios debajo de plantas nodriza ocurre principalmente por zoocoria, con frecuencia por aves que consumen los frutos y desechan semillas viables (Godínez-Alvarez & Valiente-Banuet 1998). Los límites entre la vegetación natural y los espacios abiertos a agricultura, ganadería o desarrollo creados en el proceso de fragmentación influyen en la dinámica de los fragmentos. Por ejemplo, las plantas de los bordes tienen más acceso a luz que en el interior de los fragmentos (Asbjornsen et al. 2004) y podrían tener menor competencia por agua y nutrientes. En algunos ecosistemas de bosques subtropicales secos tanto de Sudamérica como de Norteamérica, las aves frugívoras pasan más tiempo en los bordes de los fragmentos de vegetación (López de Casenave et al. 1998, Padilla-Rangel 2013). Mientras que en el interior de los fragmentos de vegetación se ha detectado una mayor remoción de frutos y semillas (Jurado et al. 2006) y menor número de especies germinando quizá como resultado de una menor exposición a la luz y mayor competencia por agua (Jurado et al. 2001b, García & Jurado 2003, García 2011).
Los bosques secos son uno de los biomas más afectados por los cambios del uso del suelo, particularmente la deforestación con fines agrícolas y ganaderos (Zak & Cabido 2002, Zak et al. 2004, Jiménez-Pérez et al. 2009, Mora-Donjuán et al. 2013). Los fragmentos de bosque son de gran importancia para la conservación de las áreas remanentes (Haddad et al. 2015) y la conectividad funcional dentro y entre fragmentos mediada por el movimiento de aves frugívoras puede promover la dispersión de semillas de especies dispersadas por aves (Díaz-Vélez et al. 2015). Los bosques secos de Argentina y México son deforestados a tasas muy altas (Zak & Cabido 2002, Zak et al. 2004, Jiménez-Pérez et al. 2009, Mora-Donjuán et al. 2013), por lo que comprender el efecto de estos procesos es fundamental para planes de conservación y manejo (Huxel & Hastings 1999). En el presente trabajo estudiamos si el borde de la vegetación y el síndrome de dispersión de las especies de árboles tienen influencia en la dinámica de regeneración de dos especies del género Zanthoxylum, Z. fagara y Z. coco, en bosques secos de México (Matorral Espinoso Tamaulipeco) y de Argentina (Chaco Serrano). Se estudiaron dos especies filogenéticamente relacionadas en diferentes ambientes debido a su historia evolutiva común (Harvey & Pagel 1991), con el fin de comprender las diferencias en rasgos ecológicos asociados a la adaptación a diferentes hábitats.
El matorral espinoso tamaulipeco es una densa vegetación espinosa con arbustos y árboles de 4 m de altura, compuestos principalmente de plantas leñosas perennes de hojas pequeñas, así como de hierbas y gramíneas (Reid et al. 1990a, b). Este tipo de matorral presenta un clima semiárido subtropical con veranos cálidos y húmedos y heladas severas en algunos inviernos; la temperatura promedio es de 22.4 °C; la precipitación promedio anual es de 800 mm; el periodo de lluvias ocurre entre abril - junio y agosto - octubre (García 1988). El matorral espinoso tamaulipeco es bastante homogéneo en apariencia; sin embargo, se han encontrado más de 22 especies de arbustos en parcelas de 0-1-ha. Las especies dominantes son Acacia berlandieri Benth., A. farnesiana (L.) Willd., A. greggi A. Gray A. greggi Benth., A. rigidula Benth., Celtis pallida Torr., Condalia hookeri M.C. Johnst., Cordia boissieri A. DC, Diospyros texana Eastw., Eysenhardtia texana Sarg., Forestieria angustifolia Torr., Helietta parvifolia (A.Gray) Beneth., Leucophyllum texanum Benth, Mimosa biuncifera Benth., Pithecellobium pallens Standl., Pithecellobium ebano (Berland.) C.H. Mull. y Zanthoxylum fagara (L.) Sarg. (Návar et al. 2001).
Al igual que el matorral espinoso tamaulipeco, el bosque chaqueño serrano se caracteriza por ser estacionalmente seco (Luti et al. 1979, Zak & Cabido 2002). El período de máximas precipitaciones se extiende en la época cálida, de octubre a marzo con un promedio anual de 725 mm y la temperatura media anual es de 16 ºC (Giorgis et al. 2011). La vegetación característica está dominada por árboles de 8-15 m de altura, de hojas pequeñas, con especies como Aspidosperma quebracho-blanco Schltdl., Lithrea molleoides (Vell.) Engl., Prosopis spp., Schinopsis lorentzi y Zanthoxylum coco Gillies ex Hook. & Arn.; por arbustos (1.5-3 m) como Celtis pallida Torr. y Acacia spp.; hierbas (< 1 m) y por muchas enredaderas y bromelias epífitas. La vegetación nativa está actualmente restringida a parches aislados dentro de una matriz intensamente administrada (Cagnolo et al. 2006, Cabido et al. 2010).
En el matorral espinoso tamaulipeco, donde estudiamos Z. fagara se ha determinado que la riqueza y abundancia de vertebrados, específicamente aves (potenciales dispersores) son mayores en el borde de la vegetación que en el interior (quizá por el efecto de borde) (Padilla-Rangel 2013). Z. coco es consumida y dispersada por aves nativas del bosque chaqueño (Ponce et al. 2012, Díaz-Vélez et al. 2015), las cuales son más abundantes en el borde de la vegetación (López de Casenave et al. 1998) y favorecen su germinación al pasar las semillas por sus tractos digestivos (Díaz-Vélez et al. 2017). De acuerdo con lo anterior se espera encontrar más semillas y plántulas de las especies estudiadas en el borde que al interior de la vegetación. Puesto que las aves frugívoras pasan más tiempo en árboles cuyas semillas poseen síndrome de dispersión por aves (Takanose & Kamitani 2003), se espera también que la densidad de semillas y plántulas de las especies de estudio sean mayores bajo estos árboles que bajo árboles con semillas con diferente síndrome de dispersión.
Materiales y métodos
Biología de las especies estudiadas y tipos de vegetación. Colima, uña de gato, limoncillo son nombres comunes que se le han dado a Zanthoxylum fagara (L.) Sarg. Es en general un arbusto o árbol pequeño, de hasta 9 metros de altura, aromático, muy espinoso y siempreverde, tiene hojas alternas, impar-pinnadamente (Everitt et al. 2002). La floración ocurre en invierno - primavera, con flores pequeñas, verde amarillentas y la fructificación ocurre de octubre a diciembre, puede extenderse hasta febrero, siendo el fruto un folículo marrón de una sola semilla (Everitt et al. 2002, Alvarado-Vázquez 2003). En Brasil se documenta, que esta especie es dispersada por aves (Pillatt et al. 2010), mientras que, en Ecuador, en las Islas Galápagos, se reporta como una especie dispersada por algunos roedores y reptiles como lagartijas (Clark 1981, Heleno et al. 2013, Nogales et al. 2017). Z. fagara se puede encontrar en diversos tipos de vegetación como en bosques tropicales, bosque espinoso, matorral xerófilo, bosque de Quercus, bosque de coníferas y bosque mesófilo de montaña ya que es la especie de distribución más amplia del género Zanthoxylum (Puga-Jiménez et al. 2013). En Norteamérica se distribuye en Texas y Florida, EUA y en diversos estados de México mientras que en el centro y sur de América se registra desde Guatemala hasta Argentina (Zuloaga et al. 2008, Puga-Jiménez et al. 2013). Los usos de Z. fagara van desde ser una fuente importante de alimento para venados cola blanca, en especial por su alto valor nutricional, hasta un frecuente sitio de anidación para aves paseriformes (Everitt et al. 2002, Alvarado et al. 2012). Esta especie fue estudiada en el matorral espinoso tamaulipeco compuesto por alrededor de 60 especies leñosas que se utilizan como fuente de recursos maderables y para la producción de forraje para la ganadería (Von Maydel 1996, Domínguez-Gómez et al. 2013). Las plantas leñosas se caracterizan por tener un amplio intervalo de patrones y dinámicas de crecimiento (Reid et al. 1990a, Domínguez-Gómez et al. 2013). La mayoría de las especies germinan en otoño y algunas en primavera, coincidiendo con los meses de mayor precipitación pluvial (Flores & Jurado 1998, Jurado et al. 2000, García & Jurado 2003).
Zanthoxylum coco Gillies ex Hook.f. & Arn. es conocido con el nombre común de coco o cocucho. Es un árbol de 4-10 metros de altura. Desarrolla una copa globosa, es caducifolio con tallos grises que contienen pequeñas espinas cónicas de color grisáceo, mientras que, las ramas jóvenes tienen rectas espinas de color marrón claro (Oggero et al. 2016). Las hojas son pinnaticompuestas, alternas, color verde oscuro. Las flores son imperfectas, blanco verdosas, de aproximadamente 5 mm de diámetro y aparecen de agosto a mayo y los frutos son folículos dehiscentes, pequeños, de unos 5-7 mm de diámetro, de superficie rugosa, morados a la madurez, agrupados en racimos pendulares y al abrirse dejan ver una semilla negra, lustrosa y de textura aceitosa al tacto, esta especie fructifica de octubre a marzo (Demaio et al. 2015). Los frutos son consumidos y dispersados por algunas especies de aves como Elaenia parvirostris, Pitangus sulphuratus, Saltator aurantiirostris (Ponce et al. 2012, Díaz-Vélez 2013). Se distribuye hasta los 1,300 m snm en Argentina (Provincias de Catamarca, Córdoba, Jujuy, La Rioja, Salta, San Luis, Tucumán), Bolivia y Paraguay (Instituto De Botánica Darwinion). Bajo Z. coco se colecta el hongo Phlebopus bruchii (Speg.) para su venta, es nativo y muy preciado, pero no se conoce si forman una asociación de ectomicorriza (Deschamps & Moreno 1999, Nouhra et al. 2008). Esta especie fue estudiada en el bosque chaqueño serrano, que pertenece a una parte del gran chaco, ubicada al centro-norte de Argentina (Luti et al. 1979). Esta región provee de importantes servicios ambientales, siendo la captación de agua la de mayor relevancia ya que se encuentran las cuencas de los ríos que abastecen alrededor del 80 % de la población de la Provincia de Córdoba, Argentina (Giorgis et al. 2011). Ambos tipos de vegetación incluyen árboles y arbustos que se ramifican cerca de la base, sin embargo, algunas especies pueden tener individuos arbóreos y arbustivos (Domínguez-Gómez et al. 2013, Giorgis et al. 2011). A lo largo del manuscrito nos referiremos a árboles para todas las especies leñosas.
Las parcelas de muestreo de Z. fagara fueron distribuidas en fragmentos de matorral espinoso tamaulipeco localizado en el Municipio de Linares, Nuevo León en la Facultad de Ciencias Forestales, Universidad Autónoma de Nuevo León, México, con las coordenadas: 24° 47’ 43. 00’’ N 99° 32’ 29.51’’O y una elevación de 379 m snm.
Las zonas de muestreo de Z. coco se localizaron en las Sierras Chicas en Córdoba, en el centro de Argentina, donde se ubica el Distrito Chaqueño Serrano, entre las coordenadas 31° 3' 39" S 64° 12' 27" O y 30° 52' 57 " S 64° 13' 1” O y una altitud media de 740 m snm.
Diseño experimental. Se utilizaron ocho parcelas por fragmento. Debido a la baja disponibilidad de sitios para realizar el muestreo Z. fagara, las ocho parcelas se distribuyeron en 2 fragmentos, mientras que para Z. coco se utilizó una parcela por fragmento (ocho fragmentos). Cada parcela fue rectangular, un lado paralelo sobre el borde de la vegetación midió 30 metros y el otro, 40 metros hacia el interior de la vegetación (Figura 1). En cada parcela se contó y registró el número de plántulas de las especies bajo estudio. Dentro de las parcelas se establecieron subparcelas de 5 × 30 m paralelas al borde con el fin de determinar el efecto de la distancia al borde. Estas subparcelas se ubicaron de los 0 a 5 m del borde (borde) y de los 35 a 40 m hacia el interior del fragmento (interior) (Figura 1).
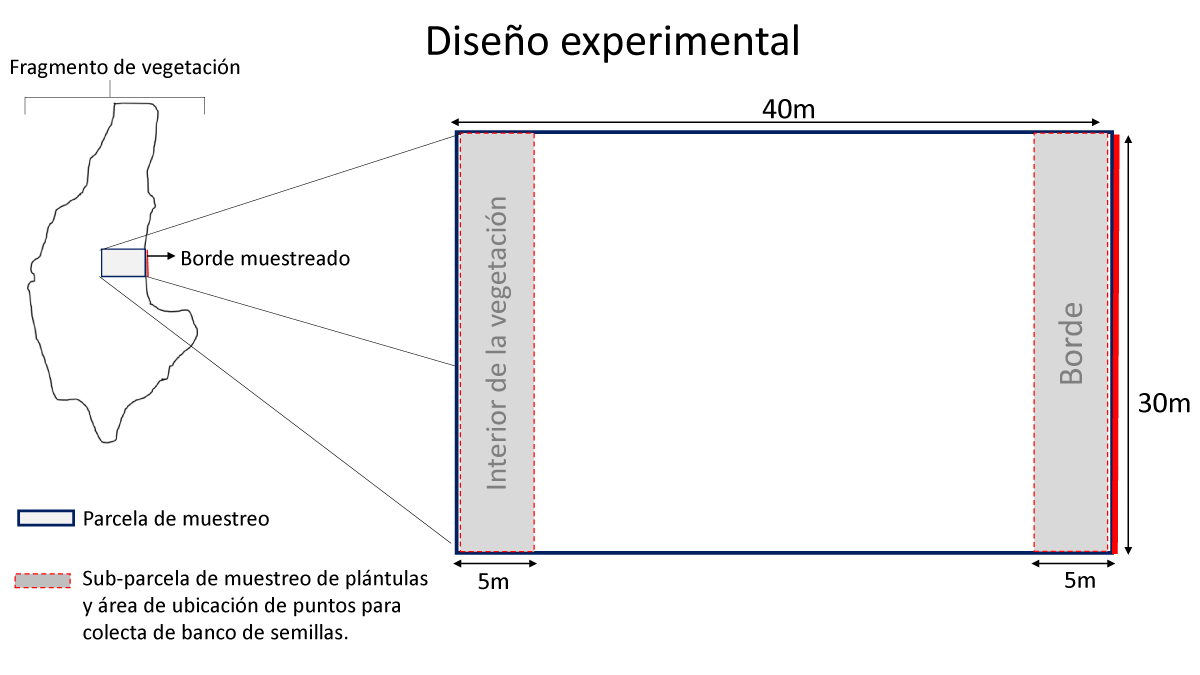
Figura 1 Esquema de parcela de muestreo dentro de un fragmento de vegetación remanente. Las sub-parcelas de borde e interior fragmento fueron utilizadas para el muestreo de semillas.
En las parcelas de 30 × 40 metros, se contó y registró el número de plántulas de las especies bajo estudio. En estas parcelas se identificó la especie bajo la que se encontró cada plántula de Zanthoxylum spp. y se midieron dos diámetros (m) perpendiculares de su copa. El tipo de dispersión de cada especie bajo cuyas copas se encontraron plántulas de Zanthoxylum spp. se determinó mediante la literatura (Jurado et al. 2001a, Voigt et al. 2011, Ponce et al. 2012, Dellafiore 2016). Mediante el promedio de los diámetros de copa se determinó el área de copa de cada árbol para posteriormente calcular la densidad promedio de plántulas bajo cada especie. Para determinar diferencias entre especies con distintos tipos de dispersión se agruparon en las siguientes categorías: 1) Plantas con frutos dispersados por fauna y 2) Plantas con otros tipos de dispersión (agrupando plantas anemócoras, explosivas y sin dispersión aparente).
En las subparcelas de 5 × 30 metros se contaron las plántulas de cada especie para determinar la densidad de plántulas en el borde e interior del fragmento (Figura 1). Además, con el objetivo de determinar la densidad de semillas, se establecieron 40 puntos para colecta de muestras de suelo para cada especie estudiada. Estas áreas fueron seleccionadas de manera sistemática, manteniendo una distancia mínima de 10 metros entre cada una y asegurándose de distribuir 20 puntos para colecta en borde y la misma cantidad para el interior del fragmento.
Las muestras fueron colectadas en áreas de 20 × 20 cm y 2cm de profundidad, con ayuda de una pequeña espátula y se depositaron en bolsas de plástico, etiquetadas según si se colectaron en el borde o al interior del fragmento de vegetación. Las muestras de suelo en donde crece Z. fagara se recolectaron en junio y julio de 2018 y de Z. coco en diciembre de 2018 y enero de 2019 (época estival de cada región). Para el conteo de semillas se utilizó el método de tamizado, pasando las muestras de suelo por un tamiz de 6.3 mm para remover las semillas grandes. Posteriormente, se usaron tamices de 2 y 1 mm y se extrajeron e identificaron todas las semillas de la muestra (ver apéndice 1 y 2). Como el número de semillas viables estará en función de todas las semillas (sean viables o no) que se encuentren en el suelo (Pando-Moreno et al. 2010), en este trabajo se consideró como “banco de semillas” al total de éstas sin considerar la viabilidad. La identificación se llevó a cabo mediante el uso de un banco de semillas de referencia. Para Z. fagara se utilizó el banco de la Facultad de Ciencias Forestales, Universidad Autónoma de Nuevo León, mientras que para Z. coco el del Instituto Multidisciplinario de Biología Vegetal, Universidad Nacional de Córdoba. Además, se colectaron frutos y semillas directamente de las plantas en las áreas de estudio como referencia.
Análisis estadísticos. Se realizaron pruebas de Shapiro-Wilk para determinar la distribución del error de los datos de densidad de semillas (g.l. = 40, P < 0.001) y plántulas de Z. fagara (g.l. = 16, P = 0.04) en diferentes ambientes (borde e interior de la vegetación), además de aplicar la misma prueba para la distribución de datos de densidad de plántulas bajo la copa de árboles con diferente tipo de dispersión (g.l. 108, P < 0.001). Posteriormente, para determinar diferencia en las medias de cada variable se utilizaron pruebas de U de Mann Whitney.
Para Z. coco también se realizaron pruebas de Shapiro-Wilk con el fin de determinar la distribución del error de los datos sobre densidad de semillas (g.l. = 40, P = 0.001) y plántulas (g.l. = 16, P < 0.001) en diferentes ambientes y de la densidad de plántulas bajo árboles con diferente tipo de dispersión (g.l. = 12, P < 0.001). Después se buscó diferencia en la media de cada variable con pruebas de U de Mann Whitney. Todos los análisis se realizaron con SPSS 22.
Resultados
Densidad de semillas. Tanto en matorral como en el bosque chaqueño la densidad de semillas fue semejante en el borde de la vegetación y a 40 m hacia el interior. Se encontraron un total de 698 semillas de Z. fagara, 233 de éstas en el borde de la vegetación y 465 a 40 m hacia el interior del matorral (U = 130.0; Z = -0.76, P = 0.44; Tabla 1). Se encontraron 173 semillas de Z. coco, de las cuales 116 estaban en el borde y 57 hacia el interior de la vegetación (U = 36.50; Z = -1.57, P = 0.11; Tabla 1).
Tabla 1 Promedio (± desviación estándar) de la densidad de semillas de dos especies de Zanthoxylum en los bordes y al interior de fragmentos de vegetación. Cada promedio equivale a 20 muestras.
| Especies de estudio | Vegetación | Borde de la vegetación (semillas/m2) | Interior de la vegetación, (semillas/m2) |
|---|---|---|---|
| Zanthoxylum fagara | Matorral espinoso tamaulipeco | 342.64 ± 510.57 a | 645.83 ± 1212.62 a |
| Zanthoxylum coco | Bosque chaqueño | 145.00 ± 225.30 a | 83.82 ± 99.58 a |
| Letras diferentes indican diferencias entre medias por fila (P < 0.05). | |||
Densidad de plántulas. La densidad de plántulas de Z. fagara fue mayor en el borde que 40 m al interior del matorral (U = 7.00; Z = -2,63, P = 0.009; Tabla 2), mientras que, para Z. coco, la densidad de plántulas fue similar (U = 22; Z = -1.20, P = 0.22; Tabla 2). Se encontraron en total 625 plántulas de Z. fagara bajo 108 individuos de 27 especies (Tabla 3). De éstas, 15 especies son dispersadas por fauna y 13 tienen otras vías de dispersión (Tabla 3). La densidad de plántulas por metro cuadrado fue mayor bajo las copas de los árboles dispersados por aves (1.101 ± 2.225) que bajo las copas de otras especies (0.411 ± 0.709; U = 1046.00; Z = -2.07, P = 0.03), sin considerar la abundancia de éstas.
Tabla 2 Promedio (± desviación estándar) de la densidad de plántulas de Zanthoxylum en los bordes y al interior de fragmentos de vegetación. Cada promedio equivale a ocho muestras.
| Especies de estudio | Vegetación | Borde de la vegetación (plántulas/m2) | Interior de la vegetación (plántulas/m2) |
|---|---|---|---|
| Zanthoxylum fagara | Matorral espinoso tamaulipeco | 0.11 ± 0.058 a | 0.0325 ± 0.026 b |
| Zanthoxylum coco | Bosque chaqueño | 0.001 ± 0.003 a | 0.005 ± 0.005 a |
| Letras diferentes indican diferencias entre medias por hilera (P < 0.05). | |||
Tabla 3 Plantas bajo cuyas copas se encontraron plántulas de Z. fagara en el matorral espinoso tamaulipeco y sus síndromes de dispersión según Jurado et al. (2001a).
| Especie | Número de plántulas de Z. fagara bajo la copa | Síndrome de dispersión |
|---|---|---|
| Acacia berlandieri Benth. | 1 | Sin síndrome de dispersión aparente |
| Amyris madrensis Wats. | 10 | Zoocoria |
| Castela erecta Turp ssp. texana (T. & G.) Cronq. | 1 | Zoocoria |
| Celtis laevigata Willd. | 1 | Zoocoria |
| Celtis pallida Torr | 26 | Zoocoria |
| Cercidium macrum I.M. Johnst. | 12 | Sin síndrome de dispersión aparente |
| Condalia hookeri M.C. Johnst. | 54 | Zoocoria |
| Cordia boissieri A. DC | 44 | Zoocoria |
| Diospyros palmeri Scheele | 73 | Zoocoria |
| Diospyros texana Scheele | 24 | Zoocoria |
| Eysenhardtia polystachya Scheele | 10 | Sin síndrome de dispersión aparente |
| Forestiera angustifolia Torr. | 28 | Zoocoria |
| Gochnatia hypoleuca DC. | 1 | Anemocoria |
| Havardia pallens (Benth.) Brit. & Rose | 47 | Sin síndrome de dispersión aparente |
| Helietta parvifolia (Gray)Benth. | 7 | Anemocoria |
| Karwinskia humboldtiana (R. & S.) Zucc. | 6 | Zoocoria |
| Leucaena leucocephala (Lam.) de Wit | 32 | Anemocoria |
| Leucophyllum frutescens (Berl.)I.M. Johnst. | 1 | Sin síndrome de dispersión aparente |
| Prosopis laevigata (Willd.)M.C.Johnst. | 29 | Zoocoria |
| Randia rhagocarpa H.B.K. | 5 | Zoocoria |
| Sargentia greggi S.Wats. | 25 | Zoocoria |
| Sideroxylon celastriunum (Kunth) Penn. | 3 | Zoocoria |
| Vachellia wrightii Benth. | 2 | Sin síndrome de dispersión aparente |
| Vachellia farnesiana (L.) Willd | 22 | Sin síndrome de dispersión aparente |
| Vachellia rigidula Benth. | 103 | Sin síndrome de dispersión aparente |
| Vachellia schaffneri (Wats.) Herm. | 9 | Sin síndrome de dispersión aparente |
| Zanthoxylum fagara (L.) Sarg. | 49 | Zoocoria |
| Total | 625 |
Se encontraron 42 plántulas de Z. coco bajo 12 especies de árboles, de las cuales ocho especies son dispersadas por aves y cuatro tienen otros tipos de dispersión (Tabla 4). El número de plántulas por metro cuadrado fue semejante (U = 39; Z = -0.94, P = 0.340) bajo árboles dispersados por aves (0.139 ± 0.088) y árboles con otros tipos de dispersión (0.168 ± 0.122).
Tabla 4 Plantas bajo cuyas copas se encontraron plántulas de Z. coco en el bosque chaqueño serrano y sus síndromes de dispersión según Voigt et al. (2011), Dellafiore (2016) y Alzugaray et al. (2006).
| Especie | Número de plántulas de Z. coco bajo la copa | Síndrome de dispersión |
|---|---|---|
| Acacia aroma Hook. & Arn. | 4 | Zoocoria |
| Acacia praecox Griseb | 16 | Autocora |
| Aspidosperma quebracho blanco Schltr | 2 | Anemocoria |
| Celtis ehrenbergiana Gillies ex Planch. | 4 | Zoocoria |
| Condalia buxifolia Reissek 1861 | 4 | Zoocoria |
| Croton sp. | 1 | Autocoria |
| Geofrea decorticans (Gill. ex Hook. & Arn.) Burkart 1949. | 2 | Zoocoria |
| Lithraea molleoides (Vell.) Engl. | 1 | Zoocoria |
| Lycium cestroides | 2 | Zoocoria |
| Melia azedarach L. | 2 | Zoocoria |
| Prosopis alba Griseb | 2 | Zoocoria |
| Zanthoxylum coco Gillies ex Hook.f. & Arn. | 2 | Zoocoria |
| Total | 42 |
Discusión
La densidad de semillas fue semejante entre el borde y el interior de la vegetación, en ambas especies estudiadas. Este resultado contrasta con los encontrados en el matorral esclerófilo en España (Herrera et al. 1994), en los bordes de bosque y matorral en Suiza (Kollmann & Schneider 1999) y otros trabajos en el bosque chaqueño en Argentina (Verga et al. 2018), donde se han encontrado mayores densidades de semillas en el borde que al interior de fragmentos de diversas especies. Estas diferencias en la densidad de semillas son atribuidas al comportamiento de los dispersores. Los resultados encontrados en el presente estudio podrían deberse a que la distancia entre el borde y el interior de la vegetación no es tan larga (40 m) para las aves, debido a que la lluvia de semillas mediada por frugívoros está influida por las distancias de deposición de semillas después de la ingestión de frutos (Rodríguez-Pérez et al. 2012). Es probable que no solamente las aves dispersoras influyen en la distribución de semillas, sino también los consumidores de semillas que las depredan, disminuyendo así el número de semillas en el suelo. Por ejemplo, podría ser que hubiera mayor dispersión al interior de la vegetación que al borde, pero que al interior hubiera mayor granivoría por otras especies.
El efecto borde afectó de manera diferencial la densidad de plántulas para Z. fagara. La densidad de plántulas de esta especie fue mayor en el borde, es decir, la distribución de semillas y plántulas no son consistentes entre sí. Estos resultados podrían indicar un efecto microambiental, por una mayor radiación solar sobre el borde que favorece la germinación y/o el establecimiento de las plántulas (Jordano & Herrera 1995, Cheib & Garcia 2012). Así, la humedad de la temporada de lluvias podría favorecer la supervivencia de algunas plántulas en el borde. Por ejemplo, Z. fagara es una especie considerada de sucesión intermedia (Williams-Linera et al. 2011) y quizá la luz que recibe en los bordes es más adecuada para su establecimiento que la luz del interior de los fragmentos. En cuanto a Z. coco no se encontraron diferencias entre bordes e interior de los fragmentos, lo cual podría indicar que es una especie con amplia capacidad de establecimiento a diferentes condiciones de luz y humedad.
Para Z. fagara se encontró lo predicho, que habría mayor densidad de plántulas bajo especies de dispersión zoocora, lo que sugiere influencia de dispersores, aún en esta fase exploratoria. Franco-Pizaña et al. (1995) encontraron alta densidad de establecimiento de Z. fagara bajo la copa de Prosopis glandulosa, una especie de dispersión zoocora. Estos patrones podrían estar relacionados a los patrones de movimiento de las especies de aves en el matorral espinoso tamaulipeco y en el bosque chaqueño, aunque sería necesario realizar estudios específicos sobre este tema. Por ejemplo, estudiar los patrones de movimiento de las principales especies de aves dispersoras en ambos países, como la relación entre las aves y la dispersión de semillas de ambas especies de Zanthoxylum, así como estudios específicos sobre dispersores y depredadores de semillas.
El presente trabajo aporta nueva información sobre el efecto de la fragmentación, particularmente el efecto borde, sobre patrones de regeneración en especies. Si bien algunos patrones fueron similares entre ambas especies, como la densidad de semillas, se encontraron marcadas diferencias como la mayor densidad de plántulas de Z. fagara en borde que en el interior de la vegetación, así como debajo de especies de árboles con dispersión zoócora que en árboles con otro síndrome de dispersión. Esto indica que incluso en especies filogenéticamente muy relacionadas, las respuestas a la fragmentación difieren. Hacen falta más estudios para entender la dinámica de regeneración de vegetación en paisajes fragmentados para contribuir a su conservación y restauración.











 nueva página del texto (beta)
nueva página del texto (beta)



