En México, cerca del 60 % del territorio está compuesto por zonas áridas y semiáridas con una alta diversidad biológica y endemismos (Rzedowski 2006). Estas regiones han sido centro de diversificación de muchos grupos, entre los que se encuentran las cactáceas (Bravo-Hollis & Sánchez-Mejorada 1991). Actualmente, en México, se tiene un registro de alrededor de 52 géneros y 850 especies de cactáceas, de las cuales aproximadamente el 84 % son endémicas (Bravo-Hollis & Sánchez-Mejorada 1991, Arias et al. 2005). Este grupo de plantas presenta características morfológicas y fisiológicas que responden a la baja disponibilidad de agua, lo que le ha permitido ser exitoso en estos ambientes (Bravo-Hollis & Sánchez-Mejorada 1991).
Dentro de las cactáceas endémicas de México, se encuentra Myrtillocactus geometrizans (Mart. ex Pfeiff.) Console, 1897, comúnmente conocida como garambullo. Esta especie resulta particularmente interesante porque, a diferencia de la mayoría de las cactáceas endémicas, presenta una amplia distribución en el país (Casas et al. 1999). Presenta un periodo de floración (febrero a abril) que coincide con el de pocas especies, lo que la hace ser uno de los pocos recursos disponibles para un gran número de artrópodos visitadores florales (Arias et al. 1997, Rosas-García 2010, Maqueda-Díaz & Callejas-Chavero 2018).
Las flores son elementos reproductivos costosos, que presentan balances costo/beneficio entre sus estructuras, por ejemplo, el tamaño y cantidad de elementos de perianto, de estambres y el estigma, con la finalidad de favorecer la reproducción (Harder & Barrett 2006). Existen numerosos estudios que demuestran que las plantas invierten en flores con elementos de perianto grandes y llamativos o en un incremento en el número de estambres o polen, para atraer a los polinizadores (Armbruster 1997, Harder & Barrett 2006). La morfología de las flores es en gran medida el resultado de la presión selectiva ejercida por los polinizadores para beneficiar las estructuras florales que favorecen la exportación y recepción del polen (Mandujano et al. 2010, Barrett 2010, Woźniak & Sicard 2018). Incluso en plantas hermafroditas, que pudieran no necesitar de polinizadores, se han desarrollado sistemas para favorecer la exportación de polen (Mandujano et al. 2010). Por ejemplo, ciertos acomodos espaciales de anteras y estigmas, conocidos como hercogamia, evitan la autopolinización (Ganders 1979, Mandujano et al. 2010). Así, las flores con estilo largo y estambres cortos (morfo Pin) reciben polen; mientras que flores con estilo corto y estambres largos (morfo Thrum) lo donan (Ganders 1979, Mandujano et al. 2010).
La diversidad de estructuras florales también está relacionada a otros factores bióticos, como lo son los visitadores florales no polinizadores, entre los que se encuentran artrópodos depredadores y parasitoides de los polinizadores, robadores de néctar y de polen (Geber & Moeller 2006, Maqueda-Díaz & Callejas-Chavero 2018).
También, se ha documentado variación en la morfología floral relacionada a condiciones ambientales que enfrentan las poblaciones como temperatura y radiación solar (Aguilar-García et al. 2018) y eventos como el disturbio que pueden influir sobre las estructuras florales, al cambiar las condiciones físicas del ambiente, modificar la composición de las comunidades, la diversidad y las relaciones interespecíficas (Strauss & Whittall 2006, Aizen 2007, Krishnadas et al. 2018). Estudios intrapoblacionales realizados sobre las flores de M. geometrizans han mostrado variaciones morfológicas en respuesta a microambientes (Aguilar-García et al. 2018), además de una diversa comunidad de artrópodos visitadores florales (Rosas-García 2010, Maqueda-Díaz & Callejas-Chavero 2018). Sin embargo, no se ha estudiado si existe variación en la morfología floral de esta especie en diferentes tipos de vegetación, ni bajo diferentes grados de perturbación antrópica y si estos factores influyen en la composición de los visitadores florales.
En el presente trabajo se estudió, durante el pico de floración, la morfología floral de M. geometrizans en dos tipos de vegetación (selva baja y matorral xerófilo) de las Reservas de la Biosfera de Tehuacán-Cuicatlán y Barranca de Metztitlán, México. Se analizó si la comunidad de artrópodos visitadores florales responde a la morfología floral y si el índice de disturbio antrópico influye en este sistema. Se plantearon las siguientes hipótesis: 1) Debido a que enfrentan presiones de selección parecidas, las flores tendrán mayor similitud morfológica relacionada al tipo de vegetación, independiente a la cercanía geográfica de los sitios; 2) Las flores grandes, por ser más atractivas, tendrán una comunidad de artrópodos con mayor riqueza y abundancia; 3) La perturbación genera nuevas condiciones microambientales que pueden favorecer el establecimiento de especies; como consecuencia, se espera que los sitios más perturbados presenten mayor abundancia de artrópodos visitadores florales.
Material y métodos
Área de estudio. Este trabajo se llevó a cabo en dos Reservas de la Biósfera en las que se distribuye M. geometrizans. En la Reserva de la Biósfera de la Barranca de Metztitlán (RBBM), Hidalgo, que se caracteriza por tener clima semiárido (CONANP 2003), con una precipitación media anual 427 mm y temperatura media anual de 22 °C (SEMARNAP 1999); se ubicaron los sitios uno y dos. El primer sitio se ubicó en matorral xerófilo (1MMX) (20° 26' 48.3'' N 98° 40' 30.72'' O, 1,611 m) y el segundo en selva baja caducifolia (2MSB) (20° 28' 33.492" N 98° 40' 38.46" O, 1,316 m). En la Reserva de la Biósfera Tehuacán-Cuicatlán (RBTC), Oaxaca, que también se caracteriza por su clima semiárido (Valverde et al. 2007), con una precipitación media anual de 380 mm y temperatura media anual de 21 °C (Arias et al. 1997, Rzedowski 2006); se ubicaron los sitios tres y cuatro. El tercer sitio se localizó en matorral xerófilo (3TMX) (18° 19' 43.68" N 97° 27' 9.50" O, 1,438 m) y el cuarto en selva baja caducifolia (4TSB) (18° 20' 04.34" N 97° 26' 52.29" O, 1,709 m) (Figura. 1).
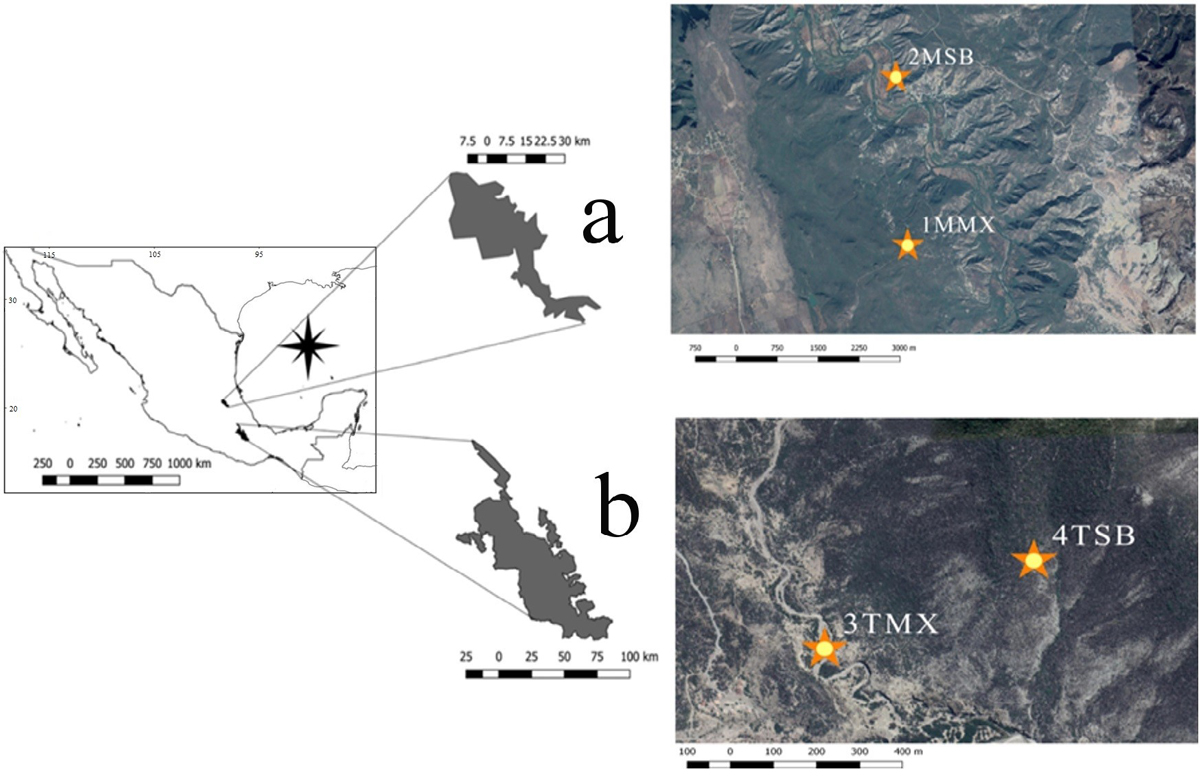
Figura 1 Ubicación de los sitios de estudio, a) Reserva de la Biósfera Barranca de Metztitlán donde se encuentran los sitios 1MMX, Matorral Xerófilo de Metztitlán; y 2MSB, Selva Baja de Metztitlán; y b) Reserva de la Biósfera Tehuacán-Cuicatlán donde se encuentran los sitios 3TMX, Matorral Xerófilo de Tehuacán y 4TSB, Selva Baja de Tehuacán.
Sistema de estudio. Myrtillocactus geometrizans (Mart. ex Pfeiff.) Console es un cactus arborescente (2-5 m de altura), endémico y ampliamente distribuido en todo México (Bravo-Hollis & Sánchez-Mejorada 1978). Su tallo principal es corto y ramificado (Arias et al. 1997). Cada rama tiene entre cinco y siete costillas (Arias et al. 1997). Presenta entre 4 a 9 espinas radiales de 0.2 a 5.0 cm. En la areola se pueden desarrollar de una a varias flores (Arias et al. 1997). Tiene flores hermafroditas, blancas con tintes purpúreos, con antesis diurna (≈ 07:00 a 14:00 h), de un solo día, de 2-3 cm de largo y 2.5-3.5 cm de ancho (Arias et al. 1997, Rosas-García 2010). La especie florece de febrero a abril, y se ha documentado que sus principales polinizadores son abejas (Arias et al. 1997, Rosas-García 2010, Maqueda-Díaz & Callejas-Chavero 2018).
Caracterización del ambiente. En cada sitio se realizó un análisis de perturbación siguiendo el procedimiento que Martorell & Peters (2009) desarrollaron para evaluar ambientes áridos. Este método permite el cálculo de un índice de disturbio (ID) a partir de la estimación de 13 parámetros, divididos en tres categorías: actividades humanas (AH), ganadería (G) y deterioro del hábitat (DH). Estos parámetros se registraron en tres transectos de 50 m de largo por 1 m de ancho para cada uno de los sitios de estudio.
Morfología floral. Se evaluó la morfología floral durante el pico de floración (comunicación personal con la gente local) con la finalidad de contar con un mayor número de flores. En los sitios 1MMX y 2MSB se realizó el 25 y 26 de marzo, mientras que para los sitios 3TMX y 4TSB los días 11 y 12 de marzo del año 2017. En cada sitio se seleccionaron al menos siete garambullos. A una altura máxima de 2 metros (altura promedio de los individuos reproductivos más pequeños), se recolectaron de 3 a 5 flores por individuo, considerando todos los sectores acimutales (30 flores por sitio) para caracterizar el promedio de las flores, sin considerar diferencias intraindividuales. Para registrar el diámetro de las 120 flores durante la antesis (Dmt Ttl), a cada una se le tomó una fotografía in situ, de frente, montada en una base con referencia métrica para que todas estuvieran en un mismo plano (porque al ser almacenadas se pierde el máximo de apertura floral) (Martínez-Ramos et al. 2017). Posteriormente, las flores se almacenaron en tubos de 50 ml con glicerina:alcohol 50:50 (Páez-Gerardo et al. 2005). En el laboratorio se registraron las características morfométricas de las estructuras florales. Se tomaron medidas de diámetro de la flor (Dmt Ttl) en las imágenes tomadas in situ mediante el software ImageJ 1.5 (Rasband 1997). Con un vernier digital, de 0.01 mm de resolución (Mitutuyo, Japón), se midió altura total de la flor (Alt Ttl), diámetro del tubo floral (Dmt Tb Flr), diámetro ecuatorial del ovario (Dmt Ectr Ovr), diámetro polar del ovario (Dmt Pl Ovr), longitud de estambres (Lng Estb), longitud del estigma (Lng Estg) y longitud de lóbulos (Lng Lbs). Con ayuda de un microscopio estereoscópico Leica EZ4, se contabilizó el número de estambres (No Estb), de lóbulos (No Lbs), de elementos del perianto (E Prnt) y de óvulos (No Ovl). Además, para la determinación del tipo de hercogamia (Hrc) se midió la longitud del estilo más el estigma y de los estambres (Figura 2).

Figura 2 Estructuras florales usadas para el análisis de la morfología floral: número de estambres (No Estb), elementos del perianto (E Prnt), número de óvulos (No Ovl) y número de lóbulos (No Lbs). Se tomaron medidas del diámetro total durante la antesis (Dmt Ttl), longitud de lóbulos (Lng Lbs), longitud de estigma (Lng Estg), longitud de estambres (Lng Estb), diámetro de tubo floral (Dmt Tb Flr), diámetro polar del ovario (Dmt Pl Ovr), diámetro ecuatorial ovario (Dmt Ectr Ovr) y altura total de la flor (Alt Ttl).
Artrópodos visitadores de las flores. Durante los días de recolecta, en cada sitio se seleccionaron al azar tres individuos de garambullo. Se recolectaron todos los artrópodos visitadores de las flores con aspiradores, redes entomológicas, pinceles y recolecta directa. La recolecta se realizó durante dos días en cada sitio, de 7:00 a 14:00 h, de manera continua durante las 7 horas, por 5 recolectores en cada sitio (60 h de recolecta por sitio). Los ejemplares recolectados se conservaron en alcohol etílico al 86 % (Morinière et al. 2017). Los artrópodos se separaron por morfoespecie (Msp) con ayuda de un microscopio estereoscópico Leica EZ4 y se identificaron con claves taxonómicas (Triplehorn & Johnson 2005) y con la ayuda del especialista Jorge Orendain-Méndez de la Universidad Autónoma Metropolitana-Iztapalapa. Se revisó bibliográficamente el grupo funcional al que pertenecen las Msp identificadas (Toft & Kimsey 1982, Morón & Terrón 1988, Borror et al. 1989, Cardel et al. 1997, Terrón et al. 1998, Moya-Raygoza et al. 2004, Ríos-Casanova et al. 2004, Strauss 2012, Martínez-Hernández & Callejas-Chavero 2015, Luna de la Torre et al. 2016, Maqueda-Díaz & Callejas-Chavero 2018, Navarrete-Jiménez 2018).
Análisis estadísticos. Para estimar el ID se elaboró una matriz con los datos de los 13 parámetros obtenidos en el análisis de perturbación y se aplicó un análisis de componentes principales (ACP) centrado, siguiendo el procedimiento propuesto por Martorell & Peters (2009), en el paquete estadístico MVSP 3.13 (Kovach 2004). Como el ACP centrado genera valores negativos y positivos, el primer eje se re-escaló para obtener un ID que abarcara un rango de 0 a 100, donde el 0 corresponde al transecto que presentó el menor disturbio antrópico y el 100 al que presentó el mayor. Se promedió el valor de ID para los tres transectos de cada sitio. Dado que los puntajes del ACP para cada sitio integran una combinación lineal de los valores registrados para cada variable, se desglosó la contribución al ID de cada categoría de disturbio (AH, G y DH) al sumar los términos lineales correspondientes a cada una de ellas (Martorell & Peters 2005).
Para identificar si había diferencias entre las flores de los cuatro sitios en función de las 14 estructuras florales, se realizó un análisis discriminante generalizado con el software SPSS Base Statistics v.19 (Norusis 2011). Para comparar las estructuras florales de los cuatro sitios, se utilizaron pruebas no paramétricas de Kruskal-Wallis. En los casos en que se detectaron diferencias significativas, se realizaron comparaciones pareadas con pruebas de U de Mann-Whitney, estimando los valores de p con la corrección de Bonferroni en el paquete estadístico PAST (Hammer et al. 2001). Se analizó la normalidad de los datos de la longitud del estilo más el estigma y la longitud de los estambres con la prueba de Kolmogorov-Smirnov y la homogeneidad de las variaciones con la prueba de Levene en el software SPSS Base Statistics v.19 (Norusis 2011). Para determinar la hercogamia se comparó, con una prueba de t-Student pareada, la longitud del estilo más el estigma con la de los estambres en el paquete estadístico PAST (Hammer et al. 2001).
Para evaluar la similitud entre las comunidades de artrópodos de los cuatro sitios se realizó un agrupamiento con el método de Bray-Curtis con el algoritmo UPGMA, utilizando un procedimiento de remuestreo con 1,000 repeticiones bootstrap para tener el valor de soporte de cada rama (Sneath & Sokal 1973), en el paquete estadístico PAST (Hammer et al. 2001). Para analizar la correlación entre la comunidad de artrópodos y las estructuras florales se realizó un análisis canónico de correspondencia (ACC). Finalmente, se estimó la correlación entre la comunidad de artrópodos y el índice de disturbio de los sitios, con un ACC. Estos análisis se realizaron con el paquete MVSP 3.13 (Kovach 2004).
Resultados
Caracterización del ambiente. El primer y segundo eje del análisis de componentes principales explicaron el 43.08 y 27.02 % de la varianza total. Este análisis mostró un gradiente a lo largo del cual se ordenaron los cuatro sitios estudiados. Se encontraron diferencias muy marcadas en los valores del índice de disturbio (ID) entre las reservas de Metztitlán y de Tehuacán (Tabla 1). El valor más alto de ID se presentó en el sitio 1MMX (ID = 79.79), donde la ganadería fue el principal agente de disturbio, seguido por el sitio 2MSB (ID = 33.39), donde el principal agente de disturbio fue el de las actividades humanas. El sitio de 4TSB presentó un ID casi cinco veces menor (ID = 8.23), con una contribución similar de actividades humanas y ganadería. Finalmente, el sitio menos perturbado fue el 3TMX con un ID de apenas 2.78, donde todos sus componentes presentaron valores similares (Tabla 1).
Tabla 1 Índice de disturbio re-escalado (de 0 a 100) y su desglose en sus tres componentes para los cuatro sitios ubicados en las Reservas de la Biosfera de Metztitlán (1MMX = Matorral Xerófilo; 2MSB = Selva Baja) y Tehuacán (3TMX = Matorral Xerófilo; 4TSB = Selva Baja). ID = Índice de Disturbio, AH = Actividades Humanas, G = Ganadería y DH = Deterioro del Hábitat.
| AH | G | DH | ID | |
|---|---|---|---|---|
| 1MMX | 27.59 | 31.82 | 20.37 | 79.79 |
| 2MSB | 12.89 | 8.51 | 11.99 | 33.39 |
| 3TMX | 0.80 | 0.94 | 1.03 | 2.78 |
| 4TSB | 2.27 | 2.56 | 3.40 | 8.23 |
Morfología floral. El análisis discriminante generalizado reveló que existen diferencias significativas entre las estructuras de las flores de M. geometrizans entre los cuatro sitios (Lambda de Wilks = 0.08; p < 0.001) (Figura 3). La matriz de estructura, integrada por los valores de correlación entre las variables y las funciones discriminantes, indicó que las estructuras florales que más contribuyeron a las diferencias entre sitios en la función 1 fueron: diámetro total de la flor (-0.522), número de óvulos (0.322) y longitud de lóbulos (-0.205). Mientras que en la función 2 fueron: diámetro ecuatorial del ovario (0.609), longitud de estigma (0.381) y diámetro del tubo floral (0.272).
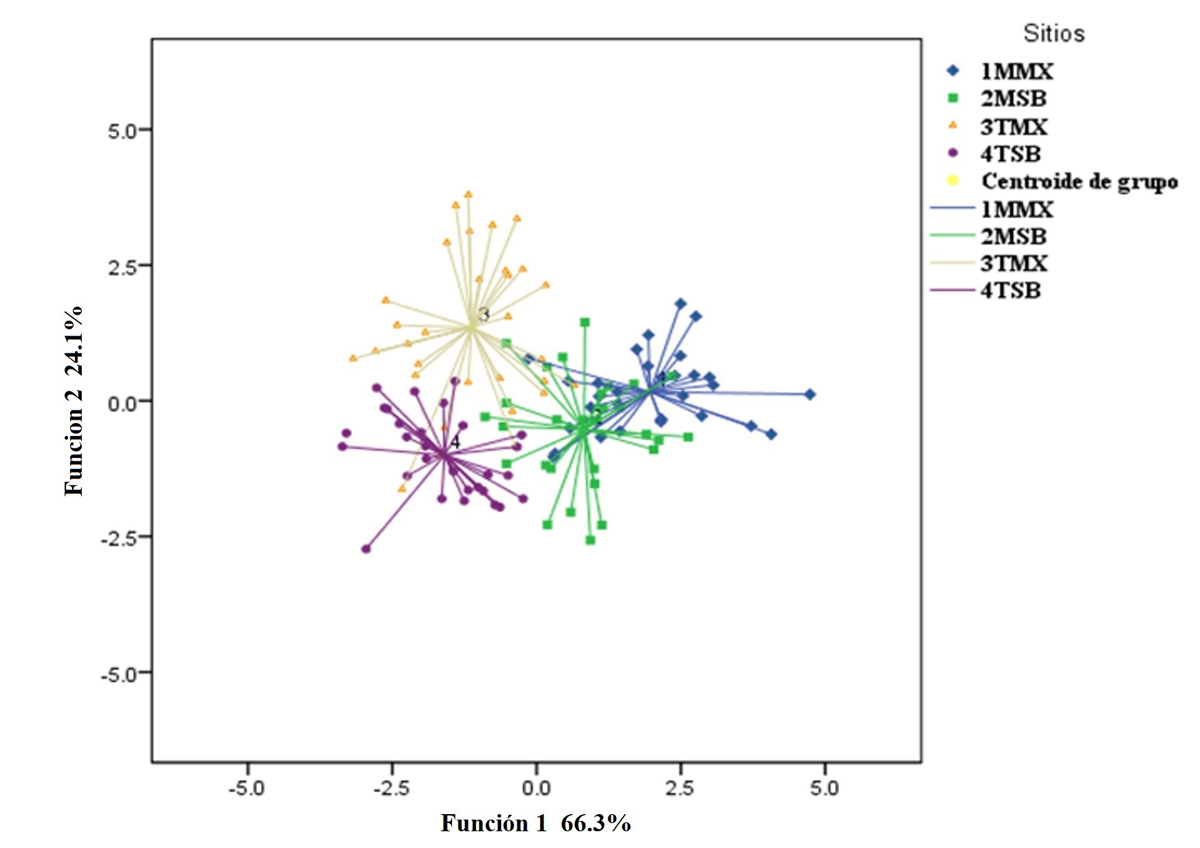
Figura 3 Diagrama de dispersión generado por análisis discriminante generalizado, que indicó diferencias significativas de las flores entre sitios. 1MMX, Matorral Xerófilo de Metztitlán; 2MSB, Selva Baja de Metztitlán; 3TMX, Matorral Xerófilo de Tehuacán; 4TSB, Selva Baja de Tehuacán.
En la Reserva de la Barranca de Metztitlán se encontraron flores con los valores más bajos en altura total, longitud de estambres y longitud de lóbulos. Pero con mayor número de óvulos, estambres y elementos del perianto (Tabla 2). En la Reserva de Tehuacán-Cuicatlán las flores mostraron la mayor altura total de la flor, de lóbulos y estambres. Pero, menor número de óvulos, estambres y elementos del perianto (Tabla 2).
Tabla 2 Estructuras florales de M. geometrizans (media ± EE) en cuatro sitios ubicados en las Reservas de la Biosfera de Metztitlán (1MMX, Matorral Xerófilo; 2MSB, Selva Baja) y Tehuacán (3TMX, Matorral Xerófilo; 4TSB, Selva Baja). En negritas se presentan los valores más altos. Letras diferentes indican diferencias significativas.
| Estructuras florales |
|
|
|
|
|---|---|---|---|---|
| Altura total (cm) | 2.49a ± 0.041 | 2.65a ± 0.067 | 2.92b ± 0.054 | 3.04b ± 0.036 |
| Diámetro total (cm) | 3.34a ± 0.63 | 3.70b ± 0.092 | 3.50bc ± 0.065 | 3.41ac ± 0.044 |
| Diámetro del tubo floral (cm) | 3.34a ± 0.014 | 0.34a ± 0.016 | 0.34a ± 0.014 | 0.41b ± 0.014 |
| Diámetro ecuatorial del ovario (cm) | 0.22ac ± 0.009 | 0.20ab ± 0.011 | 0.29c ± 0.022 | 0.18b ± 0.007 |
| Diámetro polar del ovario (cm) | 0.30a ± 0.012 | 0.31a ± 0.012 | 0.32a ± 0.036 | 0.33a ± 0.013 |
| Longitud de estambres (cm) | 1.23a ± 0.020 | 1.21ab ± 0.042 | 1.27ab ± 0.033 | 1.32b ± 0.024 |
| Longitud de estigma (cm) | 1.17ab ± 0.022 | 1.26bc ± 0.043 | 1.16b ± 0.045 | 1.36c ± 0.036 |
| Longitud de lóbulos (cm) | 0.47a ± 0.017 | 0.46ab ±0.026 | 0.54ab ± 0.029 | 0.56b ± 0.020 |
| Número de estambres | 92.60a ± 3.93 | 80.37a ± 3.34 | 89.17a ± 2.32 | 86.90a ± 2.13 |
| Número de lóbulos | 4.67a ± 0.120 | 4.50ab ± 0.133 | 4.40ab ± 0.140 | 4.03b ± 0.131 |
| Número de elementos de perianto | 19.13a ± 0.39 | 16.90b ± 0.44 | 16.60b ± 0.499 | 15.80b ± 0.326 |
| Número de óvulos | 101.77a ± 4.57 | 94.20ac ± 5.41 | 72.73b ± 4.91 | 75.63bc ± 3.370 |
| Hercogamia | Sí (p = 0.0014) | No (p = 0.0808) | Sí (p = 0.0119) | No (p = 0.254) |
De acuerdo con la prueba de t-Student pareada, las flores de los sitios de matorral xerófilo presentaron hercogamia (1MMX t = -3.46, p = 0.001 y 3TMX t = -2.68, p = 0.011). En el 63 % de los casos los estambres fueron más largos que el estilo más estigma (morfo Thrum). Mientras que, en la selva baja, las flores no presentaron hercogamia a pesar de que predominó el morfo del estigma más estilo más largo que los estambres (2MSB t = 1.81, p = 0.081 y 4TSB t = 1.16, p = 0.25) (morfo Pin) (Tabla 2).
Artrópodos visitadores de las flores. Se registraron 329 individuos de artrópodos visitadores de las flores de M. geometrizans. En el sitio 1MMX se recolectaron 126 individuos; en el 2MSB, 63; en el 3TMX, 81 y en el 4TSB, 59. Se separaron en 106 Msp pertenecientes a 5 órdenes, Hymenoptera (N = 259), Diptera (N = 40), Coleoptera (N = 22), Thysanoptera (N = 1) y Araneae (N = 7) (Apéndice 1).
El orden con mayor número de familias fue Hymenoptera con ocho, seguido por Diptera (5), Coleoptera (3) y Araneae (2) (Apéndice 1). La familia con mayor número de individuos recolectados fue Formicidae con 130, seguida de Apidae con 48 y Vespidae con 37 (Apéndice 1). Estas familias también presentaron el mayor número de Msp, Formicidae con 30, Apidae con 21 y Vespidae con 14.
Se identificaron bibliográficamente nueve grupos funcionales de artrópodos, el más representativo fue el de los polinizadores con el 56.1 % de la recolecta, pertenecientes a las familias Anthophoridae, Apidae, Halictidae, Syrphidae y Vespidae. El segundo grupo funcional más abundante fue el de los depredadores-nectarívoros con el 10.4 %, registrados en la familia Formicidae; seguidos de los nectarívoros con el 8.5 %, donde se identificaron las familias Formicidae y Thripidae (Apéndice 1).
El análisis de agrupamiento de las comunidades de artrópodos de los cuatro sitios indicó que la composición no depende del tipo de vegetación ni de la separación geográfica. Este análisis separó al sitio 1MMX del resto (correlación cofenética de 0.85), el cual se caracterizó por ser el más perturbado y presentar mayor abundancia de artrópodos (Figura 4).
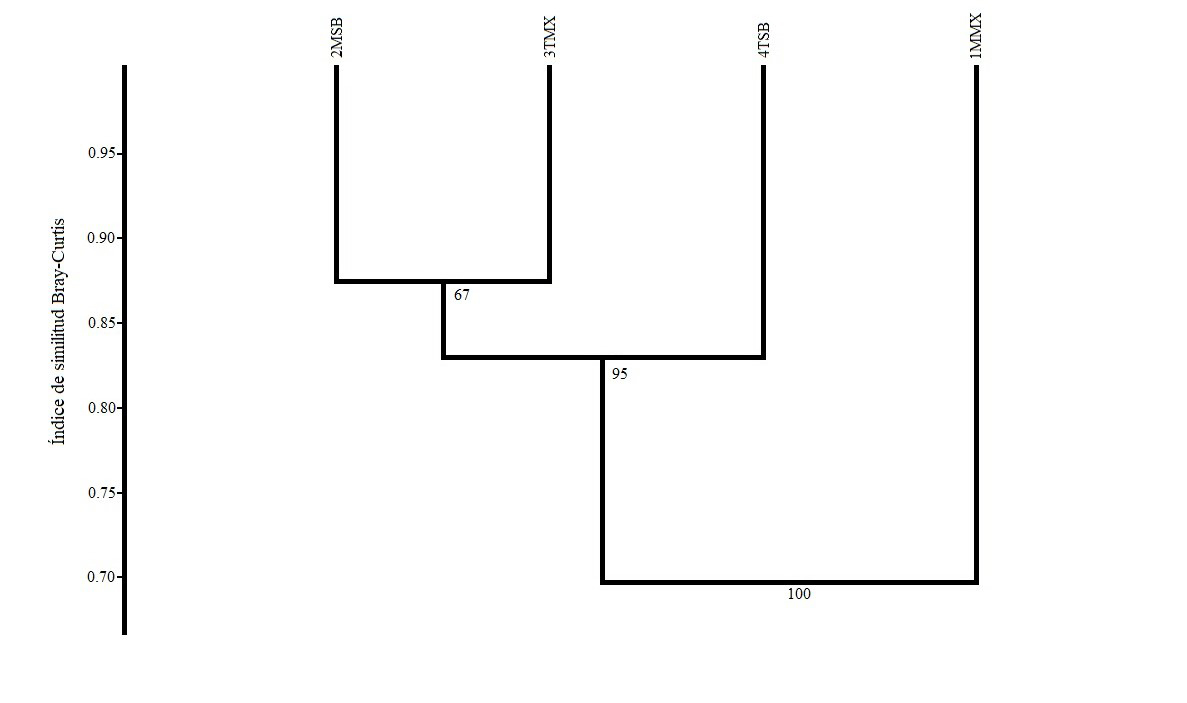
Figura 4 Dendrograma resultado de un análisis de clasificación jerárquica con el método UPGMA basado en la similitud de Bray-Curtis entre las comunidades de artrópodos visitadores de flores de M. geometrizans en los cuatro sitios de estudio (correlación cofenética de 0.85). Se indica el valor de soporte de cada rama.
Los resultados de los análisis de correspondencia explicaron en un 95.1 % que los visitadores florales presentaron mayor abundancia en el sitio 1MMX que se caracteriza por tener el mayor ID (Figura 5 A). Por otro lado, indicaron en un 97.52 % que los órdenes de visitadores florales se correlacionan únicamente con la hercogamia y no con el resto de las estructuras florales (Figura 5 B).
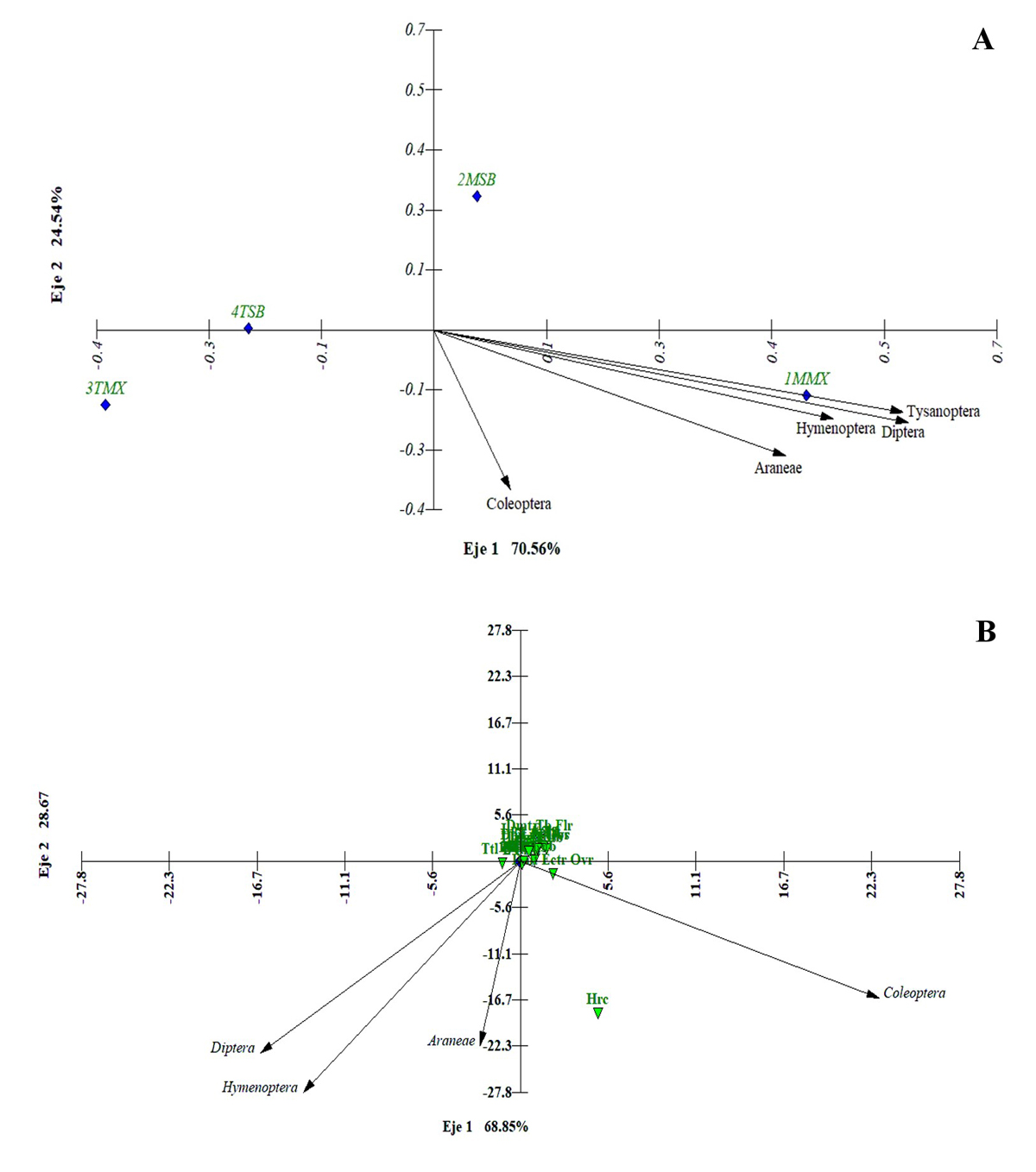
Figura 5 Gráfico del análisis canónico de correspondencia (ACC) que muestra la abundancia de los órdenes de artrópodos visitadores de las flores de M. geometrizans (vectores) con respecto a los sitios que se encuentran en un gradiente de disturbio (rombos azules) (A) y la abundancia de los órdenes de artrópodos (vectores) con respecto a las estructuras florales (triángulos verdes) (B). La longitud de los vectores está escalada por un factor de 2.00 (A) y 626.26 (B) para facilitar su visibilidad con respecto a la dispersión de los puntos en el espacio de ordenación.
Discusión
Los resultados de este estudio indican que los sitios de la Barranca de Metztitlán presentan la mayor perturbación antrópica. En contraste, los sitios de la Reserva de Tehuacán-Cuicatlán registraron valores de perturbación muy bajos. A pesar de ser una Reserva de la Biósfera, en Metztitlán se han reportado áreas de cultivo (principalmente maíz, frijol, calabaza, chile, tomate verde, jitomate y agave) e ingreso de ganado (cabras, ovejas y vacas) (Moreno et al. 2007) que contribuyen al disturbio de los sitios. En contraste, los sitios de estudio de Tehuacán se encuentran dentro del área de conservación del Jardín Botánico “Helia Bravo Hollis” donde no hay ingreso de ganado, ni zonas de cultivo. Por lo que, en los sitios de la Reserva de Metztitlán, las especies, incluyendo a M. geometrizans, enfrentan presiones de selección como mayor riesgo de desecación, mayor radiación solar e incremento del viento (Krishnadas et al. 2018, Stone et al. 2018).
Estudios realizados en cactáceas han detectado variación intraespecífica e intrapoblacional en las estructuras florales relacionadas a factores abióticos (Schlumpberger et al. 2009, Gutiérrez-Flores et al. 2017, Aguilar-García et al. 2018). Durante el pico de floración de M. geometrizans encontramos variación en la morfología floral entre reservas. En general, en la Reserva de Metztitlán, hubo flores de menor tamaño, con mayor número de estructuras florales. Mientras que, en la Reserva de Tehuacán-Cuicatlán se encontraron flores más grandes con menor número de estructuras florales. Estos resultados indican un posible compromiso, en las flores de M. geometrizans, entre tamaño floral y número de estructuras florales, lo que coincide con otros sistemas en los que se ha documentado que el aumento en la inversión a una función puede disminuir la inversión en otras (Harder & Barrett 2006, Vasconcelos & Proença 2015). Ambas estrategias (tamaño vs número de estructuras florales) pueden favorecer el éxito reproductivo de las plantas debido a lo atractivo que resultan para los visitadores florales, incluyendo a los polinizadores (Friedman & Barrett 2011). Al respecto, Gutiérrez-Flores et al. (2017) sugieren que, bajo condiciones estresantes, las flores decrecen en tamaño, pero incrementan el número de sus estructuras asociadas a las funciones reproductivas. Este resultado coincide con nuestros datos, porque las flores de la Reserva de la Barranca de Metztitlán se enfrentan a mayor disturbio antrópico lo cual podría implicar mayor estrés, a diferencia de las flores de Tehuacán que son más grandes, con menos estructuras florales y menor estrés antrópico.
Con respecto a la hercogamia, las flores de M. geometrizans también presentaron características que se relacionan con el tipo de vegetación en el que se encuentran. En las selvas bajas (2TSB y 4MSB) predominó el morfo Pin y en los matorrales (1MMX y 3TMX) el morfo Thrum. En el caso del morfo Thrum se ha reportado que puede estar favoreciendo la exportación de polen (Martínez-Ramos et al. 2017). Por lo anterior, sería interesante evaluar si existe una relación entre este morfo y la función masculina en M. geometrizans, debido a que en este trabajo se identificó mayor número de estambres en las flores con morfo Thrum. El morfo Pin, que favorece la función femenina de las flores, fue más abundante en las selvas bajas. Sin embargo, la diferencia no fue significativa, por lo anterior, sería recomendable ampliar el muestreo para confirmar este resultado
La riqueza de la comunidad de artrópodos recolectada en este trabajo fue mayor a la reportada para otras especies de cactáceas con antesis diurna (Blair & Williamson 2008, Martínez-Adriano et al. 2015, Vázquez et al. 2016, Córdova-Acosta 2017). Sin embargo, a diferencia de M. geometrizans, estas especies presentan flores más grandes y menor cantidad de flores por planta. Maqueda-Díaz & Callejas-Chavero (2018), en un estudio realizado en una localidad del estado de Hidalgo, reportaron una riqueza de artrópodos similar. En ambos trabajos, el orden Hymenoptera fue el visitador predominante en las flores del garambullo, seguido por Diptera y Coleoptera. La alta diversidad de artrópodos encontrada en este sistema puede deberse a que M. geometrizans presenta su periodo de floración en una etapa del año diferente a la mayoría de las especies, por lo que es un recurso importante para la comunidad de artrópodos (Maqueda-Díaz & Callejas-Chavero 2018).
Las comunidades de artrópodos visitadores presentaron mayor abundancia en los matorrales, particularmente en el sitio 1MMX. Las flores de las selvas bajas de ambas reservas presentaron el menor número de visitadores, particularmente el sitio 4TSB. Las flores de los matorrales xerófilos en ambas reservas tuvieron la comunidad de artrópodos más compleja, con el mayor número de familias y grupos funcionales. El número de grupos funcionales fue similar al encontrado por Martínez-Adriano et al. 2015 en las flores de Astrophytum myriostigma. Una característica importante en las flores de los matorrales es la dominancia del morfo Thrum. En este morfo el polen queda más expuesto, lo cual es atractivo para los artrópodos (Hernández-Ramírez 2018). Al respecto, se ha reportado en otros sistemas que este morfo recibe un mayor número de visitadores florales (Hernández-Ramírez 2018). El sitio 4TSB fue el que tuvo menos visitadores, en este sitio se presentó una mayor abundancia de depredadores, lo que puede estar ejerciendo un control de las poblaciones del resto de artrópodos. El ID de los sitios, también puede ser un factor que esté influyendo en la comunidad de visitadores florales. Las flores del sitio más perturbado, 1MMX, fueron las que recibieron un mayor número de visitadores florales, mientras que las del sitio 4TSB, que es de los menos perturbados, presentó menos visitadores. Este resultado contrasta con el que reportaron Juárez-Sotelo et al. (2018) en selvas bajas caducifolias, donde el sitio menos perturbado fue el que tuvo mayor diversidad de artrópodos. También, difiere con el caso de las abejas visitadoras de Opuntia heliabravoana Scheinvar 1974, que presentaron menor abundancia en sitios más perturbados (Sánchez-Echeverría et al. 2016). Sin embargo, se ha documentado que los cambios provocados por la perturbación antrópica generan diversos microambientes que favorecen la colonización de especies de artrópodos (Yang et al. 2015, Juárez-Sotelo et al. 2018). Sobre todo, de aquellas que presentan conducta de anidación, comportamiento social y hábitos alimenticios generalistas (Sánchez-Echeverría et al. 2016).
En conclusión, los resultados de este estudio indicaron que las flores de M. geometrizans no tienen mayor similitud morfológica relacionada al tipo de vegetación como lo planteado en nuestra hipótesis. Al parecer la cercanía geográfica influye más que el tipo de vegetación en la morfología floral. También, se identificó que el tamaño de la flor no fue la característica más atractiva para los artrópodos visitadores florales como se esperaba, porque las flores de menor tamaño, pero con un número relativamente mayor de estructuras florales fueron las más visitadas. Además, de acuerdo con nuestra hipótesis, el sitio más perturbado presentó mayor abundancia de artrópodos y de morfoespecies de visitadores florales, quizá por la generación de microambientes que favorecen el establecimiento de algunas especies.
Un hallazgo importante en el presente trabajo, adicional a nuestras hipótesis de investigación, fue la manera en que M. geometrizans maneja un balance costo/beneficio en su morfología floral al presentar un compromiso entre el tamaño de la flor y el número de estructuras florales durante su pico de floración.
Finalmente, en este estudio se revelaron aspectos interesantes sobre la morfología floral y la comunidad de artrópodos visitadores de las flores de M. geometrizans, durante el pico de floración, en dos Reservas de la Biósfera de México. Sin embargo, consideramos que se complementaría con: 1) Un análisis de la diversidad y estructura genética en relación con las características florales. 2) Un estudio detallado sobre la biología de los visitadores florales. 3) Realizar un análisis sobre las redes de interacción del garambullo con sus visitadores y entre estos. 4) Investigar la variación intra- e inter-anual de la morfología floral y de las relaciones con sus visitadores durante todo el periodo de floración de M. geometrizans, para conocer completa la dinámica de este sistema.











 nueva página del texto (beta)
nueva página del texto (beta)



