El xilema y floema secundarios se originan del cambium vascular (CV), el cual se activa periódicamente en zonas templadas. El número de células que presentan xilema y floema secundarios depende de la división de las células cambiales y la diferenciación de sus derivadas (Begum et al. 2013). En diversos trabajos se ha registrado que la actividad cambial está regulada por elementos del clima como la temperatura, la precipitación y la duración del día (Oribe et al. 2001, Gričar et al. 2006, Begum et al. 2007, Liang et al. 2009), y por factores endógenos como las concentraciones de hormonas como ácido indolacético, giberelinas y ácido abscísico (Hou et al. 2006, Rossi et al. 2007) y por factores transcripcionales (De Mico et al. 2019). La formación y diferenciación del xilema secundario (xilema) suelen estar más relacionadas con el la temperatura y precipitación debido a los retrasos o adelantos que presentan algunas especies entre un año como respuesta a las variaciones climáticas (Rossi et al. 2007, Seo et al. 2008, Begum et al. 2008). Adicionalmente, se conoce para coníferas que las diferentes fases de la xilogénesis están influenciadas por diversos factores como la disponibilidad de agua para promover la fase de elongación celular o como la disponibilidad de carbohidratos durante la fase de engrosamiento de la pared celular (Cuny & Rathgeber 2016) y conocer la temporalidad de cada fase es fundamental debido a que muestran una dependencia con las condiciones ambientales e intrínsecas y esto permite entender la dinámica de acumulación de carbono desde un punto de vista multidisciplinario (De Mico et al. 2019).
Con respecto a la formación y diferenciación del floema secundario (floema), se ha sugerido que es más estable entre un año y otro, por lo que probablemente los factores endógenos sean los promotores de su reactivación y diferenciación (Evert 2006). La aparente estabilidad del floema limita las investigaciones para entender la dinámica de este tejido (Gričar et al. 2014). No obstante, se ha reportado que la formación del floema y el xilema no son simultáneos, por lo que cada tejido podría estar respondiendo de manera diferencial a diversos factores intrínsecos y ambientales (Gričar & Čufar 2008).
Estudios sobre la actividad cambial y xilogénesis se han realizado en especies de zonas alpinas y de alta montaña (Rossi et al. 2006a, Deslauriers et al. 2008), en especies de amplia distribución (Li et al. 2016) y en especies que crecen en sitios contrastantes (Prislan et al. 2013). La mayoría de los trabajos sobre la actividad cambial y xilogénesis se han centrado en el estudio de árboles y arbustos (Aljaro et al. 1972, Deslauriers et al. 2008, Thibeault-Martel et al. 2008, Liang et al. 2009, Treml et al. 2015, Li et al. 2016, Dickson et al. 2017), pero desconocemos si se han evaluado en criptofítas. Aunado a esto, son escasos los trabajos que mencionan lo que sucede con el floema (Prislan et al. 2013). De aquí, se desprende la siguiente pregunta: ¿es la dinámica de la cribo-xilogénesis similar en especies con formas de vida distintas y distribuidas en un gradiente altitudinal? El objetivo de este trabajo fue describir y comparar la actividad cambial y la dinámica de la diferenciación del floema y xilema (cribo-xilogénesis) en tres especies del sotobosque con diferente forma de vida a lo largo de un gradiente altitudinal.
Materiales y métodos
Área de estudio. El cerro Tláloc (19° 23’ 43” y 19° 28’ 37” N, 98° 42’ 51” y 98° 48’ 12” O, 4,100 m snm), se encuentra en la provincia morfotectónica conocida como Faja Volcánica Transmexicana, en la región norte de la Sierra Nevada, al oriente del Estado de México, México. El clima es templado húmedo, con lluvias en verano y temperaturas promedio anuales que oscilan entre 12 y 18 °C, con una oscilación térmica de 5 a 7 °C. Los suelos son negros-pardos, grisáceos muy oscuros, profundos, ricos en materia orgánica (8.04 al 9.63 %) y de textura media (francos o franco-limosos), el potencial de hidrogeniones (pH) oscila entre 4.8 y 11.38.
Se seleccionaron seis sitios con intervalos de elevación variable, a lo largo de un gradiente altitudinal de aproximadamente 1,000 metros (Tabla 1), cuya pendiente fuera relativamente baja (< 10 %). En estos sitios se escogieron tres especies con diferentes formas de vida, siguiendo el sistema de Raunkiaer (1934); Alchemilla procumbens Rose (Rosaceae; criptófita), Acaena elongata L. (Rosaceae; hemicriptófita) y Ribes ciliatum Humb. & Bonpl. ex Roem. & Schult (Grossulariaceae; fanerófita). Es importante mencionar que tanto la criptófita y la hemicriptófita son perennifolias, pero sus estructuras de perennación se localizan bajo el mantillo o en el horizonte A del suelo (Jiménez-Noriega et al. 2017). La criptófita, A. procumbens es la única especie que se distribuye a lo largo de todo el gradiente altitudinal formando parte del estrato rasante en todos los sitios junto con otras especies como Geranium seemannii y Lupinus montanus. En cambio, A. elongata tiende a distribuirse en localidades abiertas o a plena luz y R. ciliatum tiene preferencias por los claros de luz en el dosel. La toma de datos y el muestreo en los individuos se realizó cada mes a partir de mayo del 2015 hasta julio del 2017. Durante los muestreos, se tomaron datos adicionales relacionados con el estado fenológico de los individuos bajo estudio, la humedad de los suelos mediante el empleo de Dataloggers y el ambiente lumínico mediante la captura de fotografías hemisféricas para cada individuo seleccionado. La información detallada del ambiente lumínico y de las propiedades de los suelos por sitio se puede consultar en Jiménez-Noriega (2018). El muestreo consistió en remover dos ramas de 1 a 3 años de edad de un individuo por sitio por especie para seguir la dinámica de la cribo-xilogénesis. Las muestras se fijaron con Craff III (Ruzin 1999), en segmentos de 2 cm o 6 cm de longitud. Este fijador permite un menor endurecimiento y contracción del tejido, lo cual favorece la mejor caracterización de cambium vascular (cambium) y sus derivados. Adicionalmente, a un individuo por especie por sitio se le hizo una incisión en el tallo principal hasta cambium, con el fin de relacionar la actividad cambial a partir de la marca de crecimiento en mayo del 2015. Al final del estudio en julio del 2017, se recolectaron los individuos marcados en mayo 2015 y se fijó en FAA (Ruzin 1999) la porción del tallo con la cicatriz de la incisión, porque el xilema secundario está completamente lignificado. Estas muestras permitieron verificar el crecimiento acumulado en dos años de A. elongata y de R. cililatum. En cambio, para A. procumbens, no fue posible marcar su tallo ya que estos son muy angostos (< 0.5 cm) y seguramente una incisión sobre ellos hubiera inducido su muerte.
Tabla 1 Altitud, tipo de vegetación y especies a lo largo del gradiente altitudinal en el Cerro Tláloc de la Sierra Nevada, Estado de México
| Altitud m s.n.m. | Tipo de vegetación | Especies |
|---|---|---|
| 3098 | Bosque de pino-encino | Alchemilla procumbens, Acaena elongata y Ribes ciliatum |
| 3420 | Bosque de oyamel | A. procumbens, A. elongata y R. ciliatum |
| 3550 | Bosque de pino | A. procumbens, A. elongata y R. ciliatum |
| 3630 | Bosque de pino | A. procumbens y A. elongata |
| 3840 | Bosque de pino-zacatonal alpino | A. procumbens |
| 3963 | Zacatonal alpino | A. procumbens |
Laboratorio. Las muestras recolectadas cada mes se lavaron con agua corriente y se cortaron con navajas desechables de micrótomo hasta tener un tamaño aproximado de 5 × 5 mm. Cada muestra se colocó en tubos Eppendorf en alcohol al 30 %, hasta completar la deshidratación en alcohol étilico absoluto y su inclusión en metilcrilato (Technovit7100, Kulzer, Wehrheim, Alemania) de acuerdo a Zarlavsky (2014). Se realizaron cortes transversales con un grosor de 0.5 a 1 µm para A. procumbens y de 2 a 3 µm para A. elongata y R. ciliatum con un micrótomo rotatorio (Leica 2051, Westlar, Alemania). La tinción se hizo con violeta de cresilo al 0.1 % en agua destilada por máximo 30 segundos, se lavaron y montaron con resina sintética (Hycel, Monterrey, México). Los tallos colectados al final de las observaciones se lavaron con agua corriente, se dividieron a través de la médula y se pasaron a glicerina-alcohol-agua (1:1:1), donde permanecieron hasta su ablandamiento. Se realizaron cortes transversales con un micrótomo de deslizamiento (Leica 2000R, Westlar, Alemania), de un grosor de 18-20 µm; posteriormente se tiñeron con safranina y verde rápido (Ruzin 1999) y se montaron en resina sintética. Estos cortes permitieron confirmar la presencia de anillos verdaderos o falsos. Las preparaciones para describir y comparar la dinámica de la actividad cambial y la cribo-xilogenesis se revisaron con un microscopio fotónico Olympus BX51 (Tokio, Japón) con y sin polarizador. El uso del polarizador permitió claramente definir cuando las fibras ya habían finalizado su maduración. Las preparaciones para detectar las marcas de crecimiento únicamente se observaron sin polarización. Los tejidos se fotografiaron con una cámara infinitum adaptada al microscopio Olympus BX51.
La terminología que se utilizó para describir la actividad cambial y la dinámica de diferenciación y maduración del xilema y floema fue propuesta por Esau (1977) e Iqbal (1990). Actualmente el uso de tinciones como el violeta de cresilo y los estudios detallados del floema, permiten reconocer cada fase en la dinámica de la diferenciación del xilema y floema con mayor precisión (Deslauriers et al. 2003, Rossi et al. 2006b, Gričar & Čufar 2008). En el Apéndice 1 se sintetizan las fases empleadas para describir las observaciones de la cribo-xilogénesis. En este trabajo cuando el cambium se reactivó se identificaron diferentes fases en la dinámica del xilema y se describe como se encontraba el floema. (1) Inicio: comienza la división y la diferenciación del xilema; en este momento el floema puede ser conductor. (2) Máximo: se observa el mayor número de células de xilema diferenciándose, el floema continúa siendo conductor. (3) Final: se termina de lignificar el último estrato de fibras del xilema y se delimita el crecimiento de ese año; el floema puede mantenerse conductor o no, ya que puede encontrarse colapsado o con abundante calosa.
Resultados
Formación del xilema y floema en las tres especies. La dinámica de xilema y floema se puede agrupar en tres categorías (Figura 1). La primera consiste en la diferenciación del floema antes de la del xilema, presente en las tres especies aquí estudiadas (Figura 1A). La segunda, también perceptible en las tres especies, fue la diferenciación del xilema y floema simultáneamente (Figura 1B). En la tercera, el xilema y floema se diferencian simultáneamente, pero al final de la diferenciación del xilema, el floema deja de ser conductor antes que el xilema (Figura 1C). Ésta solo fue observada en algunos individuos de Acaena elongata (Acaena) y Alchemilla procumbens (Alchemilla) (Figura 2F). Estas tres variantes se presentan en uno o más sitios donde se encuentran las especies a lo largo del gradiente.

Figura 1 Esquema que ilustra tres variantes de la cribogénesis y xilogénesis cuando el cambium vascular se encuentra activo. A) diferenciación del floema antes de la del xilema; B) diferenciación simultánea del xilema y floema; C) diferenciación simultánea del xilema y floema, cesa la conducción del floema cuando finaliza la xilogénesis. zc = zona cambial.

Figura 2 Cribogénesis y xilogénesis en Alchemilla procumbens, cortes transversales. A) inicia actividad cambial; B) división en la zona cambial, diferenciación de floema antes que xilema; C) floema conductor, sin diferenciación del xilema; D) diferenciación de xilema, paredes delgadas; E) Diferenciación de xilema y floema no conductor; F) xilema y floema conductores; G) floema conductor; H) floema no conductor; I) inicia divisiones en la peridermis. cv = cambium vascular fc = floema conductor, fd = floema diferenciado, fnc = floema no conductor, pe = peridermis, x = xilema, xc = xilema conductor, xd = xilema diferenciado, zc = zona cambial. Barra es 5 μm.
Formación del xilema y floema por especie. Al inicio de la actividad cambial se observaron, en la zona cambial de dos a tres estratos de células turgentes en Alchemilla y de cuatro a seis en Acaena y Ribes ciliatum (Ribes); mientras el floema estaba turgente y conductor (Figuras 2A, 3A, 4A). En Acaena y Ribes, hay varias divisiones en la zona cambial, antes de que fueran perceptibles las primeras células diferenciadas del xilema o el floema (Figuras 3B, 4B), hasta que ya no se distingue la separación entre ambos tejidos (Figura 3C). En Alchemilla fueron notorios de 3 a 4 estratos de células en división (ZC; Figura 2B, C). En ocasiones, como se observó en las tres especies, la diferenciación del floema sucedió antes que la del xilema (Figura 2B), o la diferenciación del xilema y el floema ocurrieron simultáneamente (Figuras 3C, 4B), o bien, la diferenciación fue simultánea pero el floema aún no era conductor (Figura 3I).

Figura 3 Cribogénesis y xilogénesis en Acaena elongata, cortes transversales. A) inicia actividad cambial; B, C) división en zona cambial, la diferenciación simultánea del xilema y floema; D, E) diferenciación de xilema; F) último estrato de células de xilema en diferenciarse y floema conductor; G) diferenciación de floema; H) floema conductor; I) floema no conductor. cv = cambium vascular, fc = floema conductor, fd = floema diferenciado, fnc = floema no conductor, x = xilema, xd = xilema diferenciado, zc = zona cambial. Barra es 5 μm.

Figura 4 Cribogénesis y xilogénesis en Ribes ciliatum, cortes transversales. A) inicia actividad cambium; B) división de la zona cambial y diferenciación de floema; C-D) diferenciación de xilema; F) último estrato de células de xilema en diferenciarse; G) xilema y floema conductores; H) floema conductor; I) parénquima floemático con contenidos y cristales y floema no conductor. c = cristal, cv = cambium vascular, fc = floema conductor, fd = floema diferenciado, pf = parénquima floemático, xc = xilema conductor, xd = xilema diferenciado, zc = zona cambial. Barra es 5 μm.
Las diferentes fases en la dinámica del floema no fueron perceptibles, como en la dinámica del xilema, donde se observó claramente el inició de la diferenciación, el punto máximo de división celular hasta la maduración del último estrato del xilema (Figuras 2C-E, 3C-F, 4C-G). Se observaron en Acaena y Ribes varios estratos (> 3) de células diferenciadas en su fase máxima; mientras que en Alchemilla solo fueron perceptibles dos estratos de células de xilema (XD; Figura 2D, E). En la fase final de la maduración del xilema, Alchemilla presentó la formación máxima de 2 a 3 estratos celulares de xilema y de 1 a 3 de floema, mientras que Acaena se registraron de 5-7 estratos hacia xilema y de 3-4 hacia el floema. Para Ribes el número máximo de estratos fue 6-8 hacia xilema y de 2-3 hacia floema.
En ocasiones, cuando finalizó la maduración del xilema, el floema continuaba siendo conductor en las tres especies (Figuras 2F, G, 3F-H, 4G). Se distinguió el floema conductor, debido a que la placa cribosa y áreas cribosas se encontraban libres de calosa (Figuras 5A, C, D, F, G). Posteriormente, los tubos cribosos presentaron acumulación de calosa (el floema no es conductor); durante este proceso, las células del parénquima floemático se llenan de contenidos obscuros (taninos) en las tres especies, además con cristales en Ribes; por último los tubos cribosos se colapsan (Figuras 2H, 3I, 4I) y fue evidente la presencia de calosa en las áreas cribosas (Figura 5B, E, H, I); en esta etapa el cambium entra en reposo (pierde turgencia).

Figura 5 Características de las placas cribosas de los tubos cribosos, cortes radiales. A-C) Alchemilla procumbens; D-F) Acaena elongata; G-I) Ribes ciliatum; A, C, D, F, G) placas cribosas sin calosa; B, E, H, I) placas cribosas con calosa. flechas blancas = placa cribosa, flechas negras = placa cribosa con calosa, pe = peridermis, xc = xilema conductor. Barra es 5 μm.
Dinámica de xilema y floema en el gradiente altitudinal. El inicio de la actividad del cambium tiende a desplazarse en el tiempo, conforme se incrementa la altitud en las tres especies (Figuras 6-8). La duración de la actividad cambial fue mayor en Acaena y Ribes (Figuras 7, 8) alcanzando hasta diez meses en comparación con Alchemilla (Figura 6) con un máximo de seis meses. La xilogénesis duró más tiempo en Acaena (Figura 7); mientras que en Ribes ocurrió en un mes (junio/julio, a una altitud de 3,098 m s.n.m.), siendo la fase conductora de xilema y floema la que mayor duración tuvo en el tiempo en que el cambium estuvo activo (Figura 8).

Figura 6 Diagrama que ilustra la xilogénesis y cribogénesis en Alchemilla procumbens a lo largo de un gradiente altitudinal. Floema en diferenciación = azul; floema conductor = amarillo; floema no conductor = rectángulo; inicia actividad cambial = triángulo negro; cambium inactivo = línea punteada negra; xilema desde inicio de la diferenciación hasta terminar la lignificación de las fibras = verde.

Figura 7 Diagrama que ilustra la xilogénesis y cribogénesis en Acaena elongata a lo largo de un gradiente altitudinal. Floema en diferenciación = azul; floema conductor = amarillo; floema no conductor = rectángulo; inicia actividad cambial = triángulo negro; cambium inactivo = línea punteada negra; xilema desde inicio de la diferenciación hasta terminar la lignificación de las fibras = verde.

Figura 8 Diagrama que ilustra la xilogénesis y cribogénesis en Ribes ciliatum a lo largo de un gradiente altitudinal. Floema en diferenciación = azul; floema conductor = amarillo; floema no conductor = rectángulo; inicia actividad cambial = triángulo negro; cambium inactivo = línea punteada negra; xilema desde inicio de la diferenciación hasta terminar la lignificación de las fibras = verde.
La diferenciación simultánea del xilema y floema se observó tanto en Alchemilla en los sitios de mayor altitud (3,630 a 3,953 m) como en Acaena, en diversos momentos a lo largo de año en el gradiente altitudinal (Figuras 6, 7). Este comportamiento en la dinámica de xilema y floema, también se registró en Ribes, pero solo en mayo, junio y julio en los extremos de su distribución en el gradiente (3,098 y 3,550 m; Figura 8). Sin embargo, en Ribes predomina la formación del floema antes que la diferenciación del xilema (Figura 8). En Alchemilla y Acaena también se observó la diferenciación del floema antes que el xilema (Figuras 6, 7), pero en Alchemilla solo en los sitios de menor altitud (< 3,550 m). En algunos individuos el floema se colapsa antes de terminar de lignificarse el xilema y al siguiente mes el floema vuelve a ser conductor; esto solo fue perceptible en Acaena y Alchemilla (Figuras 6, 7), excepto en los sitios 3,420 y 3,630 m en Alchemilla. En Ribes tanto el floema como el xilema dejaban de ser conductores simultáneamente lo que marca el inicio de la inactividad cambial (Figura 8).
Marcas de crecimiento. En todos los sitios a lo largo del gradiente para Acaena y Ribes, los anillos de crecimiento se distinguen por la porosidad anular (Figura 9A, B). Se puede notar por la marca al inicio de los muestreos en mayo de 2015 (asterisco), que la xilogénesis ya había comenzado y los vasos de la madera temprana eran funcionales. En julio de 2017 cuando se colectaron los individuos, en algunos de ellos se comenzaba a distinguir la xilogénesis (formación de vasos madera temprana); en otros únicamente se distinguía el inicio de la cribogénesis. Debido al reducido diámetro de los tallos (< 0.5 cm) de los individuos de Alchemilla, como se mencionó en Material y métodos, no se pudieron marcar. En esta especie es difícil reconocer las marcas de crecimiento (Figura 9C-F) y cuando son distinguibles, hay un máximo de dos o tres.
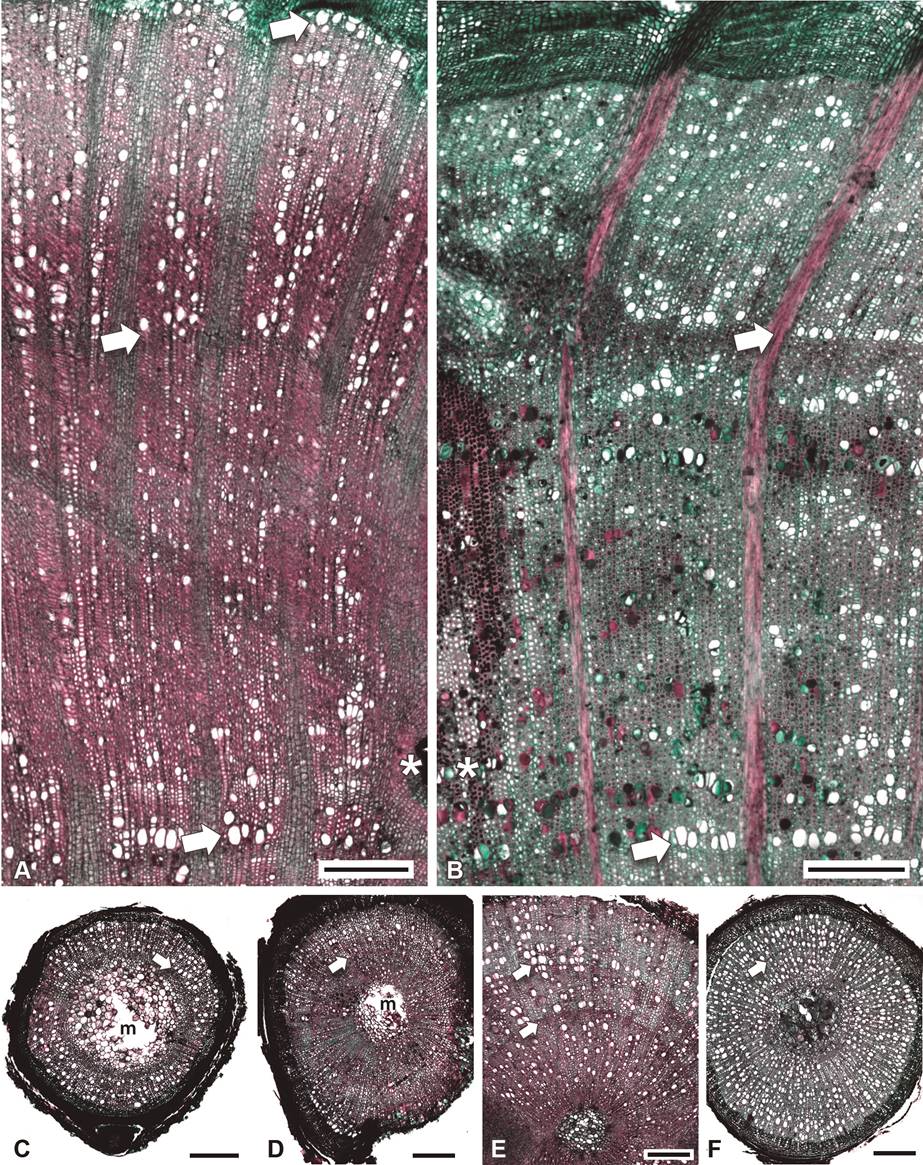
Figura 9 Madera con marcas de crecimiento de Acaena y Ribes y tallos completos de Alchemilla a lo largo del gradiente, cortes transversales. A) Acaena elongata, 3,550 m; Ribes ciliatum, 3,098 m; C-F) Alchemilla procumbens; C) 3,630 m; D) 3,550 m; E) 3,953; m; F) 3,240. Flechas = marcas de crecimiento, * = región de la marca, m = médula, Barra es 300 μm.
Discusión
El estudio de la actividad cambial y la cribo-xilogénesis en especies del sotobosque en el gradiente reveló que las tres especies tienen un comportamiento diferencial entre sitios, tanto en el tiempo de actividad cambial como en las primeras células en diferenciarse, pero similar dentro de cada uno sitio. Aquí se describe por primera vez la cribo-xilogénesis para una criptófita (Alchemilla), cuyos tallos horizontales van bajo el mantillo o el horizonte más superficial de los suelos. Un hallazgo importante es que Alchemilla se distingue por presentar periodos cortos (< 4 meses) e intermitentes de cribo-xilogenesis a lo largo del año, posiblemente asociados con su forma de vida. Mientras que Ribes (fanerofíta), ostenta una cribo-xilogénesis sincrónica con la caducidad de sus hojas, similar a otras especies arbustivas o arbóreas. En cambio, Acaena exhibe una cribo-xilogénesis más larga que Ribes y Alchemilla, se distribuye en áreas abiertas o relativamente abiertas como los bosques de pino o en los claros de luz en los bosques de oyamel. Esta hemicriptofita es perennifolia, se ramifica copiosamente y se reproduce sexual y profusamente sin interrupción a lo largo del gradiente y del año.
Actividad cambial. Los individuos de Alchemilla, Acaena y Ribes no presentaron sincronización en la formación de xilema y floema a través del gradiente altitudinal, sino que la actividad de cambium varió entre los sitios. Nuestros resultados coinciden con lo registrado para individuos de Picea abies y de Cedrus libani provenientes de diferentes sitios (Gričar et al. 2015; Güney et al. 2015). Asimismo, las características anatómicas se conservan en la mayoría de los individuos de cada especie localizadas en el mismo sitio, es decir, presentan su propia dinámica en la actividad cambial y en la cribo-xilogénesis. Ávila et al. (1975) registraron resultados similares trabajando con diferentes géneros de arbustos. Estos autores observaron que las especies que ocurrían en un mismo sitio y que compartían características similares, tenían también actividad cambial durante el mismo período. En el caso de Ribes, en los tres sitios donde ocurre, su cambium permanece inactivo cuando pierde sus hojas en septiembre o antes. Sin embargo, puede haber cribogénesis sin xilogénesis cuando aparecen las hojas de invierno, durante noviembre-diciembre, las cuales mantiene hasta el inicio de la estación lluviosa en mayo-junio.
Cuando el cambium se encuentra inactivo, el floema no es conductor y sus paredes se observan de mayor grosor y adquieren un tono nacarado. En Alchemilla y Acaena, en sitios de menor altitud, el floema se observó completamente colapsado solamente de uno a dos meses. Esto sugiere que el fin del ciclo del floema conductor se genera meses antes de la diferenciación celular del xilema.
Patrones en la diferenciación del xilema y floema en las tres especies. En Alchemilla, Acaena y Ribes el floema se diferenció antes que el xilema, durante la reactivación del cambium independientemente del sitio de distribución en el gradiente, como se ha registrado en otras especies (Wilson 1966, Alfieri & Evert 1968, Oribe et al. 2003, Swidrak et al. 2014). El floema conductor se requiere para la formación, diferenciación y maduración del xilema, ya que el xilema requiere de la energía producida por los fotoasimilados que se translocan a través de los elementos de tubo criboso y sus células acompañantes (Evert 2006, Taiz & Zeiger 2010). Sin embargo, en diferentes momentos algunos individuos en las tres especies mostraron diferenciación simultánea del xilema y floema. Solo en Alchemilla y Acaena, al final de la diferenciación del xilema, el floema se encontró colapsado, aunque al siguiente mes el floema nuevamente era conductor; probablemente el floema se diferencia rápidamente para que la actividad cambial continúe y el CV solo esté inactivo durante algunos días. Esta aseveración deberá confirmarse con muestreos semanales que permitan registrar con mayor precisión la cribogénesis de ambas especies, en especial Alchemilla, que por su forma de vida dura menos de un mes en varios periodos a lo largo del año.
Conductividad del floema en el gradiente. Este aspecto se ha estudiado para especies arbóreas de climas fríos, para las cuales se describe un periodo largo e ininterrumpido de floema conductor seguido por uno periodo corto de diferenciación floemática; para finalmente dejar de ser conductor y sus tubos cribosos se colapsan (Antonova & Stasova 2006, Gričar et al. 2006, 2007, Gričar & Čufar 2008). Esto se observó en Acaena y Ribes, especies que tuvieron largos periodos (cuatro meses en promedio) de floema conductor. Alfieri & Evert (1968) señalan que, en coníferas, los periodos de conductividad largos y periodos diferenciación cortos, se deben a que las células del floema pueden tener una duración de 1 a 2 años, formándose en primavera y manteniéndose funcionales en invierno, hasta la formación de nuevas células en primavera. Sin embargo, durante el periodo de registro de la dinámica de floema en Acaena la diferenciación de floema también presentó un periodo largo de actividad. Esto podría explicarse debido a que Acaena presenta varios periodos de actividad cambial, a lo largo del año. En contraste, en los sitios de menor altitud (≤ 3,550 m), Alchemilla presentó periodos cortos, intermitentes y constantes de conductividad en el floema y reduciéndose, aún más en individuos localizados en cotas altitudinales más elevadas (> 3,630 m). Este hecho sugiere que el patrón observado en Alchemilla, está asociado con la permanencia de hojas a lo largo del año, en especial durante los meses de enero-marzo cuando se presentan las hojas de invierno o nuevos brotes (Jiménez-Noriega 2018). En otras especies se ha registrado que la formación de nuevas derivadas en el CV se relaciona con los periodos de crecimiento vegetativo y la formación de brotes y ramas nuevas (Alfieri & Evert 1968, Golinowski 1971, Kutscha et al. 1975). En Alchemilla, esto podría corresponder a un mayor crecimiento vegetativo a menores altitudes durante los meses de mayo a septiembre (Jiménez-Noriega 2018). La formación de nuevas células requiere de una gran cantidad de energía, y en condiciones microambientales asociadas a elevadas cotas altitudinales, las plantas priorizan procesos como la respiración, formación de hojas, crecimiento de la raíz y la reproducción (Oribe et al. 2003, Polák et al. 2006, Deslauriers et al. 2009), como sería el caso de Alchemilla (Jiménez-Noriega “datos no publicados”).
Formación del xilema y floema por especie. En Acaena y Ribes se observó un mayor número de estratos de células diferenciadas hacia xilema que hacia floema, asociado a su forma de vida. Este patrón también se ha reportado otros grupos taxonómicos (Gričar et al. 2009); por ejemplo, en Schizolobium parahyba el máximo número de estratos celulares de floema fue de 4 a 6, mientras que para el xilema fueron de 15 a 33 (Marcati et al. 2008). El número de estratos que se forman hacia ambos lados de la zona cambial, parece estar relacionado con la tasa de crecimiento y forma de vida de las especies (Iqbal 1990). En contraste, Alchemilla presentó un número similar de estratos celulares de xilema y floema, mientras que el CV estuvo activo. Aunque en los sitios de menor altitud (≤ 3,550 m), la duración del periodo de diferenciación de las células del floema fue mayor que el periodo de diferenciación del xilema, por lo que probablemente la diferenciación y conductividad del floema se prioriza a la formación de xilema. Además, en Alchemilla el floema no se acumuló como en otras especies arbóreas, ya que se aprecia la formación de la nueva peridermis en el floema no conductor, cuando hay xilogénesis y cuando CV está inactivo (Figura 2H, I). Estas observaciones sugieren que hay formación de más de una peridermis por año, pero ésta se desprende y no hay ritidoma, eliminando también en este proceso floema no conductor. Aunado a esto, fueron pocos los individuos de Alchemilla con hasta tres anillos de crecimiento, en su mayoría tienen uno o dos anillos. Por lo que se podría inferir que la baja acumulación de tejido conductor está relacionada con la baja longevidad de las ramas horizontales. A pesar de que los tallos colectados de esta especie fueron conductores durante el tiempo que duraron las observaciones, pueden no tener anillos perceptibles, lo cual podría estar asociado a su continua actividad cambial en algunos sitios a lo largo del gradiente.
En los tallos de Acaena y Ribes se observó mayor acumulación de estratos tanto de xilema como de floema. Ambas especies acumulan tejido conductor semejante a lo observado en otras especies de arbustos (Aljaro et al. 1972, Li et al. 2016) y árboles (Larson 1994, Plomion et al. 2001, Thibeault-Martel et al. 2008, Gričar et al. 2014), en los cuales se correlaciona una mayor acumulación de tejido xilemático y floemático con largos periodos de actividad cambial (Gričar et al. 2009, Gričar et al. 2014). En Ribes, a altitudes de 3,420 y 3,550 m y durante el segundo año de observaciones, el CV presentó un largo período de 10 meses de inactividad asociado a la ausencia de lluvias previos a los meses de junio de 2017 (Jiménez-Noriega, obs. pers.).
La variabilidad en la reactivación cambial y la dinámica del xilema entre los individuos localizados a diferentes altitudes hacen inferir que el CV y el xilema son muy plásticos y altamente sensibles a los factores ambientales de cada sitio. Aunque la diferenciación del floema presentó algunas variaciones entre un año de registro y otro, en algunos sitios la dinámica del floema no exhibió cambios exclusivos asociados a cada altitud, sino que fue más estable, por lo que podría depender de otros factores, incluidos los endógenos. En contraste, la dinámica del xilema sí mostró cambios asociados exclusivamente con la altitud.
La dinámica del xilema y floema en Acaena y Ribes coincide con lo reportado para otras especies arbóreas y arbustivas, relacionada con la formación y conductividad del floema antes que la del xilema. Sin embargo, resulta interesante observar que esta tendencia se limita a ciertos sitios o periodos a lo largo del año en ambas especies, ya que se observaron periodos en los que xilema y floema se diferenciaron simultáneamente, mientras CV se encontró activo. En Ribes la actividad cambial y la cribo-xilogénesis presentan periodicidad, como en otros árboles que se encuentran restringidos a una localidad o dos. Posiblemente la periodicidad y tiempo de respuesta del CV limita la presencia de esta especie en el gradiente, en donde solo llega hasta los 3,550 m s.n.m. Por su parte, la criptofíta, Alchemilla, mostró poca periodicidad en la actividad cambial y diferenciación del xilema y floema a través del tiempo y el espacio. Esta especie responde a las variaciones del ambiente a lo largo del gradiente, siendo la respuesta en cuanto a la amplitud de cribo-xilogénesis a altitudes intermedias del gradiente, justo dentro del bosque de oyamel a los 3,420 m s.n.m. Esta respuesta a niveles intermedios de altitud a lo largo del mismo gradiente fue reportada también para hoja (reducción del mesofilo) de Alchemilla por Jiménez-Noriega et al. (2017). Además, los cortos periodos de actividad cambial en Alchemilla en comparación con las otras dos especies, podría indicar que es una especie que aprovecha los pulsos en los que los factores ambientales son más beneficiosos para la producción de nuevas células de xilema y floema y por ello pueden o no marcarse los anillos de crecimiento. Es evidente que para llegar a hacer generalizaciones similares a las encontradas en Alchemilla, es necesario contar con un mayor número de estudios de especies criptófitas.











 nueva página del texto (beta)
nueva página del texto (beta)



