Los agaves (Agave L., Asparagaceae) son plantas de distribución tropical y subtropical, presentes en zonas de clima árido. Existen 273 especies en el Continente Americano. La República Mexicana es considerada el centro de origen del género Agave (Nobel 1988, García-Mendoza 2007, García-Herrera et al. 2010). El 75 % de las especies se encuentran en México y 55 % de éstas son endémicas (Granados 1993, Illsey et al. 2005). Agave salmiana Otto ex Salm-Dyck, conocida como “maguey manso” o “maguey verde”, es endémica de México (Coahuila, Colima, Durango, Estado de México, Hidalgo, Puebla, San Luis Potosí, Tlaxcala y Zacatecas), desde los 1,000 hasta los 2,800 m snm, en ambientes templados y cálidos secos, con una precipitación que fluctúa entre 360 a 1,200 mm, (Gentry 1982, Granados 1993, Sánchez-Urdaneta et al. 2004).
Para Gentry (1982) las poblaciones cultivadas y silvestres de A. salmiana presentan plantas que pudieron originarse de una sola planta madre; sin embargo, tienen una amplia variabilidad morfológica que se refleja principalmente en la hoja. Taxonómicamente es una especie que aún no está totalmente delimitada, no solo por presentar una alta variación morfológica, sino también por tener una alta tasa de hibridación en condiciones naturales (Verduzco-Martínez et al. 2008, Aguilar-Juárez et al. 2014). Recientemente García-Mendoza (2011), consideró que A. salmiana sólo incluye dos subespecies: A. salmiana subsp. salmiana y A. salmiana subsp. tehuacanensis (Karw. Ex Salm-Dyck) García-Mend. La primera se caracteriza por incluir plantas más grandes, masivas, con mayor número de hojas, con margen recto a ondulado y dientes más pequeños, las inflorescencias, son más altas y robustas, con ramas más largas, hasta de cuarto orden. Existen múltiples formas obtenidas del cruzamiento entre las subespecies, pero no se registran estudios que profundicen en el conocimiento del grado de variación morfológica entre ellas.
Agave salmiana subsp. salmiana se conoce de los estados de Durango, Coahuila y Oaxaca (García-Mendoza 2011) y a lo largo de su área de distribución se observa una alta variación morfológica. Este es el caso entre los individuos que crecen en distintas localidades de la Región de Teotihuacán en el Estado de México, esto se ha observado inclusive entre individuos que crecen en una misma localidad.
Diversos estudios han mostrado la utilidad de los estudios anatómicos en el conocimiento de la variación infraespecífica en plantas y su relación con el ambiente (Ackerly et al. 2002, McDonald et al. 2003, Reyes et al. 2005, Martínez-Quezada et al. 2016, Jiménez-Noriega et al. 2017, Martínez-Valverde 2019, Sandoval-Zapotitla et al. 2019). Este enfoque a la fecha no ha sido abordado para el género Agave y sólo algunos estudios reportan aspectos generales de su anatomía foliar, donde se ha descrito la cutícula y superficie foliar de unas pocas especies (Gentry & Sauck 1978, Willmer & Pallas 1973, Nobel 1988). En otras especies, como Agave tequilana F.A.C. Weber, Hernández-Valencia et al. (2003) mencionan datos de caracteres epidérmicos; para el caso de Agave angustifolia Haw y A. tequilana, Sánchez-Galindo (2010), analiza el tejido fundamental, vascular y dérmico. A pesar de que la hoja es el órgano de la planta más sensible a las condiciones ambientales (Trewavas 2003, Mencuccini 2003), el análisis de los patrones de variación anatómica puede tener gran importancia taxonómica. En el caso de orquídeas y crassulaceas, la epidermis ha permitido diferenciar variedades, como en Vanilla planifolia Andrews (Martínez-Quezada et al. 2016), o morfotipos, como en Echeveria gigantea Rose & J.A. Purpus (Sandoval-Zapotitla et al. 2019).
Tomando como estudio de caso las poblaciones de Agave salmiana subsp. salmiana que se encuentran en la parte norte del Estado de México, el presente estudio se plantea las siguientes preguntas: ¿Qué variación existe en los caracteres epidérmico-foliares en Agave salmiana subsp salmiana? ¿Qué patrones de variación se pueden encontrar? ¿Los caracteres anatómicos son variables en las distintas regiones a lo ancho de la hoja? y finalmente, ¿Existe variación intra e interpoblacional significativa en estos caracteres? Conocer los caracteres epidérmicos, permitirá dar respuesta a las interrogantes planteadas. En este trabajo se describe la anatomía foliar de la epidermis de Agave salmiana subsp. salmiana, y se analizan los patrones de variación de los caracteres epidérmico-foliares en tres regiones de la hoja de individuos provenientes de tres poblaciones del Estado de México.
Materiales y métodos
Se recolectaron muestras de hojas de cinco individuos sanos, de entre 6 y 8 años de edad de A. salmiana subsp. salmiana de tres diferentes localidades: Tecámac, San Martin de las Pirámides y Teotihuacán, municipios ubicados en el sector II de Zumpango, Estado de México (Tabla 1, Figura 1). Las plantas cultivadas en Tecámac son propias de esta localidad, mientras que las recolectadas en San Martin de las Pirámides proceden del Colegio de Posgraduados, Montecillo, Estado de México y las de Teotihuacán de Santa María Tecajete, Hidalgo (individuos 1, 2 y 3) y de Perote, Veracruz (individuos 4 y 5, Tabla 1).
Tabla 1 Datos generales de las muestras de Agave salmiana subsp. salmiana de Teotihuacán, Edo de México ± desviación estándar.
| Localidad | Altitud m snm | Procedencia de la planta | Edad de la planta (años) | Longitud de hoja | Ancho de hoja | Intervalo de temperatura anual (°C) | Precipitación media anual (mm) |
|---|---|---|---|---|---|---|---|
| Tecámac | 2,238-2,359 | Tecámac | 6 a 8 | 1.48 + 0.22 | 32.95 + 4.01 | 6 - 31 | 636 |
| San Martín de las Pirámides | 2,238-2,925 | Colegio de Posgraduados, Montecillo, Edo. Méx. | 8 | 1.66 + 0.05 | 30.6 + 2.40 | 10 - 30 | 600 |
| Teotihuacán | 2,257-2,535 | Veracruz (Perote) e Hidalgo (Santa María Tecajete) | 8 | 1.61 + 0.02 | 32.8 + 3.04 | 6 - 31 | 586 |
Todas las muestras se obtuvieron de la zona media comprendida entre la base y el ápice de la hoja y se tomaron a partir de tres diferentes regiones: vena media, intermedia y margen (Figura 2A), para cada uno de los cinco individuos de las tres localidades, por lo que en total se examinaron 45 muestras. Estas se fijaron en campo con FAA (Formaldehído-Alcohol-Ácido acético), por un lapso de 48 horas en agitación (Agitador rotatorio LAB-LINE).

Figura 2 Agave salmiana subsp. salmiana. A. Regiones analizadas de la hoja. B-G. Vista superficial de epidermis. B. Epidermis adaxial. C. Epidermis abaxial. D. Células oclusivas (flecha). E. Reborde cuticular polar (flecha). F. Borde cuticular lateral de estoma (flecha). G. Espacio cuticular polar (línea). Vista transversal de hoja. H. Epidermis monoestratificada, células epidérmicas con pared periclinal externa engrosada. CE = células epidérmicas, CS = cámara supraestomática, C = cutícula, I = intermedia, M = margen, PPE = pared periclinal externa, VM = vena media (B y C = X200, D y H = X400, E-G = X1000).
De cada muestra se extrajeron las epidermis adaxial y abaxial con restos de mesófilo aún adherido, se sumergieron en NaOH (hidróxido de sodio) al 20 % durante 20 min, se lavaron con agua corriente y se sumergieron en NaClO (hipoclorito de sodio) al 20 %, hasta que las muestras se tornaran blanquecinas; las epidermis se limpiaron para eliminar restos de tejido adherido y se montaron con gelatina glicerinada como preparaciones temporales (Sandoval-Zapotitla et al. 2005). Se observaron en un fotomicroscopio Carl Zeiss-Axioskop donde se analizaron catorce parámetros cuantitativos, con veinte mediciones en cada uno de ellos, se registraron fotomicrografías con una cámara Point Grey, a partir de las cuales se realizaron medidas lineales y de área con el programa ImageJ v.1.48 (Schneider et al. 2012).
La determinación del índice estomático (IE) se realizó con un microscopio óptico Zeiss en un campo de 400X. El cálculo del IE se realizó a través de la ecuación sugerida por Salisbury (Willmer & Pallas 1973), la cual relaciona la cantidad de estomas por unidad de área foliar al número de células epidérmicas por la misma unidad de área. De este modo:
Donde NE = Número de estomas por campo de observación. CE = Número de células epidérmicas en el mismo campo de observación.
Otros términos, como la forma de células epidérmicas, tipo de pared anticlinal, rebordes cuticulares externos e internos, cámara supraestomática y subestomática, fueron tomados de Koch et al. (2009) y para el tipo de estomas de Wilkinson (1988). Con el propósito de conocer con detalle el nivel de variación de estos parámetros, se analizaron tres niveles de comparación: el primer nivel fue entre tres regiones a lo ancho de la hoja, el segundo nivel entre los cinco individuos de cada localidad y el tercer nivel entre las tres localidades evaluadas.
Con el propósito de saber si existen diferencias significativas en estos parámetros anatómicos, en la comparación entre las tres regiones de la hoja y entre los individuos de cada localidad, se realizó un análisis de varianza de una sola vía (ANOVA) a un nivel de significancia de 5 % (P ≤ 0.05). Cuando el análisis de la varianza fue significativo, se realizó la prueba de Tukey de comparación múltiple de las medias con el mismo nivel de significancia, estos análisis se realizaron con el programa JMP v.7 (SAS Institute Inc.). En los tres niveles de comparación se reportan los valores de media; como una medida estandarizada de variación, para cada carácter se calculó el índice de canalización microambiental (LS = Levene statistic P ≤ 0.05), el cual indirectamente indica el grado de plasticidad fenotípica (Hall et al. 2007).
Para conocer los patrones de variación en los caracteres anatómicos entre los individuos de las tres localidades, se compararon los 15 individuos con base en los 14 caracteres observados mediante un análisis de componentes principales. Para ello, se utilizó el programa NTSYS v. 2.2t (Rohlf 1998). Posteriormente se realizó un análisis de funciones discriminantes, mediante el programa IBM-SPSS v 23 (IBM 2015), para estimar la significancia de los grupos revelados por el análisis de componentes principales. Con la finalidad de conocer el nivel de significancia de la variación de los caracteres de mayor peso en los análisis multivariados, se realizó un análisis de varianza, una prueba de Tukey y se estimó el índice de canalización microambiental.
Resultados
Descripción anatómica de epidermis foliar. En vista superficial, las células de ambas epidermis son poligonales isodiamétricas y con área promedio de 3,713.86 µm2 (intervalo: 3,225.7 - 4,202.02) en epidermis adaxial y de 3,704.85 µm2 (intervalo: 3,306.82 - 4,102.88) en epidermis abaxial; la cutícula y las paredes periclinales externas son lisas, sin ornamentaciones en ambas superficies, las paredes anticlinales son rectas (Figura 2B, 2C), con grosor promedio de 5.79 µm (intervalo: 5.31 - 6.27) y de 5.72 µm (intervalo: 5.13 - 6.30) respectivamente. Presentan estomas en ambas epidermis, de tipo tetracítico, organizados en hileras paralelas al eje longitudinal de la hoja; índice estomático adaxial de 8.65 (intervalo: 8.41 - 8.88) y abaxial de 7.90 (intervalo: 7.74 - 8.05); las células oclusivas (Figura 2D), en la superficie adaxial con longitud promedio de 51.66 µm (intervalo: 46.59 - 56.73) y abaxiales de 52.35 µm (intervalo: 47.03 - 57.67); cada célula oclusiva tiene rebordes cuticulares en cada polo del estoma (Figura 2E), cuyo ancho en la epidermis adaxial es de 9.80 µm (intervalo: 9.53 - 10.07) y en la abaxial es de 9.41 µm (intervalo: 9.08 - 9.73); además tiene bordes cuticulares laterales (Figura 2F), cuyo ancho es de 37.84 µm (intervalo: 34.92 - 40.76) en epidermis adaxial y de 35.92 µm (intervalo: 34.21 - 37.62) en epidermis abaxial; los estomas tienen un espacio cuticular polar evidente (Figura 2G), en la epidermis adaxial este espacio tiene un ancho de 38.10 µm (intervalo: 36.40 - 39.79) y en la abaxial es de 36.74 µm (intervalo: 35.02 - 38.46).
En sección transversal la cutícula es lisa y gruesa, la epidermis es monoestratificada, con células oblongas y paredes periclinales externas celulósicas evidentemente engrosadas (Figura 2H). Los estomas se observan hundidos con respecto a la superficie, sin rebordes cuticulares internos; los rebordes cuticulares externos son prominentes y forman una cámara supraestomática. Se observa una cámara subestomática alargada que abarca varios estratos de células del mesofilo (Figura 2H).
Análisis de varianza entre las tres regiones de la hoja. El análisis de varianza mostró que el 57 % de los caracteres analizados tienen diferencias significativas (P ≤ 0.05; Tabla 2) en al menos en una de las tres regiones de la hoja. Los caracteres que mostraron variación son: índice estomático en ambas epidermis (IEADA/IEABA), longitud de las células oclusivas adaxiales (LCOADA), grosor de pared anticlinal abaxial (GPAABA), ancho del borde cuticular lateral adaxial (ABCLADA), ancho del espacio cuticular polar abaxial (AECPABA) y área de las células epidérmicas en ambas epidermis (ACEADA/ACEABA). Sin embargo, de las tres regiones sólo se forman dos grupos en todos los casos; la parte intermedia de la hoja incluye dos caracteres con valores significativamente mayores en LCOADA y ACEADA, mientras que en el caso de GPAABA, las diferencias son significativas en el margen.
Tabla 2 Promedio y LS (Levene statistic) de los parámetros epidérmicos de A. salmiana subs. salmiana en tres regiones diferentes de la hoja. Letras desiguales indican grupos distintos en la prueba de Tukey (P ≤ 0.05).
| Carácter | Marginal | LS | Intermedia | LS | Vena media | LS |
|---|---|---|---|---|---|---|
| IEADA | 8.20 b | 0.05 | 8.78 a | 0.02 | 8.88 a | 0.03 |
| IEABA | 7.25 b | 0.09 | 8.28 a | 0.05 | 8.19 a | 0.04 |
| LCOADA | 50.02 b | 0.03 | 53.44 a | 0.04 | 51.13 b | 0.01 |
| LCOABA | 51.90 a | 0.01 | 53.17 a | 0.02 | 51.46 a | 0.01 |
| GPAADA | 5.81 a | 0.02 | 5.59 a | 0.02 | 5.66 a | 0.01 |
| GPAABA | 5.86 a | 0.05 | 5.50 b | 0.01 | 5.27 b | 0.05 |
| ABCLADA | 36.10 b | 0.05 | 38.51 a | 0.01 | 39.34 a | 0.03 |
| ABCLABA | 35.00 a | 0.01 | 36.03 a | 0.01 | 35.44 a | 0.00 |
| ARCPADA | 9.93 a | 0.01 | 9.84 a | 0.00 | 9.83 a | 0.00 |
| ARCPABA | 9.56 a | 0.02 | 9.27 a | 0.01 | 9.23 a | 0.01 |
| AECPADA | 38.25 a | 0.01 | 38.33 a | 0.01 | 37.22 a | 0.02 |
| AECPABA | 38.17 a | 0.04 | 36.96 a | 0.01 | 34.76 b | 0.05 |
| ACEADA | 3,636.06 b | 0.01 | 3,822.46 a | 0.04 | 3,520.85 b | 0.04 |
| ACEABA | 3,678.39 a | 0.02 | 3,776.45 a | 0.05 | 3,329.62 b | 0.08 |
IEADA = Índice estomático adaxial, IEABA = Índice estomático abaxial, LCOADA = Longitud de células oclusivas adaxial (µm), LCOABA = Longitud de células oclusivas abaxial (µm), GPAADA = Grosor de pared anticlinal adaxial (µm), GPAABA = Grosor de pared anticlinal abaxial (µm), ABCLADA = Ancho de borde cuticular lateral adaxial (µm), ABCLABA = Ancho de borde cuticular lateral abaxial (µm), ARCPADA = Ancho de reborde cuticular polar adaxial (µm), ARCPABA = Ancho de reborde cuticular polar abaxial (µm), AECPADA = Ancho de espacio cuticular polar adaxial (µm), AECPABA = Ancho de espacio cuticular polar abaxial (µm), ACEADA = Área de células epidérmicas adaxiales (µm2), ACEABA = Área de células epidérmicas abaxiales (µm2).
Análisis de varianza entre individuos de la misma localidad. A partir de la comparación de las tres regiones de la hoja entre individuos de la localidad de Tecámac, se encontró variación significativa (P ≤ 0.05; Tabla 3) en cinco caracteres (35.7 %), al menos en uno de los cinco individuos analizados, estos son: LCOADA y en la epidermis abaxial (LCOABA), ancho del reborde cuticular polar abaxial (ARCPABA) y ACEADA/ACEABA. Excepto el ARCPABA con dos grupos homogéneos, en el resto de estos caracteres, la variación es mayor, ya que se forman tres grupos homogéneos.
Tabla 3 Promedio y LS (Levene statistic), de los parámetros epidérmicos de A. salmiana subs. salmiana entre individuos de la localidad de Tecámac. Letras desiguales indican grupos distintos en la prueba de Tukey (P ≤ 0.05).
| Carácter | TEC1 | LS | TEC2 | LS | TEC3 | LS | TEC4 | LS | TEC5 | LS |
|---|---|---|---|---|---|---|---|---|---|---|
| IEADA | 7.70 b | 0.09 | 8.73 a | 0.04 | 8.53 a | 0.02 | 8.75 a | 0.04 | 8.25 ab | 0.02 |
| IEABA | 7.08 a | 0.09 | 7.89 a | 0.02 | 7.76 a | 0.00 | 7.60 a | 0.02 | 8.34 a | 0.07 |
| LCOADA | 48.03 c | 0.18 | 55.20 b | 0.03 | 58.66 a | 0.03 | 60.37 a | 0.06 | 61.25 a | 0.07 |
| LCOABA | 51.29 d | 0.12 | 56.58 c | 0.02 | 58.58 bc | 0.02 | 62.16 a | 0.07 | 59.54 b | 0.03 |
| GPAADA | 5.93 b | 0.06 | 6.15 b | 0.02 | 6.86 a | 0.09 | 6.26 ab | 0.00 | 6.13 b | 0.02 |
| GPAABA | 6.23 a | 0.01 | 6.26 a | 0.00 | 6.54 a | 0.04 | 6.39 a | 0.02 | 6.05 a | 0.04 |
| ABCLADA | 38.09 c | 0.07 | 38.40 c | 0.06 | 44.31 a | 0.08 | 39.86 bc | 0.02 | 43.11 ab | 0.05 |
| ABCLABA | 38.47 a | 0.02 | 38.29 a | 0.02 | 36.00 a | 0.04 | 37.70 a | 0.00 | 37.57 a | 0.00 |
| ARCPADA | 9.78 a | 0.03 | 9.10 a | 0.05 | 9.73 a | 0.02 | 9.26 a | 0.03 | 9.75 a | 0.02 |
| ARCPABA | 10.21 a | 0.11 | 8.87 b | 0.02 | 8.95 b | 0.01 | 8.52 b | 0.06 | 8.79 b | 0.03 |
| AECPADA | 37.66 c | 0.06 | 37.50 c | 0.06 | 39.75 bc | 0.00 | 42.98 a | 0.08 | 40.85 ab | 0.03 |
| AECPABA | 39.24 ab | 0.02 | 36.72 bc | 0.05 | 34.26 c | 0.12 | 40.17 a | 0.04 | 41.78 a | 0.08 |
| ACEADA | 3,607.64 c | 0.16 | 4,182.35 b | 0.00 | 4,237.63 b | 0.01 | 4,940.01 a | 0.15 | 4,036.18 b | 0.04 |
| ACEABA | 3,572.7 d | 0.15 | 4,073.1 bc | 0.03 | 4,300.45 b | 0.02 | 4,620.84 a | 0.09 | 3,935.17 c | 0.07 |
En la variación entre individuos de San Martin de las Pirámides, se encontraron sólo tres caracteres (21.43 %) con variación significativa (P ≤ 0.05). Estos caracteres son: GPABA, AECPABA y ACEABA. En esta localidad la variación entre individuos es menor ya que sólo se formaron dos grupos (Tabla 4).
Tabla 4 Promedio y LS (Levene statistic), de los parámetros epidérmicos de A. salmiana subs. salmiana entre individuos de la localidad de San Martín de las Pirámides. Letras desiguales indican grupos distintos en la prueba de Tukey (P ≤ 0.05).
| Carácter | SM1 | LS | SM2 | LS | SM3 | LS | SM4 | LS | SM5 | LS |
|---|---|---|---|---|---|---|---|---|---|---|
| IEADA | 8.91 a | 0.00 | 8.96 a | 0.01 | 8.61 a | 0.03 | 8.57 a | 0.04 | 9.36 a | 0.05 |
| IEABA | 7.85 a | 0.03 | 8.30 a | 0.03 | 8.23 a | 0.02 | 7.68 a | 0.05 | 8.21 a | 0.02 |
| LCOADA | 47.70 a | 0.02 | 45.25 a | 0.03 | 46.62 a | 0.00 | 47.62 a | 0.02 | 45.66 a | 0.02 |
| LCOABA | 52.5 a | 0.10 | 46.37 a | 0.01 | 46.33 a | 0.01 | 45.79 a | 0.03 | 44.08 a | 0.07 |
| GPAADA | 5.30 ab | 0.04 | 5.69 a | 0.03 | 5.75 a | 0.05 | 5.69 a | 0.03 | 5.03 b | 0.09 |
| GPAABA | 5.42 ab | 0.04 | 5.84 a | 0.11 | 5.35 ab | 0.02 | 5.08 b | 0.03 | 4.40 c | 0.19 |
| ABCLADA | 33.71 c | 0.14 | 37.61 bc | 0.02 | 35.58 c | 0.08 | 44.08 a | 0.13 | 40.54 ab | 0.05 |
| ABCLABA | 34.42 ab | 0.01 | 33.98 b | 0.01 | 33.51 b | 0.02 | 37.16 a | 0.08 | 32.00 b | 0.07 |
| ARCPADA | 9.64 b | 0.04 | 9.96 ab | 0.01 | 9.34 b | 0.08 | 11.18 a | 0.10 | 10.23 ab | 0.02 |
| ARCPABA | 9.55 a | 0.03 | 9.38 a | 0.01 | 8.66 a | 0.07 | 9.53 a | 0.03 | 9.23 a | 0.00 |
| AECPADA | 36.63 a | 0.01 | 36.68 a | 0.01 | 36.73 a | 0.01 | 35.15 a | 0.04 | 36.91 a | 0.01 |
| AECPABA | 32.41 b | 0.08 | 38.95 a | 0.10 | 35.10 b | 0.00 | 33.69 b | 0.04 | 34.94 b | 0.00 |
| ACEADA | 3716.42 a | 0.05 | 3608.93 ab | 0.02 | 3679.86 a | 0.04 | 3353.22 bc | 0.05 | 3278.02 c | 0.08 |
| ACEABA | 3659.58 b | 0.05 | 3956.66 a | 0.12 | 3536.13 bc | 0.01 | 3046.13 d | 0.15 | 3248.33 cd | 0.07 |
Entre individuos de la localidad de Teotihuacán (Tabla 5), hay diez caracteres (71.43 %) con variación significativa (P ≤ 0.05), al menos en alguno de sus individuos. De estos caracteres, la variación de seis es menor ya que sólo forman dos grupos, mientras que otras tres variables forman tres grupos; el ancho del espacio cuticular polar adaxial (AECPADA), mostró mayor variabilidad al formar cuatro grupos.
Tabla 5 Promedio y LS (Levene statistic), de los parámetros epidérmicos de A. salmiana subs. salmiana entre individuos de la localidad de Teotihuacán. TEO1, TEO2, TEO3 provienen de Santa María Tecajete, Hidalgo y TEO4, TEO5 de Perote, Veracruz. Letras desiguales indican grupos distintos en la prueba de Tukey (P ≤ 0.05).
| Carácter | TEO1 | LS | TEO2 | LS | TEO3 | LS | TEO4 | LS | TEO5 | LS |
|---|---|---|---|---|---|---|---|---|---|---|
| IEADA | 8.16 b | 0.05 | 9.12 a | 0.06 | 9.08 a | 0.05 | 9.01 a | 0.05 | 7.56 c | 0.14 |
| IEABA | 7.49 c | 0.06 | 8.79 a | 0.10 | 8.05 bc | 0.02 | 8.38 ab | 0.05 | 6.91 d | 0.15 |
| LCOADA | 50.73 ab | 0.01 | 53.16 a | 0.03 | 51.16 ab | 0.00 | 53 a | 0.03 | 48.54 b | 0.06 |
| LCOABA | 55.20 a | 0.06 | 51.95 b | 0.00 | 51.08 b | 0.02 | 50.41 b | 0.03 | 50.83 b | 0.02 |
| GPAADA | 4.96 c | 0.07 | 4.80 c | 0.11 | 5.55 b | 0.04 | 4.94 c | 0.07 | 6.28 a | 0.15 |
| GPAABA | 4.56 c | 0.12 | 4.82 bc | 0.06 | 5.30 ab | 0.03 | 5.45 a | 0.06 | 5.47 a | 0.06 |
| ABCLADA | 30.89 c | 0.13 | 35.52 b | 0.02 | 33.60 bc | 0.04 | 34.80 b | 0.00 | 39.65 a | 0.12 |
| ABCLABA | 32.21 bc | 0.08 | 37.72 a | 0.08 | 31.29 c | 0.11 | 34.85 ab | 0.01 | 37.13 a | 0.07 |
| ARCPADA | 9.03 b | 0.11 | 9.74 b | 0.03 | 9.19 b | 0.09 | 9.72 b | 0.03 | 12.38 a | 0.19 |
| ARCPABA | 8.18 c | 0.19 | 11.30 a | 0.14 | 9.79 b | 0.01 | 7.90 c | 0.23 | 11.45 a | 0.15 |
| AECPADA | 28.26 d | 0.33 | 36.31 c | 0.04 | 40.09 b | 0.06 | 40.32 b | 0.07 | 43.20 a | 0.13 |
| AECPABA | 28.88 c | 0.26 | 36.84 b | 0.01 | 37.73 ab | 0.03 | 39.14 ab | 0.07 | 39.59 a | 0.08 |
| ACEADA | 2931.86 c | 0.11 | 3175.06 bc | 0.02 | 3503.48 a | 0.07 | 3259.57 ab | 0.00 | 3386.64 ab | 0.04 |
| ACEABA | 2940.43 b | 0.12 | 3336.29 a | 0.01 | 3415.68 a | 0.03 | 3383.96 a | 0.02 | 3450.11 a | 0.04 |
Patrones de variación en los caracteres de la epidermis foliar entre las tres poblaciones estudiadas. El análisis de componentes principales muestra diferencias importantes entre los individuos de las tres poblaciones comparadas. Como se observa en la Figura 3A, el primer componente principal, el cual explica el 49.1 % de la variación, discrimina a todos los individuos de la localidad de Tecámac de los demás. Los caracteres con mayor peso que contribuyen a explicar estos agrupamientos son: LCOADA y la longitud de las células oclusivas abaxiales (LCOABA) con valores mayores a 56.73 µm y 57.67 µm respectivamente, el grosor de pared anticlinal adaxial (GPAADA) y GPAABA (> 6.27 µm y 6.30 µm), además del ACEADA y ACEABA (> 4,202.02 µm2 y 4,102.88 µm2). El segundo componente principal explica el 16.3 % de la variación y separa en dos grupos a los individuos de la población de Tecámac. El primero de ellos situado en la parte superior de la gráfica (TEC3, TEC4, TEC5), corresponde a los individuos que tienen valores mayores en el índice estomático (> 8.25 en IEADA y > 7.60 en IEABA) y ancho de borde cuticular lateral adaxial (> 39.86 µm). El grupo situado en la parte inferior (TEC1, TEC2), presenta valores menores en dichos caracteres. Los individuos de Teotihuacán y San Martín de las Pirámides se combinan en la parte positiva de la escala del primer componente principal; ambos con valores menores en los mismos caracteres mencionados (< 56.73 µm en LCOADA, < 57.67 µm en LCOABA, < 6.27 µm en GPAADA y < 6.30 µm en GPAABA). Se observa, sin embargo, una tendencia de agrupamiento de los individuos de San Martín de las Pirámides en la escala positiva del segundo componente, donde los valores de índice estomático (> 8.58 en IEADA y > 7.92 en IEABA) y el ancho de borde cuticular lateral adaxial (de 38.28 µm) son mayores entre estas dos localidades.
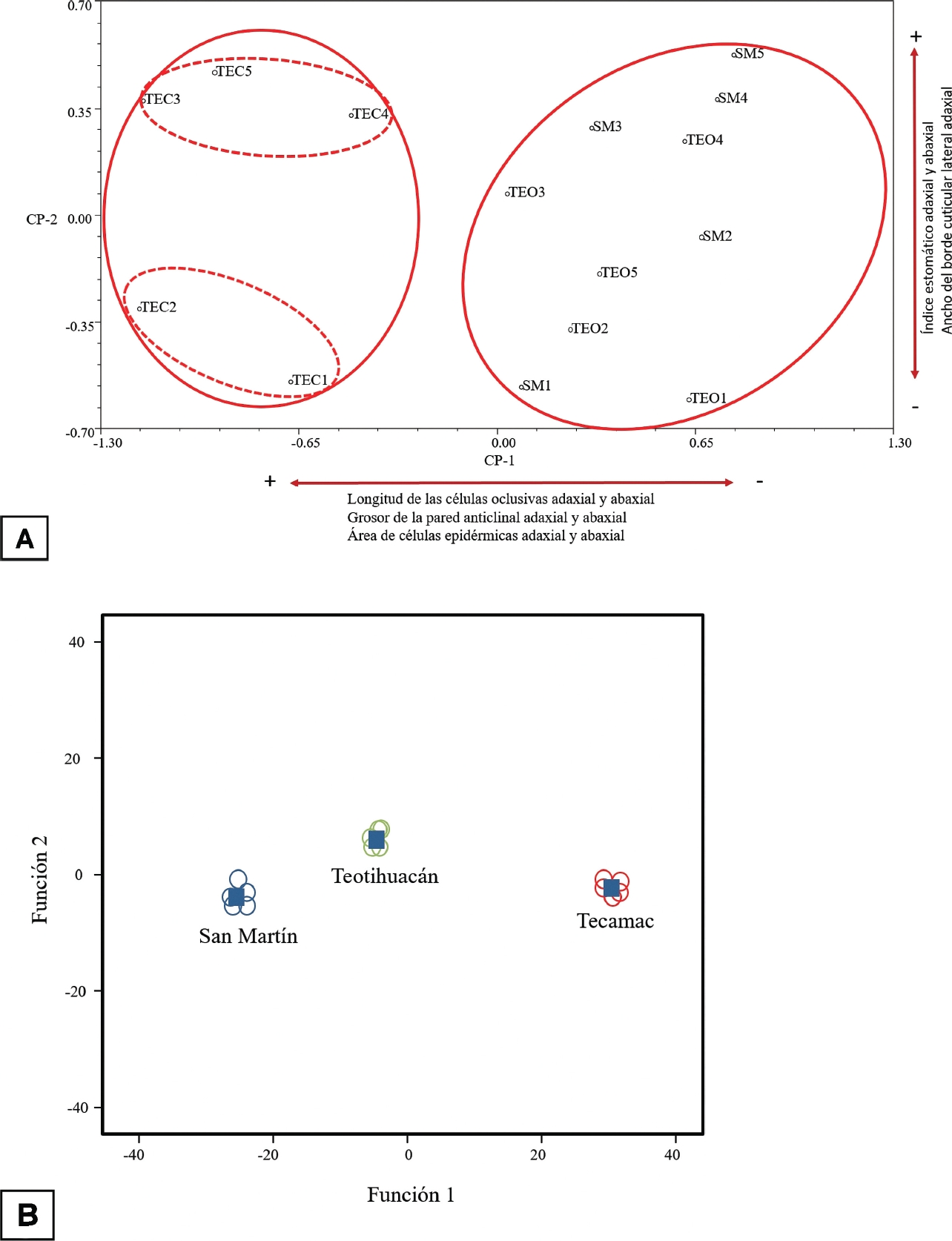
Figura 3 A. PCA: Proyección de los individuos de las tres poblaciones muestreadas (TEC = Tecámac; SM = San Martín de las Pirámides; TEO = Teotihuacán), de Agave salmiana subsp. salmiana en el espacio de los dos primeros componentes principales B. Agrupamiento de los indivi-duos de las tres localidades comparadas de acuerdo al análisis de funciones discriminantes canónicas. Los rectángulos representan al individuo promedio de cada grupo.
El análisis de funciones discriminantes prueba la significancia de los agrupamientos mostrados por el de componentes principales, separando a los individuos de las tres poblaciones (Figura 3B). Además, muestra que las diferencias entre los individuos de las localidades son estadísticamente significativas (P ≤ 0.05; Tabla 6) y que no existe ningún error de clasificación o sobrelapamiento entre poblaciones (Tabla 7). Como se observa en la figura 3B la primera función discriminante separa claramente a los individuos de Tecámac de los demás, mientras que la segunda función discriminante separa a los individuos de Teotihuacán de los de San Martín de las Pirámides. En ambos análisis los caracteres de mayor importancia para diferenciar las poblaciones son consistentes. En el análisis de varianza se encontró que los caracteres: largo de células oclusivas en ambas epidermis, área de células epidérmicas adaxiales y ancho del borde cuticular adaxial forman tres grupos, mientras que el grosor de la pared anticlinal en ambas epidermis y el área de células epidérmicas abaxiales forman dos grupos y el índice estomático adaxial y abaxial forman un solo grupo (Tabla 8).
Tabla 6 Significancia de las funciones discriminantes que separan los agrupamientos.
| Contraste de las Funciones | Lambda de Wilks | Chi-cuadrado | gl | Significancia |
|---|---|---|---|---|
| 1 a la 2 | 0.00 | 63.15 | 24 | 0.00 |
| 2 | 0.04 | 20.72 | 11 | 0.04 |
Tabla 7 Errores de clasificación encontrados por el análisis. Clasificados correctamente de los casos agrupados originales (%).
| Grupo Original | Grupo de pertenencia pronosticado | |||
|---|---|---|---|---|
| Tecámac | San Martín | Teotihuacán | Total en el grupo | |
| Tecámac | 5 | 0 | 0 | 5 |
| San Martín | 0 | 5 | 0 | 5 |
| Teotihuacán | 0 | 0 | 5 | 5 |
| Tecámac | 100 | 0 | 0 | 100 |
| San Martín | 0 | 100 | 0 | 100 |
| Teotihuacán | 0 | 0 | 100 | 100 |
Tabla 8 Promedio y LS (Levene statistic), de los nueve parámetros epidérmicos de A. salmiana subs. salmiana de mayor peso entre las tres localidades. Letras desiguales indican grupos distintos en la prueba de Tukey (P ≤ 0.05).
| Carácter | Tecámac | LS | San Martín de las Pirámides | LS | Teotihuacán | LS |
|---|---|---|---|---|---|---|
| IEADA | 8.41 b | 0.02 | 8.88 a | 0.03 | 8.58 ab | 0.00 |
| IEABA | 7.74 a | 0.02 | 8.05 a | 0.02 | 7.92 a | 0.00 |
| LCOADA | 56.73 a | 0.09 | 46.59 c | 0.11 | 51.30 b | 0.00 |
| LCOABA | 57.67 a | 0.09 | 47.03 c | 0.11 | 51.87 b | 0.01 |
| GPAADA | 6.27 a | 0.09 | 5.49 b | 0.04 | 5.31 b | 0.07 |
| GPAABA | 6.30 a | 0.12 | 5.22 b | 0.06 | 5.13 b | 0.08 |
| ABCLADA | 40.76 a | 0.07 | 38.28 b | 0.01 | 34.92 c | 0.09 |
| ACEADA | 4,202.02 a | 0.13 | 3,525.7 b | 0.04 | 3,253.91 c | 0.12 |
| ACEABA | 4,102.88 a | 0.12 | 3,377.19 b | 0.06 | 3,306.82 b | 0.09 |
Discusión
Se presenta la descripción anatómica de la epidermis foliar de Agave salmiana subsp. salmiana. En vista superficial las células epidérmicas son poligonales isodiamétricas con paredes anticlinales lineales, engrosadas y área celular promedio similar a lo establecido para A. fourcroydes Lem. (Sosa-del Castillo et al. 2014). En vista transversal, la cutícula de A. salmiana subsp. salmiana, como en otras especies de Agave que crecen en zonas áridas (Nobel 1988, Álvarez 1990), es lisa y gruesa. La epidermis es monoestratificada, como se presenta también para otros géneros de Asparagaceae (Álvarez 1990, Sosa-del Castillo et al. 2014), sus células tienen una pared periclinal externa sumamente engrosada y celulósica, como se ha descrito para Agave striata Zucc., Furcraea macdougalii Matuda, Hesperaloe nocturna Gentry y Yucca thompsoniana Trel. Sin embargo, otras especies de Agave, como A. bracteosa S. Watson ex Engelm. y A. ellemeetiana K. Koch, no desarrollan engrosamiento en dichas paredes. En algunos géneros de Cactaceae que crecen en zonas áridas y semi-áridas de México, como Coryphantha, Ferocactus y Mammillaria, también se han observado paredes periclinales externas engrosadas (Gasson 1981, Loza-Cornejo & Terrazas 2003, Grego-Valencia et al. 2014).
Los patrones genéticos y ambientales o la edad de la planta determinan las diferencias entre el espesor, estructura de la cutícula y grosor de la pared periclinal externa de las células epidérmicas, además de otras estructuras internas de la hoja. Las altas temperaturas y el estrés hídrico promueven que las cutículas tengan un mayor grosor en las plantas que habitan en zonas áridas, ya que se modifica la estructura de los cordones de cera en la epidermis (Jordan et al. 1984, Mauseth 1988). Al igual que otras especies del mismo género, como A. bracteosa S. Watson ex Engelm, A. ellemeetiana y A. striata Zucc, los individuos de A. salmiana subsp. salmiana, presentan cutículas gruesas y estomas hundidos. Solo que esta última especie tiene paredes periclinales externas engrosadas, que junto con las abundantes fibras vasculares y no vasculares de paredes celulósicas reportadas anteriormente (Olvera & San Agustín 2017), confieren soporte mecánico y elasticidad a sus hojas que llegan a medir más de un metro de largo y 30 cm de ancho, permitiendo que se mantengan erguidas. Estas paredes engrosadas pueden favorecer el almacenamiento adicional de agua debido a su alto contenido de hemicelulosa y pectina (Mauseth 1988); no obstante, aunque es una ventaja adaptativa importante, no todas las especies de Agave la presentan, por lo que este carácter no distingue al género. La presencia de una cutícula y una pared periclinal externa engrosada, además de rebordes cuticulares externos prominentes, como se observó en el A. salmiana subsp. salmiana, son caracteres xeromórficos que desarrollan las plantas como una adaptación al severo déficit de agua (Álvarez 1990, Hernández-Valencia et al. 2003, Moreno 2009).
Como en otras monocotiledóneas, los estomas en Agave salmiana subsp. salmiana son de tipo tetracítico. A pesar de que se ha mencionado que la familia Asparagaceae carece de células subsidiarias (Stebbins & Khush 1961), algunos géneros pueden tener dos o hasta cuatro células subsidiarias, como fue reportado por Álvarez (1990) quien menciona que en las Asparagaceae existen diferentes grados de organización del complejo estomático, siendo mucho más complejo en aquellos géneros con hojas xeromórficas si se comparan con los de hojas herbáceas. El complejo estomático es un carácter con valor taxonómico ya que muestra gran constancia a nivel de género (Stebbins & Khush 1961), a través de esta investigación se confirmó que también es constante a nivel de la subespecie estudiada.
Los estomas descritos están presentes en ambas epidermis y organizados en hileras paralelas al eje longitudinal de la hoja, como fue descrito para la mayoría de los géneros de la familia Asparagaceae (Álvarez 1990) y para otras especies de Agave (Blunden et al. 1973, Gentry & Sauck 1978, Hernández-Valencia et al. 2003, Sosa-del Castillo et al. 2014); la presencia de estomas en ambas epidermis ha sido considerada como un carácter xeromórfico en otras plantas (Roth 1992). Esta condición anfiestomática parece incrementar el valor de conductancia en la capa limítrofe de la hoja y confiere ventajas en ambientes donde la tasa fotosintética está limitada (Branco-Camargo & Marenco 2012); algunos autores mencionan que además de aumentar la captación de CO2, incrementa la tasa de transpiración, lo que propicia una considerable disminución de la temperatura interna en la hoja (Willmer & Fricker 1996, Taiz & Zeiger 2010).
En otras especies con estomas en ambas epidermis, como en Dasylirion cedrosanum Trel., llegan a presentar mayor número en la superficie adaxial que en la abaxial (Hernández-Juárez 2008). Para A. salmiana subsp. salmiana también el índice estomático adaxial es mayor. Tichá (1982) encontró que una alta densidad de estomas por unidad de área está relacionada con una mejor capacidad fotosintética, esto hace suponer que la mayor capacidad fotosintética de A. salmiana subsp. salmiana se encuentra en la superficie adaxial. Por otro lado, varios autores han observado que, en hojas de otras especies, la densidad estomática puede variar dentro de la especie debido al genotipo, intensidad solar, humedad, CO2 atmosférico y edad de la planta (Gossypium hirsutum L., Kakami et al. 2003, Dasylirion cedrosanum Trel., Hernández-Juárez 2008), por lo que se considera que es un carácter altamente sensible a condiciones ambientales (Kürschner et al. 1998, Barrientos-Priego et al. 2003). No obstante, los resultados del presente estudio indican que en A. salmiana subsp. salmiana el índice estomático se mantiene constante independientemente de las diferentes condiciones ambientales de las tres localidades analizadas.
La ubicación de los estomas respecto al resto de las células epidérmicas es variable dentro de las Asparagaceae, ya sea que se encuentren al mismo nivel que el resto de las células epidérmicas, como en algunas especies de Beschorneria, en criptas como en Hesperaloe o hundidos. En algunos casos se ha observado que si bien los estomas están hundidos, permanecen a nivel del resto de las células epidérmicas como en Agave ellemeetiana y A. striata, ya que las paredes periclinales externas de las células epidérmicas están muy engrosadas. En otros casos los estomas pueden estar por debajo del resto de la epidermis como en A. tequilana (Hernández-Valencia et al. 2003), A. bracteosa, Beschorneria calcicola (García-Mendoza 1998) y Furcraea macdougallii. En A. salmiana subsp. salmiana los rebordes cuticulares externos forman una cámara supraestomática, misma que es descrita para A. tequilana (Hernández-Valencia et al. 2003), así como para otros géneros de Asparagaceae (Álvarez 1990).
Stebbins & Khush (1961), reconocen que existe una correlación entre el tamaño de las células epidérmicas (CE) y el de las células oclusivas (CO), estos autores plantean que las especies con mayor número de células subsidiarias (4 a 6) tienen una baja relación CE/CO, donde las células epidérmicas son más pequeñas que las células oclusivas; no obstante que A. salmiana subsp. salmiana tiene cuatro células subsidiarias, esta relación tiene un valor de uno, ya que las células epidérmicas son del mismo tamaño que las oclusivas.
Las plantas CAM presentan estomas pequeños, generalmente encriptados en ambas superficies, además de cutículas gruesas y bajas frecuencias estomáticas que contribuyen a reducir la pérdida de agua (Sharkey 1993). Si bien las hojas de A. salmiana subsp. salmiana con anatomía foliar típica de las plantas CAM, conservan una cutícula gruesa, estomas hundidos presentes en ambas superficies y una cámara supraestomática, tienen un índice estomático alto y células oclusivas muy grandes.
A excepción de la cutícula, los individuos de Tecámac tienen valores mayores en el grosor de la pared periclinal externa de las células epidérmicas, como también fue observado por Olvera & San Agustín (2017). Estos ejemplares tienen hojas más anchas que pueden demandar un mayor soporte interno, lo que explica el mayor grosor de su pared; esta característica también está presente en otras especies de Agave y otros géneros de la misma familia (Nobel 1988, Álvarez 1990).
Las plantas de San Martín de las Pirámides proceden del Colegio de Posgraduados en Montecillo, Estado de México, mientras que las de Teotihuacán proceden de Veracruz e Hidalgo. No obstante, de tener un origen geográfico distinto, comparten valores similares (35.71 %), en el grosor de la pared anticlinal de ambas epidermis, el ancho del borde cuticular lateral abaxial, el ancho del espacio cuticular polar adaxial y el área de las células epidérmicas abaxiales.
A partir de lo observado en A. salmiana subsp. salmiana y de acuerdo con lo planteado para otras especies de Agave (Álvarez 1990), se propone que las principales tendencias adaptativas de su epidermis foliar hacia ambientes xéricos, son el desarrollo de un complejo estomático tetracítico, altos valores de índice estomático, tamaño similar entre las células oclusivas y las restantes células epidérmicas, baja relación superficie/volumen foliar, paredes anticlinales gruesas, mayor espesor de cutícula, pared periclinal externa muy engrosada, células oclusivas hundidas y presencia de una cámara supraestomática. Estos caracteres son considerados como xeromórficos por Gentry & Sauck (1978), Álvarez (1990), Nilsen & Orcutt (1996) y Aasaman et al. (2001).
Variación anatómica entre las regiones de la hoja. Existen pocos estudios sobre la variación de los caracteres epidérmicos a lo ancho de la hoja. Para A. salmiana subsp. salmiana, se observó que el 57 % de los caracteres muestran diferencias significativas y que están relacionadas con el tamaño de las células epidérmicas, la abundancia de los estomas y otros parámetros asociados al estoma. La variación en la abundancia de los estomas observada en A. salmiana subsp. salmiana se ha encontrado en otras especies. En el estudio de Toral (2010), realizado en Sequoia sempervirens Endl., se reportó que la abundancia de estomas varía dependiendo de las distintas regiones de la hoja, así como de su posición dentro de la copa de los árboles.
Este estudio hace evidente la existencia de plasticidad fenotípica significativa en dos de los caracteres epidérmicos de las tres regiones de la hoja. A nivel del margen, el índice estomático abaxial, así como el área de las células epidérmicas abaxiales en la vena media, reflejaron un valor bajo de canalización microambiental (LS > 0.05) y, por lo tanto, una alta plasticidad fenotípica, por lo que se propone que sólo se seleccione la región intermedia de la hoja con el propósito de estandarizar el muestreo en futuros estudios comparativos, evitando así otros parámetros que estén afectando la comparación de las variables analizadas.
Variación entre individuos de la misma localidad. Con el propósito de entender el nivel de variación entre individuos de una misma localidad, se realizó un análisis de varianza entre cinco individuos de cada una de las tres localidades incluidas. Para la localidad de Tecámac se encontró que sólo cinco caracteres son variables y están relacionados con la longitud de las células oclusivas y el tamaño de las células epidérmicas en ambas epidermis, donde la variación en estos parámetros es amplia entre los individuos de esta localidad. Se pone en evidencia que once de los caracteres analizados (78.57 %), tienen valores de LS > 0.05, una canalización microambiental baja por lo que tienen una plasticidad fenotípica significativa, donde al menos dos individuos por carácter presentan estos valores (Tabla 3). Aun cuando estas plantas son las únicas nativas de la región, el nivel de plasticidad fenotípica en su epidermis es evidente. Para explicar esto habría que analizar el manejo agronómico, así como las condiciones microclimáticas y de suelo en las que los individuos crecen.
En San Martín de las Pirámides sólo tres caracteres son significativamente diferentes entre sus individuos y con un nivel de variación menor. Por otro lado, diez de los caracteres (71 %), tienen valores LS > 0.05, es decir baja canalización microambiental y alta plasticidad fenotípica (Tabla 4), lo cual pudiera deberse a la distinta procedencia de las plantas (Colegio de Posgraduados, del Estado de México), a las condiciones microclimáticas y de suelo en donde crecen, o al manejo agronómico que reciben.
En Teotihuacán se encontró una gran variación entre los individuos, ya que diez de los parámetros son significativamente diferentes, así mismo también se encontró que los catorce caracteres analizados tienen valores de LS > 0.05, al menos para uno de sus individuos (Tabla 5), denotando una amplia plasticidad fenotípica, acentuada en el grosor de la pared anticlinal en ambas epidermis, el ancho del borde cuticular lateral abaxial, el ancho del reborde cuticular polar abaxial y el ancho del espacio cuticular polar adaxial. Es probable que la amplia variación en estos caracteres entre los individuos sea atribuida a que éstos proceden originalmente de distintas localidades (Tabla 1), o de las condiciones microclimáticas y del suelo; aspectos que no se evaluaron en este trabajo.
Variación entre localidades. Los resultados de los análisis de componentes principales y de funciones discriminantes apoyan claramente la hipótesis de la existencia de una variación anatómica significativa en la epidermis foliar entre las tres localidades comparadas, particularmente en nueve de los 14 caracteres epidérmicos observados. Si bien, el índice estomático en ambas epidermis tiene gran peso en el segundo componente principal, para distinguir entre los individuos de Tecámac, al comparar las tres localidades, este presenta valores de LS < 0.05, revelando una clara canalización microambiental. Los siete caracteres restantes que en el análisis de componentes principales resultaron tener mayor peso en la separación de los grupos, en su mayoría tienen valores de LS > 0.05, lo que indica una plasticidad fenotípica significativa, particularmente en el caso de Tecámac. De estos siete caracteres, en San Martín de las Pirámides solo cuatro (LCOADA/LCOABA, GPAABA y ACEABA) y cinco en Teotihuacán (GPAADA/GPAABA, ABCLADA y ACEADA/ACEABA), enfatizan su gran variación fenotípica en el tamaño de estomas, grosor de pared anticlinal, ancho del borde cuticular lateral y tamaño de células epidérmicas en Agave salmiana subsp. salmiana de estas dos localidades particulares.
En todos los niveles de comparación estudiados existe variación significativa en más de 20 % de los caracteres epidérmicos de la hoja de A. salmiana subsp. salmiana. Los agrupamientos resultantes de los análisis multivariados separan notoriamente a los individuos de las tres localidades y muestra que las diferencias entre los individuos de estas localidades son estadísticamente significativas. La alta variación interpoblacional observada puede deberse tanto a la plasticidad fenotípica como a la diferenciación genética adaptativa entre y dentro de las poblaciones de A. salmiana subsp. salmiana en la zona de estudio.
Debido a que la hoja es el órgano más sensible a las condiciones externas, su estructura interna refleja el efecto del estrés hídrico y otros factores ambientales (Nilsen & Orcutt 1996, Nevo et al. 2000, Guerfel et al. 2009). Distintos autores consideran que la correlación entre la variación de los caracteres anatómicos y la variación ambiental es resultado de la plasticidad fenotípica o de diferenciación genética adaptativa entre y dentro de las poblaciones donde se agrupan las especies (Balaguer et al. 2001, Bruschi et al. 2003, Hovenden & Vander-Schoor 2006). El elevado porcentaje de plasticidad fenotípica observada en las hojas de A. salmiana subsp. salmiana, puede indicar la posible relación que tienen los caracteres anatómico-foliares con las condiciones ambientales donde crece esta planta, por lo que sería interesante indagar acerca de esta posible interacción.
En conclusión, A. salmiana subsp. salmiana comparte varios caracteres epidérmicos con otras especies del mismo género y de otros géneros de la misma familia, particularmente con las especies que habitan zonas secas cuyos caracteres, como el grosor de cutícula y de la pared periclinal externa, la ubicación de los estomas y el nivel de los mismos, se consideran xeromórficos y que favorecen la economía del agua. La variación entre regiones de la hoja es mayor a 55 % y los parámetros variables son: la abundancia de estomas, longitud de las células oclusivas adaxiales, grosor de la pared anticlinal abaxial, ancho del borde cuticular lateral adaxial, ancho del espacio cuticular polar abaxial y área de las células epidérmicas en ambas epidermis; la región intermedia de la hoja muestra valores mayores en siete de los caracteres.
Entre los individuos de cada una de las tres localidades, los de San Martín de las Pirámides poseen una menor variación explicada; sin embargo, al comparar las tres localidades hay una variación en los caracteres epidérmicos mayor a 70 % entre ellas. Las regiones de la hoja tienen la menor plasticidad fenotípica de los caracteres epidérmicos; no obstante, a nivel de individuos de cada una de las localidades y entre las tres localidades, el porcentaje de plasticidad fenotípica en los 14 caracteres analizados es mayor a 70 %. A partir de las localidades estudiadas, se establece que los caracteres: índice estomático, ancho de reborde cuticular polar y ancho de espacio cuticular polar en ambas superficies, cuyo valor de canalización microambiental es significativo, podrían ser útiles para distinguir a Agave salmiana subsp. salmiana y tener algún valor taxonómico, sin embargo, se requieren analizar estos mismos parámetros en otras subespecies.











 nueva página del texto (beta)
nueva página del texto (beta)