El género Sesbania Adans., comprende 56 especies (The plant List 2013) distribuidas en las regiones tropicales y subtropicales de África, Australia, Asia y América (Salimuddin & Ramesh 1993, Forni-Martins & Guerra 1999). Incluye herbáceas anuales y perennes, arbustivas y árboles con un porte de pequeño a mediano con grandes flores papilionadas amarillas (Daviña & Honfi 2000). Sesbania virgata (Cav.) Pers., es un arbusto perenne de gran porte que alcanza hasta cuatro metros de altura y crece en ambientes tropicales. Es originaria de la región de las Pampas en Argentina (Branzini et al. 2012) con una distribución que comprende el centro y sur de Brasil, Argentina, Uruguay y Paraguay (Pott & Pott 1994) y se extiende hasta México donde se le encuentra asociada preferentemente con ambientes húmedos e inundables. Debido a sus características de crecimiento rápido ha sido usada para la reforestación de bosques riparios, control de la erosión de suelos, rehabilitación de áreas degradadas, producción de leña y carbón vegetal y recientemente como biorremediador debido a su capacidad de absorber metales en zonas contaminadas (De Souza-Moreira et al. 2006, Simões et al. 2008, Branzini et al. 2012). Por otra parte, en sus semillas han sido caracterizados algunos compuestos polifenólicos fitotóxicos como las catequinas, los cuales inhiben el crecimiento y competencia por parte de otras plantas (Simões et al. 2008).
Desde el punto de vista citogenético, en Sesbania se han estudiado alrededor de 29 especies y la mayoría de los taxa exhiben 2n = 12 (Forni-Martins et al. 1994), no obstante existen especies tetraploides (2n = 24) como Sesbania bispinosa, S. formosa, S. grandiflora, S. sericea, S. simpliciuscula además de citotipos de S. sesban que exhiben un 2n = 4x = 24 (Pawar & Kulkarni 1955, Joshua 1989, Salimuddin & Ramesh 1993, Vijayakumar & Kuriachan 1995, Kumar et al. 2014) e incluso existen registros de 2n = 14 en S. pachycarpa (Abou-El-Enain et al. 1998, Kumar et al. 2014). El número básico propuesto para el género es x = 6 (Goldblatt 1981, Bairiganjan & Patnaik 1989, Forni-Martins et al. 1994). Aunque existen conteos cromosómicos contradictorios (Kumar et al. 2014) existe acuerdo sobre la poca variación en forma y tamaño de los cromosomas entre las especies analizadas y se han descrito cariotipos donde predominan cromosomas metacéntricos (m) y submetacéntricos (sm), aunque también se han registrado pequeñas diferencias cariotípicas a nivel de subgénero (Forni-Martins et al. 1994). Sin embargo, la morfología cromosómica detallada para algunas especies aún es contradictoria (Salimuddin & Ramesh 1993) y existe controversia en relación con el número de constricciones secundarias, satélites, organizadores nucleolares y su posición en los cromosomas del complemento. En efecto, existen investigaciones (Abou-EI-Enain et al. 1998) donde no se registran constricciones secundarias ni satélites en 14 especies y 19 accesiones y otras (Heering & Hanson 1993, Vijayakumar & Kuriachan 1995) donde estos marcadores pueden ser vistos claramente. Interesantemente las investigaciones anteriores incluyen a S. keniensis y S. sesban, por ejemplo. Asimismo, en S. sesban y S. sesban var. nubica, ambas 2n = 12, se han descrito a los organizadores nucleolares en forma de constricciones secundarias en el primer par cromosómico (Datta & Neogi 1970, Sareen & Trehan 1979, Salimuddin & Ramesh 1993) y en forma de satélites en el brazo corto del cuarto par (Heering & Hanson 1993) y quinto par (Parihar & Zadoo 1987). Incluso, para esta misma especie se han descrito cariotipos con dos (Lubis et al. 1981) y tres pares de cromosomas nucleolares (Jacob 1941).
Por otra parte, Forni-Martins & Guerra (1999) utilizaron fluorocromos (CMA y DAPI) y mostraron que en Sesbania virgata la posición de las bandas CMA+ adyacentes a las constricciones secundarias no concordaron con la posición de satélites propuestas en una investigación anterior (Forni-Martins et al. 1994). Además, señalaron la presencia de dos a cuatro regiones teñidas por CMA dentro del nucleolo en interfase lo que sugería que las bandas de CMA estaban asociadas a las regiones organizadoras del nucleolo o “NOR” y que el polimorfismo de las bandas CMA+ observado en dos poblaciones brasileñas podría indicar la existencia de razas citogeográficas.
Aunque el número cromosómico de Sesbania virgata se conoce desde hace más de 70 años (Castronovo 1945) son pocos los estudios que detallan su arquitectura cromosómica y menos aun los que describen el número y posición de los satélites (Forni-Martins et al. 1994, Forni-Martins & Guerra 1999). El objetivo de este trabajo es aplicar una técnica de extendido en superficie y secado al aire para identificar en células en metafase y prometafase el número de constricciones secundarias y satélites, su tipo, posición y la relación que guardan con la organización del nucleolo en dos poblaciones americanas geográficamente distantes de Sesbania virgata. Esta información se utilizará en la interpretación del cariotipo en esta especie y su consideración como razas geográficas o citotipos.
Materiales y métodos
En México, semillas de S. virgata (ADS 2695) fueron recolectadas en el Municipio de Tlacotalpan, Estado de Veracruz, 18° 37′ 0″ N, 95° 40′ 0″ O. En Argentina, las semillas de S. virgata (ADS s/n) se recolectaron en la Provincia de Salta, Ruta Nacional 34, entre Embarcación y El cruce 23° 9ʹ 49.18ʹʹ S; 64° 3ʹ 41.06ʹʹ O. Lotes de 8 a 10 semillas fueron utilizados para el análisis de cada población. Este número de semillas, aunque reducido, permite obtener un número suficiente de células en metafase y prometafase para cumplir los objetivos de la presente investigación; las semillas fueron germinadas a temperatura ambiente en cajas Petri con algodón humedecido. Los meristemos radiculares se separaron de raíces de 1-1.5 cm de longitud y pretratados con 8-hidroxiquinoleína 0.002 M durante 5 horas a temperatura ambiente y fijados en solución Farmer, etanol absoluto-ácido acético glacial, 3:1.
Para la obtención de los cromosomas en prometafase y metafase se siguió el método de extendido en superficie y secado al aire propuesto por Tapia-Pastrana & Mercado-Ruaro (2001), con algunas modificaciones, el cual se basa en la maceración enzimática (pectinasa 20 % + celulasa 1 %) de los meristemos durante 75 minutos a 37 °C. El botón celular fue separado por centrifugación a 1,500 rpm durante 10 minutos y transferido a una solución de KCl 0.075 M durante 13 min a 37 °C. Posteriormente, se realizaron dos lavados con la misma solución y el botón celular fue fijado en solución Farmer. Dos gotas del botón celular se colocaron en un portaobjetos y se dejaron secar al aire. La tinción de los cromosomas fue realizada con Giemsa al 10 % y las preparaciones se hicieron permanentes empleando resina sintética (Sigma) como medio de montaje. Todas las células en estadios de prometafase y metafase típica observadas en cada población fueron registradas y cuidadosamente analizadas. Los mejores campos, aquellos donde los cromosomas exhiben claramente la posición del centrómero y con un grado similar de condensación de la cromatina, fueron fotografiados con un microscopio óptico Zeiss Axioscop (Carl Zeiss Jena GmbH, Jena, Alemania), usando película Kodak Technical Pan. Se utilizó un vernier digital Mitutoyo Digimatic Caliber CD-G’’BS (Mitutoyo Corporation, Kanagawa, Japón) para establecer las tallas cromosómicas y otras medidas morfométricas sobre 5 fotografías de placas en metafase típica de cada población amplificadas con la misma magnificación. Para la obtención de la fórmula cariotípica y nomenclatura, se aplicó el sistema propuesto por Levan et al. (1964). La proporción de brazos, r, se obtuvo mediante el cociente q/p, valor que muestra la relación del brazo largo entre el brazo corto de los cromosomas individuales. La proporción de la suma total de longitudes de brazos cortos respecto a la suma total de longitudes cromosómicas como indicador de simetría o asimetría de un cariotipo (TF %) se realizó según Sinha & Roy (1979). Los ejemplares de herbario depositados en FEZA fueron preparados de plantas crecidas en condición de invernadero a partir de semillas proporcionadas por el Dr. Alfonso Delgado Salinas.
Resultados
Sesbania virgata, Tlacotalpan, México. Para verificar la ubicación de las constricciones secundarias y satélites y establecer el número cromosómico diploide se observaron 21 células en metafase típica y 3 células en prometafase, las cuales exhibieron claramente un 2n = 12.
Sesbania virgata Salta, Argentina. El número cromosómico diploide y la localización de constricciones secundarias y satélites se establecieron a partir de la observación de 142 células en metafase típica y nueve células en prometafase, todas exhibieron un 2n = 12.
Las características cariotípicas de Sesbania virgata en las poblaciones de Tlacotalpan, México y de Salta, Argentina se describen en las Tablas 1 y 2 respectivamente. La Tabla 3 incluye otras características cuantitativas de ambos cariotipos. Se registró la presencia de solo dos cromosomas con satélite en ambas poblaciones. Los macrosatélites, siguiendo la clasificación de Battaglia (1955) fueron intensamente teñidos y fáciles de detectar.
Tabla 1 Análisis cariotípico de Sesbania virgata Tlacotalpan, Veracruz, México. PC, par cromosómico; LCT, longitud cromosómica total haploide en µm; LBL, longitud de brazo largo en µm; LBC, longitud del brazo corto en µm; r, proporción del brazo largo entre el corto de los cromosomas; N, nomenclatura; *cromosoma con constricción secundaria y satélites; m, metacéntrico.
| PC | LCT | LBL | LBC | r | N |
|---|---|---|---|---|---|
| 1 | 4.19 | 2.40 | 1.79 | 1.34 | m |
| 2 | 3.81 | 2.33 | 1.48 | 1.57 | m |
| 3 | 2.70 | 1.43 | 1.27 | 1.13 | m |
| 4 | 2.39 | 1.30 | 1.09 | 1.19 | m |
| 5 | 2.07 | 1.12 | 0.95 | 1.18 | m |
| 6 | 1.71 | 0.98 | 0.73 | 1.34 | m* |
Tabla 2 Análisis cariotípico de Sesbania virgata Salta, Argentina. PC, par cromosómico; LCT, longitud cromosómica total haploide en µm; LBL, longitud de brazo largo en µm; LBC, longitud del brazo corto en µm; r, proporción del brazo largo entre el corto de los cromosomas; N, nomenclatura; *cromosoma con constricción secundaria y satélites; m, metacéntrico; sm, submetacéntrico.
| PC | LCT | LBL | LBC | r | N |
|---|---|---|---|---|---|
| 1 | 3.42 | 2 | 1.42 | 1.41 | m |
| 2 | 3.22 | 1.87 | 1.34 | 1.40 | m |
| 3 | 2.15 | 1.17 | 0.97 | 1.21 | m |
| 4 | 1.95 | 1.05 | 0.90 | 1.17 | m |
| 5 | 1.78 | 0.97 | 0.80 | 1.21 | m |
| 6 | 1.42 | 0.9 | 0.52 | 1.73 | sm* |
Tabla 3 Características cuantitativas del complemento cromosómico de Sesbania virgata (Cav.) Pers. obtenidos a partir de cinco células en metafase. FC, fórmula cromosómica; LCTH, longitud cromosómica total haploide en µm; TCP, talla cromosómica promedio en µm; Rango (longitud del cromosoma mayor-longitud del cromosoma menor); Razón (cromosoma mayor/cromosoma menor); TF %, índice de asimetría (longitud total de brazos cortos/longitud cromosómica total × 100).
| Sesbania virgata | FC | LCTH | TCP | Rango | Razón | TF % |
|---|---|---|---|---|---|---|
| Tlacotalpan, México | 6m | 16.78 ± 1.47 | 2.80 ± 0.23 | 2.48 | 2.45 | 43.3 |
| Salta, Argentina | 5m+1sm | 13.96 ± 0.91 | 2.32 ± 0.15 | 2.0 | 2.48 | 42.68 |
Discusión
Un aspecto fundamental en la descripción de los cariotipos de especies vegetales es la búsqueda e identificación de marcadores cromosómicos (Guerra 2012). Para el caso del género Sesbania, la información disponible muestra notables discrepancias en relación con la identificación precisa de los cromosomas que portan satélites, así como al tipo y ubicación de estos, información útil en la delimitación taxonómica y citogenética comparada.
En el caso de las dos poblaciones de S. virgata estudiadas aquí, los complementos cromosómicos en metafase mostraron un 2n = 12 (x = 6) y cariotipos bimodales (Figuras 1 y 2). Las diferencias en el tamaño cromosómico y la posición del centrómero fueron suficientes para permitir la identificación sin ninguna duda de los pares cromosómicos individuales, la elaboración detallada de los cariotipos (Tablas 1 y 2; Figura 3) y la obtención de otras características cuantitativas de los mismos (Tabla 3). Asimismo, los satélites fueron fácilmente discriminados como macrosatélites según la clasificación de Battaglia (1955) y se observaron intensamente teñidos y localizados sobre los brazos cortos de los dos cromosomas más pequeños a los cuales se unen mediante largas constricciones secundarias (Tablas 1 y 2 y Figuras 1-5). Se corroboró que la cromatina de las constricciones secundarias se mostró ampliamente descondensada en metafase y el tamaño de los satélites favoreció considerablemente su utilidad como marcadores cromosómicos en S. virgata. Por otra parte, en prometafase fue común encontrar a los dos cromosomas con satélite asociados al nucleolo por los extremos que portan satélite (Figuras 4 y 5). Lo anterior corrobora que éstos son los cromosomas “NOR”. La variación morfológica en la proporción de brazos entre los cromosomas portadores de satélites explica las diferencias entre las fórmulas cariotípicas e índices de asimetría (TF %) de ambas poblaciones (Tabla 3). El análisis detallado de los cromosomas somáticos en S. virgata de las poblaciones estudiadas reveló cariotipos esencialmente simétricos con predominancia de cromosomas metacéntricos acorde con los valores TF %.
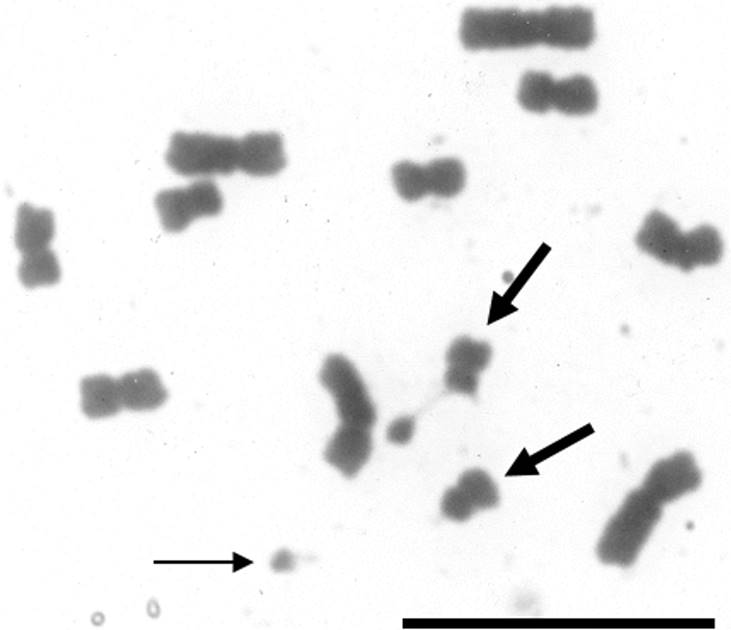
Figura 1 Complemento cromosómico de S. virgata (2n = 12) de la población de Tlacotalpan, México. Las flechas gruesas señalan al par de cromosomas con constricciones secundarias asociadas a macrosatélites. La flecha delgada resalta a un satélite ampliamente separado del cuerpo del cromosoma al cual se asocia. Barra = 10 µm.
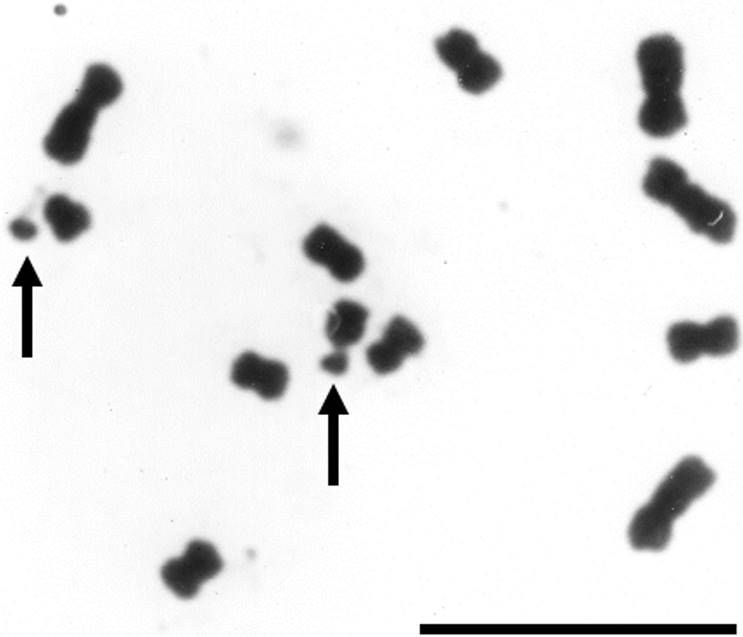
Figura 2 Complemento cromosómico de S. virgata (2n = 12) de la población de Salta, Argentina. Las flechas señalan al par de cromosomas con constricciones secundarias asociadas a macrosatélites. Barra = 10 µm.
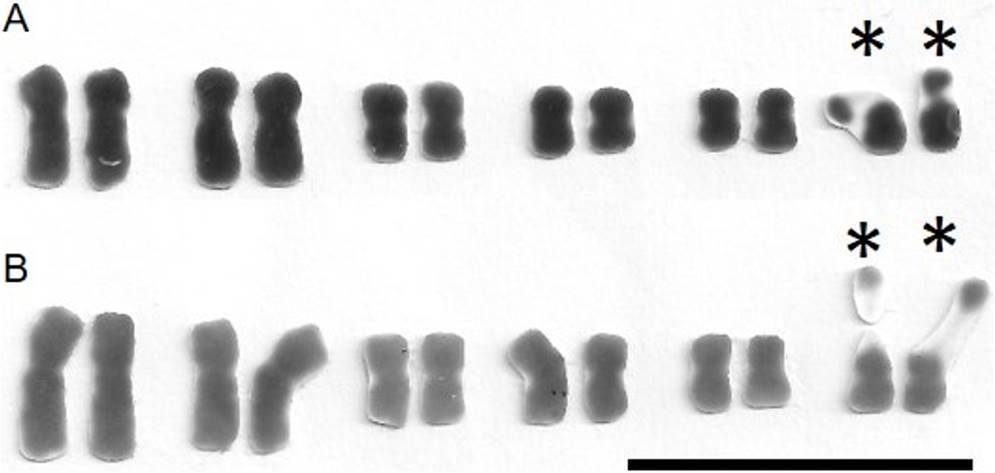
Figura 3 Cariotipos de S. virgata 2n = 12. A, Tlacotalpan, México. B, Salta, Argentina. Los cromosomas están alineados por el centrómero y ordenados en forma decreciente. *, satélites y constricciones secundarias asociadas a brazos cortos del sexto par. Barra, 10 µm.
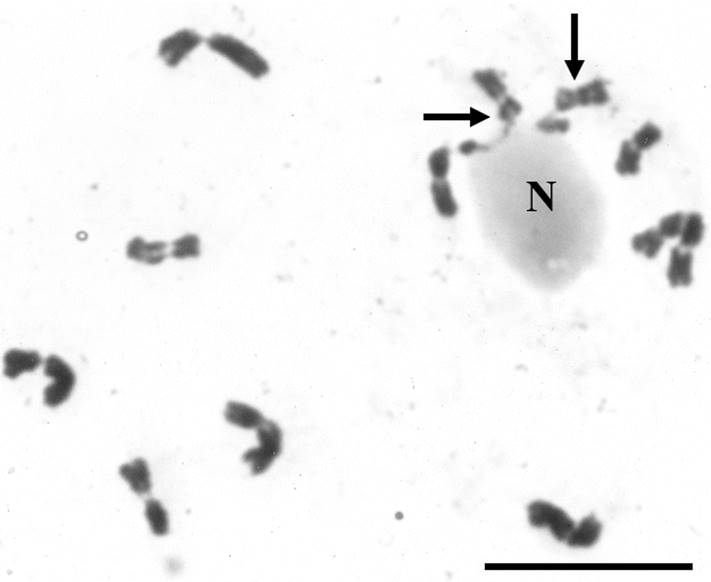
Figura 4 Núcleo en prometafase de S. virgata 2n = 12 de Tlacotalpan, México. Las flechas resaltan a los cromosomas satelitales asociados a un nucleolo único por los extremos que portan satélites. N, nucléolo. Barra, 10 µm.
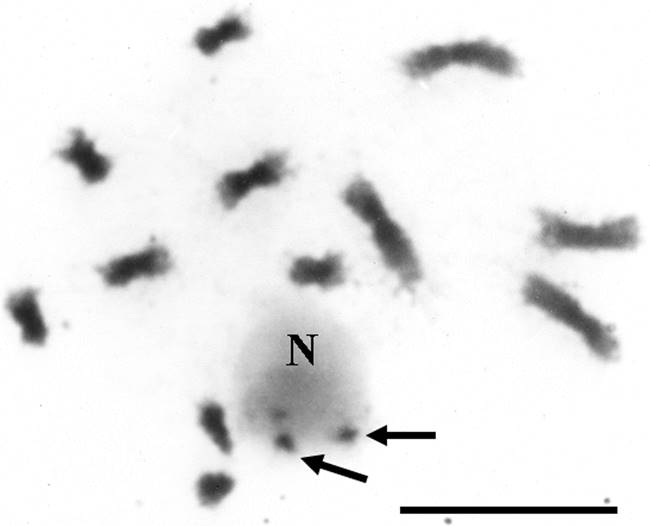
Figura 5 Núcleo en prometafase de S. virgata 2n = 12 de Salta, Argentina. Las flechas resaltan a los cromosomas satelitales asociados a un nucléolo único por los extremos que portan satélites. N, nucléolo. Barra, 10 µm.
A pesar de que investigaciones citogenéticas previas en S. virgata describen la presencia de satélites en el brazo largo del sexto par (Forni-Martins et al. 1994) y bandas CMA+ adyacentes a constricciones secundarias aparentemente en el mismo lugar, además de una marca adicional en un par cromosómico mediano a grande (Forni-Martins & Guerra 1999) los resultados de la presente investigación muestran que en las poblaciones de S. virgata bajo estudio las constricciones secundarias y satélites se posicionan únicamente en el brazo corto del sexto par. Lo anterior parece confirmar una generalidad observada en los complementos cromosómicos de especies vegetales donde el 86 % de las constricciones secundarias preferentemente se localizan en los brazos cortos (Lima De Faria 1976, Lim et al. 2001), particularmente en Leguminosae (Tapia-Pastrana & Mercado-Ruaro 2001, Gómez-Acevedo & Tapia-Pastrana 2003, Tapia-Pastrana & Gómez-Acevedo 2005, Biondo et al. 2006, Tapia-Pastrana & Jiménez-Salazar 2011, Tapia-Pastrana 2012, Tapia-Pastrana et al. 2012). Por otra parte, si se considera que las dos poblaciones bajo estudio se encuentran geográficamente aisladas es probable que las diferencias citológicas a nivel intraespecífico registradas en esta investigación apunten hacia un proceso de diferenciación genómica vía remodelado cromosómico que favorece el proceso de especiación entre citotipos y que puede involucrar o no cambios morfológicos significativos (Kenton 1981, 1984, Kenton et al. 1988, Grant 1989, Palomino & Martínez 1994, Martínez et al. 2000). Procesos similares de diferenciación citológica en los genomas de citotipos que tienen su origen en rearreglos cromosómicos han sido informados en diversos géneros de angiospermas (Palomino & Martínez 1994 y literatura allí citada). La propuesta de razas cromosómicas en S. virgata (Forni-Martins & Guerra 1999) y la distribución y variación del citotipo (esta investigación) señalan la necesidad de realizar estudios de mayor alcance en esta especie que por su amplio intervalo de distribución geográfica presenta poblaciones geográficamente aisladas y por tanto sujetas a selección natural. Lo anterior es relevante pues es la primera ocasión que se realiza este tipo de investigación involucrando por lo menos una población mexicana para cualquier especie del género.











 nova página do texto(beta)
nova página do texto(beta)


