Los manglares son ecosistemas dominantes en la zona intermareal de las regiones tropicales y subtropicales (Twilley & Day 2012, Clough 2013). Forman hábitats constituidos por plantas tolerantes a suelos salinos e hipersalinos, y muy reducidos por la falta de oxígeno por estar inundados frecuentemente (Lugo & Snedaker 1974, Tomlinson 2016). Una de las razones de su éxito es que poseen raíces aéreas que, aparte de brindar soporte mecánico a la planta, transportan oxígeno a la rizósfera; las raíces transportan nutrientes y savia elaborada, además que absorben agua y nutrientes del substrato (Srikanth et al. 2015).
Muchos microorganismos que son importantes en los ciclos biogeoquímicos viven asociados a las raíces del manglar (Bashan & Holguin 2002, Gomes et al. 2014). Las raíces son también hábitat para una meiofauna y la macrofauna muy diversa (Bosire et al. 2008, Nagelkerken & Faunce 2008, Serafy et al. 2015) y su arquitectura es aprovechada como guardería y refugio durante parte del ciclo de vida de muchas especies de importancia ecológica y comercial que además aprovechan el detritus generado por la descomposición de la hojarasca y las raíces finas (Nagelkerken et al. 2008, Zhila et al. 2014).
Los manglares tienen dos tipos de raíces que pueden representar hasta el 60 % del total de la estructura del árbol (Komiyama et al. 2008): (1) aéreas (crecen por arriba del suelo), que tienen forma de zanco y dan apoyo mecánico en Rhizophora o de pneumatóforos que crecen verticalmente y permiten un intercambio directo entre la atmósfera y el suelo (ejemplo, Avicennia spp. y Laguncularia racemosa; (2) las subterráneas que transportan nutrientes y agua (Adame et al. 2017). Las raíces subterráneas se pueden dividir de acuerdo a su grosor (Komiyama et al. 1987, Vogt et al. 1998, Adame et al. 2017); reconociendo que las raíces de 0 a 20 mm funcionan para tomar agua y nutrientes del substrato; las mayores a 20 mm sirven para la comunicación entre pneumatóforos, cuyo crecimiento radial proporciona soporte y cobertura subterránea al árbol. Por otro lado, la biomasa y productividad de las raíces finas tienen una relación directa con la elevación del suelo (acreción) pudiendo responder al incremento del nivel del mar (McKee 2011). El suelo de los manglares está compuesto por sedimentos minerales y componentes orgánicos, fundamentalmente raíces, pero también madera y hojarasca derivados de la productividad primaria del manglar.
En los estuarios hay abundantes sedimentos terrígenos (alóctonos, constituidos por minerales) que forman planicies lodosas que los manglares pueden colonizar (Thom 1967, Feller et al. 2010, Lovelock et al. 2015, Woodroffe et al. 2016). En contraste, en ambientes sin ríos con poco aporte de sedimentos, los manglares son la fuente primordial de la acumulación del suelo autóctono y principalmente orgánico (McKee & Faulkner 2000, Cahoon et al. 2006, McKee 2011). La producción de las raíces subterráneas en los manglares contribuye a la formación de la turba, y son la acumulación de raíces vivas y muertas quienes mayor contribuyen en la elevación del suelo (Krauss et al. 2013). Además, se ha establecido claramente que los manglares tienen una contribución significativa en la captura subterránea de carbono a través de las raíces finas (Chmura et al. 2003, Alongi 2014).
Debido a que la biomasa y productividad de raíces presentan variaciones en función de la estacionalidad anual, la calidad ambiental y gradientes de hidroperíodo (Castañeda-Moya et al. 2011), es posible utilizar su cuantificación como un método confiable para evaluar el estado ecológico de un manglar (Reddy & DeLaune 2008). Además, la evaluación de la productividad de las raíces ante los cambios cualitativos y biogeoquímicos del agua y suelo o de disponibilidad de nutrientes, permiten también evaluar el estado de conservación de los manglares (Feller et al. 2003, Naidoo 2009, Castañeda-Moya et al. 2013).
Las raíces son clave en el proceso de oxigenación del suelo durante las inundaciones, porque participan en el intercambio gaseoso entre el suelo, el agua y la atmósfera (Skelton & Allaway 1996, Alongi & Brinkman 2011), modifican el pH y mejoran la infiltración de agua y el transporte de nutrientes (Srikanth et al. 2015). Las raíces forman asociaciones simbióticas con bacterias y hongos (Bashan & Holguin 2002). La productividad de raíces en función de la disponibilidad de nutrientes, principalmente el déficit de fósforo (ambientes carbonatados); la productividad puede aumentar de 40 a 60 % respecto a la aérea (Komiyama et al. 2000, Castañeda-Moya et al. 2013). Cuando el fósforo es escaso, hay mayor productividad de biomasa subterránea debido a una mayor asimilación y reciclaje del fósforo (Sherman et al. 2003, Kapulnik & Koltai 2016). Adicionalmente, la rápida producción, senescencia y descomposición de las raíces, son consideradas variables integradoras del funcionamiento del ecosistema (Ellison 2000, McKee & Faulkner 2000, Donato et al. 2011, Ouyang et al. 2017), y son especialmente importantes en el proceso de formación de suelo en los manglares establecidos en ambientes carbonatados, un factor crítico para la resiliencia del ecosistema ante la elevación del nivel del mar (Cahoon et al. 2006).
La degradación y pérdida de los manglares es un problema global (Giri et al. 2011). En México, se ha perdido alrededor del 10 % de los bosques de manglar en un periodo de tan sólo 35 años (Valderrama-Landeros et al. 2017). Es por ello que se ha enfatizado la importancia de su restauración para recuperar sus procesos y funciones (Zaldivar-Jimenez et al. 2010, Rodríguez-Zúñiga et al. 2013), especialmente en la mitigación de los efectos del cambio climático. Documentar y comprender los efectos de la restauración hidrológica sobre la productividad de raíces, abre la posibilidad de utilizarla como indicador de la recuperación de funciones del ecosistema (McKee & Faulkner 2000).
Este estudio tiene como objetivo evaluar la biomasa y productividad de raíces subterráneas de manglares en tres sitios sujetos a acciones de restauración con diferente condición ecológica (estructura forestal y tiempo de restauración hidrológica) y compararlo con un sitio de referencia natural. El propósito de este estudio fue evaluar la utilidad de la biomasa y la productividad de raíces como indicador de la recuperación de los manglares sometidos a restauración hidrológica.
Materiales y métodos
Área de estudio. El área de estudio fue en el estero Bahamitas en la Isla del Carmen, Campeche, dentro del Área de Protección de Flora y Fauna Laguna de Términos. Está en una isla de barrera (Bach et al. 2005) constituida por dunas y cordones litorales arenosos; detrás de ellos, se distribuyen los manglares de franja y cuenca en función de las mareas y la microtopografía (Lugo & Snedaker 1974).
La laguna de Términos tiene un área aproximada de 2,500 km2 y una profundidad media de 3.5 m, tiene una descarga de agua dulce continental y un comportamiento estuarino (Yañez-Arancibia & Day 2010). El sistema lagunar se separa en la zona occidental que recibe la mayor proporción de la descargas de los ríos y un aporte de sedimentos lodosos; y la zona oriental predominan los sedimentos calcáreos (Bach et al. 2005). A través de la corriente litoral entra el agua del Golfo de México a la laguna de Términos desde las Bocas de Puerto Real y del Carmen (Contreras-Ruiz et al. 2014). Las especies que se distribuyen en el área de estudio son Rhizophora mangle L. (mangle rojo), Avicennia germinans (mangle negro), Laguncularia racemosa (mangle blanco) y Conocarpus erectus L. (mangle botoncillo) (Day et al. 1987). Además, hay en la zona lagunar praderas de pastos marinos, principalmente Thalassia testudinum (Grenz et al. 2017).
El clima de la región es húmedo tropical con precipitaciones anuales que van desde 1,100 - 2,000 mm. Las épocas climáticas que se han registrado para la región son secas (febrero-abril), transición (mayo), húmedo (junio-septiembre), y nortes (octubre-marzo) (Guerra-Santos & Kahl 2018). Las mareas astronómicas en Isla del Carmen son diurnas con intervalo de amplitud de 0.43 m, con mareas mínimas de -0.24 m y máximas de 0.92 m (Escudero et al. 2014).
El área de estudio corresponde a una zona de manglar con vegetación muerta debido a la pérdida de la conectividad hidrológica con la laguna de Términos que modificó los patrones del hidroperíodo. Por ello, se realizaron acciones de restauración ecológica donde la principal acción fue la rehabilitación hidrológica y el desazolve de canales de marea en función de la microtopografía (Figura 1). Con ello se buscó la reactivación del régimen hidrológico (principalmente el hidroperíodo) y los procesos biogeoquímicos (Zaldivar-Jimenez et al. 2017).

Figura 1 Área de estudio donde se ubican los sitios de muestreo representados por los cuadrados negros; se muestran además, las áreas sometidas a restauración (color gris claro) y las zonas de manglares naturales o sin disturbio (color gris oscuro).
Diseño de muestreo. Se establecieron tres sitios para cubrir un gradiente de condición ecológica y un sitio 4 fue utilizado como referencia (sitio testigo; Figura 1) para los análisis (Zaldivar-Jimenez et al. 2017). El gradiente de la condición ecológica se determinó con base en la estructura de la vegetación y el tiempo de la restauración. En el sitio 1 se identificaron plántulas de Rhizophora mangle y Avicennia germinans (altura promedio = 0.43 m, densidad = 111 ind. ha-1). En el sitio 2 se registraron juveniles de A. germinans (altura promedio = 0.55 m, densidad = 82 ind. ha-1); mientras que en el sitio 3 se registró A. germinans en forma arbustiva (altura promedio = 1.86 m, densidad = 1,450 ind. ha-1). El sitio 4 de referencia, fue donde se observó la cobertura vegetal con mayor desarrollo (A. germinans, árboles de 5.85 m de altura, densidad = 3,400 ind. ha-1) (Rivera-Rosales 2017). Los sitios degradados fueron sometidos a un tratamiento de restauración hidrológica en los años 2010, 2012 y 2013 (Sitio 2, Sitio 3, y Sitio 1 respectivamente). En cada sitio se establecieron dos unidades de muestreo para la determinación de la biomasa, productividad de raíces finas e hidroperíodo. En cada una de estas unidades de muestreo fueron medidas variables fisicoquímicas (temperatura, salinidad, pH y potencial de óxido reducción (Eh)), además de los nutrientes (nitritos, nitratos, amonio y fosfatos) así como la concentración de sulfuros del agua intersticial. La duración del experimento fue de 18 meses (agosto 2013 - febrero 2015).
Variables hidrológicas. El régimen de inundación fue determinado con medidores automáticos de presión “hobo water level” (Onset Computer Corporation), instalados en cada uno de los sitios de estudio dentro tubos de PVC hidráulico de tres pulgadas de diámetro a una profundidad mayor a 50 cm. Los sensores fueron programados para registrar valores cada 60 minutos durante el año 2014. La duración, el nivel y la frecuencia de inundación que definen al hidroperíodo, se calcularon mensualmente.
La colecta de muestras de agua intersticial se realizó a 30 cm de profundidad utilizando una jeringa y tubos de acrílico que se introdujeron en el suelo. Las variables fisicoquímicas fueron medidas en campo. La salinidad y la temperatura se midieron con una sonda multiparamétrica YSI-30, el potencial redox (Eh) y el pH mediante un tester combo de ORP/pH (Hanna-HI9126). Las muestras de agua intersticial se colectaron en recipientes de plástico y se transportaron al laboratorio para análisis químico. Para determinar la concentración de iones se utilizó un espectrofotómetro CHEMetrics V-2000. La concentración de los sulfuros (S-2) del agua intersticial se analizó in situ mediante el método de azul de metileno, mientras que los iones restantes fueron determinados en el laboratorio el mismo día de su colecta utilizando cloruro de estaño para la determinación de PO4 -3, clorante azoico para NO2 -, reducción de cadmio para NO3 - y nesslerización directa para NH4 + (APHA 2005).
Biomasa y productividad de raíces. Se colectaron ocho núcleos de suelo en cada sitio (cuatro núcleos x unidad de muestreo), mediante un nucleador de acero inoxidable (diámetro = 10 cm × profundidad = 30 cm). La biomasa capturada en los núcleos fue separada de las raíces mediante lavado y enjuague con agua dulce para eliminar el suelo completamente y lograr la separación de las raíces vivas (Adame et al. 2014). Las raíces fueron clasificadas para su análisis según el diámetro en raíces finas (< 2 mm), medianas (2 - 5 mm), gruesas (5 - 20 mm) (Komiyama et al. 1987, Vogt et al. 1998, Adame et al. 2017). Una vez separadas, las raíces vivas se secaron a 60 °C por 48 horas en una estufa y se pesaron en una balanza analítica. La biomasa fue calculada mediante los gramos de raíces secas por metro cuadrado de suelo (Adame et al. 2014).
Para determinar la productividad de raíces, se fabricaron núcleos de crecimiento de raíces de 10 cm de diámetro por 30 cm de altura con “peat moss” (características similares a la densidad del suelo del manglar) comercial libre de raíces, utilizando bolsas de plástico con luz de malla de 3 mm (Castañeda-Moya et al. 2011, Adame et al. 2014). Estos núcleos se implantaron verticalmente a 30 cm de profundidad en los sitios de muestreo y se incubaron por 18 meses. Al final de este período las unidades se extrajeron y se procesaron siguiendo el mismo protocolo utilizado para la determinación de la biomasa de raíces. La productividad de las raíces (g m2 año-1) se determinó utilizando el peso de las raíces secas (g) por metro cuadrado de suelo dividido entre el tiempo total (años) del experimento (Adame et al. 2014).
Análisis de datos. Se calcularon los valores medios ± errores estándar de biomasa de raíces (g m-2) y productividad de raíces (g m-2 año). Para comparar entre sitio, los valores encontrados entre sitios de biomasa y productividad de raíces, así como de las variables hidrológicas (fisicoquímicas y químicas), se aplicó la prueba de Kruskal-Wallis (KW). Para determinar la asociación de la biomasa y productividad de raíces se llevó a cabo un Análisis de Componentes Principales (ACP). Este tipo de análisis se realiza cuando hay correlación entre variables, reduce la dimensionalidad de los datos mediante relaciones lineales entre variables e identifica las que explican el mayor porcentaje de variación (Anderson 2003). Para el ACP se incluyeron las variables con diferencias significativas entre sitios. Los fosfatos (p = 0.06) también se incluyeron en el análisis por ser importantes en la productividad de raíces (Mckee 2010). Para normalizar los datos se aplicó una transformación logarítmica (log V+1) a la biomasa, productividad, salinidad, nitratos más nitritos, amonio, fosfatos, periodo, nivel y frecuencia de inundación. Este análisis se llevó a cabo utilizando el programa PRIMER v6 (Clarke & Gorley 2006). Todos los resultados fueron considerados significativos a p ≤ 0.05.
Resultados
Variables hidrológicas. Huo variaciones significativas de la salinidad entre sitios (χ2 = 9.11, p < 0.050; Figura 2). Las salinidades más altas se registraron en los sitios 1 y 3 (57 y 56 ups, respectivamente) y las menores en los sitios 2 y 4 (48 y 42 ups, respectivamente). No hubo diferencias significativas entre sitios en la temperatura intersticial, pH, Eh y sulfuros; pero si en la concentración de NO2 -+NO3 - (χ2 = 15.13, p = 0.001). La mayor concentración se registró en el sitio 1 (6.58 mg l-1) y la menor en el sitio 4 (0.93 mg l-; Figura 2). La concentración de NH4 +, fluctuó entre 66.80 y 207.49 mg l-1 (χ2 = 12.73, p < 0.05, Figura 2) y hubo diferencias significativas entre sitio. Finalmente, la concentración de PO4 -3 varió entre 2.05 y 6.36 mg l-, y tampoco hubieron diferencias significativas entre los sitios de muestreo (χ2 = 7.22, p = 0.064, Figura 2).

Figura 2 Variación espacial de la características fisicoquímicas y químicas (valor promedio y error estándar). Las letras distintas indican que hubo diferencias significativas entre los sitios.
Hidroperíodo. La frecuencia, la duración y el nivel de inundación fueron significativamente diferentes entre sitios (χ2 = 29.93, p < 0.001). Las comparaciones múltiples indicaron que los sitios 1 y 3 difirieron de los sitios 2 y 4 en todas las variables relacionadas con el hidroperíodo (Figura 3). Los mayores niveles de inundación y las inundaciones más prolongadas se registraron en los sitios 1 y 3 (0.11 - 0.33 m; 473 - 738 h mes-1). En contraste, los valores de inundación y el periodo en los sitios 2 y 4 oscilaron entre 0.04 - 0.12 m, y 95 - 524 h mes-1 respectivamente. Finalmente, se registraron de 9 a 17 inundaciones mes-1 en los sitios 2 y 4, y de 1 a 5 inundaciones mes-1 en los sitios 1 y 3 (Figura 3).
Biomasa y productividad de raíces. Hubo diferencias significativas entre sitios, en la biomasa (χ2 = 19.85, p < 0.001) durante el periodo de estudio. En los sitios 3 y 4 se registró la mayor biomasa de raíces (Tabla 1). En todas las categorías de raíces analizadas, la biomasa de raíces fue mayor en los sitios 3 y 4. La contribución de las raíces finas y medianas fue mayor en el sitio 3, con el 46 % en las finas (χ2 = 19.60, p < 0.001) y el 24 % en las medianas (χ2 = 20.0, p < 0.001); mientras que la mayor proporción de las raíces gruesas fue en el sitio 4 con el 52 % (χ2 = 19.94, p < 0.001; Tabla 1).
Tabla 1 Biomasa y productividad de raíces para cada una de las categorías de raíces, se presentan todos los sitios de muestreo con su mediana (percentil de 25 y 75 %). Letras diferentes indican diferencias significativas (p < 0.05).
| Biomasa (g m-2) | Sitio 1 | Sitio 2 | Sitio 3 | Sitio 4 | χ2 | p |
|---|---|---|---|---|---|---|
| Finas | 1.7 a | 10.2 b | 434.2 c | 354.6 c | 19.6 | < 0.001 |
| (0.8, 3.8) | (5.20, 31.2) | (310.7, 581.9) | (215.8, 414.8) | |||
| Medianas | 0 a | 86.6 b | 225.4 c | 201.2 c | 20 | < 0.001 |
| (0, 2.5) | (49.7, 98.0) | (197.3, 294.1) | (132.7, 293.8) | |||
| Gruesas | 0 a | 21.6 a | 287.7 b | 606.1 c | 19.9 | < 0.001 |
| 0, 8.59 | (0, 48.38) | (227.91, 401.07) | (424.6, 1173.0) | |||
| Total | 1.7 a | 118.4 b | 988.0 c | 1140.2 c | 19.8 | < 0.001 |
| (0.8, 17.5) | (67.6,164.9) | (725.7, 1208.3) | (963.8,1936.9) | |||
| Productividad (g m-2 año-1) | ||||||
| Finas | 6.4 a | 55.9 b | 47.8 b | 153.0 b | 14.5 | < 0.001 |
| (5.7, 24.4) | (32.6, 93.2) | (14.9, 100.8) | (102.0, 227.7) | |||
| Medianas | 5.3 | 80.6 | 32.9 | 121.5 | 7.31 | 0.062 |
| (0, 31.1) | (13.1, 127.5) | (22.0, 118.4) | (52.3, 144.4) | |||
| Gruesas | 0 | 95.8 | 49.9 | 85.7 | 3.47 | 0.324 |
| (0, 26.8) | (0, 132.26) | (12.1, 310.5) | (0, 353) | |||
| Total | 16.8 a | 232.5 b | 197.7 b | 414 b | 11.1 | 0.011 |
| (5.7, 79.8) | (64.1, 313.9) | (71.4, 496.6) | (280, 634.2) | |||
La productividad de raíces también varió significativamente entre sitios (χ2 = 11.07, p < 0.05), siendo mayor en el sitio 4, intermedia los sitios 2 y 3 y menor el sitio 1 (Tabla 1), asociándola a la cobertura de la vegetación presente. Adicionalmente, la productividad de raíces finas fue mayor en el sitio 4 que respecto a los demás sitios de muestreo (χ2 = 14.54, p < 0.05). Sin embargo, la productividad de raíces medianas y gruesas fue similar entre sitios (χ2 = 7.31, p > 0.05; χ2 = 3.47, p > 0.05, respectivamente; Tabla 1).
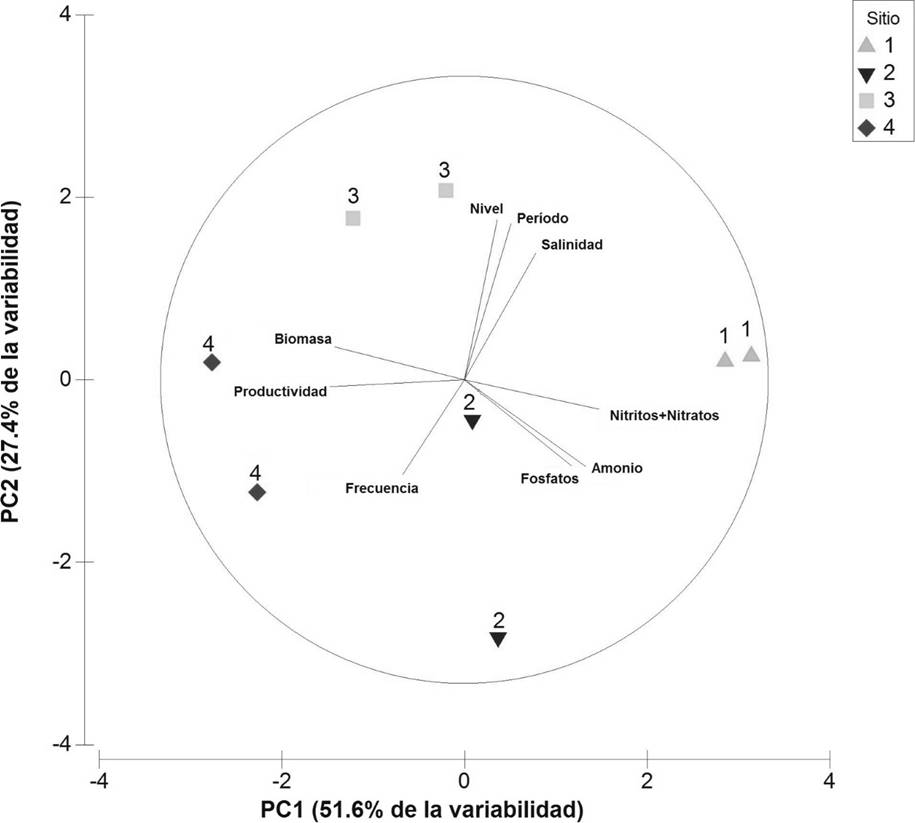
Los dos componentes del ACP explicaron el 79 % de la variabilidad total de los datos, en el primer (PC1, 51.6 % de la varianza) las variables más relevantes fueron la biomasa, la productividad de raíces y las concentraciones de NO2 -+NO3 - , NH4 + y PO4 -3. En el segundo componente (PC2, 27.4 % de la varianza) las variables de mayor relevancia fueron salinidad, nivel, periodo y frecuencia de inundación (Tabla 2, Figura 4). Este análisis indicó una correlación negativa de la biomasa y productividad de raíces con las concentraciones de NO2 -+NO3 -, NH4 + y PO4 -3. La menor biomasa y productividad de raíces se registraron en el sitio 1 y 2, influenciados por las mayores concentraciones de PO4 -3 , NO2 -+NO3 - y NH4 +. La mayor cantidad de biomasa y productividad se registraron en el sitio natural (sitio de referencia) asociándose a mayores frecuencias de inundación. Por otro lado, hubo correlación positiva entre la salinidad con el nivel y el periodo de las inundaciones, pero negativa con la frecuencia de inundación (Figura 4).
Tabla 2 Porcentaje de las variables utilizadas en el Análisis de Componentes Principales. Los números en negritas son los coeficientes de mayor influencia en los dos primeros componentes principales.
| VARIABLES | PC1 | PC2 |
|---|---|---|
| Biomasa de raíces | 0.434 | 0.110 |
| Productividad de raíces | 0.443 | -0.023 |
| NO2 - + NO3 - | -0.443 | -0.097 |
| NH4 + | -0.401 | -0.287 |
| PO4 -3 | -0.356 | -0.286 |
| Salinidad | -0.235 | 0.417 |
| Nivel de inundación | -0.108 | 0.528 |
| Periodo de inundación | -0.153 | 0.514 |
| Frecuencia de inundación | -0.238 | -0.313 |
Discusión
La cantidad de biomasa en los manglares de referencia fue de 11.62 Mg ha-1 similares a los reportados en los manglares de tipo franja de R. mangle en México (11.30 Mg ha-1; Adame et al. 2013) y también fue similar a los manglares tipo franja y ribereños en Micronesia (9.50 a 13.17 Mg ha-1; Cormier et al. 2015). Además, se pudo demostrar que los manglares en restauración (sitio 1, 2 y 3) se ha reactivado el proceso de producción de raíces y que la variabilidad dependió de la estructura forestal presente, encontrándose valores de 0.02 y 9.47 Mg ha-1 que corresponden a sitios con plántulas y con arbustos de A. germinans respectivamente. Las variaciones de la biomasa de raíces entre tipos de manglar de diferentes escenarios ambientales está en función de la densidad de árboles, la salinidad del suelo y el hidroperíodo (Adame et al. 2017).
La productividad de raíces en los manglares en restauración (sitio 1, 2 y 3) fluctuó entre 0.17 a 2.32 Mg ha-1 año-1 y de 3.60 Mg ha-1 año-1 para los manglares de referencia (sitio 4); lo que fue similar a la valores reportados para los manglares conservados (1.4 a 2.89 Mg ha-1 año-1; Castañeda-Moya et al. 2011) y restaurados en Florida (1.83 a 2.10 Mg ha-1 año-1; McKee & Faulkner 2000). Además, se comparó con otros manglares naturales de Belice que fue de 0.43 a 1.97 Mg ha-1 año-1 (Mckee et al. 2007) y en Micronesia de 0.46 a 7.5 Mg ha-1 año-1 (Cormier et al. 2015); demostrando que la productividad está en los intervalos de los manglares restaurados de Belice, Micronesia y Florida, pero están por debajo de los manglares de referencia. Además, en el sitio 2 (5 años después del inicio de las acciones de restauración) la productividad fue igual a la del sitio de referencia (Tabla 1); donde a pesar de que la estructura forestal fue arbustiva (< 0.55 m) la productividad fue mayor (2.32 Mg ha-1 año-1), esto se atribuye al tiempo transcurrido después de la restauración que también fue un factor clave.
El incremento en la biomasa y productividad de raíces fue diferencial en los sitios de restauración; como el sitio 3, que después de 2 años de que fueron intervenidos, alcanzaron valores similares a los manglares de referencia (sitio 4). La diferencia en la velocidad de respuesta de las raíces del sitio 3, respecto a los sitios 1 y 2 fue porque en el momento de la intervención existía una cobertura de manglar relicto arbustiva y de baja densidad de A. germinans. Comparando con otros sitios se ha reportado que después de 6 años en manglares reforestados la biomasa alcanza valores comparables con manglares naturales (Bosire et al. 2008). Los sitios degradados que presentan vegetación relicto, requieran menor tiempo para reactivar el proceso de productividad de raíces favoreciendo la captura carbono subterráneo (Tamooh et al. 2008).
La disponibilidad limitada de fósforo incrementó la biomasa y productividad de raíces finas. Los manglares de Laguna de Términos tuvieron más del 40 % de materia orgánica en suelo pero son deficientes en nutrientes, especialmente del fósforo (Coronado-Molina et al. 2012); por ello la absorción de nutrientes en estos manglares depende una mayor productividad de las raíces finas (Feller et al. 1999). En este estudio se observó una relación N:P mayor a 62, lo que evidencia la limitada disponibilidad de este nutriente en el área de estudio, como ocurrió en los manglares de Shark River y Taylor Slough en Florida, en donde se reportaron relaciones N:P iguales a 32 (Castañeda-Moya et al. 2013). Por otro lado, la deficiencia de fósforo limita la altura de los árboles cuando existen deficiencias de este elemento (Feller et al. 1999) aunque el crecimiento también está en función del Eh (Cormier et al. 2015) y de la salinidad.
En este estudio, el sitio de referencias (sitio 4) la biomasa y la productividad de raíces fue influenciada por la frecuencia de inundación; la cual en los otros sitios, esta contribución no fue notable. Por otro lado, el hidroperíodo contribuyó directamente a la estabilización de la concentración de nutrientes y salinidad del agua intersticial. La salinidad intersticial en el sitio 2 (mayor tiempo de restauración), fue similar a la del sitio conservado (sitio 4). A pesar de que la salinidad del suelo regula el desarrollo de las raíces (Sherman et al. 2003), las concentraciones registradas no tuvieron un efecto claro en la biomasa y productividad, esta falta de relación puede ser debida a la sinergia entre la salinidad y otros factores reguladores como temperatura, pH y sulfuros en el suelo (Adame et al. 2014) y a los cambios por la restauración hidrológica (Perez-Ceballos et al. 2017).
Las raíces subterráneas finas (< 2 mm) participan en la absorción de agua y nutrientes, mientras que medianas y gruesas (2 a 20 mm) son importantes en el transporte, almacenamiento de materiales y soporte de la planta (Gleason & Ewel 2002). La biomasa de raíces finas representó el 51 % del total de raíces en los manglares restaurados; en contraste con los manglares naturales en donde las raíces medianas y gruesas (> 2 mm) representaron el 69 % del total. Similares valores fueron registrados en manglares con tres años en restauración en Kenya (65-90 %; Lang’at et al. 2013). La acumulación de la mayor biomasa de raíces gruesas fue una señal de mayor longevidad (Adame et al. 2014) y la longevidad de raíces es en un mecanismo para conservar nutrientes en estructuras más gruesas y perenes (Huxham et al. 2010). Respecto a la productividad de raíces en función al tamaño, las finas representaron la mayor contribución en los sitios naturales (42 %) que en los de restauración (38 %). En manglares de Florida se determinó que el comportamiento de raíces finas se relacionó con la calidad ambiental del suelo y el agua (Castañeda-Moya et al. 2013). El sitio 2 de restauración (5 años de intervención) presentó la mayor productividad de raíces con 2.32 Mg ha-1 año-1 y fueron las raíces finas y medianas (< 5 mm) las que mayor contribuyeron (59 %). Se ha evaluado que la productividad tiene una relación positiva con la edad de la vegetación y el tiempo de la restauración (Tamooh et al. 2008).
Nosotros concluimos que la productividad de raíces varió en función de la recuperación de la estructura de la vegetación (regeneración natural) y del tiempo de la restauración hidrológica; determinado por las condiciones ambientales del suelo, la hidrología y la recuperación de cobertura de la vegetación (de plántulas a arbustos). La biomasa y productividad de raíces demostró ser una variable integral del ecosistema. Por lo tanto, su cuantificación de las raíces fue la señal de la recuperación funcional del manglar después de la restauración hidrológica.
Las diferencias ambientales encontradas en los sitios de estudio, demostraron que el desazolve de los canales de marea como una estrategia de restauración hidrológica, contribuyó a mejorar la calidad del suelo y del agua en áreas de manglar degradados, generando las condiciones necesarias para desarrollo de biomasa y productividad de raíces subterráneas.











 nova página do texto(beta)
nova página do texto(beta)