El género Magnolia L. registra cerca de 245 especies, distribuidas en Asia Meridional y oriental, México, Venezuela y el este de Estados Unidos (BGCI, 2008), 131 especies están reportadas como en peligro de extinción. Muchas de éstas son apreciadas como ornamentales por la belleza de sus follajes, flores y frutos. En México, existen cerca de 27 especies de magnolias (Vázquez-García et al., 2012a) que representan el 11 % de las especies a nivel mundial. En Jalisco actualmente se conocen seis especies, una de ellas es M. pugana (Iltis & A. Vázquez) A. Vázquez & Carvajal. Esta especie estaba considerada como una subespecie del complejo M. pacifica A. Vázquez (Vázquez-García, 1994). Sin embargo, estudios más recientes de Vázquez-García et al. (2002), integraron suficientes elementos en la descripción de la especie para considerarla como independiente de M. pacifica. Magnolia pugana está clasificada en peligro crítico de extinción por varios autores (Walter y Gillett, 1997; Oldfield et al., 1998; Cicuzza et al., 2007). Magnolia pugana es endémica del occidente de México y está actualmente restringida a pequeñas poblaciones locales donde se distribuye en bosques de galería en las barrancas del sur de Zacatecas y del centro-norte de Jalisco (Vázquez-García 1994, 2002, 2012b); donde es utilizada principalmente para la elaboración de muebles y como combustible.
La producción de semillas, su dispersión y germinación podrían ser un factor clave para limitar los procesos de la dinámica de las poblaciones y comunidades (Harper, 1977). En particular, la reproducción sexual podría actuar como un cuello de botella, si las semillas son inviables o presentan algún tipo de latencia (Venable y Brown, 1988). La germinación es la fase más importante del desarrollo de las plantas, ya que de ésta depende la distribución y abundancia de las especies (Scifres y Brock, 1971). El éxito en el establecimiento de las plántulas depende de si las semillas presentan o no mecanismos de latencia, además del tipo y grado con que se presenta, y también de su viabilidad y del tiempo necesario para que inicie la germinación (González-Zertuche y Orozco-Segovia, 1996; Vázquez-Yanes y Orozco-Segovia, 1996).
Las magnolias pueden ser propagadas por semillas, esquejes enraizados y acodos (Gardiner, 1991). Las semillas del género Magnolia presentan diferentes tipos de latencia, las más comúnmente registradas son la latencia fisiológica y la morfo-fisiológica; sin embargo, también han sido reportadas la química y la mecánica (Tabla 1).
En México han sido poco los estudios sobre la viabilidad, latencia y germinación en especies de este género, entre estos, se encuentran los realizados por Saldaña-Acosta et al. (2001) que encontraron que las semillas de Magnolia iltisiana presentan latencia mecánica, física y química. Además, encontraron que el 78 % de las semillas fueron viables y registraron 60 % de germinación con el tratamiento de maceración del arilo. Corral-Aguirre y Sánchez-Velásquez (2006) en semillas de M. dealbata sin arilo, registraron 100 % de viabilidad y 100 % de germinación con tratamientos de estratificación en agua durante 24 horas, a temperatura ambiente. Por otro lado, Vásquez-Morales y Sánchez-Velásquez (2011), en M. schiedeana encontraron 80 % de viabilidad y 84 % de germinación con remoción manual del arilo e inmersión en agua durante 48 horas. En especies mexicanas de este género no se han utilizado hormonas promotoras del rompimiento de latencia de las semillas, pero Han y Long (2010a) encontraron que semillas de M. ingrata del sur y sureste de China germinaron 80-96 % bajo diferentes concentraciones de GA3. Para Magnolia pugana no se han realizado estudios de la ecofisiología de sus semillas. De esta manera, el objetivo de esta investigación fue conocer la viabilidad de las semillas e identificar los tratamientos germinativos para romper la latencia en semillas de M. pugana de cuatro localidades.
Materiales y métodos
Localidades de estudio. La colecta se realizó en cuatro localidades, tres en el estado de Jalisco y una en Zacatecas. Los tres sitios de colecta de Jalisco están dentro del municipio de Zapopan. El primer sitio se localiza dentro del Centro Universitario de Ciencias Biológicas y Agropecuarias (CUCBA), es una población que data de los años 80´s, las semillas fueron colectadas en San Lorenzo, pero las plántulas crecieron en condiciones de invernadero y fueron trasplantadas e integradas a los jardines de este centro universitario. Esta zona se consideró como una población aparte porque los individuos no están creciendo en condiciones semejantes al bosque ripario, el cual es su hábitat natural. Este sitio tiene clima semi-cálido templado con verano cálido y lluvias en verano (SPP, 1981). El segundo sitio está en San Lorenzo (SL) aquí los árboles de Magnolia pugana se distribuyen en la rivera del arroyo San Lorenzo que es un tributario del Río Santiago. En San Lorenzo el clima es semi-cálido templado con verano cálido y lluvias en verano (SPP, 1981). La tercera localidad se encuentra en San Nicolás (SN) que está ubicado a tres kilómetros de San Lorenzo y los individuos se distribuyen a lo largo del margen del arroyo La Virgen, ambas localidades (SL y SN) tienen clima cálido subhúmedo con verano cálido y lluvias en verano (SPP, 1981). En los tres sitios anteriores la geología data del Terciario con rocas sedimentarias e ígneas intrusivas (SPP, 1981). Los suelos predominantes son de tipo Regosol eútrico y Feozem háplico poco profundos con textura arenosa y pobres en materia orgánica (Ibarra-Castillo et al., 2007). La cuarta localidad es Palo Verde (PV), ubicada en el municipio de Mezquital del Oro, Zacatecas, sobre el río Los Cardos y el Arroyo Grande. La geología está caracterizada por rocas ígneas extrusivas con basalto y tobas, que datan de la era Cenozoica del periodo Terciario con múltiples fracturas. Los suelos dominantes son Leptosol y Luvisol háplico, crómico con fase lítica. El clima es cálido subhúmedo con lluvias en verano (SPP, 1981) (Tabla 2).
Tabla 2 Coordenadas geográficas y características climáticas de las localidades de estudio. Datos obtenidos de estaciones climáticas cercanas a los sitios de estudio (CONAGUA, 2014).

El hábitat natural de Magnolia pugana es el bosque ripario y se acompaña de especies como: Aphananthe monoica, Ficus insipida, Litsea glaucescens, Lysiloma acapulcensis, Oreopanax jaliscana, Piper hispidum, P. jaliscanum, Prunus ferruginea, Salix humboldltiana, Taxodium mucronatum y Xanthosoma robustum (Acevedo-Rosas et al., 2008).
Colecta de semillas. Durante los meses de febrero y marzo del 2014 se colectaron más de 2,400 semillas provenientes de polifolículos maduros de por lo menos diez individuos adultos por localidad (CUCBA, SL, SN, PV). Las semillas se extrajeron manualmente y se sumergieron en una solución de hipoclorito de sodio al 3 % por 30 minutos para eliminar la contaminación por hongos (García-Ramírez et al., 2007), posteriormente fueron secadas con papel absorbente e inmediatamente después se conservaron en un medio bien ventilado y húmedo dentro de un refrigerador (MABE-RMT 1951xmxb) a 4-5 °C, para evitar la deshidratación (Saldaña-Acosta et al., 2001; Barbour, 2008).
Prueba de viabilidad de las semillas. Para realizar las pruebas de viabilidad se utilizaron 30 semillas por localidad, éstas fueron cortadas trasversalmente y sumergidas en una solución de tetrazolium al 1 % por un periodo de 24 a 48 horas a 30 °C en un horno (JISICO Co., Ltd. J-DECO). Los embriones que se tiñeron de color rojo profundo se consideraron como viables, los de color rosa tenue como viables con bajo vigor y los que no adquirieron ninguna coloración como no viables (Yaklich y Kulick 1979; Romo-Campos et al., 2010).
Pruebas de imbibición. Por localidad, se midieron el largo, ancho y grosor (mm) de 30 semillas con un vernier digital (Mitutoyo, serie 500). Después se sumergieron en agua destilada a temperatura ambiente por dos horas con el objetivo de eliminar el arilo de la semilla. Enseguida cada semilla fue secada y pesada (peso inicial) en una báscula analítica (Ohaus Pioneer PA214). Posteriormente, las semillas se pusieron en cajas de Petri (con agua destilada hasta la mitad) a temperatura ambiente (24 °C) y fueron pesadas por intervalos de 24 horas o hasta obtener peso constante. Después fueron secadas a 72 °C, por periodos de 24 horas o hasta obtener peso constante (Hampton et al., 1995) en un horno (Jisico Co., Ltd. J-DECO). El porcentaje de agua tomado por semilla se calculó con base en la siguiente fórmula:
Dónde: P i = peso biomasa inicial, P f = peso seco final.
Tratamientos germinativos. Para las pruebas de germinación se utilizaron 600 semillas por sitio (2,400 en total) y se sometieron a los siguientes tratamientos: (1) remoción manual del arilo (RMA) (Saldaña-Acosta et al., 2001; Baskin y Baskin, 2004), (2) remoción de arilo por lixiviación (RLA), en el que las semillas fueron sumergidas en agua a 30 °C en una estufa de incubación por dos horas y posteriormente se colocaron en agua corriente a temperatura ambiente por 48 horas (Callaway, 1994; Vovides e Iglesia, 1996; Saldaña-Acosta et al., 2001), (3) inmersión por 24 horas en ácido giberélico (AG3) a tres diferentes concentraciones: (a) AG3 con 100 mg L-1, (b) AG3 con 200 mg L-1y (c) AG3 con 300 mg L-1 (Wang y Tian, 1996; Baskin y Baskin, 1998) y (d) semillas con arilo, como control (C). El diseño experimental fue completamente al azar con un arreglo factorial de 4 × 6, cuatro localidades (CUCBA, SL, SN y PV) y seis tratamientos (C, RMA, RLA, y ácido giberélico a diferentes concentraciones (AG3100 mg L-1, AG3 200 mg L-1 y AG3 300 mg L-1).
Pruebas de germinación. Las pruebas de germinación se realizaron en un invernadero ubicado en el Centro Universitario de Ciencias Biológicas y Agropecuarias, durante el tiempo de estudio se registraron la temperatura y humedad relativa del ambiente con un dispositivo electrónico HOBO H08-004-02 (Onset Computer Corporation, Massachusetts, EEUU). El 20 de marzo de 2014 se sembraron 100 semillas por tratamiento con 20 semillas por contenedor, con cinco repeticiones para cada localidad por separado. Las semillas fueron enterradas a 1.5 cm de profundidad en contenedores de plástico de 25 ml. El sustrato que se utilizó para la siembra fue “peat-moss” (Sharma et al., 2006). Los contenedores se regaron diariamente con 100 mm de agua para mantener la humedad. En el invernadero la temperatura durante el experimento varió entre 7 y 39.22 °C, la densidad de flujo de fotones fotosintéticos (DFFF) varió de 338.2 hasta 1236.7 µmol m-2s-1 y la humedad relativa osciló entre 10.2 y 79.6 %. Se registró diariamente el número de semillas germinadas durante 60 días, período de tiempo sugerido por Barbour (2008) para la germinación de las especies de Magnolia. Se consideró que las semillas habían germinado al emerger la radícula (Ogawa et al., 2003) o al observar el hipocótilo (Bewley y Black, 1994).
Análisis estadístico. Para las pruebas de germinación se realizó un análisis de varianza de dos vías, con localidad y tratamiento como factores. Previo al análisis, los datos se normalizaron por medio de la transformación utilizando la función arcoseno de la raíz cuadrada (Sokal y Rohlf, 1995) y los resultados fueron expresados en porcentaje. Para analizar las variables de largo, ancho, grosor, imbibición y biomasa de las semillas se realizaron análisis de varianza de una vía con la localidad como factor. Las diferencias entre tratamientos fueron determinadas con la prueba de comparación múltiple de Tukey (α = 0.05). Todos los análisis fueron realizados con el paquete estadístico SAS (SAS, 2002). Adicionalmente, se consideró la posible correlación entre la biomasa y el porcentaje de imbibición por localidad con la prueba de correlación de Pearson.
Resultados
Pruebas de Viabilidad. El 67 % de las semillas fueron viables. Por localidad, se encontró que SL presentó la mayor cantidad de semillas viables con vigor alto, mientras que CUCBA registró el porcentaje más bajo. En PV se observó el mayor porcentaje de semillas no viables, mientras que SL fue el que tuvo el menor porcentaje. Con respecto a las semillas viables pero con bajo vigor, SL presentó el número más alto, mientras que en PV fue en el que se registró el más bajo (Tabla 3).
Tabla 3 Prueba de viabilidad en semillas de M. pugana provenientes de cuatro localidades: Centro Universitario de Ciencias Biológicas y Agropecuarias (CUCBA), Palo Verde (PV), San Lorenzo (SL) y San Nicolás (SN).

Pruebas de imbibición. Las semillas comenzaron a embeberse en las primeras 24 horas. Entre localidades hubo diferencias significativas (F = 18.27, P < 0.01), las semillas de SN embebieron 52 % más agua en comparación con las de PV que embebieron 21 %.
El peso seco (mg) de las semillas reveló diferencias por localidad (F = 10.3, P < 0.01). Las semillas de PV registraron 54.38 % mayor peso seco, en comparación con las de SN que registraron el menor peso, las demás localidades no mostraron diferencias. Además, la biomasa y la imbibición presentaron correlación negativa (r 2 = 0.17, P < 0.01), las semillas con mayor biomasa embebieron menos agua (Figura 1). Las semillas más largas y anchas fueron encontradas en SN (F = 3.3, P < 0.05; F = 4.5, P < 0.01; respectivamente) (largo de semillas: CUCBA = 8.3 ± 0.15, PV = 8.58 ± 0.15, SN = 8.63 ± 0.11, SL = 8.04 ± 0.18), (ancho de semillas: CUCBA = 5.8 ± 0.16, PV = 6.2 ± 0.16, SN = 6.8 ± 0.23, SL = 6.1 ± 0.17), el grosor no varió entre localidades.
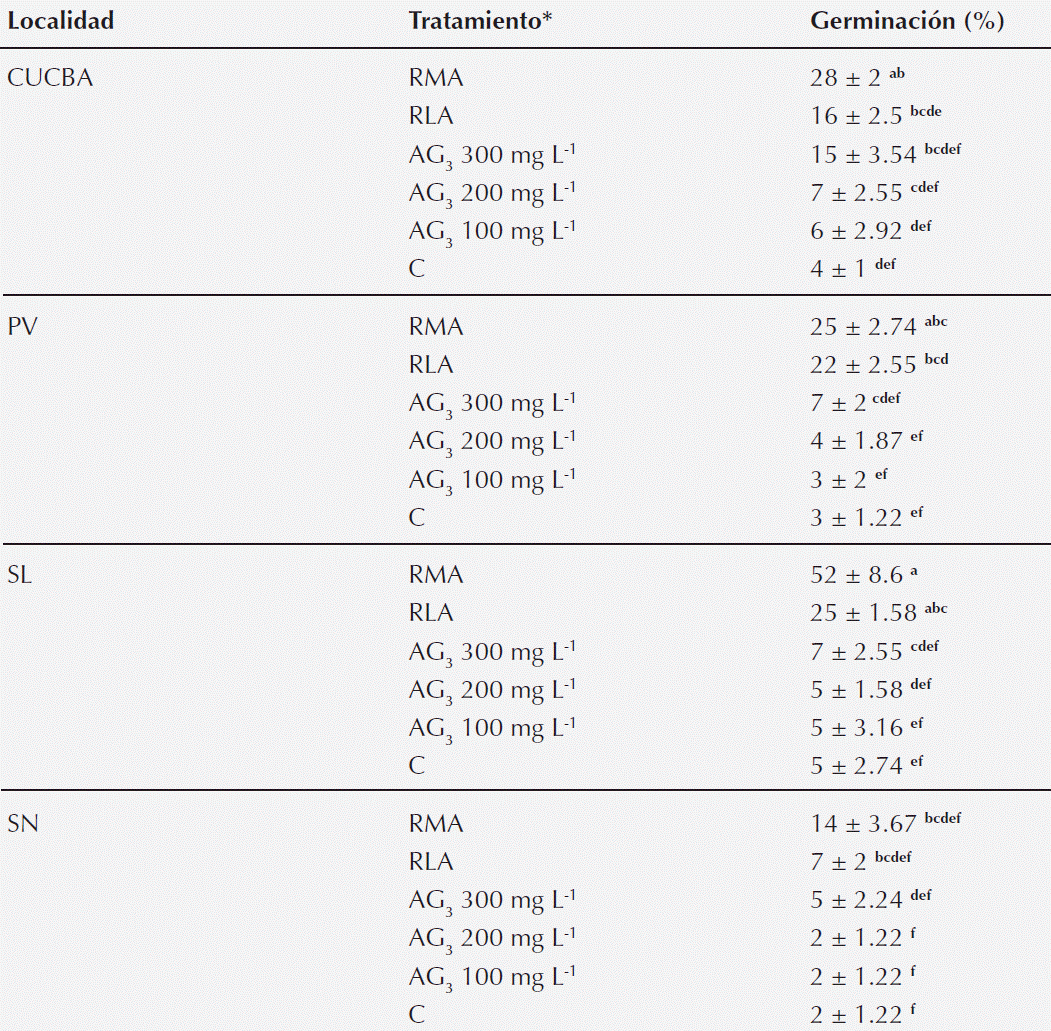
Pruebas de germinación. La germinación Magnolia pugana fue de tipo epigea, el embrión desarrolló un par de cotiledones foliáceos, un endospermo flácido grasoso, un hipocótilo y una radícula, confinados en el área del micrópilo. Entre los diferentes tratamientos aplicados se encontraron diferencias significativas (F = 34.28, P < 0.01). En el tratamiento de remoción manual del arilo (RMA) se obtuvo la mayor cantidad de semillas germinadas (52 %), mientras que el control (C) presentó el menor porcentaje (3 %). Entre localidades también se mostraron diferencias significativas (F = 9.57, P < 0.01), en SL se registró el porcentaje más alto de germinación con 25 %, mientras que SN obtuvo el más bajo con 7%. También la interacción localidad × tratamiento mostró diferencias significativas (F = 1.92, P < 0.05). El tratamiento con RMA presentó el mayor porcentaje de germinación para el sitio SL con 52 %, mientras que SN fue el que obtuvo el porcentaje más bajo con 14 %. El tratamiento C presentó el menor porcentaje de germinación en todas las localidades (Tabla 4).
Tabla 4 Promedio (± EE) del porcentaje de germinación de seis tratamientos germinativos para M. pugana en cuatro localidades: Centro Universitario de Ciencias Biológicas y Agropecuarias (CUCBA), Palo Verde (PV), San Lorenzo (SL) y San Nicolás (SN) (n = 100). Letras negritas indican diferencias entre promedios (p<0.05) de acuerdo con la prueba de Tukey HSD. * RMA (remoción manual del arilo), (RLA) remoción de arilo por lixiviación, AG3 (ácido giberelico con 100 mg L-1), AG3 (ácido giberelico con 200 mg L-1), AG3 (ácido giberelico con 300 mg L-1) y C (control).
Discusión
La viabilidad de las semillas para las cuatro localidades fue del 67 % en promedio (28 % de alto vigor y 39 % de bajo vigor), este porcentaje es menor que el registrado en otras especies de Magnolia. Por ejemplo, Saldaña-Acosta et al. (2001) reportaron 78 % de semillas viables para M. iltisiana. Corral-Aguirre y Sánchez-Velásquez (2006) encontraron el 100 % de viabilidad en semillas de M. dealbata. Vásquez-Morales y Sánchez-Velásquez (2011) obtuvieron 80 % de viabilidad en semillas de M. schiedeana. De las semillas con bajo vigor, emergieron plántulas anormales con malformaciones en la elongación del hipocótilo y en los cotiledones foliáceos, las cuales solamente sobrevivieron pocos días después de la germinación. Esto mismo ha sido observado en especies de cultivo como el trigo (Helm et al., 1989). Se conoce que las semillas con bajo porcentaje de proteínas y alto contenido de almidón o aceites absorben menos volumen de agua (Azcón-Bieto y Talon, 2008). Las semillas de SN registraron el mayor peso y tamaño, éstas también embebieron menor cantidad de agua. Es probable que en la composición de sustancias como aceites o almidones en las semillas de M. pugana varíe entre las distintas localidades como consecuencia de las variaciones ambientales.
En general el porcentaje de germinación obtenido para Magnolia pugana fue bajo, la mayor germinación se observó para la localidad de SL que obtuvo 52 % con el tratamiento de remoción del arilo. El porcentaje de germinación obtenido fue menor que el de viabilidad, pero el porcentaje de germinación es aún más bajo si se consideran solamente las de semillas de alto vigor. Baja germinación puede indicar que las semillas tienen latencia; se considera que el fenómeno de latencia de semillas es un mecanismo selectivo para que la germinación ocurra bajo condiciones ambientales adecuadas (Flores et al., 2005). Así, el establecimiento exitoso de las especies depende del tiempo en que tarden en germinar después de haber embebido agua en las primeras lluvias (Vázquez-Yanes y Orozco-Segovia, 1996; De la Barrera y Nobel, 2003).
En esta investigación, los tratamientos germinativos aplicados a Magnolia pugana no lograron romper la latencia (porcentajes de germinación < 70 %; Flores et al., 2005). Los tratamientos que lograron el mayor porcentaje de germinación fueron la remoción manual del arilo y la lixiviación, ambos indicadores de latencia química (Baskin y Baskin, 1998). Este tipo de latencia se ha reportado para M. virginiana (Del Tredici, 1981), M. dealbata (Vovides e Iglesias, 1996), M. iltisiana (Saldaña-Acosta et al., 2001), M. obovata (Kim et al., 2007) y M. biloba (Hu et al., 2011). Los resultados también coinciden con Dirr y Heuser (1987) quienes reportaron que los arilos de Magnoliaceae contienen inhibidores que retrasan la germinación.
Por otra parte, se ha comprobado que el ácido giberélico es un promotor de la germinación de semillas con latencia fisiológica (Baskin y Baskin, 1998). Wang y Tian (1996) observaron que el ácido giberélico aumentó los porcentajes de germinación en semillas de Magnolia sieboldii, de manera contraria, los tratamientos con AG3 utilizados en nuestro experimento no aumentaron el porcentaje de germinación en M. pugana, por lo que se sugerie que las semillas de esta especie no poseen latencia fisiológica, sino solamente química. La latencia fisiológica se ha reportado para M. dealbata (Gutiérrez y Vovides, 1997), M. fraseri (Merkle y Wiecko, 1990), M. grandiflora (Le Page-Degivry, 1970), M. ovata (Anderson et al., 2009), M. schiedeana (Vásquez-Morales et al., 2011), M. sieboldii (Wang y Tian, 1996), M. soulangeana Le Page-Degivry, (1970) y M. virginiana (Del Tredici, 1981).
Diversos autores han reportado la existencia de latencia física para especies del género, como Magnolia grandiflora (Le Page-Degivry, 1970), M. acuminata (Smith, 1990), M. portoricensis (Alemañy-Merly, 1999) y M. iltisiana (Saldaña-Acosta et al., 2001). Sin embargo, en estos estudios no se realizaron pruebas de imbibición para corroborar la existencia de este tipo de latencia. En este estudio se encontró que las semillas de M. pugana no tienen latencia física debido a que tienen la capacidad de absorber agua. En otras investigaciones se ha sugerido la existencia de latencia mecánica, como en M. acuminata (Smith, 1990) y M. iltisiana (Saldaña-Acosta et al., 2001); o bien, morfo-fisiológica, como en M. globosa (Baskin y Baskin, 1998), M. ingrata (Han y Long, 2010a), M. biloba (Hu et al., 2011), M. officinalis (Shu et al., 2012) y M. champaca (Fernando et al., 2013), pero para M. pugana no se encontraron estos tipos de latencia.
Conclusiones
El 67 % de las semillas de Magnolia pugana fueron viables, pero su germinación es baja debido a que poseen latencia química. La biomasa de las semillas mostró una correlación negativa con la imbibición. Las semillas más largas y anchas se registraron en PV. El tratamiento con el que se alcanzó el mayor porcentaje de germinación fue el de remoción manual del arilo con el 52%. Los tratamientos con ácido giberélico y el control, obtuvieron los porcentajes de germinación más bajos. Considerando que el mayor porcentaje de germinación se alcanzó con la remoción manual del arilo, la siembra de semillas de M. pugana con arilo removido, bajo condiciones controladas de invernadero, puede ser una práctica exitosa para la propagación de plántulas de esta especie, que ayuden a la reforestación y restauración de sus poblaciones en su ambiente natural.











 text new page (beta)
text new page (beta)




