Debido a la elevada tasa de desaparición de los bosques tropicales (Trejo y Dirzo, 2000; Miles et al., 2006; Portillo-Quintero y Sánchez-Azofeita, 2010; Dirzo et al., 2011), resulta importante entender las características básicas del hábitat y la estructura poblacional de sus especies, particularmente las endémicas, raras, amenazadas o en peligro de extinción, para evaluar su estado de conservación, valorar el riesgo de extinción y establecer medidas para su preservación y manejo (Bernardos et al., 2006; Herbert, 2006; Sánchez-Velásquez y Pineda-López, 2006; Godínez-Alvarez et al., 2008; Shen et al., 2009). Las especies con poblaciones pequeñas, afectadas por la destrucción y fragmentación de su hábitat y expuestas a amenazas externas como la extracción selectiva, tienen mayores probabilidades de extinción (Lande, 1993; Morris y Doak, 2002; Oostermeijer, 2003). Este riesgo es aún mayor para las especies endémicas, porque recuperar sus poblaciones depende de la comprensión y manejo de los factores que dieron origen a su distribución restringida (Ribeiro y Fernandes, 2000; Oostermeijer, 2003; Cuevas-Guzmán et al., 2008).
Para evaluar el estado de conservación de las poblaciones es común utilizar estudios demográficos (Sarukhán et al. 1985; Beissinger et al. 1998; Menges, 2000; Fréville et al. 2004; López-Mata, 2013), pero éstos requieren una fuerte inversión en tiempo y recursos; por lo que algunos autores proponen utilizar como indicadores preliminares el análisis de su densidad y estructura de tamaños (Ribeiro y Fernandes, 2000; Caldato et al., 2003; Ayerde-Lozada y López-Mata, 2006; Medel-Narváez et al., 2006; Vílchez y Rocha, 2006; Cuevas-Guzmán et al., 2008; Godínez-Alvarez et al., 2008). Estos indicadores son particularmente útiles cuando se carece de datos sobre la demografía de una población (Martínez-Ramos y Álvarez-Buylla, 1995; Sánchez-Velásquez et al., 2002; Wright et al., 2003; Souza y Martins, 2004; Vischi et al., 2004; Gómez-Aparicio et al., 2005; Souza, 2007; Read et al., 2008; Freitas de Souza et al., 2010) y aplica en el caso de especies endémicas, raras o en peligro, las cuales, como se ha señalado, son especialmente susceptibles a la alteración de su hábitat (Sosa et al., 1998; García et al., 1999; George et al., 2005; Shen et al., 2009).
Ecólogos y biólogos de la conservación han utilizado con frecuencia la distribución en categorías de tamaño como indicador de la viabilidad de poblaciones (Primack, 1995; Poorter et al., 1996; Sosa et al., 1998; George et al., 2005). De acuerdo con la propuesta de Leak (1965), un alto porcentaje de individuos juveniles es evidencia de un crecimiento poblacional sostenible y viable de la población. Con base en este criterio, se propone como deseable una estructura poblacional tipo log-normal o en forma de “J” invertida (Silvertown, 1987; Lamprecht, 1990; Howard y Valerio, 1992; Silvertown y Lovett-Doust, 1993; Smith et al., 1997); o bien se considera que una elevada proporción de individuos juveniles indica que la regeneración natural es exitosa (Swaine y Hall, 1988; Primack, 1995; Poorter et al., 1996; Sosa et al., 1998; Elzinga et al., 2001; George et al., 2005). Sin embargo, es necesario considerar el hecho de que la dinámica poblacional de una especie está influenciada por las interacciones entre tasas de supervivencia en cada categoría, crecimiento y fecundidad; por lo que las tasas netas de crecimiento poblacional (λ) rara vez presentan una correlación directa con la estructura de tamaños de la población (Condit et al., 1998; Case, 2000). Este problema se puede superar comparando el coeficiente de asimetría de la distribución de tamaños en varias poblaciones de la misma especie, siempre que se incluyan sitios poco perturbados (Wright et al., 2003; Souza y Martins, 2004; Gómez-Aparicio et al., 2005; Souza, 2007; Read et al., 2008).
Otro aspecto a considerar en el análisis de la estructura en categorías de tamaño de la población es la existencia de ciertos patrones en las especies arbóreas del bosque natural bien conservado, relacionados con la presencia de grupos funcionales de especies con ciclos de vida similares (Swaine y Whitmore, 1988; Swaine et al., 1990; Poorter et al., 1996; Kohira y Ninomiya, 2003; Wright et al., 2003). Una estructura poblacional con mayoría de individuos adultos y muy pocos juveniles caracteriza a las especies dependientes de claros (gap-dependent); mientras que una estructura con abundantes juveniles y escasos adultos, es característica de especies tolerantes a la sombra (Wright et al., 2003; Souza, 2007). Esta información proporciona una interpretación distinta a la curva en forma de “J” invertida y permite al menos dos aplicaciones: la comparación de poblaciones para revelar las características del ciclo de vida de una especie poco estudiada (Poorter et al., 1996; Watkinson y Powell, 1997) y la evaluación de la respuesta de las poblaciones a la actividad humana, si se toma como referencia sitios bien conservados que hayan estado sujetos a eventos estocásticos similares (Doak y Morris, 1999; García et al., 1999; Peres et al., 2003; Souza y Martins, 2004; Gómez-Aparicio et al., 2005). En este tipo de análisis, la ausencia de individuos en alguna categoría de tamaño de la población podría interpretarse como evidencia de un “cuello de botella” demográfico en el reclutamiento, crecimiento y/o supervivencia en dicha categoría (Andrzejczyk y Brzeziecki, 1995; Hutchings, 1997; García et al., 1999; Peres et al., 2003; Gómez-Aparicio et al., 2005). Por otro lado, las alteraciones en la estructura poblacional de una especie en una localidad, en comparación con una población de referencia en un sitio poco perturbado, podrían indicar dificultades para la supervivencia de la población a futuro (Poorter et al., 1996; Case, 2000; Kelly et al., 2001).
Con el objeto de proponer un indicador preliminar rápido para analizar el estado de conservación de una especie amenazada, en el presente trabajo se utilizó como estudio de caso a Resinanthus aromaticus (Cast.-Campos & Lorence) Borhidi (Borhidi, 2007), un árbol maderable endémico del centro de Veracruz, México (Sosa et al., 1998; González-Astorga y Castillo-Campos, 2004; Castillo-Campos et al., 2005; Palacios-Wassenaar et al., 2014), catalogado desde 1997 en la Lista Roja de la Unión Internacional para la Conservación de la Naturaleza (IUCN), como especie en peligro de extinción por su distribución restringida, su uso maderable y la presión por la destrucción de su hábitat (Vovides, 1998; IUCN, 2014). Para ello se evaluó la densidad y la estructura poblacional en categorías de tamaño de esta especie en cinco sitios en el centro de Veracruz. Se analizó la estructura poblacional observada utilizando tres distintas interpretaciones: el ajuste a la curva log-normal, la proporción de juveniles vs adultos y el coeficiente de asimetría de la distribución de tamaños de la población. Se espera responder a la interrogante de cuál de estas interpretaciones podría utilizarse como indicador preliminar de una alteración en las poblaciones de esta especie, lo cual permitiría inferir posibles riesgos a su supervivencia y se empleará la información obtenida para revisar la categoría de R. aromaticus en la Lista Roja de la IUCN, de acuerdo con los criterios establecidos por dicha organización (UICN, 2000).
Materiales y métodos
Resinanthus aromaticus (Borhidi, 2007), conocido también por sus sinónimos, Antirhea aromatica Cast.-Campos & Lorence y Stenostomum aromaticum (Cast.-Campos & Lorence) Borhidi, es un árbol de 6 a 15 m de altura, con diámetro a la altura de pecho (DAP) entre 10 y 30 cm (Castillo-Campos y Lorence, 1985). Tiene una distribución geográfica altamente restringida, limitada a la localidad Tipo, en el centro del estado de Veracruz, México (Castillo-Campos y Lorence, 1985). Se conocen cinco poblaciones que se desarrollan en pequeños fragmentos (< 40 ha cada uno) de selva mediana subcaducifolia sensu Miranda y Hernández-X. (1963), separados entre sí por distancias inferiores a los 15 km (González-Astorga y Castillo-Campos, 2004; Palacios-Wassenaar, 2013). La especie se ubica en áreas con barrancas de difícil acceso y los pobladores locales utilizan su madera para la construcción de los techos de viviendas, llamándole comúnmente Chicahuastle (Castillo-Campos y Lorence, 1985; González-Astorga y Castillo-Campos, 2004; Palacios-Wassenaar 2013). Los fragmentos de vegetación donde se encuentra están rodeados por cultivos permanentes (mango y café) y hay una fuerte presión debido a la deforestación para el cambio de uso de suelo a agricultura (González-Astorga y Castillo-Campos, 2004; Palacios-Wassenaar, 2013). La mayor parte de los terrenos son de propiedad comunitaria, bajo la figura de ejidos (Palacios-Wassenaar, 2013).
Área de estudio. Las poblaciones conocidas de Resinanthus aromaticus se encuentran en los municipios de Jalcomulco, Apazapan y Tlaltetela, localizados en la zona central del estado de Veracruz, México (Figura 1), entre los 19º 17’ y 19º 21’ de latitud norte y 96º 42’ y 96º 46’ de longitud oeste (Castillo-Campos y Lorence, 1985; González-Astorga y Castillo-Campos, 2004; Palacios-Wassenaar, 2013). La zona presenta una altitud que varía desde 350 hasta 900 m s.n.m. y un gradiente climático entre semicálido húmedo a cálido subhúmedo. De acuerdo con los datos de la estación de Jalcomulco del Servicio Meteorológico Nacional (SMN, 2010), los promedios anuales de temperatura y precipitación son de 24.6 ºC y 1,088 mm respectivamente, con un periodo lluvioso concentrado en los meses de junio a septiembre. Siguiendo la definición utilizada en Clinebell et al. (1995) y Trejo y Dirzo (2002) se presentan seis meses secos (precipitación < 60 mm) y cuatro meses húmedos (precipitación ≥ 100 mm). Estas características climáticas de temperatura y precipitación definen a la vegetación en general de toda el área como un bosque tropical estacionalmente seco (BTES) de acuerdo con la descripción de Mooney et al. (1995), Murphy y Lugo (1995) y Dirzo et al. (2011). Sin embargo, las variaciones edáficas y topográficas de la zona generan diferentes condiciones de humedad, que permiten el desarrollo de varios subtipos de vegetación sensu Miranda y Hernández-X. (1963), tales como selva baja caducifolia, selva mediana subcaducifolia y selva mediana perennifolia entre otras (Castillo-Campos, 1995). Los poblados más cercanos tienen menos de 5 mil habitantes y las actividades económicas predominantes son la agricultura y el turismo. La zona de estudio se encuentra en uno de los cinco refugios primarios del Pleistoceno de México, por lo que es frecuente encontrar biotipos raros y está considerada como un área de prioridad para la conservación (Vovides y Gómez-Pompa, 1977; Toledo, 1982). En la zona se encuentran otras especies arbóreas amenazadas, como Aspidosperma megalocarpon Müll. Arg., Hyperbaena jalcomulcensis E. Pérez & Cast.-Campos y Pistacia mexicana Kunth (IUCN, 2014; Palacios-Wassenaar et al., 2014), y endémicas del estado de Veracruz, como Bauhinia jucunda Brandegee, Aristolochia asclepiadifolia Brandegee y H. jalcomulcensis (Castillo-Campos et al., 2005; Gómez-Pompa et al., 2010; Palacios-Wassenaar et al., 2014).
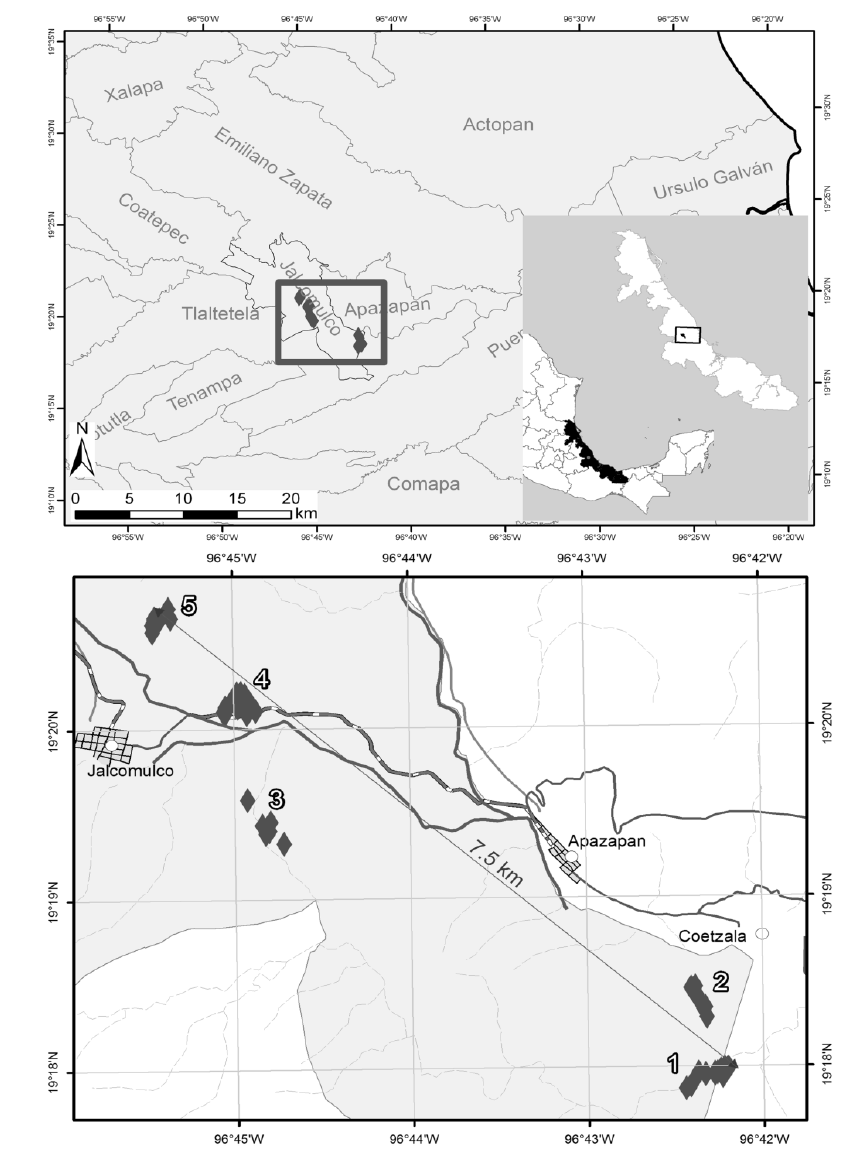
Figura 1 Ubicación de los sitios de estudio. 1-Barranca de Monterrey (BM); 2-El Manantial (M); 3-Arroyo Blanco (AB); 4-El Cerrito (C); 5-El Ojital (O).
Muestreo. El estudio se realizó en 67 parcelas de muestreo de 10 × 10 m (100 m2), para un total de 6,700 m2, distribuidas en cinco sitios de estudio donde fueron localizadas las poblaciones de Resinanthus aromaticus: Barranca de Monterrey (BM), El Manantial (M), Arroyo Blanco (AB), El Cerrito (C) y El Ojital (O; Figura 1). En cada parcela se midió el diámetro y la altura de todos los individuos de R. aromaticus con altura igual o superior a 0.10 m. En los individuos con altura superior a 2 m se midió el diámetro a la altura del pecho (DAP) y en los menores, el diámetro fue medido en la base del tallo.
En cada parcela de muestreo se consideraron como factores de intervención antrópica la distancia al poblado más cercano, presencia de ganado, cultivos y extracción selectiva de especies arbóreas. La extracción de Resinanthus aromaticus se realiza cortando el árbol desde la base cuando su DAP es inferior a 10 cm, mientras que en los individuos con DAP ≥ 10 cm, se cortan las ramas que tienen entre 3 y 5 cm de diámetro y longitudes superiores a 2 m. También se registró el número de individuos cortados como indicador de la intensidad de uso de la especie.
Análisis de los datos. El estudio de las poblaciones de Resinanthus aromaticus incluyó la estimación de la densidad (nº de individuos/ha) y el análisis de la estructura en categorías de tamaños de la población. De acuerdo con las observaciones de campo durante el presente estudio, se consideraron adultos los individuos con DAP ≥ 5 cm, ya que a partir de este diámetro se inicia la floración y/o reproducción de la especie.
El análisis de la estructura de tamaños de los individuos de Resinanthus aromaticus y su relación con el estado actual de la población de cada sitio de estudio se realizó con base en tres interpretaciones:
A.- Verificación del ajuste de la distribución de categorías de tamaño basadas en el DAP a la curva log-normal o de “J” invertida, mediante un análisis de bondad de ajuste de Kolmogorov, con apoyo del programa estadístico SigmaPlot 10.0 (Systat Software Inc., 2006).
B.- Comparación entre la proporción de individuos juveniles y adultos.
C.- Estimación y análisis comparativo del coeficiente de asimetría (g 1) de la distribución de tamaños de la población en cada sitio de estudio. Se empleó el logaritmo del DAP para realizar la distribución en categorías de tamaño en cada sitio de estudio, siguiendo la metodología empleada por Wright et al. (2003) y Freitas de Souza et al. (2010). El coeficiente de asimetría (g 1) de la distribución de tamaños se calculó por medio de la siguiente ecuación:
Donde n, x i , x y s representan el número de individuos, el log10 del DAP de cada individuo i, el promedio de x i y la desviación estándar de x i respectivamente (Bendel et al., 1989).
Adicionalmente, se emplearon los criterios establecidos por la IUCN (UICN, 2000) para evaluar la permanencia de Resinanthus aromaticus en la categoría “en peligro de extinción”.
Resultados
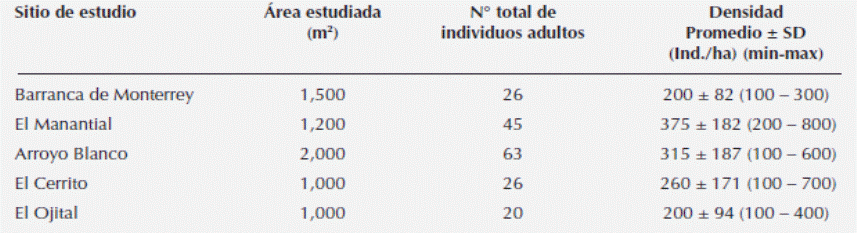
Densidad de Resinanthus aromaticus. Se registraron 383 individuos de R. aromaticus en una superficie de 0.67 ha, de los cuales 180 presentaron un DAP ≥ 5 cm, por lo que se consideraron individuos adultos. La densidad promedio general de R. aromaticus en los sitios de estudio es de 277 ± 165 individuos adultos por hectárea, variando entre 100 a 800 ind./ha; la densidad en los sitios de estudio se presenta en el Tabla 1. La primera prueba estadística aplicada señaló diferencias entre los sitios en cuanto a la densidad (Kruskal-Wallis, H = 10.469, 4 gl, P = 0.033); pero al aplicar la prueba de comparaciones múltiples de Dunn (P < 0.05) para identificar el o los sitios diferentes, no se logró establecer dicha diferencia. Esto probablemente se debe a la heterogeneidad de los datos, reflejada en un elevado coeficiente de variación (CV = 59.6 %).
Estructura poblacional de Resinanthus aromaticus. El análisis de bondad de ajuste de la distribución en clases de tamaño de R. aromaticus a la curva log-normal en los sitios de estudio indicó que sólo las poblaciones de AB y O presentan esta característica (Kolmogorov P > D 0.0994 y 0.0941, respectivamente).
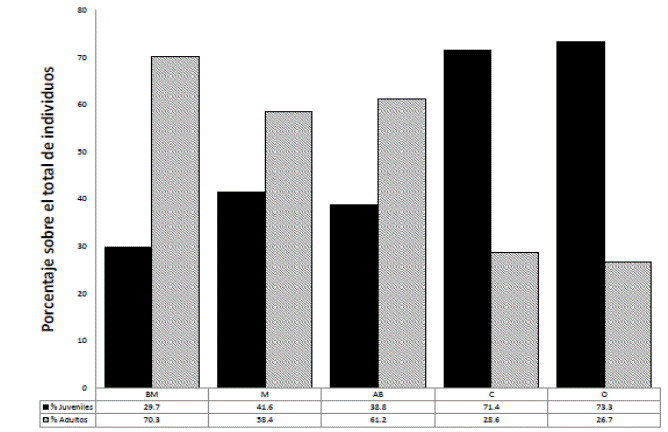
La proporción de juveniles de Resinanthus aromaticus en los sitios de estudio varía desde 29,7 % en BM, hasta 73.3 % en O. En BM, M y AB se presenta una mayor proporción de adultos (≥ 58 %); mientras que en C y O, es notorio el predominio de juveniles (≥70 %; Figura 2).
El análisis de la distribución de los individuos en clases de tamaño log10 (DAP) y su coeficiente de asimetría (g 1) también refleja diferencias en la estructura poblacional de las poblaciones estudiadas. En AB el coeficiente de asimetría es cercano a cero (g1 = 0.0315; Figura 3A), lo cual indica una distribución equitativa de los individuos en las categorías de tamaño; no se observan categorías predominantes. En BM y M se presentan coeficientes de asimetría negativos (Figura 3B, C), indicando una predominancia de las categorías de mayor tamaño. Por el contrario, en C y O se presentan coeficientes de asimetría positivos (Figura 3D, E), lo que indica un predominio de juveniles.
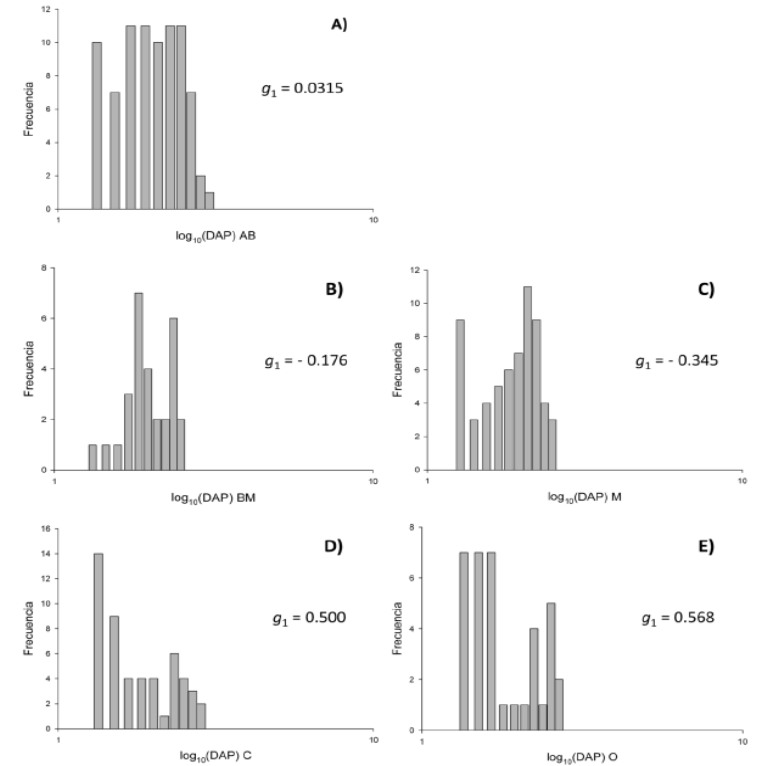
Figura 3 Estructura poblacional y coeficientes de asimetría de las clases de tamaño log10 (DAP) de Resinanthus aromaticus en los sitios de estudio. A) AB; B) BM; C) M; D) C; E) O.
Criterios de la Lista Roja IUCN. El análisis de los criterios de la Lista Roja de la IUCN indicó que el área de distribución conocida y el área de ocupación son inferiores a 500 km2; el número de poblaciones conocidas es ≤ 5; la vegetación donde se desarrolla la especie se encuentra severamente fragmentada; hay una reducción de la densidad de población de 57 % con relación a un estudio previo realizado por Sosa et al. (1998); y existe un alto riesgo de pérdida del hábitat de la especie por la deforestación para cambio de uso del suelo. Los fragmentos de SMsC en el área son pequeños, con superficies inferiores a 40 ha, lo cual incrementa dicho riesgo. Por ello la especie claramente presenta los elementos que la ubican en la categoría “En Peligro”, mismos que están incluidos en los criterios A2b,c; B1 y B2a,b(iii, v) (UICN, 2000).
Características físicas y ecológicas del hábitat de Resinanthus aromaticus y grado de intervención antrópica. Los fragmentos de vegetación primaria donde se encuentra R. aromaticus se distribuyen en varios tipos de paisaje, incluyendo laderas, cañadas y barrancas en cuyo fondo se forman arroyos temporales. La diferencia de altitudes entre sitios es inferior a 200 m (348 a 538 m). En general, los sitios presentan pendientes pronunciadas y suelos someros, con una pedregosidad superior a 60 %. El fragmento con mayor superficie es AB, con unas 35 ha, mientras que M y C ocupan superficies pequeñas, de unas 5 ha. La mayor intensidad de uso de R. aromaticus se presenta en C, O y M donde 84, 71 y 64 % de los individuos respectivamente, se encuentran afectados por cortes para la extracción de madera. En cuanto a otras actividades antrópicas, se observó extracción de leña y avances de la expansión agrícola en todos los sitios de estudio. El único lugar donde se registró pastoreo por ganado vacuno es BM, donde se permite el acceso de los animales durante los meses de enero a mayo. De acuerdo con el análisis de este trabajo, el sitio mejor conservado es AB, que presenta bajos niveles de intervención antrópica y la mayor distancia a un centro de población.
Discusión
La densidad promedio de Resinanthus aromaticus registrada es de 277 ind./ha, inferior a la reportada por Sosa et al. (1998) (650 ind./ha). De acuerdo con estas cifras, hay una reducción de 57 % en la densidad poblacional de R. aromaticus en el área de estudio. El valor de densidad reportado por Sosa et al. (1998) incluyó a los individuos con DAP ≥ 10 cm, mientras que el presente estudio incluye a los individuos con DAP ≥ 5 cm, por lo que se infiere que la disminución de la población es aún mayor. La densidad poblacional de R. aromaticus es inferior a otras especies arbóreas útiles y endémicas amenazadas como Magnolia dealbata Zucc. (Magnoliaceae) que presenta una densidad de 1,137 ind./ha en una zona de vegetación secundaria de bosque mesófilo de montaña en Veracruz, México (Sánchez-Velásquez y Pineda-López, 2006); no obstante, es superior a otras especies en peligro de extinción como Euryodendron excelsum H. T. Chang (Theaceae) que se presenta en fragmentos de vegetación secundaria con una densidad promedio de 50 ind./ha (Shen et al., 2009).
La estructura tipo log-normal de la población de Resinanthus aromaticus en AB y O parecería señalar una buena regeneración natural en estos sitios, así como un bajo nivel de reclutamiento en los sitios restantes. De acuerdo con diversos autores, AB y O presentan un reclutamiento adecuado; mientras que en las otras tres poblaciones el reclutamiento es bajo, lo cual podría indicar riesgos para la supervivencia a largo plazo de la especie en estas localidades (Silvertown, 1987; Lamprecht, 1990; Howard y Valerio, 1992; Silvertown y Lovett-Doust, 1993; Smith et al., 1997). Sobre la base de los resultados del presente estudio, esta interpretación puede ser contradictoria, ya que una de las dos poblaciones que presentaron una estructura ajustada a la log-normal se encuentra en el sitio mejor conservado (AB), pero la otra se encuentra en un sitio muy afectado por la intervención antrópica (O). Por tanto, este análisis no permitió diferenciar claramente entre una población conservada y otra alterada por la intervención humana.
El análisis de la proporción de juveniles vs adultos indica que sólo las poblaciones de C y O presentan un porcentaje de juveniles superior al de los individuos adultos. En nuestro caso, las conclusiones son distintas a las de Sosa et al. (1998), que reportan una adecuada regeneración y por lo tanto, buenas probabilidades de supervivencia a largo plazo para esta especie, debido al predominio de juveniles. En el presente estudio, la elevada proporción de juveniles parece estar relacionada con una alteración de la población, ya que ambos sitios son los que presentan los mayores niveles de afectación por cortes (> 70 %) y el resultado podría ser consecuencia de un bajo número de adultos ocasionado por la extracción selectiva de la especie.
El análisis del coeficiente de asimetría de las categorías de tamaño de la población en el sitio mejor conservado (AB) permite afirmar que Resinanthus aromaticus es una especie de bosque primario, tolerante a la sombra, con una distribución equitativa de los individuos en las categorías de tamaño, por lo cual presenta un coeficiente de asimetría muy cercano a cero (Swaine et al., 1990; Poorter et al., 1996; Kohira y Ninomiya, 2003; Wright et al., 2003). En el caso de BM y M, el coeficiente de asimetría negativo (g 1 < 0) señala un predominio de individuos en las categorías de mayor tamaño (adultos), lo cual podría indicar que la regeneración de la especie en estos sitios presenta dificultades. La presencia de ganado vacuno en BM explicaría esta baja proporción de juveniles. En C y O el coeficiente de asimetría positivo (g 1 > 0), que señala un predominio de juveniles parecería indicar una buena regeneración. Sin embargo, estos dos sitios también presentan el mayor nivel de disturbio, reflejado en el elevado porcentaje de individuos de R. aromaticus afectados por cortes. De ello se podría deducir que el predominio de juveniles es consecuencia de la extracción de adultos, más que del éxito en la regeneración.
Comparando los tres procedimientos empleados para evaluar el estado de las poblaciones de Resinanthus aromaticus, el método de análisis de los coeficientes de asimetría resultó el más adecuado para evaluar el estado de conservación de esta especie. Los análisis basados en la bondad de ajuste a la curva log-normal y en la proporción de individuos juveniles vs individuos adultos se enfocan principalmente al estado de la regeneración, sobrestimando su importancia y no consideran las características ecológicas propias de la especie (Wrigth et al., 2003; Souza, 2007). En el caso de R. aromaticus, el análisis comparativo de los coeficientes de asimetría, en conjunto con las características de los sitios estudiados permite inferir que esta especie pertenece al bosque primario, es tolerante a la sombra y tiene buena capacidad para regenerarse bajo el dosel. Tanto la ausencia de regeneración como una proporción muy elevada de juveniles estarían indicando efectos adversos sobre la población y por lo tanto, posibles riesgos para su supervivencia a futuro.
Con base en los resultados de este estudio y con los criterios de la IUCN se recomienda que Resinanthus aromaticus permanezca en la categoría especie “En Peligro” de extinción de la Lista Roja de la IUCN. Se puede afirmar que las poblaciones de R. aromaticus evaluadas están en peligro de extinción, principalmente por lo reducido del área de distribución conocida (< 500 km2). Así mismo, por la condición fragmentada de la vegetación donde se encuentran y el riesgo de desaparición de las poblaciones en los fragmentos remanentes debido a la deforestación para la expansión agrícola y pecuaria. Sin embargo, la especie tiene a favor de su supervivencia una alta capacidad de rebrote como respuesta al corte, así como una adecuada variabilidad genética (González-Astorga y Castillo-Campos, 2004). Los fragmentos de SMsC en el área de estudio no están protegidos por ningún sistema de reserva, por lo que se sugiere la creación de un área de protección especial. De acuerdo con el análisis del hábitat y estructura poblacional de R. aromaticus, se recomienda para este propósito el sitio AB, por presentar el mejor estado de conservación, tanto de la especie, como de la vegetación original donde habita. Se considera importante que haya participación de los habitantes locales en la planificación, ejecución y seguimiento de un programa de manejo sostenible de la especie, así como en los beneficios económicos que puedan generarse, ya que esto favorece la protección de la especie (Zimmerman y Kornos, 2012). También es urgente la inclusión de R. aromaticus en el listado de especies protegidas de la NOM-059 (SEMARNAT, 2010), con la finalidad de promover las acciones para su conservación.











 nueva página del texto (beta)
nueva página del texto (beta)