Calea urticifolia (Mill.) DC. es un arbusto de la familia Asteraceae que mide de 1 a 3 m de altura, se distribuye ampliamente desde México hasta Panamá en climas cálidos y semicálidos, se asocia con ecosistemas de selva baja caducifolia, bosque tropical y de encino. Se le conoce comúnmente como hierba del negro, negrito, jaral de castilla, chilchaca (PUM, 2009) y como juanislama en el Salvador (Matsuura et al., 2005).
Estudios previos sobre su composición química de Calea urticifolia han mostrado que posee lactonas sesquiterpénicas (Yamada et al., 2004). En la literatura se ha reportado que estos compuestos químicos presentes en extractos orgánicos de las hojas de Calea urticifolia generan apoptosis en la línea celular tumoral HL60, activan la vía Nrf2/ARE que previene el daño oxidativo en células de feocromocitoma PC12 de rata, inhiben la síntesis de melanina en células de melanoma de ratón B16 e inhiben la diferenciación de los preadipocitos en la línea celular 3T3-L1, siendo así un inhibidor de la adipogenesis (Matsuura et al., 2005; Nakagawa et al., 2005; Umemura et al., 2008; Ohguchi et al., 2009). Sin embargo, los estudios relacionados con la evaluación farmacológica del uso tradicional son limitados.
En San Luis Potosí, México; el grupo étnico Xi’iuy o pame usa tradicionalmente la decocción de las hojas de Calea urticifolia tomada en ayunas (0.13 g de hojas secas en 256 ml de agua), lo correspondiente a una dosis aproximada de 0.276 mg de extracto acuoso seco/kg de peso corporal/día como remedio terapéutico para tratar problemas gastrointestinales, diabetes e inflamación (Guzmán-Guzmán, 2010). Su uso tradicional como anti-inflamatorio, fue corroborado al evaluar el extracto acuoso y etanólico en un modelo in vivo de inflamación aguda y el extracto etanólico en un modelo in vivo de inflamación crónica de bajo grado del tejido adiposo, donde se observó la capacidad de inhibición sobre la secreción de citocinas proinflamatorias como TNF-α, IL-6 e IL-1β, tal efecto posiciona a la especie como un agente bioactivo eficaz que inhibe el proceso inflamatorio (Guzmán-Guzmán, 2010; Ortiz-Segura, 2011).
La importancia del estudio de plantas medicinales sobre la inflamación de bajo grado que se presenta en la obesidad, ha generado un amplio interés de investigación debido a que las enfermedades relacionadas con este proceso como la diabetes mellitus tipo 2, la enfermedad cardiovascular y en algunos tipos de cáncer, representan un problema de salud pública de importancia en México y en el mundo (Oviedo et al., 2007; Balistreri et al., 2010; OMS, 2015).
En la actualidad el interés por el uso de las plantas medicinales se ha incrementado, la Organización Mundial de la Salud (OMS) estima que más del 80 % de la población mundial principalmente de países en vías de desarrollo, utiliza la medicina tradicional como parte de su atención primaria de salud y que gran parte de los tratamientos tradicionales comprenden el uso de extractos de plantas o sus principios activos (OMS, 2008). Por lo que la validación de la no toxicidad de las plantas medicinales resulta de gran valía, ya que representa la seguridad de la población que las consume.
Por tanto, con la finalidad de contribuir a la investigación preclínica de Calea urticifolia y de validar científicamente la inocuidad de las plantas medicinales; en el presente trabajo se evaluó el efecto tóxico de los extractos etanólico y acuoso de las hojas de la especie, mediante la determinación de la DL50 por el método alternativo de clases de toxicidad oral aguda.
Materiales y métodos
Material vegetal. Se recolectaron las hojas de plantas adultas en fase vegetativa de Calea urticifolia en la comunidad indígena Xi´iuy del Potrero del Carnero del municipio de Rayón, San Luis Potosí, México; en agosto de 2012. El material vegetal fue colocado en papel absorbente a temperatura ambiente y al abrigo de la luz para su secado.
Preparación de los extractos de Calea urticifolia. El extracto etanólico se preparó por maceración de las hojas trituradas y secas con etanol absoluto en una proporción 1:4 (peso/volumen) durante diez días. Se filtró y el alcohol fue parcialmente evaporado a presión reducida (600 mmHg) y temperatura de 40 ˚C en un rotavapor (Büchi RE111). Finalmente, el extracto se colocó en cápsulas de porcelana (estandarizadas en peso constante) a temperatura ambiente y al abrigo de la luz para la eliminación total del solvente restante.
La extracción acuosa se llevó a cabo por decocción colocándose 100 g de hojas trituradas y secas en un litro de agua destilada a ebullición durante 5 min. Una vez frío el extracto acuoso, se filtró para ser sometido a liofilización en un Freezedryer (Modelo TFD5505, Ilshin®).
El rendimiento de la extracción etanólica y acuosa se determinó por peso de extracto seco/100 g de planta seca.
Modelo animal. Se utilizaron ratas macho y hembra de la cepa Wistar de 8-12 semanas de edad, con peso corporal de 180 a 240 g. Se colocaron en jaulas de acrílico individuales a una temperatura de 22 ± 3 ˚C y bajo ciclos de luz/oscuridad de 12 h. Se les proporcionó dieta estándar (Formulab Chow 5001) y agua ad libitum durante el tiempo de adaptación (5 días) y experimentación (14 días). Los animales fueron proporcionados por el Bioterio de la Facultad de Medicina de la Universidad Autónoma de San Luis Potosí y fueron manejados de acuerdo con la Norma Oficial Mexicana NOM-062-ZOO-1999, según las especificaciones técnicas de producción, cuidado y uso adecuado de animales de laboratorio.
Toxicidad aguda por el Método de Clases. La DL50 se evaluó mediante el método alternativo de clases de toxicidad aguda por vía oral de acuerdo con la guía No. 423 de la OECD (OECD, 2000). Este método cumple con el principio de las tres R (reducción, refinamiento y reemplazo) y dispone la evaluación toxicológica en grupos reducidos de animales de experimentación a dosis fijas durante 14 días (Seidle et al, 2010).
Para la evaluación de la DL50 se utilizaron 36 ratas hembra y 36 macho las cuales fueron distribuidas aleatoriamente en función de los tratamientos en grupos de tres unidades. Con ayuno previo de 12 h se administró por vía oral a través de una cánula intragástrica (16G) los extractos etanólico y acuoso de Calea urticifolia de manera independiente en función de la dosis correspondiente. Posterior a la administración aguda de los tratamientos y con la finalidad de favorecer la absorción de los extractos; el alimento y el agua ad libitum se administraron 4 h después, de acuerdo con lo que se establece en la técnica experimental de la guía 423 de la OECD.
La observación de los animales se inició inmediatamente después de administrar los tratamientos y fue dirigida principalmente a la ocurrencia de muertes para determinar la DL50; así como la aparición de signos tóxicos de bajo grado relacionados con el estado general y comportamiento de las ratas (lagrimeo, apnea, disnea, salivación, temblor, somnolencia, letargo, ruido nasal, piloerección, epistaxis y convulsiones). El primer día de experimentación se registraron las observaciones a las 0.5, 4, 8, 12, 16, 20 y 24 h; y posteriormente cada 24 h hasta completar los 14 días del ensayo.
Las dosis evaluadas para el extracto acuoso liofilizado fueron 50, 100, 300, 2,000 y 5,000 mg/kg (disueltas en agua destilada) y para el extracto etanólico fueron de 50, 100 mg/kg (disueltas en agua destilada), 300 y 1,000 mg/kg (disueltas en aceite de maíz). El grupo control fue tratado con agua destilada o aceite de maíz de acuerdo con el extracto evaluado. De manera adicional se registró el peso corporal de las unidades experimentales, así como el consumo de alimento y agua en los días 1, 7 y 14.
Parámetros bioquímicos. Con la finalidad de determinar cambios bioquímicos en la funcionalidad renal y hepática, a las unidades experimentales se les extrajo una muestra sanguínea a través de la vena caudal por técnica de goteo antes de la administración de los tratamientos (basal) para determinar el intervalo de referencia por sexo y otra al final del experimento (postratamiento), para evaluar los cambios relacionados con la exposición aguda a los extractos de la especie.
Las muestras biológicas fueron centrifugadas a 3,000 rpm durante 5 min a temperatura ambiente, el suero fue separado, etiquetado y almacenado a -20 °C hasta su posterior análisis. Para evaluar la funcionalidad renal se cuantificó la concentración sérica de creatinina por el método colorimétrico-cinético de Jaffé a 492 nm y de urea por el método de ureasa GLDH cinético a 340 nm en un instrumento RA-50 de Bayer. Para la funcionalidad hepática se determinó la concentración de las enzimas transaminasas glutámico pirúvica (TGP) y glutámico oxalacética (TGO) por el método de NADH cinético UV a 340 nm en un instrumento RA-50 de Bayer.
Análisis estadístico. Los parámetros cuantitativos fueron expresados como la media ± desviación estándar y para el análisis de los resultados se utilizó el paquete estadístico Stata versión 13.0. Se realizó estadística descriptiva y los datos fueron evaluados por un análisis de varianza (ANOVA), seguido de una comparación múltiple de medías de Bonferroni para determinar la diferencia entre tratamientos. Un valor de P ≤ 0.05 fue considerado estadísticamente diferente. Para las variables con medidas en el tiempo se utilizó el análisis de mediciones repetidas.
Resultados
Rendimiento de la extracción. Por cada 100 g de hojas secas de Calea urticifolia se obtuvo 14.88 g de extracto acuoso seco y 2.44 g de extracto etanólico seco.
Toxicidad aguda por el Método de Clases. La administración oral del extracto etanólico (50, 100 300 y 1,000 mg/kg) y del extracto acuoso (50, 100, 300, 2000 y 5,000 mg/kg) en ratas hembra y macho de la cepa Wistar no causaron mortalidad en los 14 días del ensayo. Por lo que la DL50 en ratas Wistar y en ambos sexos es > 1,000 mg/kg para el extracto etanólico y > 5,000 mg/kg para el extracto acuoso.
Signos de toxicidad de menor grado caracterizados por letargo, somnolencia y piloerección moderada fueron observados durante las primeras 24 h de experimento en una unidad experimental del grupo tratado con la dosis de 1,000 mg/kg del extracto etanólico en ambos sexos y en dos ratas hembra de la dosis de 5,000 mg/kg del extracto acuoso. Tales signos fueron revertidos al día siguiente de haber iniciado el experimento. En general, los grupos tratados no mostraron anormalidades en su comportamiento, ni en el estado físico o afecciones gastrointestinales caracterizados por diarrea y vómito.
Ganancia de peso corporal, consumo de alimento y agua. El peso corporal se caracteriza por ser un indicador importante dentro de la valoración toxicológica aguda de una sustancia, esta variable se ve influida directamente por el consumo de alimento y agua en la rata. Los resultados fueron referidos como la ganancia de peso corporal en porcentaje durante los días 1, 7 y 14 del experimento con respecto al inicio del ensayo. Con relación a esta variable; los grupos de ratas hembra tratadas con sus respectivas dosis de 50, 100, 300 y 1,000 mg/kg de extracto etanólico de Calea urticifolia (Figura 1A), no mostraron modificaciones en la ganancia de peso corporal en comparación con el grupo control (P > 0.05). Respecto a los grupos de ratas macho (Figura 1B), únicamente se observó una disminución significativa de la ganancia de peso corporal con respecto al control (P < 0.05), con las dosis de 100 y 1,000 mg/kg en el día 7. Para las demás dosis y tiempos de evaluación no se observaron cambios significativos (P > 0.05).
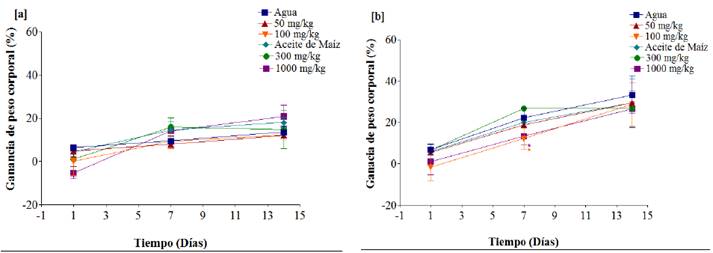
Figura 1 Ganancia de peso corporal (%) en ratas hembra (A) y macho (B) de la cepa Wistar en los días 1, 7 y 14 posterior a la administración oral del extracto etanólico de Calea urticifolia. Los puntos representan la media ± DE (n = 3/grupo). *P ≤ 0.05 vs control (agua destilada o aceite de maíz).
El efecto del extracto acuoso de Calea urticifolia sobre la ganancia de peso corporal en los grupos de ratas hembra no mostró cambios significativos (P > 0.05) durante el periodo de experimentación con respecto al grupo control (Figura 2A). Para el grupo de ratas macho las dosis de 100 y 300 mg/kg mostraron menor ganancia de peso corporal con respecto al grupo control (P < 0.05) en el día 1 y 7 del experimento únicamente, debido que para el día 14 se observó recuperación del peso corporal en ambos grupos (Figura 2B). Los demás grupos con sus respectivas dosis de 50, 1,000, 2,000 y 5,000 mg/kg no mostraron efectos significativos sobre la ganancia de peso corporal durante el periodo de experimentación (P > 0.05).

Figura 2 Ganancia de peso corporal (%) en ratas hembra (A) y macho (B) de la cepa Wistar en los días 1, 7 y 14 posterior a la administración oral del extracto acuoso de Calea urticifolia. Los puntos representan la media ± DE (n = 3/grupo). *P ≤ 0.05 vs control (agua destilada).
En las Tablas 1 y 2 se muestran los resultados del efecto de los extractos etanólico y acuoso de Calea urticifolia sobre el consumo de alimento y agua en ambos sexos. El grupo de ratas hembra tratadas en sus respectivas dosis no mostraron efectos significativos (P > 0.05) sobre estos parámetros en el tiempo de experimentación (Tabla 1). En el caso de las ratas macho, únicamente la dosis de 50 mg/kg de extracto acuoso produjo una disminución significativa (P < 0.05) en el consumo de agua con respecto al grupo control el día 14 del experimento (Tabla 2).
Tabla 1 Efecto del extracto etanólico de Calea urticifolia sobre el consumo de alimento y agua de ratas hembra y macho de la cepa Wistar, en los días 1,7 y 14 del experimento. Los valores representan la media ± DE (n = 3/grupo). Sin cambios significativos P > 0.05 vs control. La dosis de 0 mg/kg corresponde al grupo control (agua destilada ó † aceite de maíz).

Tabla 2 Efecto del extracto acuoso de Calea urticifolia sobre el consumo de alimento y agua de ratas hembra y macho de la cepa Wistar, en los días 1,7 y 14 del experimento. Los valores representan la media ± DE. (n = 3/grupo). *P ≤ 0.05 vs control. La dosis de 0 mg/kg corresponde al grupo control (agua destilada).

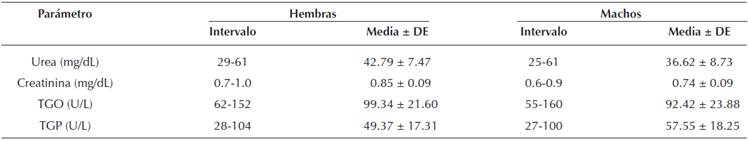
Parámetros bioquímicos. En la Tabla 3 se muestran los intervalos de referencia del estado basal de ratas de 8 a 12 semanas de edad en ambos sexos establecido bajo las condiciones iniciales del experimento, se evaluó la funcionalidad renal a través de la cuantificación de urea y creatinina, así como la funcionalidad hepática evaluada por la cuantificación de enzimas transaminasas glutámico pirúvica (TGP) y glutámico oxalacética (TGO).
Tabla 3 Parámetros bioquímicos de urea, creatinina, transaminasas glutámico oxalacética (TGO) y glutámico pirúvica (TGP) de ratas hembra y macho de la cepa Wistar. n = 36
La Tabla 4 muestra los valores de los parámetros bioquímicos obtenidos postratamiento del extracto etanólico en ambos sexos. Los resultados sobre la funcionalidad renal y hepática en el grupo de ratas expuestas al extracto etanólico en ambos géneros no presentaron cambios significativos (P > 0.05) al ser comparados los tratamientos con su respectivo control (agua vs 50 y 100 mg/kg, y aceite de maíz vs 300 y 1,000 mg/kg).
Tabla 4 Efecto del extracto etanólico de Calea urticifolia sobre los parámetros bioquímicos de ratas hembra y macho al final del experimento. Los valores representan la media ±DE (n=3/grupo). Sin cambios significativos P > 0.05 vs control (agua destilada o aceite de maíz).

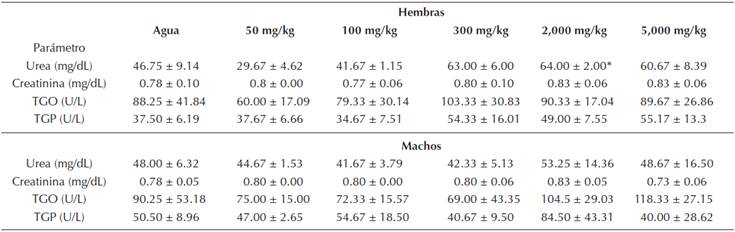
En el caso de las unidades experimentales tratadas con el extracto acuoso (Tabla 5), únicamente el grupo de ratas hembra expuestas a la dosis de 2,000 mg/kg, presentó un incremento significativo (P = 0.05) en la concentración de urea de 64 ± 2 mg/dL en comparación con el grupo control (agua) 45,75 ± 9.14 mg/dL. Los otros tratamientos en ambos sexos y dosis no presentaron cambios en las concentraciones de urea y creatinina (P > 0.05). En el caso de la cuantificación de las enzimas transaminasas, no manifestaron cambios significativos (P > 0.05) en ambos sexos (Tabla 5).
Discusión
En nuestro país la medicina tradicional representa una práctica médica alternativa desde tiempos prehispánicos por razones culturales, pero además por aspectos socioeconómicos, por lo que en la actualidad su uso cotidiano es fundamental para resolver problemas de salud, principalmente en comunidades indígenas (Merino-Sánchez, 2011). Por ello es importante valorar de manera científica la inocuidad de las plantas medicinales a través de la corroboración de sus efectos terapéuticos y su toxicología. Ambos aspectos son fundamentales para el desarrollo de estudios preclínicos que sustenten la investigación clínica de plantas con uso potencial para el tratamiento de enfermedades, principalmente aquellas relacionadas con procesos inflamatorios como la diabetes mellitus tipo 2, enfermedad cardiovascular y algunos tipo cáncer como de próstata y de mama entre otros (Balistreri et al., 2010; Hsing et al., 2010).
El efecto anti-inflamatorio demostrado de la especie Calea urticifolia (Guzmán-Guzmán, 2010; Ortiz-Segura, 2011), la posiciona como un agente eficaz para prevenir la inflamación de bajo grado responsable de inducir alteraciones sobre la sensibilidad del receptor de insulina presente en el sobrepeso y la obesidad (Bastard et al., 2006; González et al., 2006; Flehmig et al., 2014), y su asociación con enfermedades crónicas degenerativas.
Con base a los resultados de esta investigación, los efectos observados en las ratas macho sobre la disminución en la ganancia de peso corporal expuestas al extracto etanólico con dosis de 100 y 1,000 mg/kg en el día 7 del experimento y la disminución observada en las ratas macho expuestas al extracto acuoso con las dosis de 100 y 300 mg/kg en el día 1 y 7, no representan signos de toxicidad en las ratas; ya que el efecto no fue dosis dependiente, y no se relacionó con el consumo de agua y alimento para ambos grupos lo que permitió que al día 14 del experimento las ratas recuperan la ganancia de peso corporal con respecto al grupo control (P > 0.05). Además, el peso corporal alcanzado a lo largo del experimento en ambos sexos y las diferentes dosis se encontró dentro de los parámetros establecidos en la curva de crecimiento de esta especie (Lewi y Marsboom, 1981).
Respecto al consumo de agua y alimento únicamente se observó cambios significativos en el consumo de agua de ratas macho expuestos al extracto acuoso con la dosis más baja (50 mg/kg) el día 14 de experimentación, tal hallazgo se consideró que no representa un efecto tóxico debido a que el grupo de ratas expuesta a esta dosis no mostró adicionalmente cambios en el consumo de alimento que se puedan atribuir a un efecto sobre la ganancia de peso corporal, la cual no fue modificada.
En lo que respecta a las pruebas de funcionalidad renal y hepática, únicamente en la concentración de urea del grupo de ratas hembra expuestas con la dosis de 2000 mg/kg mostró un incremento significativo (P = 0.05) en comparación con el grupo control (agua destilada), sin embargo tal diferencia biológica no mostró ser dosis dependiente y por lo tanto no representa importancia toxicológica (Mu et al., 2011).
Los hallazgos de esta investigación indican que la especie Calea urticifolia en sus extractos etanólico y acuoso no causan mortalidad a las dosis evaluadas en ambos sexos, lo que la clasifica como una sustancia de categoría 4 en su extracto etanólico y 5 en su extracto acuoso de acuerdo con el GHS (Globally Harmonized Classification System), lo que se traduce en presentar una DL50 en ratas Wistar y en ambos sexos > 1,000 mg/kg para el extracto etanólico y > 5,000 mg/kg para el extracto acuoso (OECD, 1998).
Finalmente se considera este estudio relevante debido a que en la medicina tradicional empleada por la etnia Xi´iuy la dosis que se utiliza para el tratamiento de una persona de 70 kg es de 0.044 mg/kg/día, en su extracto etanólico y 0.276 mg/kg/día en su extracto acuoso. Lo que representa de acuerdo con la estimación de la DL50 para el extracto etanólico una exposición de 22,727 veces la dosis tradicional y para el extracto acuoso 18,115 veces, por lo que la seguridad terapéutica de esta especie es alta. Sin embargo, no hay que descartar estudios posteriores de toxicidad crónica y citotoxicidad para sustentar la futura investigación clínica de la especie.











 nueva página del texto (beta)
nueva página del texto (beta)