Introducción
El establecimiento del sexo de un individuo ocurre en el momento de la fecundación con la combinación de la información genética materna y paterna, ya que el ovocito contribuye con un cromosoma sexual X, mientras que el espermatozoide aporta alguno de los dos cromosomas sexuales, X o Y; como consecuencia, se determina el sexo genético, ya sea XX para fenotipo femenino o XY para fenotipo masculino.1,2
Posterior a la determinación del sexo génico, ocurren las diferenciaciones a nivel gonadal y somático que conllevan al desarrollo de las características sexuales específicas para cada fenotipo durante la vida embrionaria y fetal, consolidándose en la pubertad con la aparición de los caracteres sexuales secundarios. Estos procesos de diferenciación tisular dependen de una expresión génica altamente controlada para asegurar que los genes apropiados se expresen en los momentos adecuados; y de esta forma obtener ovarios o testículos correctamente diferenciados que produzcan hormonas sexuales femeninas y masculinas respectivamente. Es importante mencionar que para la determinación del sexo se deben desarrollar una cadena de eventos moleculares, hormonales y no hormonales que deben sincronizarse de forma perfecta. Alteraciones cromosómicas, en particular de los cromosomas sexuales, o en genes involucrados con el desarrollo embrionario de los órganos sexuales, o anomalías en alguno de los factores, impacta directamente en la formación o funcionamiento de las gónadas, tractos urinario-genital, sistema reproductivo y endocrino, ocasionando trastornos del desarrollo sexual (DSD por sus siglas en inglés, disorders of sex development).2-5
La sociedad de endocrinología pediátrica Lawson Wilkins (lWPeS) y el Consenso de Chicago en el 2006, definieron los trastornos del desarrollo sexual como condiciones congénitas caracterizadas por la discordancia entre la apariencia externa (masculinidad o feminidad) y la constitución cromosómica o sexo gonadal, abarcando así las condiciones intermedias entre fenotipos masculino y femenino del sexo anatómico en un individuo.4
Dentro de los trastornos del desarrollo sexual ligados a alteraciones en los cromosomas sexuales encontramos el síndrome de Klinefelter (47,XXY) (SK). SK se caracteriza por la polisomía del cromosoma X en el varón; tiene una incidencia aproximada de 1 afectado por cada 500 niños nacidos vivos y el 75% de estos individuos tienen un cariotipo 47,XXY, el 20% son mosaicismos siendo el más frecuente el 46,XY/47,XXY. También se han reportado variantes 48,XXYY, 48,XXXY,49,XXXXY en un 5% de casos.5,6
De otra parte, el síndrome de Turner (45,X) (ST) es un trastorno genético, caracterizado por la ausencia completa o parcial del cromosoma X en todas las líneas celulares o en parte de ellas. Se presenta en aproximadamente 1 de cada 2500 nacimientos vivos en todo el mundo y es la patología más frecuente en las mujeres que compromete los cromosomas sexuales.6,7
Los estudios biomoleculares de estas patologías son escasos a nivel mundial, lo que ha limitado el conocimiento de las relaciones genotipo-fenotipo con muy pocos genes candidatos específicos vinculados a las características clínicas, aun así hay reportes en la literatura de estudios que han analizado los perfiles de expresión génica del ST y SK, lo cuales han planteado que algunos de los genes que escapan de la inactivación del cromosoma X contribuyen a los fenotipos del ST y SK.8,9
Cabe resaltar que a partir del 2020 se empiezan a publicar estudios de análisis bioinformáticos que identifican genes comunes expresados diferencialmente entre pacientes con ST Y SK. Los genes identificados están involucrados con la regulación de la expresión génica, mecanismos epigenéticos, regulación de procesos de splicing y síntesis de proteínas; a su vez estos hallazgos indica la existencia de mecanismos moleculares comunes para la regulación de genes en ST y SK que transmiten los cambios de dosificación de genes al transcriptoma.10,11
Determinación sexual
El establecimiento del sexo de un individuo ocurre en el momento de la fecundación, donde la fusión de los gametos femenino y masculino (oocito secundario y espermatozoide) genera un cigoto con una carga cromosómica diploide, es decir la combinación de la información genética materna y paterna. Los gametos contienen sólo la mitad de la carga cromosómica humana: 22 autosomas y un cromosoma sexual. El ovocito contribuye con un cromosoma sexual X, mientras que el espermatozoide aporta alguno de los dos cromosomas sexuales, X o Y. Como consecuencia, se determina el sexo genético, ya sea XX para fenotipo femenino o XY para fenotipo masculino.1,12
De esta manera, se determina el sexo a nivel genético. Se requieren diferentes mecanismos de diferenciación a nivel gonadal y somático que conllevan al desarrollo de las características sexuales específicas para cada fenotipo. Estos procesos inician en la vida embrionaria y fetal, e incluso continúan después del nacimiento una vez establecido el eje hipotálamo-hipófisis-gónada se siguen desarrollando caracteres sexuales secundarios.12
La diferenciación gonadal se produce entre la sexta y séptima semana de gestación; y consiste en la diferenciación de la gónada bipotencial hacia un ovario o un testículo dependiendo directamente del sexo cromosómico y la activación de cascadas génicas que dan origen a la vía testículo-específica u ovario-específica simultáneo a la represión de la vía opuesta. Estos procesos de diferenciación tisular depende de una expresión génica altamente controlada ya que se debe asegurar que los genes apropiados se expresen en los momentos adecuados; y de esta forma obtener ovarios o testículos correctamente diferenciados que produzcan hormonas sexuales femeninas y masculinas respectivamente. Por otro lado, la diferenciación somática o genital (interna y externa) ocurre después de la octava semana de gestación y depende de las hormonas que están siendo secretadas por las gónadas y el sistema nervioso central (SNC). El sexo somático se consolida en la pubertad con la aparición de los caracteres sexuales secundarios (distribución y cantidad del vello, zonas específicas de concentración de grasa corporal, tono de voz, desarrollo muscular, etcétera).2,12-14
Es importante mencionar que para la determinación del sexo se deben desarrollar una cadena de eventos moleculares, hormonales y no hormonales que deben sincronizarse de forma perfecta, ya que cualquier alteración en alguno de estos factores impacta directamente en la formación o funcionamiento de las gónadas, tractos urinario-genital, sistema reproductivo y endocrino.2,3,5,13
Formación y diferenciación de la gónada bipotencial
Entre la cuarta y sexta semana de gestación, del mesoblasto intermedio se desarrollan los gononefrotomos que dan origen a las crestas urogenitales, que se dividen en crestas urinarias y cresta gonadal. Esta última es constituida por varios tipos de células, el principal componente celular son las células germinales primordiales (PGC) provenientes del epiblasto, estas migran a través del saco vitelino y recubren los cordones sexuales primarios derivados del epitelio celómico y estroma, que posteriormente serán los conductos müllerianos o paramesonéfricos, y los wolffianos o mesonéfricos, destinados a convertirse en estructuras genitales. De este modo se forma la gónada morfológicamente indiferenciada o bipotencial, es decir, que puede diferenciarse hacia tejido testicular u ovárico según la constitución genética del individuo.2
En la séptima semana de gestación, las células de sostén derivadas del epitelio celómico darán lugar a las células de Sertoli y las células intersticiales a las células de Leydig, mientras que las células mioides peritubulares y endoteliales formarán la vasculatura típicamente masculina si la gónada se diferencia hacia testículos. Si por el contrario, la gónada se diferencia a ovario las células granulosas y tecales serán las implicadas.2,15-18
Se han identificado también factores de transcripción esenciales para el desarrollo temprano de los sistemas urogenitales a nivel embrionario como Lim1, Lhx9 y Emx2, entre otros factores un poco más específicos, como WT1 y SF1.16,19
LHX9, es un gen que se ubica en el cromosoma 1q31-32 y codifica para un factor de transcripción que actúa sobre el promotor de SF1.
SF1 (steroidogenic factor 1) o NR5A1, está ubicado en el cromosoma 9q33 y codifica para una proteína que actúa como un receptor nuclear implicado en la formación y la diferenciación de la gónada y la suprarrenal, a su vez se expresa en todos los tejidos implicados en la esteroidogénesis.
WT1 (Wilms tumor 1) es un gen que se encuentra en el cromosoma 11p1 y está implicado en el desarrollo renal y gonadal. Se expresa en las células de las cretas urogenitales y posteriormente en las células renales, células de Sertoli en los individuos XY o en las células granulosas en individuos XX. También desempeña la función de factor de transcripción y regula la expresión del gen SRY.
EMX2 se encuentra en el cromosoma 10q26.1 y codifica para un factor de transcripción involucrado en el desarrollo del sistema nervioso central y del sistema urogenital.
Determinación sexual femenina
Durante la séptima semana de la gestación los conductos de Müller dan origen a las trompas uterinas, el útero y los dos tercios superiores de la vagina tras la ausencia de hormonas masculinas.20
La formación del ovario desde la gónada bipotencial se ve influenciada por los siguientes genes:
RSPO1, se encuentra en el cromosoma 1p34.3, y es un activador de la vía WNT4/β-catenina.
FOXL2, ubicado en el cromosoma 8q23 codificando a un factor de transcripción.
WNT4 presente en el cromosoma 1p35 y codifica para un factor de señalización implicado en la morfogénesis renal y la inhibición de la migración de las células mesonéfricas con potencial androgénico.
CTNNB1 que se localiza en el cromosoma 3p22 y codifica para la proteína β-catenina.
La activación de la vía WNT4/β-catenina es modulada por R-spondina 1 (RSPO1) mediante su unión a los receptores LGR4/5/6. En esta condición se activa la β-catenina y regula positivamente la transcripción de genes que inhiben la expresión de SOX9; a su vez WNT4 antagoniza la vía masculina interfiriendo en la expresión de SOX9. Por otro lado, FOXL2 tiene una acción antitesticular por la represión de SOX9 a través de la región Enhancer TESCO.19,21,22
En la figura 1 se muestran los principales factores de transcripción y genes que intervienen en la determinación de los ovarios a nivel embrionario.
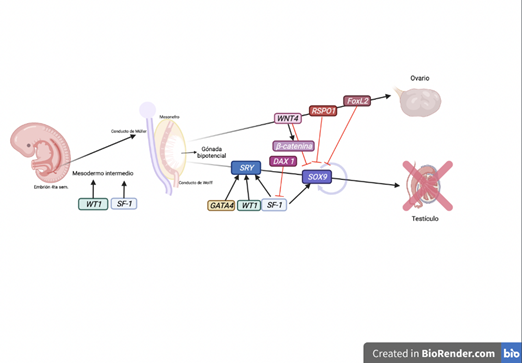
Las células precursoras de la gónada bipotencial se derivan del mesodermo intermedio, expresan SF1 y WT1 de forma temprana; la formación del ovario necesita una represión de SOX9 y una activación de la vía WNT4/β-catenina modulada por R-spondina 1 (RSPO1) y su vez FOXL2 también tiene una acción antitesticular por la represión de SOX9. Imagen creada en BioRender.com y modificada de: Morel Y, Roucher F, Mallet D, Plotton I. Genetic of gonadal determination. Ann Endocrinol (Paris). 2014;75(2):32-9.19
Figura 1 Principales factores que intervienen en la determinación de los ovarios
Determinación sexual masculina
La diferenciación de la gónada bipotencial hacia el desarrollo testicular esta regulado por los genes de la familia SOX (Sry-related HMG box), principalmente el gen SRY (sex determining region Y) que se encuentra ubicado en el brazo corto del cromosoma Y, es el responsable de activar la cascada de diferenciación sexual en el sexo masculino de los mamíferos. Varios reportes en la literatura mencionan que la expresión de SRY es activada por los factores de transcripción SF1, SP1 y WT1.
Una vez se realiza la traducción de la proteína SRY, esta ingresa al núcleo y se une a la región TESCO (del inglés Testicular Enhancer Specific of SOX9 Core) del gen SOX9, estimulando la expresión de este, que promueve la diferenciación gonadal hacia testículos y la inhibición de WNT4 y DAX1 que impide la diferenciación hacia ovarios. La proteína SOX9 puede unirse a su propio promotor, regulando su propia expresión para generar la diferenciación y proliferación de las células de Sertoli y la organización tubular de los testículos. Otro gen involucrado en la regulación de SRY es DAX1 (dosage-sensitive sex reverse) o NROB1; se encuentra localizado en el cromosoma X (p21.3) y actúa como un represor transcripcional de genes que intervienen en la esteroidogénesis, y se expresa en las glándulas adrenales, en las gónadas y en la región hipotálamo-hipofisaria.19,22-26
En la figura 2 se muestran los principales factores de transcripción y genes que intervienen en la determinación de los testículos a nivel embrionario.
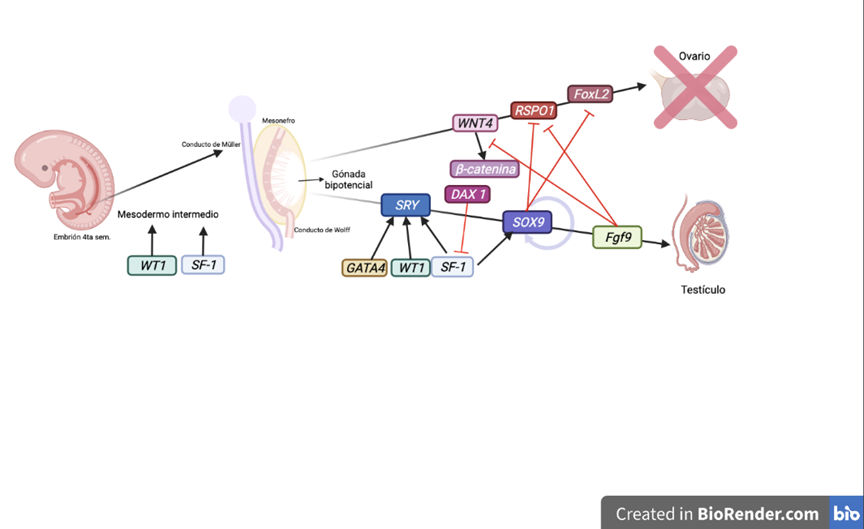
Las células precursoras de la gónada bipotencial se derivan del mesodermo intermedio, expresan SF1 y WT1 de forma temprana; la formación testicular está determinada por el gen SRY que actúa con SF1 para regular de forma positiva la expresión SOX9. Imagen creada en BioRender.com y modificada de: Morel Y, Roucher F, Mallet D, Plotton I. Genetic of gonadal determination. Ann Endocrinol (Paris). 2014;75(2):32-9.19
Figura 2 Principales factores que intervienen en la determinación de los testículos
Justo después de que SRY y SOX9 comienzan a expresarse en las células, se inicia una cascada de expresión génica donde se encuentra el gen AMH que codifica para la hormona antimülleriana, que genera la regresión de los conductos de Müller (conductos paramesonefróticos) y se genera el desarrollo y la diferenciación de los conductos de Wolff (conductos mesonefróticos). Después de la octava semana de gestación las células de Leydig producen la testosterona que estimula la transformación del conducto Wolff en conducto deferente, vesícula seminal y epidídimo.20
En la figura 3 se visualiza el desarrollo sexual humano durante la vida fetal; desde el estadio indiferenciado donde la gónada bipotencial por medio de mecanismos moleculares (expresión y represión de genes) tendrá una determinación sexual que la llevará a diferenciarse en testículos u ovarios, según la constitución genética del individuo, para concluir con la diferenciación de los genitales internos y externos dependiendo de la presencia o ausencia de hormonas.
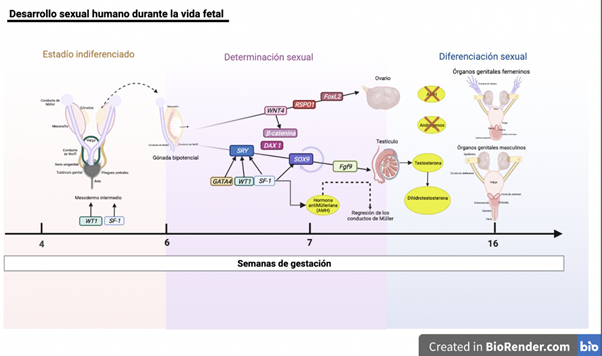
Imagen creada en BioRender.com y modificada de: Granada ML, Audí L. El laboratorio en el diagnóstico multidisciplinar del desarrollo sexual anómalo o diferente (DSD): I) Fisiología, clasificación, abordaje y metodología II) Marcadores bioquímicos y genéticos diagnósticos en los 46,XX. Advances in Laboratory Medicine / Avances en Medicina de Laboratorio. 2021 Dec 1;2(4):481-93.27
Figura 3 Desarrollo sexual humano durante la vida fetal
Trastornos del desarrollo sexual (DSD, disorders of sex development)
En 2006, la sociedad de endocrinología pediátrica Lawson Wilkins (lWPeS) y el Consenso de Chicago definieron los trastornos del desarrollo sexual (DSD) como condiciones congénitas que se caracterizan por la discordancia entre la apariencia externa (masculinidad o feminidad) y la constitución cromosómica o sexo gonadal, abarcando así las condiciones intermedias entre fenotipos masculino y femenino del sexo anatómico en un individuo.4
Los trastornos del desarrollo del sexo están relacionados con alteraciones a nivel del desarrollo gonadal y del tracto urinario-genital e incluso del sistema reproductivo-endocrino; dentro de las causas de estas se encuentran las genéticas, las cuales son provocadas por anomalías cromosómicas, en particular de los cromosomas sexuales, o por alteración de genes involucrados con el desarrollo embrionario de los órganos sexuales; como también, anomalías que generen la interrupción de la síntesis de hormonas específicas.3,4,28,29
El Consenso de Chicago también permitió la clasificación de trastornos del desarrollo del sexo según el cariotipo del paciente, proponiendo tres grupos principales:
DSD cromosómicos, cuando la composición de los cromosomas sexuales es distinta de los pares XX o XY.
DSD 46,XX.
DSD 46,XY.
Estos a su vez se dividen en otras categorías, como lo evidencia la Tabla 1.
Tabla 1 Clasificación de los trastornos del desarrollo sexual (DSD)
| DSD 46,XX | DSD 46,XY | |||
|---|---|---|---|---|
| DSD por cromosomas sexuales | Trastornos en el desarrollo gonadal | Trastornos en el desarrollo genital por alteración hormonal | Trastornos en el desarrollo gonadal | Trastornos en el desarrollo genital por alteración hormonal |
| -45,X y mosaicos 45,X0/46,XX: Síndromes de Turner y variantes. | -Disgenesia gonadal 46,XX. | Producción fetal: | -Disgenesia gonadal 46,XY (completa o parcial). | Alteraciones de la síntesis de andrógenos: |
| -47,XXY: síndrome de Klinefelter y variantes. | -46,XX ovotesticular. | a. Deficiencia de 21-hidroxilasa (CPY21A2) | -46,XY ovotesticular. | a. Déficit congénito de LH (hipogonadismo hipogonadotrópico) |
| -45,X / 46,XY: disgenesia gonadal mixta. | -DSD Testicular 46,XX | b. Deficiencia de 11-β-hidroxilasa (CYP11B1) | -Síndrome de regresión testicular (incluye la anorquia y el síndrome de fuga testicular). | b. Mutaciones del receptor de LH (hipoplasia o aplasia de células de Leydig; LHCGR) |
| -47,XYY | c. Deficiencia P450 oxido-reductasa (POR) | c. Síndrome Smith-Lemli- Opitz (déficit de 7-dehidrocolesterol reductasa: DHCR7) | ||
| d. Deficiencia de citocromo b5 (CYB5) | d. Hiperplasia suprarrenal lipoidea congénita (StAR) | |||
| e. Deficiencia de 3-β-hidroxiesteroide deshidrogenasa (HSD3B2) | e. Deficiencia de colesterol desmolasa (CYP11A1) | |||
| f. Mutaciones del receptor de glucocorticoides (NR3C1) | f. Deficiencia de 3β-hidroxiesteroide deshidrogenasa (HDS3B2) | |||
| Producción fetoplacentaria: | g. Deficiencia de 17α-hidroxilasa /17-20 liasa (CYP17A1) | |||
| a. Deficiencia de aromatasa placentaria y fetal (CYP19A1) | h. Deficiencia P450 oxidorreductasa (POR) | |||
| b. Deficiencia P450 oxido-reductasa (POR) | i. Deficiencia de citocromo B5 (CYB5) | |||
| c. Tumores fetales o placentarios de andrógenos | j. Deficiencia de 17β-hidroxiesteroide deshidrogenasa (HDS17B3) | |||
| Producción materna: | k. Deficiencia de 5α-reductasa tipo 2 (SRD5A2) | |||
| a. Fármacos androgénicos | Alteraciones en la acción de los andrógenos: | |||
| b. Tumores maternos virilizantes (por ejemplo, luteomas, tumor de Kruken- berg). | a. Insensibilidad a los andrógenos (AR; total o parcial=CAIS o PAIS) | |||
| b. Fármacos y moduladores ambientales | ||||
| Alteraciones en la síntesis o acción de la hormona antimülleriana: | ||||
| a. Síndrome de los conductos de Müller persistentes (AMH/ AMHR2). |
Según el Consenso de Chicago de 2006, la clasificación está basada en el cariotipo, de modo que se distinguen tres grandes grupos de DSD: 1) cuando existen anomalías en los cromosomas sexuales; 2) cuando el cariotipo es femenino 46,XX y 3) cuando el cariotipo es masculino 46,XY. Modificado de: Lee PA, Houk CP, Ahmed SF, Hughes IA, International Consensus Conference on Intersex organized by the Lawson Wilkins Pediatric Endocrine Society and the European Society for Paediatric Endocrinology. Consensus statement on management of intersex disorders. International Consensus Conference on Intersex. Pediatrics. 2006;118(2):e488-500.4
Los DSD se pueden clasificar también acorde con a las alteraciones en los niveles de designación del sexo: sexo génico, cromosómico, gonadal, hormonal, ductal, genitales externos, características secundarias, legales, de crianza y psicológicas.30
Se ha estimado que los DSD ocurren de 1-2/1000 nacidos vivos a nivel mundial, pero solamente es posible el diagnóstico en un 20% de los casos.27
Para Colombia, estudios de vigilancia epidemiológica de ECLAMC realizados entre 2001-2008, registraron un 0.03% de recién nacidos con sexo indeterminado, esto indica que su incidencia es baja, pero aun así esta condición no debe ignorarse ya que estas anomalías están presentes en nuestra población,31 generando gran impacto para el paciente y sus familiares; ya que limitan el desarrollo emocional y social de estos al no tener su sexo definido, ni entender el porqué de su condición.30
DSD por cromosomas sexuales
Síndrome de Turner
El Síndrome de Turner (45,X) (ST) es un trastorno genético, caracterizado por la ausencia completa o parcial del cromosoma X en todas las líneas celulares o en parte de ellas, término conocido con el nombre de mosaicismo. Fue descrito por primera vez en 1938 por el endocrinólogo estadounidense Henry Turner, en una cohorte de siete mujeres adolescentes que presentaban talla baja, cuello alado e infantilismo sexual.32
En 1959 se determinó que el ST no tenía un origen endocrino, sino citogenético tras un fallo en la segregación de los cromosomas sexuales durante la meiosis o en alguna de las divisiones mitóticas en los primeros estadios del desarrollo embrionario, que conlleva a que las mujeres con ST porten un solo cromosoma X (45, X0) en lugar de los dos cromosomas X convencionales para el sexo femenino (46, XX).33
La mayoría de las aneuploidias sexuales son de origen paterno y se ha reportado que etiología del ST se debe a la fecundación del ovocito por un espermatozoide sin cromosoma sexual, probablemente debido a la no disyunción de los cromosomas durante la primer anafase meiótica;34 y en menor frecuencia se pueden presentar casos 45,X de origen femenino donde se presenta una falla prematura en la separación de las cromátides hermanas del X durante la primer anafase meiótica en la ovogénesis.35
Se ha estimado que sólo el 2% de los embriones 45,X llegan al nacimiento, ya que el 98% restante terminan en abortos espontáneos durante el primer trimestre de gestación, siendo esta la única monosomía viable en humanos.36
Las anomalías numéricas o estructurales en el cromosoma X en pacientes con ST, pueden ser:
Ausencia o monosomía en línea pura o en mosaico, que corresponde al 50% de los casos de ST y manifiestan un fenotipo más alterado.37
Anomalías estructurales a nivel de los brazos cortos o largos en el 20% de los casos.38
Mosaicismo cromosómico con una línea celular que tiene ausencia de un cromosoma sexual o al menos un cromosoma estructuralmente anormal, presente en el 30% de los pacientes con un fenotipo más leve.39
El avance en el conocimiento del ST ha permitido análisis de los diferentes fenotipos clínicos. Varias herramientas de biología molecular han permitido identificar regiones críticas del cromosoma X implicadas en algunos de los rasgos característicos de este síndrome, en particular en lo referente a talla y función ovárica.7,40
La ausencia total o parcial de un cromosoma X da como resultado la perdida de una variedad de genes;41 la expresión fenotípica del ST se puede explicar en base a tres hipótesis:
a) El estado de haploinsuficiencia (presencia en una sola dosis génica, cuando se requieren de ambas para un correcto desarrollo) de genes que normalmente se expresan en los dos cromosomas sexuales y que escapan al fenómeno de inactivación del cromosoma X en las hembras (proceso que inicia en el «centro de inactivación» (XIC) en Xq13.3, por el cual se inactiva transcripcionalmente mediante mecanismos epigenéticos,42 la mayoría de los genes en uno de los dos cromosomas X, con el fin de compensar la dosis de expresión génica de los dos cromosomas X y asegurar que solo un cromosoma X funcione tanto en hembras como en machos).43 En humanos se ha establecido que aproximadamente entre el 15 y el 20% de los genes del cromosoma X escapan de la inactivación y estos se localizan en el brazo corto del cromosoma X, concretamente en la región distal.9,44 (Figura 4)
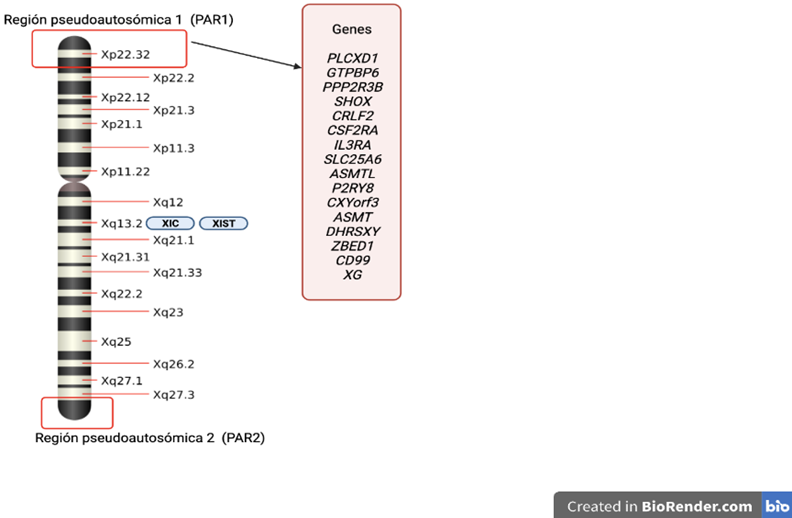
Las regiones pseudoautosómicas (PAR1 y PAR2) son regiones cortas de homología entre los cromosomas X e Y de los mamíferos y se recombinan durante la meiosis. Todos los genes caracterizados dentro de PAR1 escapan a la inactivación X. Imagen creada en BioRender.com y modificada de: Helena Mangs A, Morris B. The Human Pseudoautosomal Region (PAR): Origin, Function and Future. CG. 2007;8(2):129-36.45
Figura 4 Loci del cromosoma X y sus principales regiones
b) Fenómeno de imprinting (modificación epigenética que altera la expresión génica y por ende permite a la célula diferenciar su procedencia parental) por el que se modifica la expresión del gen en función de su procedencia.46
c) Por efectos propios del desbalance cromosómico.
La talla baja característica de las pacientes con ST se ha asociado con el gen SHOX (short stature homeobox-containing gene) que se encuentra localizado en el brazo corto del cromosoma X (Xp22.3); su haploinsuficiencia además está relacionada con alteraciones esqueléticas, paladar ojival, cuarto metacarpiano corto, cúbito valgo y deformidad de Madelung. Las anomalías a nivel de función ovárica se han asociado con pérdida de genes que están ubicados en el brazo corto del cromosoma X como BMP15 (bone morphogenetic protein 15) y otros ubicados en el brazo largo como son FMR1 y FMR2 (fragile X mental retardation), DFFRX (Drosophilla fat facets related), RPS4X (gen que codifica una isoforma de la proteína ribosomal S4) y DIAPH2 (gen necesario para una normal función ovárica).17,19
El retraso mental que afectan al comportamiento y la comunicación de las pacientes con ST se relacionan con el centro de inactivación y la expresión de XIST (transcripción específica del X inactivo, un ARN largo no codificante necesario para la regulación de la inactivación del cromosoma X).47,48
Las pacientes con este síndrome se caracterizan por la triada: talla baja, amenorrea primaria asociado con insuficiencia ovárica prematura y cuello alado y/o corto como también cubitus valgus. En algunos casos se presentan anomalías esqueléticas, problemas renales y/o un defecto cardíaco congénito e incluso pueden presentar problemas de aprendizaje y/o problemas de conducta, junto con trastornos de percepción espacial y coordinación visomotriz podemos encontrar un amplio rango de anomalías clínicas con sus respectivas frecuencias en los pacientes con ST reflejadas en la tabla 2.49,50
Tabla 2 Hallazgos clínicos en el síndrome de Turner y su frecuencia
| Hallazgos clínicos en ST | Frecuencia (%) |
|---|---|
| Musculoesqueléticos | |
| Talla baja | 100 |
| Cuello corto | 40 |
| Proporción anormal de segmento superior/inferior | 97 |
| Cubitus valgus | 47 |
| Metacarpianos cortos | 37 |
| Deformidad de Madelung | 8 |
| Escoliosis | 35 |
| Genu valgo | 35 |
| Micrognatia y paladar ojival | 38 |
| Mamilas hipoplásicas y muy separadas | 80 |
| Obstrucción linfática | |
| Pterigium colli | 25 |
| Implantación baja de cabello | 42 |
| Edema de manos y pies | 80 |
| Displasia de las uñas | 13 |
| Dermatoglifos característicos | 35 |
| Defectos de células germinales | |
| Fallo gonadal | 96 |
| Infertilidad | 99 |
| Otras anomalías | |
| Cardiovasculares | 55 |
| Renales | 39 |
| Nevus pigmentados | 50 |
| Ptosis | 11 |
| Estrabismo | 18 |
| Defectos de audición | 50 |
| Anomalías asociadas | |
| Tiroiditis de Hashimoto | 34 |
| Hipotiroidismo | 10 |
| Alopecia | 2 |
| Vitíligo | 2 |
| Anomalías gastrointestinales | 3 |
| Intolerancia a carbohidratos | 40 |
El síndrome de Turner se presenta en aproximadamente 1 de cada 2500 nacimientos vivos en todo el mundo y es la patología más frecuente en las mujeres que compromete los cromosomas sexuales.6
Síndrome de Klinefelter
El síndrome de Klinefelter (47,XXY) (SK), es una enfermedad genética caracterizada por la polisomía del cromosoma X en el varón; descrito por primera vez en 1942 por Harry Klinefelter en 9 pacientes de sexo masculino de 17 a 38 años de edad con ginecomastia bilateral, testículos pequeños, azoospermia y aumento de FSH.51
El síndrome de Klinefelter tiene una incidencia aproximada de 1 afectado por cada 500 niños nacidos vivos y el 75% de estos individuos tienen un cariotipo 47,XXY, el 20% son mosaicismos siendo el más frecuente el 46,XY/47,XXY; como también existen variantes 48,XXYY, 48,XXXY,49,XXXXY en un 5% de casos.52
Normalmente, los cromosomas se separan uno del otro durante la anafase de la división celular (meiosis) mediante el proceso que se conoce como disyunción. A medida que las células se dividen, cada óvulo obtiene solamente un cromosoma X y cada espermatozoide puede tener un cromosoma X o un cromosoma Y. Sin embargo, si no hay una disyunción normal, estas células sexuales pueden tener una copia adicional del cromosoma X, siendo esta la causa del síndrome de Klinefelter. Se ha reportado que en el 53% de los casos ocurre en la meiosis I paterna y un 43% errores en la meiosis I o II materna, el 4 % restante se asocia a errores mitóticos poscigóticos.53,54 Es importante mencionar que no existe evidencia que la no disyunción pueda repetirse en una familia particular por ende el SK no es heredable.55
Los pacientes con SK presentan una gran variedad fenotípica.54 Y esto se debe a que aunque existen múltiples vías para garantizar el silenciamiento de los cromosomas X en ganancia, algunos genes pueden escapar de dicha inactivación y continúan expresándose,56 pero usualmente se caracterizan por presentar una talla más elevada que la media, esto se debe al exceso de dosis del gen SHOX que interviene en la regulación del crecimiento, a su vez se ha relacionado con las proporciones anormales del cuerpo, es decir, piernas largas, tronco corto y hombros igual al tamaño de la cadera.57
Otra de las características de los pacientes SK es la presencia de testículos pequeños o criptorquidia e infertilidad con azoospermia, cuya causa es el exceso de gonadotropina, que se produce de forma progresiva una hialinización y fibrosis de los túbulos seminíferos, con una inadecuada producción de testosterona y azoospermia en la mayoría de los casos. Otros síntomas que también pueden ser: pubertad retrasada o incompleta con falta de características sexuales secundarias que resultan en escaso vello facial, corporal o sexual, voz aguda y distribución de peculiar de la grasa corporal que resulta en que hay más grasa depositada en las caderas, las nalgas y en los muslos; cantidad y distribución del vello facial y corporal, menor capacidad de coordinación, cierto grado de hipotonía y caderas algo más anchas.58-60
Los pacientes con SK tienen un alto riesgo de presentar enfermedades autoinmunes, especialmente el lupus eritematoso diseminado artritis reumatoide, tiroiditis y diabetes tipo I,61 como también tienden a tener mayor prevalencia de obesidad por un exceso de grasa abdominal, y por ende, hacer resistencia a la insulina, siendo esto característico de la diabetes tipo II;62 como también se ha sido asociado a una variedad de neoplasias hematológicas, sarcomas, cáncer de mama y tumores de células germinales de localización extragonadal.63,64
Varios autores han reportado en la literatura la sobreexpresión de genes PAR1 en pacientes con SK (promedio 1.4 en relación con XY) y múltiples genes ubicados en PAR1 tienen funciones relevantes a la inmunidad y están relacionados con el cáncer, lo cual puede explicar la predisposición a presentar enfermedades autoinmunes y neoplasias malignas.56
Dentro de los genes PAR1, se encuentra CSF2RA (receptor del factor estimulante de colonias de granulocitos y macrófagos) que juega un papel importante en la producción, diferenciación y función de granulocitos y macrófagos y IL3RA (receptor de interleucina 3) que codifica una subunidad del receptor de la interleucina 3 y su expresión aberrante se asocia con mal pronóstico en la leucemia mieloide aguda.65,66 Otro gen es CRLF2 (factor 2 similar al receptor de citoquinas), este codifica para el receptor de linfopoyetina del estroma tímico que promueve la proliferación de células T CD4+ se sobre expresa en la leucemia linfoblástica aguda (LLA).65,67
En cuento a la función neurocognitiva, los pacientes SK, presentan afectación especial del área verbal asociado al retraso en el habla y una discapacidad de aprendizaje;68 trastornos psiquiátricos, esquizofrenia, crisis de ansiedad, trastornos depresivos y déficit de atención.69 A nivel del sistema musculoesquelético, pueden presentar una displasia leve a nivel de la articulación del codo, y clinodactilia del quinto dedo de las manos.46 El gen GTPBP6 ubicando en PAR1 se ha asociado con la afección del desarrollo del lenguaje de estos pacientes.70
Genes comunes diferencialmente expresados en los síndromes de Turner y Klinefelter
Las diferentes manifestaciones clínicas del ST como la infertilidad, las malformaciones cardíacas u óseas, enfermedades autoinmunes, entre otras, se han asociado directamente con la monosomía del cromosoma X, que perturba profundamente la homeostasis genómica, es decir, el fenotipo ST es el resultado de un desequilibrio genómico global.71 Por otro lado, las manifestaciones clínicas del SK se deben a la presencia de un cromosoma X adicional, como también se han relacionado algunos genes que se escapan de la inactivación del cromosoma X, planteando la hipótesis de que estos contribuyen al fenotipo de los pacientes con SK.11
La inactivación del cromosoma X (XCI) silencia la transcripción de un cromosoma X en las hembras de mamíferos, en los que la mayoría de los genes están inactivos pero algunos genes escapan del XCI, y se encuentran regulados negativamente en el ST y positivamente en el SK.11
Es importante destacar que algunas características fenotípicas del ST y SK parecen tener una relación dependiente del número de cromosomas sexuales, como la deficiencia de habilidades motoras y la capacidad visuoespacial; pero también, se han descrito otras características clínicas divergentes como la altura y el rendimiento con el lenguaje. Además, se ha reportado que individuos con ST o SK pueden presentar el mismo cariotipo pero exhibir rasgos completamente diferentes, lo que sugiere que no existe una relación convencional genotipo-fenotipo.72-75
Sin embargo, para entender el fenotipo resultante de las aneuploidias de los cromosomas sexuales en los pacientes con ST y SK, se requiere de más investigación para dilucidar la relación entre los genes, factores transcripcionales y mecanismos epigenéticos que afectan la expresión génica en todo el genoma, ya que se ha planteado la hipótesis de que estos síndromes están asociados a redes genéticas.56,76
Manotas et al., mediante un análisis bioinformático in silico, lograron identificar 16 genes expresados diferencialmente entre pacientes con ST y SK de los cuales 14 están ubicados en el cromosoma X y 2 en cromosomas autosómicos. Ocho de estos genes están involucrados en la regulación de la expresión génica, cinco genes están relacionados con los mecanismos epigenéticos, dos con la regulación de los procesos de splicing y uno con el proceso de síntesis de proteínas (Tabla 3).56,69,70,77-84 Es importante mencionar que estos autores no encontraron la existencia de “genes comunes” sobreexpresados o infraexpresados simultáneamente en ambas condiciones clínicas.10
Modificado de: Manotas MC, Calderón JC, López-Kleine L, Suárez-Obando F, Moreno OM, Rojas A. Identification of common diffe- rentially expressed genes in Turner (45,X) and Klinefelter (47,XXY) syndromes using bioin- formatics analysis. Molecular Genetics and Genomic Medicine. 2020;8(11).10
Conclusión
La amplia variabilidad de las manifestaciones patológicas de los trastornos del desarrollo como son el ST y SK no solo están dadas por las aneuploidias de los cromosomas sexuales en los pacientes. Existe una relación que aún no es clara entre los genes, factores transcripcionales y mecanismos epigenéticos que afectan la expresión génica.
Se requieren más estudios para dilucidar dichas relaciones y ampliar el conocimiento de las características genéticas del síndrome de Turner y Klinefelter, lo cual puede usarse como una herramienta para entender la relación fenotipo-genotipo e impactar en el diagnóstico y tratamiento de estos trastornos del desarrollo sexual; de esta manera, se podrá contribuir en el mejoramiento de la calidad de vida del paciente y la de su familia.











 nueva página del texto (beta)
nueva página del texto (beta)



