Introducción
El cáncer de vejiga (CV) es una condición que requiere amplio reconocimiento por el médico general y el urólogo. Su estudio incluye una adecuada historia clínica y múltiples herramientas, tanto endoscópicas como imagenológicas. Con el advenimiento de la tecnología, en la actualidad es posible el uso de múltiples herramientas no invasivas que permiten una adecuada estatificación y evaluación de la progresión de la enfermedad. Herramientas que cuentan con un futuro promisorio.1
El CV ocupa el undécimo puesto de incidencia de neoplasias malignas a nivel mundial y se posiciona en el duodécimo lugar en mortalidad cuando se evalúan ambos sexos.2 La incidencia es mayor en la población masculina 3:1.3 Se presenta principalmente en pacientes entre la séptima y octava década de la vida, teniendo como factor de riesgo principal, hasta en el 50% de los casos el hábito tabáquico.4 Otros factores de riesgo como la radiación, la quimioterapia (ciclofosfamida) y la exposición laboral a bencenos o aminas aromáticas, juegan también un papel importante en la etiología y el desarrollo de la enfermedad.5 La gran mayoría de los pacientes, se presentan con hematuria macroscópica como única alteración, aunque la sintomatología urinaria baja, en especial la irritativa, puede ser parte de la queja inicial.6 El 75% de los tumores vesicales no invaden la capa muscular en el momento del diagnóstico, siendo hasta el 80% de bajo grado. Sin embargo, 80% de estos pacientes con tumor no músculo invasor tendrán una recurrencia de la enfermedad y hasta una tercera parte de estos tumores recurrentes, podrá progresar a un estadio invasor y comprometer el músculo detrusor.7
Tras la sospecha clínica del CV, se deben realizar múltiples estudios que incluye tanto el estudio del tracto urinario bajo como el alto.8 Es aquí, donde entran algunas técnicas nuevas que permiten la evaluación rápida y detallada de la vejiga y el tracto urinario superior. Es posible que, en un futuro, dichas herramientas puedan cambiar el abordaje inicial, clasificación e incluso el tratamiento en los pacientes con CV. El objetivo de este estudio fue realizar una revisión narrativa de la literatura en búsqueda de esos métodos diagnósticos novedosos que pueden cambiar el paradigma en el diagnóstico del CV. Se realizó una búsqueda no sistemática de la literatura en diferentes bases de datos médicas (PubMed, Medline, Scopus, ScienceDirect) para determinar las nuevas herramientas diagnósticas que podrían utilizarse en el diagnóstico actual del CV.
Abordaje Inicial
La tamización universal para CV no está estandarizada, sin embargo, considerando factores de alto riesgo como la edad superior a de 40 años, tabaquismo y sexo masculino, se ha propuesto la realización de tamización en esta población.9 El uroanálisis con microhematuria, definida esta como la presencia de tres eritrocitos o más por campo de alto poder, puede ser la manifestación inicial de un tumor vesical sin ninguna otra alteración o sintomatología. Por eso, si el paciente tiene algún factor de riesgo y microhematuria, debe iniciar el estudio para CV sin la necesidad de confirmar esta con otro uroanálisis, pues la microhematuria puede ser intermitente y un segundo examen negativo no descarta la presencia de una lesión tumoral.10
La cistoscopia es parte del abordaje inicial en el estudio de la hematuria cuando se está ante la sospecha diagnostica de un CV, con una sensibilidad mayor al 90% para el diagnóstico de un tumor localizado en el tracto urinario inferior.11 La cistoscopia tiene como desventajas la no visualización de tumores planos o carcinoma in situ (CIS) y ser un procedimiento invasivo del tracto urinario inferior, que puede conllevar estrechez de la uretra e incomodidades para el paciente durante el procedimiento.12 Dentro del estudio inicial de la hematuria, se encuentra la urografía por tomografía (UT), que permite la evaluación anatómica del tracto urinario, particularmente el superior, que permite descartar la presencia de cálculos y tumores renales al igual que defectos de llenado en el sistema colector y el uréter en la fase excretora, que pueden indicar la presencia de una lesión neoplásica en el tracto urinario superior.13 Si bien la sensibilidad de la UT es buena para el diagnóstico de CV, estudios la ubican entre el 79-93% con una especificidad del 83-99%,14,15 no se permite obviar la cistoscopia en el diagnostico de CV,8 siendo los tumores avanzados T3b y T4, los que son más fácilmente diagnosticados, sin permitir diferencia entre tumores músculo invasores (TMI) y no músculo invasores (TNMI).15 Por otra parte, la localización tumoral en el trígono vesical, hace obligatoria la realización de una UT, ya que en esta ubicación 15 a 30% de los pacientes, pueden tener compromiso tumoral a nivel del tracto urinario superior.16
Estado del arte en la imagenología vesical
Se encuentran pocas cosas novedosas en la literatura, sin embargo, hay varios cambios en las imágenes y métodos diagnósticos que se deben resaltar por el valor que pueden llegar tener a corto plazo, pues éstas podrían cambiar el paradigma diagnóstico y el abordaje del paciente con CV.
Imágenes fotodinámicas en cistoscopia
Como se mencionó previamente, la cistoscopia es muy útil dentro del diagnóstico de CV, sin embargo, una de sus desventajas es la baja sensibilidad que posee para el diagnóstico de lesiones planas, CIS o lesiones uroteliales pequeñas (sensibilidad 58-68%).17 Para mejorar esto, las técnicas de diagnóstico fotodinámico han jugado un papel importante en el enfoque del CV, al igual que los equipos endoscópicos flexibles que permiten acceder más fácilmente a la totalidad de la anatomía vesical con menor incomodidad para el paciente.18 Dentro de los complementos fotodinámicos (DF) encontramos la luz azul, que al usarla en la cistoscopia, resalta las lesiones vesicales previa instilación intravesical de ácido 5-aminolevulínico (5ALA) o hexaminolevulinato (HAL), pudiendo aumentar así la detección de lesiones pequeñas del urotelio hasta en 15% y de un 40% cuando se evalúa la detección de lesiones planas tipo CIS comparado con la cistoscopia de luz blanca tradicional.19 Las lesiones que no visibles en la cistoscopia convencional, se logran visualizar con luz azul hasta en un 23%, cambiando así, el tratamiento instaurado inicialmente en el paciente.20 Esta mejoría en el rendimiento diagnóstico impacta directamente la supervivencia libre de recurrencia en el primer año hasta en un 10%,21 sin embargo, al evaluar la progresión a un estado músculo invasor de la enfermedad, no hay datos concluyentes, siendo necesarios más estudios al respecto.19 La terapia intravesical adyuvante con BCG, reduce la recurrencia tumoral; sin embargo, no hay evidencia clara que el uso de esta terapia junto con DF mejore la tasa de supervivencia de los paciente.22 De igual manera se encontró que no hay diferencia entre el uso o no de HAL en la presentación de efectos adversos tras la cistoscopia.23
De igual forma, las imágenes de banda angosta (NB), adoptadas de la gastroenterología para el diagnóstico de tumores de colon hacen parte del DF. Este método ha sido llevado al campo de la urología para detectar lesiones uroteliales, que al igual que la luz azul, tiene una mejor tasa de detección tumoral comparada con la luz blanca tradicional. Esta mejoría es del 10-12% para la detección de lesiones uroteliales pequeñas y hasta un 35% en la detección de lesiones planas tipo CIS. En cuanto a la recurrencia y la progresión de la enfermedad aún hay datos limitados, sin embargo, logra una reducción en la supervivencia libre de progresión a los 3 meses del 50% comparado con la luz blanca.24 Recientemente se publicó un meta-análisis en el que comparaban NB, DF y cistoscopia convencional. Se evidenció diferencia en la sensibilidad: 96%, 93% y 71%, respectivamente; además, en el OR diagnóstico: 39%, 21% y 6%, respectivamente.25
Los complementos fotodinámicos y las imágenes de banda angosta ayudan a mejorar la sensibilidad diagnóstica de la cistoscopia en CV, sin embargo, aún no se encuentra masivamente difundida en todas las instituciones, estando disponible únicamente en centros de referencia, reduciendo así la posibilidad de su uso a una población limitada.26
Cistoscopia virtual
La cistoscopia, es un procedimiento incómodo y potencialmente lesivo de la uretra y el urotelio.12 Dentro de las alternativas no invasivas, existe la posibilidad de una reconstrucción de la anatomía vesical por medio de una UT, generando una imagen que se asemejaría a una cistoscopia. Descrita inicialmente en 1996 por David J. Vining en la que se propone una reconstrucción por tomografía de la vejiga,27 esta técnica ha sido adaptada para lograr una visualización anatómica vesical semejante a la lograda bajo visón directa.28 La toma de esta imagen tiene un protocolo particular que puede variar de acuerdo con el del centro donde se tome la imagen. Inicialmente el paciente debe evacuar completamente la vejiga. Posteriormente en la sala de tomografía se avanza una sonda Foley de 14 Fr para completar la evacuación vesical, el balón de la sonda se llenará con 5 cc de aire y por la sonda se procederá a llenar la vejiga con un volumen de 350 a 500 cc de aire. En este momento se toma el SCOUT tomográfico en el cual se verifica la adecuada distensión de la vejiga, teniendo como valores del diámetro vesical: <10 cm, de 10-15 cm y >15 cm para calificar la distensión de la vejiga en mala, aceptable y óptima. Es en este momento, con el paciente en supino es donde se realiza el primer barrido tomográfico simple. Posterior a éste, se realizan 2 barridos más tras la inyección de medio de contraste. Estos dos barridos se realizan en posición prono que corresponderían a las fases nefrogénicas y cortico medular. Por último, se realiza la extracción completa del aire vesical y se toma una nueva serie de imágenes que corresponde a la fase excretora, entre siete y diez minutos después de la administración del medio de contraste intravenoso. Una vez tomadas las imágenes se inicia la reconstrucción vesical que permite obtener una imagen en tres dimensiones que se asemeja a una cistoscopia óptica.29 (Figuras 1 y 2).
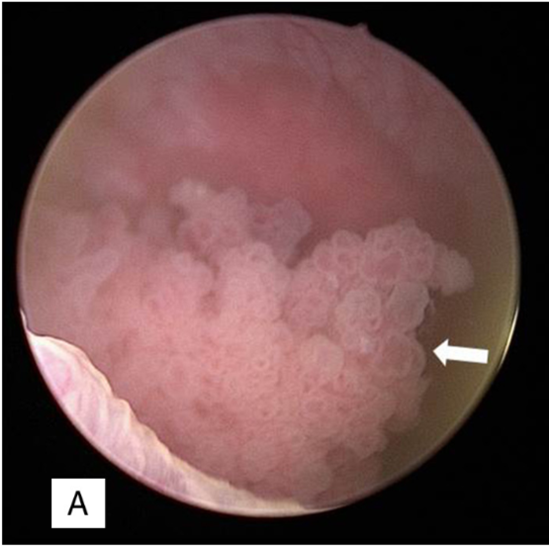
Tomado de: Ibáñez Muñoz D, et al. Cistoscopia virtual, urografía por tomografía computarizada y uretrocistoscopia óptica en el diagnóstico y el seguimiento del cáncer de vejiga. Radiología. 2017
Figura 1 Imagen por cistoscopia de lesión vesical
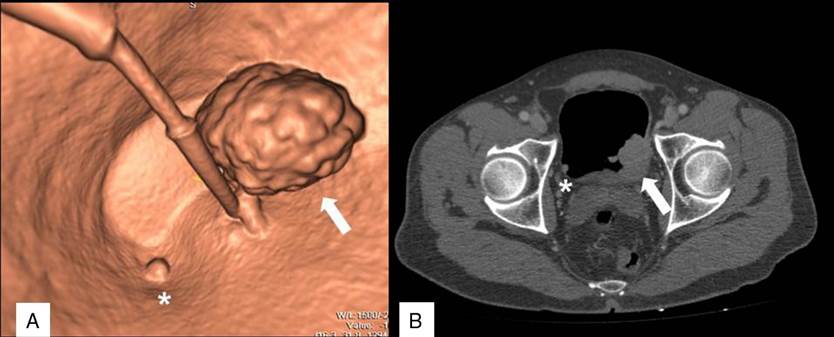
Tiene una sonda vesical con balón lleno de aire que no genera artefacto; además de pequeña lesión satélite. Tomado de: Ibáñez Muñoz D, et al. Cistoscopia virtual, urografía por tomografía computarizada y uretrocistoscopia óptica en el diagnóstico y el seguimiento del cáncer de vejiga. Radiología. 2017.
Figura 2 Imagen de reconstrucción tridimensional por tomografía (cistoscopia virtual) de lesión vesical previa
Se ha reportado una sensibilidad del 89-100% y especificidad del 80-87%,28-30 para el diagnóstico de CV con cistoscopia virtual, en comparación con 87-100% y 75-95% de la cistoscopia óptica, respectivamente.12 La sensibilidad disminuye en lesiones menores de 3 cm al igual que en la sospecha de tumor in situ, en estos casos es más fiable la visualización directa de las lesiones.29 Si bien es una buena aproximación al diagnóstico de los tumores vesicales, no descarta la necesidad de hacer una cistoscopia óptica, en especial cuando estemos ante lesiones pequeñas o la sospecha de un CIS.
Ecografía contrastada
La ecografía contrastada, o CEUS por sus siglas en inglés, es otro método de imagen de última generación con la que se está estudiando el diagnóstico de las lesiones tumorales vesicales. En este método, se aplica por vía endovenosa un material contrastado ultrasonográfico compuesto por microburbujas de gases inertes encapsuladas en un medio lipídico. La reverberación de las ondas sonográficas con estas burbujas son las que permiten ver el realce de las imágenes estudiadas, sin embargo, es un estudio operador dependiente (Figura 3). El reforzamiento evaluado en las lesiones intravesicales está dado gracias a la concentración de las microburbujas en zonas altamente vascularizadas. Dependiendo de sus características ultrasonográficas, es posible clasificarlas como lesiones de alto y bajo grado. Además, con la administración de contraste la pared vesical puede presentar una separación de las capas, entre la lámina propia y la muscular propia, siendo incluso factible, según la experticia del operador, clasificar el compromiso muscular.30,31
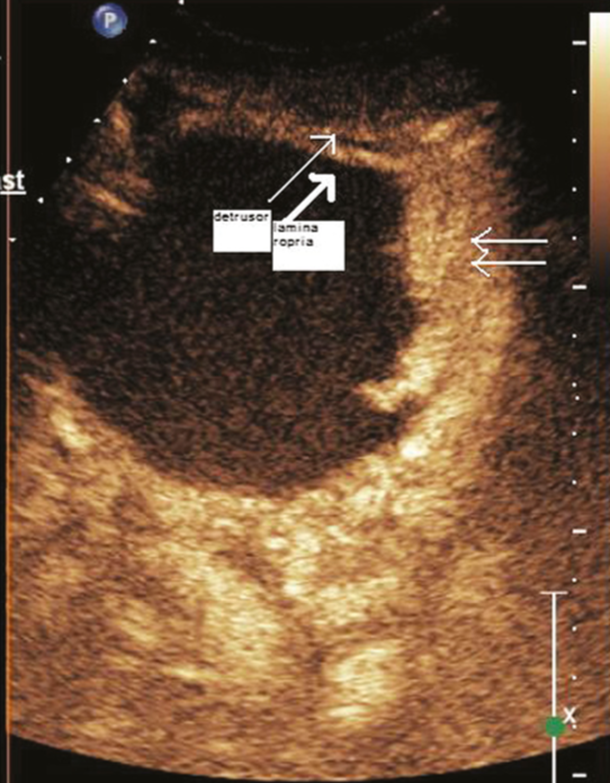
Tomado de: Gupta VG, Kumar S, Singh SK, Lal A, Kakkar N. Contrast enhanced ultrasound in urothelial carcinoma of urinary bladder: an underutilized staging and grading modality. Cent European J Urol. 2016;69:360-365
Figura 3 Imagen de CEUS, lesión T2, señalada con las dos flechas delgadas
En un estudio retrospectivo de 20 pacientes, la ecografía contrastada logró la identificación del 89% de los casos tumorales. Cabe aclarar que las lesiones que no fueron identificadas eran lesiones menores de 1,5 mm de diámetro lineal mayor, en dos casos con recidiva de la enfermedad y no es el método de imagen de elección para este grupo de pacientes.32 Por lo tanto, la ecografía contrastada puede lograr una mejoría en la caracterización de imágenes y se considera una técnica prometedora que mejoraría el manejo clínico de los pacientes con CV, sin embargo, más estudios son requeridos. Igualmente se debe tener en cuenta que la calidad operativa del estudio es dependiente de del entrenamiento del radiólogo que lo realice.
Otra de las aplicaciones y estudios que se están realizando sobre el CEUS, es la posible diferenciación entre bajo y alto grado tumoral por medio de las curvas de intensidad de onda evaluables con los equipos. Estas curvas tienen además una variación cuando el tumor tiene un componente vascular importante. Esto a su vez, puede impactar en el diagnóstico, tratamiento y pronóstico, sugiriendo la posibilidad de que los tumores de bajo grado tendrían una mayor presencia de microvasculatura evaluable.31,33
Resonancia magnética multiparamétrica
Como es sabido, la imagen por resonancia magnética desde su invención y masificación ha ido aumentando en su uso en diferentes patologías, además que, con las técnicas nuevas y las mejoras tecnológicas, ha ganado mayor fiabilidad y certeza en los diagnósticos, sin tener que exponer a los pacientes a radiación ionizante.34 Con la aparición de la resonancia nuclear multiparamétrica (RMmp) en próstata, que es una imagen compuesta por las secuencias anatómicas de la resonancia acompañada de una o más secuencias de imágenes funcionales, ha ocurrido durante los últimos años un cambio en el diagnóstico, enfoque inicial e incluso seguimiento de estos pacientes.35 Más recientemente, se ha propuesto la aplicación de esta técnica en el diagnóstico del CV, introduciendo la clasificación VI-RADS, como sistematización de la lectura de la imagen.36
La RMmp alcanza una sensibilidad y especificidad de aproximadamente el 90% para lograr una diferenciación entre tumores músculo-invasores o no, con un área bajo la curva ROC (AUC) de 94% en el diagnóstico de cualquier tipo de tumor vesical.37 En el 2018 Panebianco et. al., propone una clasificación estándar para la lectura de la RMmp de vejiga conocida desde entonces como VI-RADS.38 En esta publicación se propone como rol potencial de la RMmp y su clasificación en vejiga (VI-RADS), lograr la disminución del riesgo para el paciente en el diagnóstico, pues hasta la fecha, es imperativa resección transuretral de la lesión tumoral. (RTUV) El informe de histopatología de la muestra puede variar significativamente de acuerdo con la experticia del cirujano que toma la muestra y del patólogo que revisa el material procesado, esto sin mencionar que las imágenes convencionales no logran una adecuada valoración de la invasión a la capa muscular propia y pueden presentar discordancia con el diagnostico final del paciente.39-41 La clasificación de VI-RADS, presenta una evaluación sistemática de las lesiones, permitiendo así la caracterización objetiva de éstas, para posteriormente clasificarla dentro de ciertos parámetros establecidos. Estos parámetros fueron definidos en la reunión global de la RSNA Radiological Society of North America ocurrida Chicago en 2017.38 Para lograr una adecuada consecución de las imágenes, se debe tener en consideración la técnica de toma de las mismas, esto incluye que, en las dos semanas previas a la realización de la imagen, el paciente no haya sido llevado a una RTUV, biopsia o instilación de medicamentos por vía intravesical, puesto que dichos procedimientos generan edema a nivel de la mucosa y detrusor, alterando así la visualización en la imagen por resonancia, que puede generar una sobreestadificación local.42 La vejiga debe estar llena con al menos 300cc de orina para lograr una distensión suficiente que permita una visualización adecuada de su pared.43 En la RMmp se adquieren como mínimo imágenes en secuencias ponderadas en T2 en los tres planos ortogonales (T2W) así como 2 secuencia funcionales secuencias de difusión (DWI) y una secuencia de difusión contrastada (DCE-MRI). Las imágenes ponderadas en T1 se usan para evaluar la presencia de sangre o coágulos, así como la presencia de metástasis óseas en pelvis.44 Una vez tomadas las imágenes, se puede lograr la visualización del tumor y si puede llegar a comprometer la capa muscular. De acuerdo con cada una de las secuencias de la RMmp, se puede lograr la visualización del compromiso muscular o no (Figura 4). Se debe indicar localización y tamaño de acuerdo a la esquematización de la vejiga propuesta por Panebianco et.al.37 (Figura 5).

Las imágenes T2W muestran una señal de intensidad baja de la capa muscular y no se pueden visualizar el urotelio o la lámina propia. En el DWI, la capa muscular aparece como una línea de intensidad intermedia, mientras que la capa interna no se visualiza. Los componentes de la pared de la vejiga cambian de apariencia durante las fases de la imagen contrastada dinámica. Tomado de: Panebianco V., Narumi Y., Altun E. Multiparametric magnetic resonance imaging for bladder cancer: development of VI-RADS (Vesical Imaging-Reporting and Data System) Eur Urol. 2018;74:294-306
Figura 4 Esquematización de la anatomía de la pared vesical y respectivas imágenes de resonancia magnética en imágenes T2W, DWI, ADC y DCE

Tomado de: Panebianco V., Narumi Y., Altun E. Multiparametric magnetic resonance imaging for bladder cancer: development of VI-RADS (Vesical Imaging-Reporting and Data System) Eur Urol. 2018;74:294-306.
Figura 5 Esquema para reportar lesiones vesicales
Las imágenes de secuencia T2W, muestran la anatomía vesical, la localización y el tamaño tumoral. El grosor de los cortes debe ser entre 3-4 mm preferiblemente con imágenes turbo-spin-eco (TSP). El músculo se visualizará hipointenso, en caso contrario, posiblemente se presenta una invasión de la capa muscular propia.45 De forma similar, en la imagen contrastada, el tumor realza tras la administración del medio de contraste; además, la muscular propia no debe realzar con el contraste y es reconocible debajo del tumor si éste no la está invadiendo.38 En la secuencia de difusión (DWI), refleja el movimiento de moléculas de agua y es un componente determinante en la RMmp. El tumor debe mostrar una alta intensidad, así como niveles bajos de ADC; teniendo la muscular propia una intensidad intermedia.38,44 Por último, la imagen DCE-MRI, que realza temprano con la administración del medio de contraste por debajo de la muscular propia debe considerarse músculo invasora.44 Cada una de las señales se clasifica de 1-5 de acuerdo al compromiso o no de la capa muscular y con esto se genera la clasificación final de VI-RADS (Figura 6). Se ha encontrado además que si hay una diferencia en el diagnóstico y la correlación del VI-RADS cuando se usa equipos de 3 Tesla contra los de 1.5 Tesla.46

Modificado de: Panebianco V., Narumi Y., Altun E. Multiparametric magnetic resonance imaging for bladder cancer: development of VI-RADS (Vesical Imaging-Reporting and Data System) Eur Urol. 2018;74:294-306.
Figura 6 Ilustración esquemática de las apariencias de mpMRI de las puntuaciones VI-RADS 1-5 utilizando imágenes ponderadas en T2, DCE MRI, DWI y ADC
Ueno et al.,47 reportaron una serie de 74 pacientes que fueron sometidos a una RMmp antes de la RTU de vejiga, queriendo evaluar la presencia de compromiso de la muscular previo a la RTU. Las imágenes fueron evaluadas por cinco radiólogos, obteniendo una concordancia interobservador del 85% con un desempeño del VI-RADS satisfactorio, con un área bajo la curva ROC de 90% en general y con una detección del 94% de los casos con compromiso invasor clasificados como VI-RADS 4 o 5. En otro estudio Wang et al.,46 hicieron una revisión retrospectiva de 340 pacientes en los cuales el 25% eran músculo invasores (85 pacientes).
En esta serie de pacientes el área bajo la curva ROC que alcanzó el estudio fue del 94% con una sensibilidad del 87% y una especificidad del 97% para el diagnóstico de tumor invasor a la muscular teniendo un VI- RADS 3 o mayor. Al evaluar la correlación interobservador y la facilidad de replicar los hallazgos, Ueno el al., mostraron que un índice Kappa de 0.67, siendo este valor considerablemente bueno.48,49
Con el tiempo la RMmp de vejiga, no solo se ha limitado al diagnóstico inicial de la patología. La clasificación VI-RADS, se ha empezado a utilizar en el pronóstico tras los múltiples tratamientos posibles. Ercok el al.,50 incluyo 158 paciente llevados a Re-RTUV con una RMmp previa al procedimiento, 25.3 % fue re estadificado como TMI tras la patología. Las imágenes prequirúrgicas mostraron una sensibilidad del 87%, especificidad del 91% y una AUC 0.9 diagnosticando adecuadamente TMI antes de ser llevados a RTUV. En un estudio similar 231 pacientes sometidos a RMmp para discriminar TMI y TNMI antes de Re-RTUV, logrando una sensibilidad, especificidad y AUC del 91.9%, 91.1% y 0.94 respectivamente.46 Un metaanálisis que incluyó 1770 pacientes,51 con una sensibilidad y especificidad agrupadas de 0.83 (IC 95% 0.70-0.90) y 0.90 (IC 0.83-0.95) con un área bajo de curva de ROC de 94% para la detección de lesiones que comprometen el detrusor, sin embargo, el análisis mostraba una alta heterogeneidad entre los estudios. Un metaanálisis más reciente, que incluyó 22 estudios y 5414 reportes de RNMmp, con una AUC 0.93 y con una sensibilidad de 89% y especificidad del 84% para detectar TMI lo que vuelve al VI-RADS una herramienta altamente precisa.52 Por último, se encuentran estudios que pretenden evaluar la respuesta al tratamiento sistémico o locoregional (quimioterapia o radioterapia) y la correlación entre las imágenes y la respuesta en el espécimen patológico,53 sin embargo, estos van más allá del interés de esta publicación. Actualmente este método solo es mencionado por la guía de la Asociación Europea de Urología EAU, mencionando que la clasificación VI-RADS, aún requiere validación.53
Conclusión
Las imágenes diagnosticas, al igual que la cistoscopia hacen parte fundamental del diagnóstico de cáncer de vejiga. Sin embargo, algunas de estas tienen la desventaja de exposición a radiación ionizante o de ser procedimientos invasivos para el paciente. Nuevos métodos para lograr el diagnóstico de cáncer vesical están en estudio, entre ellos la ecografía contrastada y la cistoscopia con ayuda fotodinámica. Se destaca como el más prometedor la resonancia magnética multiparamétrica de vejiga, que no es invasiva ni expone al paciente a radiación, con un rendimiento diagnóstico adecuado. Esta herramienta que aún está en fase de validación y estandarización.











 nueva página del texto (beta)
nueva página del texto (beta)



