Introducción
La toxina botulínica (TXB) es una potente neurotoxina venenosa producida por la bacteria Clostridium botulinum y especies relacionadas.1 Su acción consiste en la inhibición de la liberación del neurotransmisor acetilcolina en las fibras nerviosas, lo cual inhibe las contracciones musculares.2
Clínicamente, la neurotoxina botulínica tipo A (TXB-A) se ha aplicado con éxito para el tratamiento del estrabismo, el espasmo muscular ocular, el espasmo facial y muchos otros trastornos caracterizados por una contracción muscular excesiva o inapropiada, incluida la distonía muscular y la hiperhidrosis axilar.3 En los últimos años, se ha sugerido el papel de TXB-A como agente terapéutico para la hiperplasia prostática benigna (HPB) y otras disfunciones del tracto urinario inferior y sexuales como la hiperactividad de la vejiga/detrusor hiperactiva, la disinergia del esfínter detrusor-esfínter (DSD), cistitis intersticial/síndrome de vejiga dolorosa, dolor pélvico crónico y, más recientemente, la eyaculación precoz.4,5
Su uso en la próstata fue descrito por primera vez por Doggweiler et al.,6 quienes estudiaron en 30 ratas el efecto de la TXB-A, hallando una atrofia generalizada de las células acinares de la próstata, así como una apoptosis glandular difusa. Este efecto se confirmó en 2 estudios posteriores en ratas y perros, respectivamente.7,8 En humanos, Kuo confirmó el efecto de la atrofia generalizada de las células glandulares obtenidas antes y después de la inyección de TXB-A;9 y Chuang et al.,7describieron una regulación negativa de los receptores adrenérgicos-α1A en la próstata de rata sin cambios de receptores de andrógenos.
La inyección intraprostática de TXB-A se encuentra entre las nuevas opciones de tratamiento de la HPB, demostrados a través de varios estudios en ratas, perros y humanos. Considerando las potencialidades que la TXB posee como una terapia efectiva en afecciones prostáticas, pero considerando que sus mecanismos son poco claros, el objetivo de esta revisión es organizar la evidencia actual y describir los fundamentos fisiopatológicos y mecanismo de acción conocidos hasta ahora, con la finalidad de motivar nuevas investigaciones, con lo cual plantear investigaciones en el campo específico del cáncer de próstata.
Materiales y métodos
La evidencia se recopiló mediante una búsqueda en PubMed y Scielo de publicaciones en el idioma inglés y español, utilizando las palabras clave “toxina botulínica”, “próstata”, “hiperplasia prostática benigna”, “cáncer de próstata”, “mecanismo de acción”, en varias combinaciones, de 1980 a 2019. Se incluyeron estudios experimentales en animales y humanos, así como aquellos que evaluaron el mecanismo de acción.
Se seleccionaron todos los artículos originales, ensayos clínicos, metaanálisis y de revisión relacionados con las inyecciones de BTX-A en la próstata.
1. Regulación nerviosa de la próstata
La próstata contiene una gran cantidad de fibras nerviosas simpáticas y parasimpáticas, por lo que su función está significativamente influenciada por el sistema nervioso autónomo. La inervación parasimpática es mayor en el epitelio glandular y tiene un efecto importante en la secreción y el crecimiento de la próstata.10 El componente dinámico está regulado por la inervación simpática, y su hiperactividad puede tener un efecto trófico en la próstata, además, la estimulación simpática induce el factor de crecimiento epidérmico.11
La próstata humana contiene neurorreceptores adrenérgicos, colinérgicos y no adrenérgicos no colinérgicos (NANC) α1 bajo la influencia de diversas inervaciones autónomas diferenciadas.10 Se sabe que las fibras nerviosas que inervan el músculo liso pueden ser tanto adrenérgicas como colinérgicas o separadas.12 Además, se ha sugerido que los nervios colinérgicos en el estroma prostático podrían suprimir la liberación de noradrenalina de los terminales adrenérgicos.13 La inervación adrenérgica α puede ser antagonizada por la relajación inducida por NANC mediada por óxido nítrico.14 Las inervaciones adrenérgicas, colinérgicas y nitrinérgicas y su interacción pueden estar relacionadas con el tono del músculo liso de la próstata. Por lo tanto, pueden jugar un papel importante en el componente dinámico de la hiperplasia prostática benigna. La inervación colinérgica y nitrinérgica se reduce en la HPB en comparación con la del tejido prostático normal; sin embargo, la actividad adrenérgica aumenta.15
Por lo cual la función de la próstata no solo está influenciada por la acetilcolina, sino también por otros factores como el andrógeno y la noradrenalina.16
2. Mecanismo de acción de la TXB sobre la próstata
La TXB es un producto que lleva 20 años dentro de las herramientas terapéuticas de los urólogos, pero su mecanismo de acción todavía continúa siendo confuso y parcialmente comprendido.17
Como se mencionó anteriormente, el mecanismo de acción de TXB-A involucra la inhibición de las uniones neuromusculares mediante el bloqueo de la liberación de acetilcolina y desensibilización de los nervios sensoriales mediante la reducción de la liberación de neurotransmisores de ATP, sustancia P y CGRP.18
Los efectos de TXB-A no solo se limitan a la unión neuromuscular, sino que también se extienden a la unión neuroglandular para inducir cambios atróficos, apoptosis y/o disminuir la contracción muscular sin cambios inflamatorios focales,7 además de vacuolización de las células del músculo liso y de las células estromales de la próstata.19
La disminución del volumen de la próstata descrita uniformemente después de las inyecciones intraprostáticas de TXB-A debe estar relacionada con la apoptosis generalizada que se ha detectado en la glándula después de la administración de TXB-A en ratas, perros y seres humanos. Otros mecanismos, como el efecto necrótico directo de la solución inyectada, parecen improbables, ya que no se han observado cavitaciones en el tejido glandular durante los ultrasonidos transrectales realizados repetidamente durante los estudios.6 La apoptosis involucra tanto los componentes epiteliales como los del estroma y las observaciones recientes sugieren un mecanismo de acción que involucra el deterioro de la inervación autonómica.6,8,20 De hecho, Silva et al., demostraron en ratas que la apoptosis de las glándulas inducida por la inyección intraprostática de TXB-A fue causada por la falta de un impulso simpático continuo. La apoptosis inducida por TXB-A se podría prevenir manteniendo la estimulación adrenérgica de la glándula con fenilefrina, un agente adrenérgico, administrado por vía subcutánea.20A pesar de la rica inervación colinérgica reportada previamente en la próstata,21 el deterioro de la inervación parasimpática en la atrofia de la próstata fue menos notable. La estimulación colinérgica no previene la atrofia inducida por TXB-A.20
Originalmente se pensó que la neurotoxina actuaba solo inhibiendo la liberación de acetilcolina en la unión neuromuscular presináptica.22 Actualmente, se sabe que otros mecanismos están involucrados, como el bloqueo de las uniones neuroglandulares. Se cree que también promueve una disminución de la liberación de norepinefrina de las terminaciones simpáticas, lo que lleva a la consiguiente reducción de la estimulación de los receptores adrenérgicos-α1A.23 Smith et al.24 encontraron que la inyección de TXB-A en el esfínter uretral proximal de la rata induce reducciones marcadas en la norepinefrina después de una estimulación de campo eléctrico alto (20 Hz). La inhibición de la norepinefrina ha atraído mucho interés en términos de la modulación de la disfunción del tracto urinario inferior, especialmente en hombres con HPB. Además, se ha demostrado que TXB-A inhibe la liberación de neuropéptidos (p. ej., el péptido relacionado con el gen de la calcitonina) que se cree desempeña un papel en las condiciones de vejiga hiperactiva, como la urgencia sensorial o la prostatitis crónica.25
Doggweiler et al.,6 sugirieron que la denervación puede alterar la expresión del factor de crecimiento en la próstata y producir una muerte celular programada; y Kyprianou demostró que la supresión del tono simpático en la próstata indujo la apoptosis celular.26
Por lo tanto, es probable que los cambios apoptóticos en la próstata después del tratamiento con TXB-A estén relacionados con una menor influencia neurotrófica en la glándula.8
Los efectos de la denervación provistos por la TXB-A se desgastan, ya que los nuevos axones volverán a brotar en aproximadamente 6 meses.27
3. Evidencias
3.1. Estudios in vitro
En 2009, Karsenty et al.,28 informaron la inhibición del crecimiento de las células LNCaP y PC3 in vitro e in vivo (xenoinjertos de cáncer de próstata en ratones) después de la aplicación de la toxina Abobotulinum, al respecto observaron que TXB redujo significativamente la proliferación de células LNCaP, así como un aumento de la apoptosis de una manera dependiente de la dosis, pero no afectó a PC-3. Una unidad de TXB resultó en una tasa de crecimiento significativamente más baja y una progresión de PSA más lenta durante 28 días en comparación con los controles. Un hallazgo interesante aportado por el estudio de Karsenty et al., es la presencia del receptor SV2 en ambas líneas celulares en una proporción de 4:1 (LNCaP / PC-3).
Proietti et al.,29 realizaron experimentos similares en líneas celulares de cáncer de próstata LNCaP y PC-3, y en concentraciones de TXB-A algo más altas (1 U-5 U / ml) y observaron una reducción similar del índice mitótico en las líneas LNCaP y PC-3. Además, TXB-A aumentó la expresión de fosfolipasa A2 (PLA2) fosforilada. Se sugirió que TXB-A inhibe la expresión de PLA2 activada, lo que puede reducir la síntesis de ácido araquidónico y eicosanoides.29 La línea celular PC-3 no expresa la transcripción de SNAP-25 ni la proteína respectiva.30
3.2. Estudios en animales
Doggweiler et al.,6 en 1998, fueron quizás los primeros en investigar el papel de la toxina botulínica en la HPB. Examinaron el efecto de la inyección intraprostática en 30 ratas, a las cuales le administraron una dosis de 5 U, obteniéndose como resultado una reducción del 44% en el peso de la próstata. Se obtuvo una reducción adicional con inyecciones seriadas de 2 U o 3 U de la toxina, lo que resultó en una reducción del 73% en el peso de la próstata. El análisis histológico reveló denervación selectiva de la próstata, con apoptosis y atrofia generalizada de la glándula.
Estos resultados se reprodujeron en un estudio aleatorizado y controlado en un modelo canino, demostrándose atrofia prostática y aumento de la apoptosis, proporcionando así el ímpetu para los ensayos clínicos en humanos.31 En la investigación de Doggweiler et al.,6 se observó que en ratas, los efectos del tratamiento disminuyeron a las 4 semanas, mientras que en el estudio en perros realizado Park et al.,32 los efectos se mantuvieron hasta 3 meses.
Marchal et al.,33 en una revisión publicada en 2012, identificaron nueve estudios sobre el tratamiento con TXB en ratas y dos con perros. Los hallazgos informados incluyeron apoptosis estromal y de las glándulas prostáticas,8,34 junto con una disminución en el número de células inflamatorias y la expresión de COX-235 y una expresión reducida de los receptores adrenérgicos-α1 en ratas.24,35
Al estudiar las células de la próstata tratada con TXB, para analizar la expresión del marcador de apoptosis celular, (terminal deoxynucleotidyl transferase biotin‐dUTP (TUNEL)), se encontró un aumento de células TUNEL-positivas en relación con los controles. Sin embargo, las ratas tratadas con TXB y fenilefrina presentaron menos células TUNEL-positivas.20
Según Lin et al.,19 en las próstatas de perros, la inyección de 200 UI de TXB-A reduce la presión uretral después de la estimulación eléctrica o la inyección de norepinefrina además de atrofia glandular y apoptosis celular, revelada por inmunohistoquímica.
Chuang et al.,7 publicó en 2006 los resultados de una investigación en la cual se inyectaron ratas Sprague-Dawley macho adultas con dosis variables de TXB-A en la próstata y se recogieron las próstatas después de 1 o 2 semanas. Observándose una semana después de la inyección de TXB-A, atrofia de próstata generalizada, con un aumento significativo en las células apoptóticas (12, 16 y 22 veces) y una disminución en las células proliferativas (38%, 77% y 80%) y el adrenérgicos-α1A (13%, 80% y 81%), para 5, 10 y 20 UI, respectivamente. No hubo cambio significativo en los receptores de andrógenos. En este estudio se comprobó que los mencionados efectos, disminuyeron 2 semanas después del tratamiento con TXB-A; concluyéndose que la inyección de TXB-A en la próstata altera la dinámica celular al inducir la apoptosis, inhibiendo la proliferación y regulando a la baja los receptores adrenérgicos-α1A, además se demostró una disminución dependiente de la dosis en la expresión de los receptores adrenérgicos-α1A.
En otro estudio, pero realizado en perros Chuang et al.,8 informaron que al examen general de la próstata se reveló un tamaño más pequeño y menos endurecido después de la inyección de TXB-A que el control (Figura 1). Las secciones teñidas con hematoxilina y eosina (HE) de la próstata de los animales de control de los grupos de 1 y 3 meses revelaron glándulas hipertrofiadas (Figura 2A). Sin embargo, las secciones teñidas con HE de los animales tratados con TXB-A revelaron una degeneración de las glándulas prostáticas (Figura 2C).
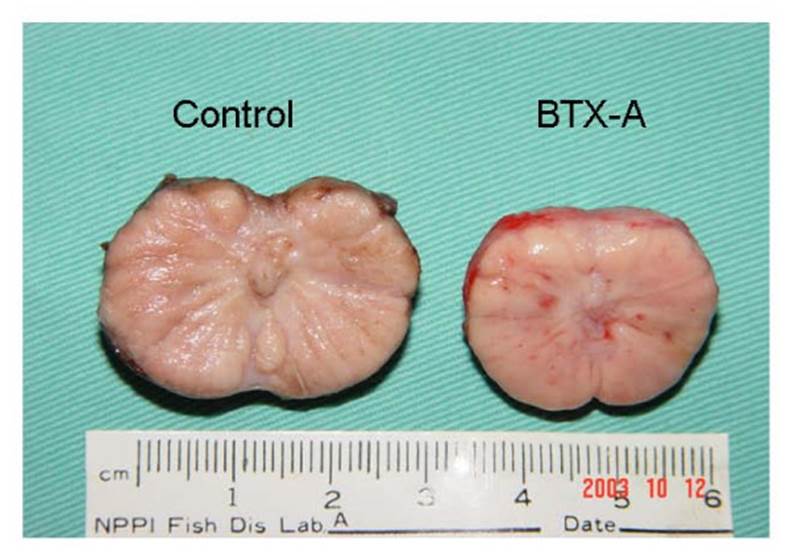
Imagen tomada de: Chuang YC, et al. Intraprostatic injection of botulinum toxin type-A relieves bladder outlet obstruction in human and induces prostate apoptosis in dogs. BMC Urol. 2006;6:12. Licencia https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1481565/
Figura 1 Corte coronal de la próstata canina un mes después de la inyección de TXB-A o solución salina. Reducción de tamaño y menos induraciones después de la inyección de TXB-A (B) que el control (A).8
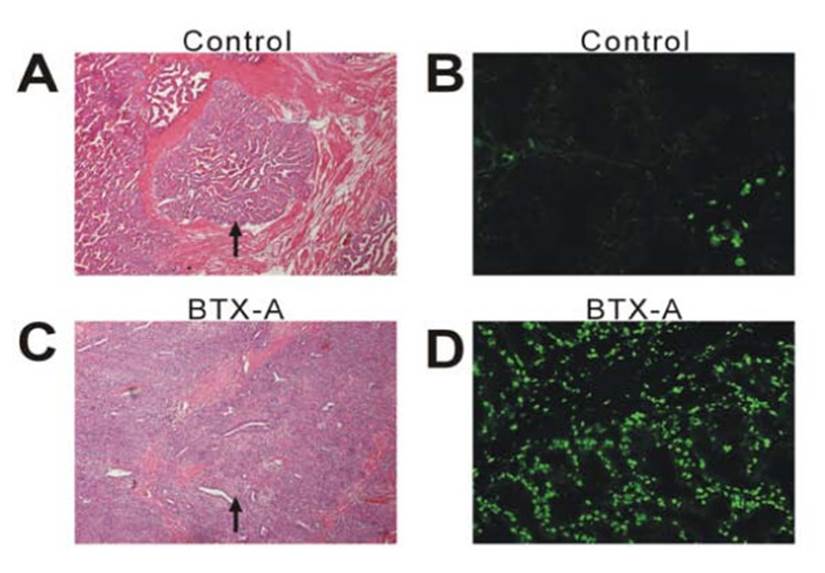
Imagen tomada de: Chuang YC, et al. Intraprostatic injection of botulinum toxin type-A relieves bladder outlet obstruction in human and induces prostate apoptosis in dogs. BMC Urol. 2006;6:12. Licencia https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1481565/
Figura 2 Fotomicrografías y tinción terminal de desoxinucleotidil mediada por desoxiuridina trifosfato nick (TUNEL) tinción de secciones de próstata después de la solución salina (A, B) y TXB-A (C, D) inyección a un mes. Se observó una proliferación glandular significativa con inflado papilar en el lumen en el canino de control (A). Se observó un cambio de atrofia del componente glandular con aplanamiento del epitelio de revestimiento en el canino tratado con TXB-A (C). Muy pocos núcleos apoptóticos son reconocibles en el animal control (B). Se observó una fuerte fluorescencia de los núcleos apoptóticos en el animal tratado con TXB-A a un mes. (A 10 X; C 40 X; B y D 100 X).8
Al investigar los efectos de la inyección intraprostática de la TXB-A en HPB en ratas, Xu et al.,34 hallaron que, en comparación con el grupo de solución salina, los grupos de 5, 10 y 20 UI, mostraron disminuciones significativas en el volumen prostático (P <0.01; 0.01 y 0.05), peso y áreas glandulares e intersticiales, así como epitelios atróficos en el conducto glandular a las 2 semanas. Estos cambios se redujeron a las 4 semanas, especialmente en el grupo de 5 UI.
Ferguson et al.,36investigaron en 18 perros machos sexualmente intactos con HPB el efecto de la TXB sobre los parámetros del semen, para lo cual dividieron aleatoriamente a los perros en tres grupos, los cuales recibieron respectivamente, una inyección intraprostática de solución salina (grupo control), 250 y 500 UI de TXB-A bajo guía ultrasónica transabdominal. Independientemente del tipo de tratamiento, el volumen de esperma, la motilidad progresiva, el vigor, la morfología, la prueba de hinchazón hiposmótica y la tinción fluorescente no cambiaron significativamente durante los períodos evaluados y se mantuvieron en el rango normal descrito para las especies caninas. Por lo cual concluyeron que la inyección intraprostática de 250 o 500 UI de TXB-A no altera los parámetros del semen y los perfiles bioquímicos y de proteínas seminales en plasma de perros con HPB después de 8 semanas de tratamiento.
Lin et al.,19 demostraron que la inyección de 200 UI de TXB-A en la próstata de perros disminuye la presión de la uretra bajo la estimulación de norepinefrina y la electroestimulación en comparación con el grupo de inyección de solución salina normal. Sin embargo, el resultado no se vio en el grupo onabotulinumtoxinA 100 UI. En el estudio histológico, el tejido de la próstata después de la inyección de TXB-A 200 UI mostró más atrofia glandular que el grupo de inyección de TXB-A 100 UI.
3.3. Estudios en humanos
El primer uso de TXB-A en humanos fue informado por Maria et al.,37 en 2003, quienes realizaron un ensayo doble ciego controlado con placebo, en el cual le inyectaron TXB-A como terapia de HPB a 30 hombres que ya no respondían a la medicación oral y se negaron a recibir tratamiento quirúrgico. Los resultados de dicho ensayo permitieron observar que la inyección con 200 UI redujo el volumen prostático a la mitad en un mes y a un tercio a los dos meses. El beneficio fue más notable en pacientes con próstatas más grandes.
Las series de Chuang et al.,38 Silva et al.,39 y Kuo et al.,40 han mostrado diferentes tasas de reducción del volumen de próstata, que van de 13 a 54%. En los estudios de Arnouk et al.,41 y Crawford et al.,42 realizados en humanos, se observó una disminución de hasta el 40% en el tamaño de la próstata y una recurrencia al tamaño del inicio del tratamiento en aproximadamente 18 meses, periodo similar al reportado en 2009 por Silva et al.,43 Por lo cual concluyeron que la atrofia de la glándula prostática grande que sigue a la inyección de 200 UI de TXB-A es transitoria.
En la revisión de Marchal et al.,33 se observó que la reducción del PSA no fue consistente en las diferentes series. Se observó una caída significativa en 10 estudios (41.6%), con una reducción global de 1.15±0.93 ng/ml, con la mayor reducción (7 ng/ml) reportada por Guercini et al.44 Autores como Nikoobakht et al.,45encontraron que la reducción de PSA se mantiene hasta 12 meses, mientras que Park et al.,32observaron diferencias a los 6 meses de postratamiento. En la actualidad, sigue sin estar claro por qué los valores de PSA y el volumen de la próstata no siguen el mismo patrón.
4. Dosis
No existe un enfoque estándar para las dosis aplicadas; en 24 publicaciones sobre el tratamiento de la HBP con TXB-A, las dosis aplicadas oscilaron entre 100 (Onabot-A) y 600 UI (Onabot-A y Abobot-A)33 (ver Tabla 1). Algunos autores utilizaron 100 UI en próstatas pequeñas de volumen (30 cm3),32 mientras que otros, como Jasinski et al.,46 utilizaron la misma dosis sin estratificar a los pacientes por volumen de próstata. Por otro lado, autores como Crawford et al.,47 usaron 100 y 300 UI para determinar la dosis más efectiva. Kuo et al.,48 compararon la efectividad de las dosis de 200 y 600 UI y Nikoobakht et al.,45evaluaron la eficacia de 300 y 600 UI en próstatas de <30 cm3 y >30 cm3, respectivamente. Mirkin et al.,49 para estudiar la seguridad y eficacia de TXB-A emplearon la inyección de 150 UI.
Tabla 1 Dosis/dilución y técnica de la toxina botulínica
| Estudio | Dosis (UI) | Técnica | Dilución/Punto de inserción de la aguja | Anestesia |
|---|---|---|---|---|
| María et al.37 | 200 | Transperineal | 4 ml / ambos lóbulos laterales | No |
| Chuang et al.8 | 200 | Transperineal | 8 ml / ambos lóbulos laterales | Sedación |
| Chuang et al.38 | 100 | Transperineal | 4 ml / ambos lóbulos laterales | Sedación |
| Kuo et al.40 | 200 | Transuretral | 20 ml / ambos lóbulos laterales + lóbulo mediano | General |
| Larson et al.53 | 100 | Transrectal | Base mediana de la próstata + ambos lóbulos laterales. | No |
| Guercini et al.44 | 300 | Transperineal | - | No |
| Park et al.32 | <30 cm3: 100 30-80 cm3: 200 >80 cm3: 300 | Transperineal | 4-9 ml / ambos lóbulos laterales. | No |
| Chuang et al.54 | <30 cm3: 100 >30 cm3: 200 | Transperineal | 4-8 ml / ambos lóbulos laterales. | Sedación / no |
| Sreedar et al.55 | 200 | Transrectal | Ambos lóbulos laterales | No |
| Agrawal et al.56 | 200 | Transperineal | Ambos lóbulos laterales | No |
| Silva et al.39 | 200 | Transrectal | 8 ml / ambos lóbulos laterales | No |
| Jasinski et al.46 | 100 | Transrectal | 4 ml / ambos lóbulos laterales | No |
| Crawford et al.47 | 100/300 | Transrectal | - | No |
| Kuo et al.48 | 200/600 | Transperineal | 10 ml / ambos lóbulos laterales + lóbulo mediano | Local |
| Nikoobakht et al.45 | 300/500 | Transperineal | - | No |
| Mirkin et al.49 | 150 | Catéter de Schelin | Ambos lóbulos laterales | No |
5. Eventos adversos o complicaciones
Crawford et al.,42 como conclusión de un ensayo clínico de fase II, multicéntrico, doble ciego, aleatorizado, de 2 dosis de onaTXB-A en hombres con HPB, informaron que las dosis de 100 y 300 UI cumplen con los criterios de eficacia y seguridad del tratamiento y que cualquiera de las dosis puede ser candidata para un estudio adicional que compare la toxina con el placebo. La dosis de 100 UI puede ser preferible para un ensayo aleatorio debido a una eficacia similar y al potencial de costos reducidos y efectos adversos.
Otros estudios han reportado diluciones variables 4 ml37 a 9 ml32 y 20 ml.40
6. Técnica de inyección de próstata TXB
La aplicación intraprostática de la TXB es un procedimiento ambulatorio mínimamente invasivo que se puede realizar con anestesia local.50 Existen un conjunto de experiencias al respecto, las cuales se resumen en la Tabla 1.
Arnouk et al.,41 plantean que la administración de TXB intraprostáticas se puede realizar mediante abordajes transperineal, transrectal y transuretral, dependiendo de la técnica que mejor dominen los urólogos.
Kuo describió por primera vez el abordaje cistoscópico con anestesia general ligera o sedación.40 En tal sentido, Hamidi et al.,51 describen que la inyección cistoscópica intraprostática de TXB-A podría utilizarse como un método seguro y bien tolerable en el tratamiento de pacientes con HPB.
Bajo visión ecográfica, la TXB-A puede ser inyectada en el parénquima prostático por vía transperineal, transuretral o transrectal, usando una aguja 21-23 G. El abordaje transperineal se ha descrito más frecuentemente;32 las vías transuretral y transrectal también se han usado, pero menos frecuentemente.40,43
La inyección transperineal minimiza el riesgo de infección, pero la inyección transrectal prostática guiada por ultrasonido es el procedimiento con el que los urólogos están más familiarizados en Europa y América del Norte.52
Chuang et al.,8 informaron que en su estudio inyectaron en la próstata en 2-4 lugares diferentes, utilizando una aguja de calibre 21-23 de 15 o 20 cm de largo bajo la guía de un ultrasonido transrectal con vistas trasversales y sagitales para garantizar la colocación adecuada de la aguja, la cual era visible como un punto brillante en el centro de cada lóbulo lateral donde se inyectan 2 ml de TXB en cada lado.
El uso terapéutico de TXB para el tratamiento de la HPB ha demostrado ser seguro y fácil de realizar.57 La TXB tiene un perfil de eventos adversos mínimos y, en general, es bien tolerado por muchos pacientes.5 Hay pocos eventos adversos reportados en la literatura secundaria a la inyección de próstata con TXB.52
En la serie de Arnouk et al.,41 se describe que las complicaciones fueron poco frecuentes y parecían estar relacionadas con la manipulación uretral en lugar de un resultado directo de la inyección de TXB: la hematuria macroscópica se observó en 5.8% de los pacientes, al igual que la retención urinaria transitoria y prostatitis aguda (5.8%). En el estudio de Marberger et al.58 la prostatitis se notificó en 8 de 380 pacientes (2.1%) (7 en el grupo transrectal; 1 en el grupo transperineal).
Un conjunto de series que adoptaron el enfoque transperineal o transrectal no informaron tales complicaciones.6,7
Dada la naturaleza vascular de la próstata, podría ocurrir una absorción sistémica de la toxina. Sin embargo, no se han reportado complicaciones sistémicas después de las inyecciones intraprostáticas, incluso con 300 UI.32
Las principales reacciones adversas notificadas después del tratamiento con TXB-A incluyen síntomas similares a la gripe: náuseas, vómitos, boca seca, hematuria, infecciones relacionadas con la punción, insuficiencia respiratoria leve e incluso parálisis en los casos en que la toxina se inyectó accidentalmente en el torrente sanguíneo.59
Marberger et al.58 desarrollaron un estudio aleatorizado, doble ciego, controlado con placebo de Fase II de dosis de onaTXB-A en hombres con HPB (380 individuos con tratamiento por vía transperineal) y se concluyó que el tratamiento con onaTXB-A fue bien tolerado, sin ninguna interferencia en la función sexual, lo cual es similar a lo obtenido por Sacco et al.,60 los cuales reportaron que en su muestra de estudio no hubo modificaciones sexuales, tales como cambios en la función eyaculatoria.
Asimismo, Silva et al.,61 observaron que la inyección intraprostática de TXB-A no produce un deterioro de ningún dominio de la función sexual, tales como la funciones eréctil, orgásmica o eyaculatoria y no cambia la líbido.
Similares resultados se han obtenido en estudios experimentales con perros, como el realizado por Mostachio et al.,57 quienes describieron que el tratamiento con 250 UI no afecto la libido y la calidad del semen en perros con HPB.
Conclusiones
La toxina botulínica puede inducir la involución prostática en ratas, perros y humanos sin causar inflamación local o efectos secundarios sistémicos significativos, lo cual debería estimular nuevas investigaciones sobre su efecto en lesiones de próstata tanto benignas como malignas ya que con la evidencia actual es posible plantear ensayos clínicos correctamente diseñados dirigidos a experimentar su acción en el cáncer de próstata.











 nueva página del texto (beta)
nueva página del texto (beta)


