Antecedentes
La enfermedad de Von Hippel Lindau fue descrita por primera vez por el alemán Eugen Von Hippel, quien estudió los hemangiomas retinianos, y el patólogo sueco Arvid Lindau quien detectó una conexión entre hemangioblastomas cerebelares, hemangioblastomas retinianos y otros tumores viscerales.1,2 Sin embargo, fue hasta 1993 cuando fue mapeado, encontrando su locus en el gen 3p2526.3 Es una entidad poco común con una incidencia de 1 en cada 36,000 nacidos vivos que no cuentan con antecedentes familiares de la enfermedad.4 En pacientes sin antecedentes familiares de esta patología la mutación del gen VHL es responsable de producir el 50% de los hemangioblastomas retinianos, 33% de hemangioblastomas cerebelosos, 1% de cáncer renal de células claras y 11% de los feocromocitomas. En las familias ya diagnosticadas se requiere consejo genético, ya que tiene un patrón de herencia autosómico dominante, con probabilidad de 50% de herencia en cada embarazo y por si fuera poco tiene una penetrancia de hasta el 90%, por lo que 9 de cada 10 portadores presentan por lo menos un síntoma tumoral antes de los 65 años de edad.5
La fisiopatología parte de entender que el gen VHL (un supresor tumoral), es parte de un complejo multiproteico que incluye elonguina B, elonguina C y cullina 2 (cul2). Este complejo es normalmente responsable de la ubiquitinación y degradación de las subunidades α de los factores inducibles por hipoxia 1 y 2. En hipoxia las prolinas no pueden modificarse y pVHL no puede unirse a su ligando, igual que cuando se encuentra ausente o mutado activa la respuesta del gen hipóxico que desencadena la transcripción de un gran repertorio de genes implicados en procesos de angiogénesis, proliferación celular, apoptosis y de metabolismo celular. También se presenta aumento de la expresión de factores tumorales que se asocia con el desarrollo de neoplasias altamente vascularizadas (por secreción desmedida de VEFG), observadas en esta entidad.6
Las manifestaciones clínicas asociadas a la enfermedad son múltiples, desde hemangioblastomas retinianos, hemangioblastoma cerebeloso y espinal, quistes renales, carcinoma renal de células claras (CRCC), hemangioma hepático, quistes pancreáticos, adenoma seroso microquístico pancreático, tumores neuroendocrinos pancreáticos, y tumores del saco endolinfático.7
En 1964, Melmon y Rosen sugirieron criterios diagnósticos que continúan vigentes. La enfermedad se clasifica según la presencia o no de feocromocitoma, el tipo 1 no cuenta con él, y tipo 2 que lo tiene presente se encuentra subclasificado en el tipo 2a con feocromocitoma, otros tumores abdominales, pero sin cáncer renal. El tipo 2b cuenta con ambos (tumor renal de células claras y feocromocitoma) y tipo 2c que solo cuenta con feocromocitoma.7 Según estudios retrospectivos y de reportes de caso, la manifestación tumoral que causa la mayor tasa de mortalidad es el cáncer renal de células claras.
Caso clínico
Se trata de femenino de 45 años originaria del estado de Oaxaca, como antecedentes de importancia refiere madre fallecida por tumor cerebral no especificado, hermano fallecido por cáncer renal de células claras, 2 sobrinas con diagnóstico de hemangioblastomas retinianos, 3 hermanos con diagnóstico de cáncer renal de células claras.
Dentro de sus antecedentes patológicos refiere diagnóstico de hipertiroidismo hace 14 años tratada con iodo radioactivo y desde entonces se indicó levotiroxina por hipotiroidismo secundario.
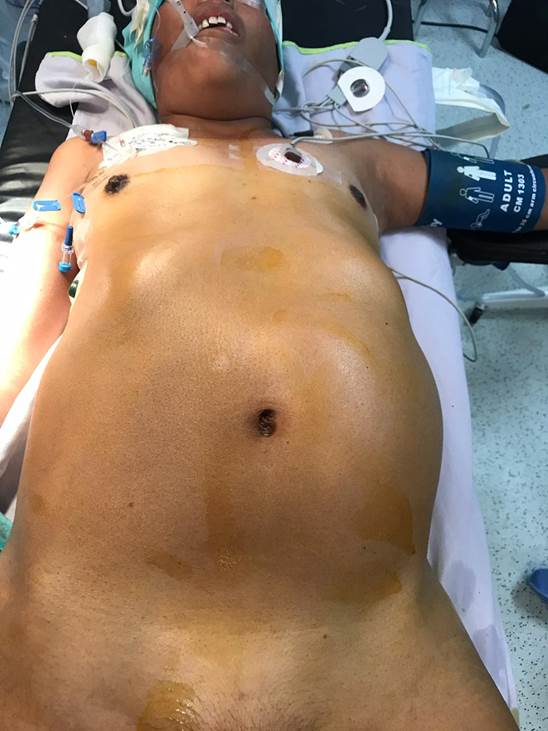
Inició su padecimiento un año previo a su diagnóstico presentando astenia, adinamia y distensión abdominal progresiva, sin embargo, al acudir a facultativo externo se asoció a la enfermedad tiroidea. A pesar del manejo presentó aparición de una tumoración en la región del flanco izquierdo con crecimiento progresivo. Por tal razón acudió a nuestra unidad donde se inició el abordaje diagnóstico, a través de la exploración física se encontró un abdomen globoso a expensas de tumoración de 25 por 15 cm en flanco izquierdo, desde el borde subcostal hasta 5 cm por debajo de cicatriz umbilical, dolorosa a la palpación y fija a planos profundos (Figura 1).
Se solicitó una tomografía de abdomen simple y contrastada donde se encontró una neoplasia renal primaria izquierda con depósitos quísticos en páncreas, quiste renal derecho Bosniak I y ectasia pielocalicial izquierda (Figura 2 y 3). Posterior a completar su protocolo de estudio se realizó una nefrectomía radical izquierda por línea media con hallazgos de tumoración de 20 por 19 por 15 (Figura 4) cm de diámetro, sangrado transquirúrgico de 250 ml sin complicaciones. Pasó posteriormente a recuperación postquirúrgica y se mandó el espécimen a análisis histopatológico que reportó carcinoma convencional de células claras con citoplasma amplio y aparentemente vacío, núcleos centrales grado 2; los límites celulares bien definidos, pero sin reforzamiento de la membrana citoplasmática. (Figura 5 y 6)
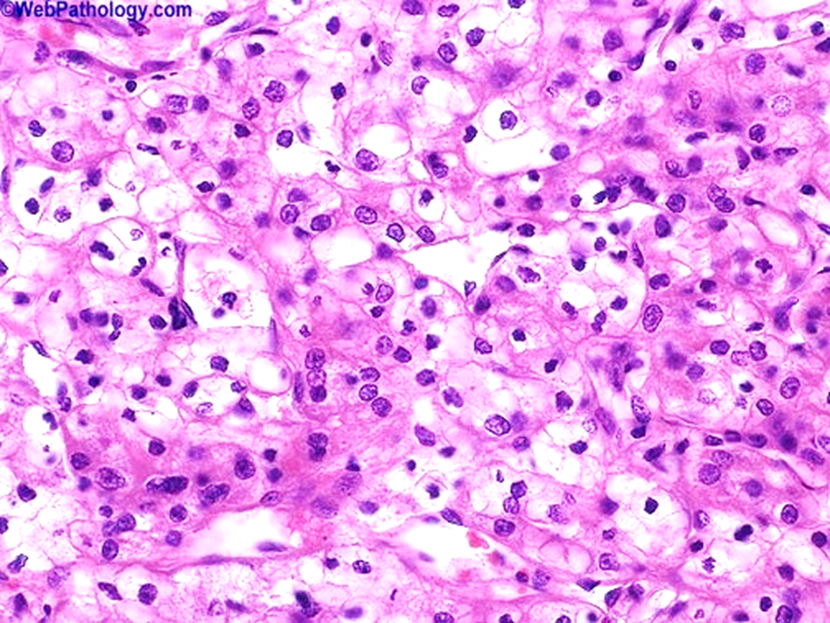
Figura 6 Corte con tinción de hematoxilina y eosina que muestra un carcinoma convencional de células claras.
En su seguimiento posoperatorio se tomó resonancia magnética nuclear con hallazgos de hemangioblastoma cerebeloso y en análisis por oftalmología se descartó la presencia de hemangioblastomas retinianos. En la valoración genética se concluyó enfermedad de von Hippel Lindau tipo I.
Discusión
El tumor renal de células claras es la causa más común de muerte en pacientes con enfermedad de VHL, y representa más del 50% de las muertes. Los pacientes también son propensos al riesgo de una cirugía extensa con graves consecuencias a largo plazo desarrollando lesión renal con necesidad de sustitución de la función a través de hemodiálisis o diálisis peritoneal.8 La edad media al momento del diagnóstico es de 40 años, sin embargo, se ha informado que se produce en niños de hasta 16 años; con una incidencia de por vida para las formas fenotípicas más comunes de la enfermedad (subtipos 1 y 2b) de alrededor del 70% con una mayor probabilidad de desarrollar tumores bilaterales múltiples.9
Los genes mutados con mayor frecuencia en el cáncer renal de células claras fueron los reguladores de cromosomas e histonas PBRM1, SETD2 y BAP1.10 En el tumor renal las mutaciones de TCEB1 que anulan la unión de elonguina B a VHL aumentan la expresión de HIF-α, que es determinante para que se produzcan tumores renales. Dichas teorías genéticas se han demostrado en modelos animales como el pez cebra en donde se inactivó el gen VHL utilizando ksp-cre y se dio seguimiento encontrando que a los 6 meses se producen cambios con aumento de colágeno y quistes, y en un plazo de 10 meses se generan cambios compatibles con cáncer renal de células claras.11
Los carcinomas renales de células claras crecen lentamente y los tumores pequeños menores de 3 cm tienen un riesgo bajo de metástasis, que ocurren con predominancia al hueso, pulmón e hígado. Actualmente, se recomienda la vigilancia activa hasta un tamaño umbral de 3 a 4 cm para la intervención quirúrgica, lo que da como resultado una tasa de supervivencia sin recurrencia del 76% a los 5 años y del 20% a los 8 años.12,13 Los pacientes con cáncer renal pueden desarrollar hematuria, dolor ardoroso lumbar o una masa palpable como signo o síntoma de presentación, sin embargo, puede manifestarse como en este caso, como una tumoración abdominal de crecimiento progresivo sin ningún otro tipo de síntoma.
Una vez que se presenta de forma esporádica o cuando ya se conocen antecedentes familiares del Von Hippel Lindau el estudio de elección para detección de las neoplasias tanto en sistema nervioso central como en abdomen es la resonancia magnética nuclear con gadolinio. Quienes padecen la enfermedad deben de ser abordados por un equipo multidisciplinario que incluye al especialista en genética, oftalmólogo, neurólogo, neurocirujano, cirujano oncólogo y psicología. Una vez detectada alguna de las manifestaciones clínicas de esta enfermedad, debe iniciarse el consejo genético para investigar a la familia e iniciar la vigilancia en los casos con mayor propensión a presentar alguna neoplasia. Se han hecho esfuerzos para detectar la enfermedad con prontitud y en la actualidad se dispone de pautas que establecen la prevención a desarrollar. Anualmente se debe de realizar un examen clínico neurológico, consulta de vigilancia y consejo con nefrología, vigilancia por endocrinología y examen de metanefrinas en orina, escaneo espinal y cerebral, examen oftalmológico y resonancia magnética nuclear de abdomen.14 Sin embargo, este tipo de estrategias en una población tan desprotegida, tal como la paciente descrita antes, son difíciles de realizar por la dificultad de acceso a los servicios de salud. En este caso la tumoración alcanzó grandes dimensiones debido al desconocimiento de la enfermedad a pesar de los antecedentes familiares, la dificultad de acceso a los servicios de salud especializados y a los síntomas escasos de la enfermedad.
Conclusiones
La enfermedad de Von Hippel Lindau es un trastorno genético relacionado con mutaciones en genes supresores de tumores, que como expresión clínica desarrolla múltiples neoplasias, de las cuales el carcinoma renal de células claras es el que presenta mayor morbimortalidad. Su diagnóstico es complejo cuando se desconoce el antecedente familiar, hay dificultad de acceso a atención médica especializada o cuando no existen síntomas tempranos que obliguen a buscar atención medica; por lo que se considera una entidad de baja incidencia y alto impacto en morbimortalidad. Deben de crearse estrategias económicas y eficaces enfocadas a este tipo de población para detectar de manera precoz las neoplasias con mayor morbimortalidad, ofertar tratamiento menos invasivo y curativo, y al mismo tiempo estudiar a los familiares que puedan estar afectados, para de esta manera establecer una vigilancia estrecha.











 nueva página del texto (beta)
nueva página del texto (beta)