Introducción
El cáncer de próstata es la neoplasia más frecuente en hombres mayores de 50 años en todo el mundo. En 2012, aproximadamente 1.1 millones de hombres fueron diagnosticados con cáncer de próstata, con una tasa de mortalidad de 5,1 por 100000 habitantes1. En México, la incidencia de cáncer de próstata es de 35.5 por 100000 habitantes, con una tasa de mortalidad de 9.4 por 100000 muertes debido a complicaciones relacionadas con el cáncer de próstata2-5.
El cáncer de próstata resistente a la castración metastásico (mCRPC, por sus siglas en inglés) se refiere a la situación en que la neoplasia prostática progresa a pesar de una privación adecuada de andrógenos. La mCRPC puede evidenciarse mediante la progresión bioquímica (niveles elevados de antígeno prostático específico; APE) o síntomas clínicos sugestivos. Las opciones terapéuticas incluyen manipulaciones hormonales, inhibición suprarrenal o uso de corticosteroides.6
El acetato de abiraterona proporciona inhibición suprarrenal, actuando como un inhibidor clase I del citocromo P-450c17, una enzima crítica en la síntesis de andrógenos extragonadales y testiculares. Se ha observado que este fármaco proporciona un beneficio potencial, ya sea en las etapas anteriores o posteriores a la quimioterapia. Mientras que otros factores, como el puntaje de Gleason, se han descrito como modificadores de la respuesta clínica. El acetato de abiraterona ha mostrado una eficacia particular en la población con mCRPC que ha desarrollado metástasis radiológicas y/o clínicas, con manifestación de síntomas leves y sin dolor significativo. Los datos de los ensayos clínicos de fase III muestran que el acetato de abiraterona puede retrasar el tiempo hasta la progresión radiológica y bioquímica en pacientes refractarios a la castración, con tendencia a mejorar la sobrevida general. Por lo tanto, el acetato de abiraterona representa una terapia prometedora para los pacientes con mCRPC, potencialmente útil para aquellos pacientes vírgenes a quimioterapia, que mantienen una condición general aceptable.7-9
A pesar de las expectativas, la experiencia clínica con acetato de abiraterona en Latinoamérica es escasa. Algunos estudios en países latinoamericanos sugieren un costo-beneficio efectivo como terapia oncológica, y con menos efectos secundarios;10,11 mientras que otros estudios plantean controversias en sus beneficios.12,13
En la población mexicana no hay informes previos con respecto a los beneficios terapéuticos o evidencias de su uso en el mundo real. En el presente estudio se analizó la experiencia clínica obtenida en pacientes con mCRPC vírgenes a quimioterapia, que fueron tratados con acetato de abiraterona en el Centro Médico Nacional “20 de Noviembre”, ISSSTE, México. También exploramos el efecto de algunos factores pronósticos como el puntaje de Gleason.
Material y Métodos
Resumen del Estudio
Se realizó un estudio observacional de una cohorte prospectiva en el Centro Médico Nacional “20 de Noviembre”, ISSSTE, Ciudad de México. Todos los datos se obtuvieron de los expedientes clínicos desde enero de 2014 hasta diciembre de 2016. También se realizó una comparación de nuestros resultados con aquellos obtenidos en reportes previos relacionados a la experiencia con el uso de acetato de abiraterona. Además, se exploró la influencia de los factores pronósticos descritos anteriormente. El Comité de Ética Institucional autorizó este estudio (ID304.2016) y el protocolo se sometió a ClinicalTrials.gov (publicación en proceso). Todos los procedimientos cumplieron con las pautas éticas del Comité de investigación local de acuerdo con la Declaración de Helsinki revisada versión 1975.
Población del Estudio
Los pacientes fueron reclutados consecutivamente. Los criterios de inclusión fueron: edad ≥ 18 años, diagnóstico de adenocarcinoma de próstata metastásico, confirmado por histología e imagen diagnóstica que incluye tomografía computarizada y gammagrafía ósea; y que además fueran vírgenes a quimioterapia. La resistencia a la castración se definió de acuerdo con las recomendaciones del Grupo de Trabajo de Ensayos Clínicos sobre el Cáncer de Próstata (PCWG2).14 Se excluyeron los pacientes con metástasis viscerales y/o terapia previa con ketoconazol durante más de 7 días. Se recolectaron datos demográficos, marcadores clínicos como la puntuación de Gleason y valor de APE; así como el tiempo de castración y valores de laboratorio de rutina. Los eventos adversos fueron vigilados y registrados durante el desarrollo del estudio.
Tratamiento
El acetato de abiraterona se administró a una dosis de 1000 mg vía oral, una vez al día; combinado con prednisona 10 mg vía oral, una vez al día; y leuprolide 22.5mg subcutáneo cada 3 meses. El acetato de abiraterona se asignó como medicación abierta. No se incluyó población control. En su lugar, se realizó la comparación con los informes históricos ya publicados.
Evaluaciones
De acuerdo con la evaluación primaria, se consideró progresión si: a) el APE aumentó al menos 50% con respecto al valor inicial, o b) hubo progresión radiológica o, c) evidencia de metástasis en los tejidos blandos mediante una tomografía computarizada con o sin progresión de APE; de acuerdo con los criterios de evaluación de respuesta modificada en tumores sólidos (RECIST) y criterios de PCWG2.14
El impacto del uso de acetato de abiraterona se evaluó mediante las siguientes evaluaciones primarios: a) el tiempo para la progresión radiológica y b) la sobrevida global. Las evaluaciones secundarias fueron: a) el tiempo para el descenso del puntaje ECOG, b) el tiempo para iniciar quimioterapia citotóxica, c) el tiempo para el uso de analgésicos y d) el tiempo para la progresión del APE. Además, comparamos todas estas variables en subgrupos divididos según la puntuación de Gleason (valor de corte = 7).
Análisis estadístico
Las variables categóricas se muestran como número total y porcentaje. Las variables continuas se muestran una mediana y percentiles (p25-p75). Los análisis de las evaluaciones primarias y secundarias se realizaron utilizando la curva de Kaplan-Meier. La diferencia entre los subgrupos divididos por el puntaje de Gleason se determinó mediante la prueba de Log-Rank. Finalmente, se discutió la comparación de la eficacia y la seguridad con los reportes previos, ya publicados. Los datos se analizaron con el software SPSS versión 22 (SPSS INC., Chicago, IL, EE. UU.).
Resultados
Este estudio de la vida real incluyó a 18 pacientes que comenzaron el tratamiento a partir de enero de 2014, que fueron seguidos durante un período de 20 meses (tiempo medio de seguimiento de 18 meses). La mayoría de la población del estudio (94,4%) fueron mayores de 65 años, sus características se muestran en el cuadro 1. No se incluyó ninguna población control sin tratamiento. En su lugar, se realizó una comparación con reportes de la literatura ya publicados. Las evaluaciones clínicas se realizaron mensualmente durante los primeros 3 meses, y cada 2 meses a partir de entonces. Mientras que las evaluaciones de laboratorio y/o imagen se realizaron mensualmente.
Tabla 1 Características de la Población (n=18)
| Edad (mayor a 65 años) | 17 (94.4) |
| ECOG Basal | |
| Score 0 | 14 (77.7) |
| Score 1 | 4 (22.3) |
| Método Diagnóstico | |
| TRUS | 12 (66.6) |
| TURP | 6 (33.4) |
| Terapia Hormonal Previa | |
| Goselerina | 9 (50.0) |
| Acetato de Leuprolida | 7 (38.8) |
| Otros (*) | 2 (11.2) |
| Tiempo para la Resistencia a la Castración | |
| < 2 años | 7 (38.8) |
| ≥ 2 años | 11 (61.2) |
| Tiempo de inicio de acetato de abiraterona | |
| 0 años | 10 (55.5) |
| 1 año | 5 (27.7) |
| 2 años | 3 (16.6) |
| Gammagrama Basal | |
| No metastático | 2 (11.1) |
| Oligometástatico | 8 (44.4) |
| Multimetástatico | 8 (44.4) |
| Gleason Basal | |
| Score ≤ 7 | 7 (38.9) |
| Score > 7 | 11 (61.1) |
| APE basal (ng/dL) | 22.5 (9.9 - 32.2) |
| Enzimas Hepáticas Basales | |
| AST | 22.0 (20.2 - 25.7) |
| ALT | 22.0 (16.0 - 27.0) |
| AP | 95.5 (83.0 - 181.5) |
| Electrolitos Basales | |
| Na | 142.0 (139.8 - 143.3) |
| K | 4.2 (4.0 - 4.4) |
Las variables se muestran como número de pacientes (%) o mediana y percentiles (p25-p75). Abreviaturas: TRUS, ultrasonido transrectal; TURP, resección transuretral de próstata. (*) Otros: degarelix o una combinación de acetato de leuprolida con bicalutamida, ya que estos medicamentos se administraron inicialmente pero luego ya no estaban disponibles.
Respecto a los puntos finales primarios, 2 casos (11,1%) desarrollaron progresión radiológica después de 7 y 10 meses; mientras que 1 caso (5,5%) falleció después de 9 meses de seguimiento, debido a insuficiencia respiratoria (Figura 1).
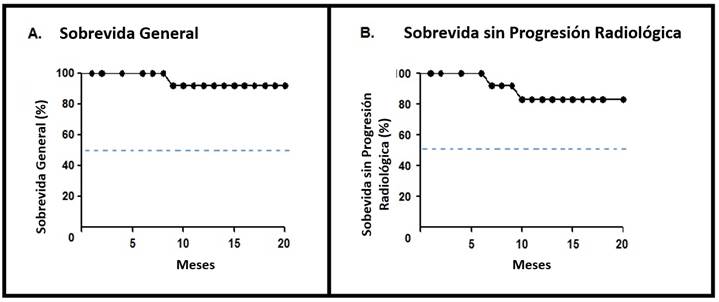
Figura 1 Análisis de Kaplan-Meier de la Evaluación Primaria. El panel A muestra datos de la sobrevida general, y el panel B muestra datos de la sobrevida libre de progresión radiológica. La línea discontinua azul en los paneles A y B indica el valor de la mediana de pacientes.
Durante la evaluación secundaria, se observó la necesidad temprana de uso de analgésicos, ya que más de la mitad de la población requería opiáceos o AINE a los 10 meses de tratamiento. Del mismo modo, otras evaluaciones secundarias como el inicio de la quimioterapia, la elevación del ECOG y/o del APE indicaron la progresión de la enfermedad, en menos de la mitad de la población durante todo el tiempo del estudio (Figura 2).
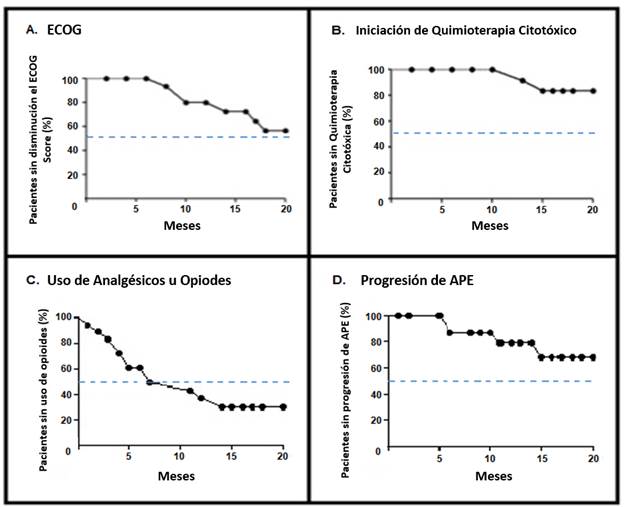
Figura 2 Análisis de Kaplan-Meier de la Evaluación Secundaria. Panel A, disminución del puntaje de ECOG. Panel B, tiempo de inicio de la quimioterapia citotóxica. Panel C, Tiempo hasta el inicio de uso analgésico, ya sea AINE u opiáceos, dependiendo de la disponibilidad institucional de la terapia analgésica. Panel D, tiempo hasta la progresión del APE. La línea azul discontinua indica el valor de la mediana de pacientes.
Para probar el efecto de la puntuación de Gleason en la evaluación secundaria, se realizó una comparación estratificada. Curiosamente, observamos un inicio más temprano de la quimioterapia, así como progresión más rápida de ECOG y uso de analgésicos en el subgrupo de Gleason >7, mientras que el APE aparentemente no se modificó por la puntuación de Gleason (Figura 3).
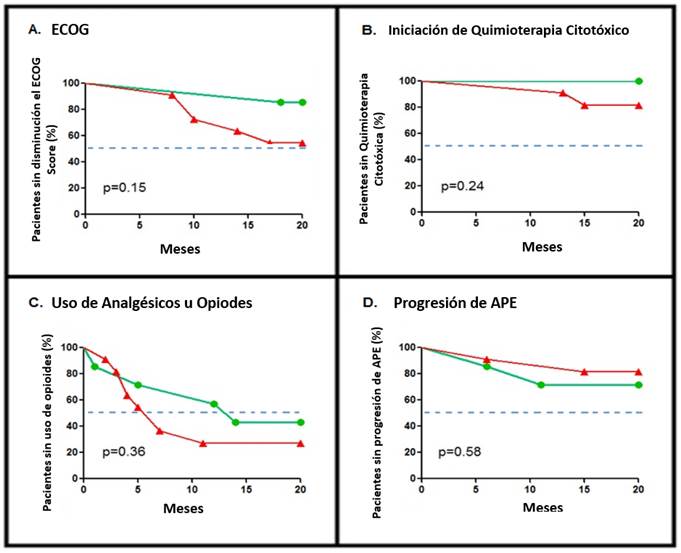
Figura 3 Análisis de Kaplan-Meier de la Evaluación Secundaria según la Estratificación por Puntaje de Gleason. Panel A, disminución del puntaje de ECOG. Panel B, tiempo de inicio de la quimioterapia citotóxica. Panel C, tiempo hasta el inicio de uso analgésico, ya sea AINE u opiáceos, dependiendo de la disponibilidad institucional de la terapia analgésica. Panel D, tiempo hasta la progresión del APE. La línea azul discontinua indica el valor de la mediana de pacientes. Símbolos: -▲- representa Gleason> 7, -●- Gleason ≤7.
Los eventos adversos se resumen en los cuadros 2a y 2b. Trece (72,2%) pacientes bajo tratamiento con acetato de abiraterona mostraron eventos adversos, pero ninguno de ellos se asoció con la muerte. La fatiga, el dolor de espalda y sofocos fueron algunos de los eventos adversos notificados con mayor frecuencia. No hubo eventos relacionados con la enfermedad cardiovascular ni desequilibrios hidroelectrolíticos significativos (hipopotasemia, retención de líquidos o edema); lo que sugiere que la terapia con acetato de abiraterona fue razonablemente segura.
Tabla 2 Efectos Adversos (n=18)
| Eventos Adversos Generales | ||
| Fatiga (grado 1) | 5 (28.0) | |
| Dolor de espalda (grado 2) | 3 (17.0) | |
| Artralgia (grado 1) | 2 (11.0) | |
| Nauseas (grado 1) | 2 (11.0) | |
| Estrenimiento (grado 1) | 2 (11.0) | |
| Rubor (grado 1) | 3 (11.0) | |
| Diarrea (grado 1) | 1 (6.0) | |
| Dolor oseo (grado 2) | 2 (11.0) | |
| Espasmo muscular (grado 1 a 4) | 0 (0.0) | |
| Tos (grado 1) | 2 (11.0) | |
| Efectos adversos de interés especial | ||
| Retencion de liquidos o edema (grado 1) | 2 (11.0) | |
| Hipokalemia (grado 1 a 4) | 0 (0.0) | |
| Hipertension (grado 1 a 4) | 0 (0.0) | |
| Trastorno cardiaco (grado1 a 4) | 0 (0.0) | |
| Aumento de ALT (grado 1 y 2) | 8 (44.0) | |
| Ningún evento adverso | 5 (27.7) | |
Las variables se muestran como número de pacientes (%). El grado de severidad de cada efecto adverso se evaluó de acuerdo a las definiciones propuestas por “National Cancer Institute Common Terminology Criteria for Adverse Events 5.0 toxicity scale Abreviaturas: ALT, alanina aminotransferasa.
Discusión
En nuestra serie, ni el punto final primario de la supervivencia general ni la progresión radiológica alcanzaron la mediana. Estudios similares de la terapia con acetato de abiraterona en pacientes con mCRPC vírgenes a quimioterapia han informado una media de supervivida global alrededor de 13,6 meses; mientras que el periodo libre de progresión radiológica varía entre 9,5 a 16,5 meses.8,15 De esta forma, podemos considerar nuestros resultados como comparables o incluso mejores que los estudios publicados con el mismo tiempo de seguimiento. Esto podría explicarse debido a las características de la población, tales como los valores más bajos de Gleason y ECOG; así como la falta de terapia previa con ketoconazol; y finalmente, no podemos descartar un posible error de tipo II.
En cuanto a la evaluación secundaria, la disminución del ECOG y la progresión del APE no alcanzaron la mediana en nuestro estudio. Esto es contrario a lo observado en estudios previos, donde se ha observado una disminución del ECOG a los 12.3 meses y una progresión de APE que varía entre 6.8 y 1.1 meses.8,15 En nuestro estudio no se puede descartar un posible efecto de los valores basales de ECOG y/o de un tamaño de muestra limitado. Por otro lado, no se observaron diferencias con respecto al inicio de la quimioterapia, ni en el periodo libre de uso de analgésicos, que fue de 7 meses; un tiempo más temprano en comparación a otros estudios. La posible explicación del uso analgésico más temprano es que este medicamento se inició con base en el dolor subjetivo, según lo informado por el paciente, mientras que la correlación con la progresión radiológica o el dolor relacionado con el cáncer puede no ser siempre confiable.
Es bien sabido que la puntuación de Gleason tiene capacidad predictiva para la supervivencia general en el cáncer de próstata. De hecho, la puntuación de Gleason ≤6 se ha considerado de bajo riesgo.16,17 Por lo tanto, exploramos el efecto de estratificar nuestra serie según la puntuación de Gleason. De manera interesante, encontramos que la puntuación de Gleason >7, considerada como de riesgo intermedio o alto, se asoció con una disminución temprana del ECOG, el inicio de la quimioterapia citotóxica y el uso de analgésicos. Sin embargo, la puntuación de Gleason >7 no pareció afectar la progresión del APE en nuestro estudio. Estudios anteriores han encontrado que la puntuación de Gleason >7 se asoció significativamente con la progresión del APE,18 así como el APE mostró una elevada capacidad diagnóstica para discriminar la puntuación de Gleason >7.19 Por el contrario, otros estudios han encontrado una correlación no significativa entre la agresividad del tumor de próstata, evaluada por la puntuación de Gleason y los niveles de APE.20 La controversia en la relación del APE con el puntaje de Gleason puede explicarse por las variaciones del APE en función de la etnicidad, su diferente producción según el grado de diferenciación, tamaño tumoral; y/o debido a las diferencias en el diseño de los estudios.20,21
Finalmente, podemos considerar que el acetato de abiraterona fue una terapia segura, ya que menos de un tercio de la población mostró un evento adverso potencialmente asociado al uso de acetato de abiraterona. Todos los eventos adversos ocurrieron en grado leve, y los más frecuentes fueron fatiga, dolor de espalda y sofocos, lo cual es consistente con informes anteriores.8,22,23 Sin embargo, se observó un mayor número de casos con aumento de ALT en comparación con otras series. Esto podría deberse a la susceptibilidad genética del CYP17 para daño hepático, como se puede deducir de los polimorfismos del CYP17, que varían según las características étnicas, y se han asociado con elevación de enzimas hepáticas y desarrollo de hepatocarcinoma.24-26
Conclusiones
En un escenario del mundo real, la terapia con acetato de abiraterona mostró un perfil de eficacia y seguridad comparables con reportes de ensayos clínicos controlados en pacientes con mCRPC vírgenes a quimioterapia; lo cual sugiere su papel como opción terapéutica en poblaciones similares.











 nueva página del texto (beta)
nueva página del texto (beta)


