Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Ingeniería agrícola y biosistemas
versão On-line ISSN 2007-4026versão impressa ISSN 2007-3925
Ing. agric. biosist. vol.14 no.1 Chapingo Jan./Jun. 2022 Epub 24-Out-2022
https://doi.org/10.5154/r.inagbi.2021.09.110
Artículo científico
Propiedades fisicoquímicas y antifúngicas de películas activas de gelatina-carboximetilcelulosa con extracto de cáscara de coco
1Instituto Politécnico Nacional, Centro de Investigación en Ciencia Aplicada y Tecnología Avanzada - Unidad Legaria. Calzada Legaria, núm. 694, colonia Irrigación, Ciudad de México, C. P. 11500, MÉXICO.
2Universidad Autónoma Chapingo, Departamento de Ingeniería Agroindustrial. Carretera México-Texcoco km 38.5, Texcoco, Estado de México, C. P. 56230, MÉXICO.
Introducción:
La formulación de envases bioactivos representa una alternativa innovadora para controlar el desarrollo de microorganismos que afectan la vida de anaquel de los alimentos.
Objetivo:
Evaluar el efecto de un extracto de cáscara de coco incorporado a películas biopoliméricas de gelatina-carboximetilcelulosa sobre sus propiedades fisicoquímicas y antifúngicas, para determinar su uso potencial como material de envase de productos hortofrutícolas.
Metodología:
Se prepararon películas de gelatina-carboximetilcelulosa con diferentes concentraciones de extracto de cáscara de coco y se determinó su espesor, propiedades mecánicas (fuerza de punción y resistencia a la tensión), físicas (permeabilidad al vapor de agua) y microestructurales, color, FTIR, transmitancia de luz UV, opacidad y actividad antifúngica in vitro.
Resultados:
Se observaron cambios en las propiedades mecánicas, físicas y microestructurales dependiendo de la concentración del extracto. El color se modificó por efecto del extracto, observándose mayor opacidad y menor transmitancia de luz conforme aumentó su concentración. En los espectros FTIR se observaron interacciones intermoleculares entre los biopolímeros y los componentes del extracto. Las pruebas in vitro demostraron capacidad inhibitoria en el crecimiento de Aspergillus niger y Rhizopus stolonifer.
Limitaciones del estudio:
El efecto del aditivo de cáscara de coco solo aplica para las condiciones de extracción utilizadas.
Originalidad:
No existen estudios que sustenten la capacidad antifúngica del extracto de cáscara de coco incorporado en películas biopoliméricas.
Conclusiones:
Se obtuvieron películas activas de gelatina-carboximetilcelulosa con actividad antifúngica. Las propiedades físicas y estructurales de las películas las hacen aptas para ser empleadas como material de envase para productos hortofrutícolas.
Palabras clave matriz biopolimérica; fitopatógenos; extracto antimicrobiano; propiedades de barrera; propiedades mecánicas
Introduction:
The formulation of bioactive packaging represents an innovative alternative to control the development of microorganisms affecting the shelf life of foods.
Objective:
The aim of this study was to analyze the effect of a coconut shell extract added to gelatin-carboxymethylcellulose biopolymeric films on their physicochemical and antifungal properties to determine their potential use as packaging material for fruit and vegetable products.
Methodology:
Gelatin-carboxymethylcellulose films were prepared with different concentrations of coconut shell extract and their thickness, mechanical (puncture force and tensile strength), physical (water vapor permeability) and microstructural properties, color, FTIR, UV light transmittance, opacity and in vitro antifungal activity were determined.
Results:
Changes in mechanical, physical and microstructural properties were observed depending on the concentration of the extract. The color was modified by the effect of the extract, with higher opacity and lower light transmittance as its concentration increased. Intermolecular interactions between the biopolymers and the extract components were observed in the FTIR spectra. In vitro tests showed inhibitory capacity on the growth of Aspergillus niger and Rhizopus stolonifer.
Limitations of the study:
The effect of the coconut shell additive only applies to the extraction conditions used.
Originality:
There are no studies supporting the antifungal capacity of coconut shell extract added to biopolymer films.
Conclusions:
Active gelatin-carboxymethylcellulose films with antifungal activity were reported. The physical and structural properties of the films make them suitable for use as packaging material for fruit and vegetable products.
Keywords biopolymeric matrix; phytopathogens; antimicrobial extract; barrier properties; mechanical properties
Introducción
La pandemia de COVID-19 provocó un incremento en la perturbación ambiental debido al uso excesivo de materiales plásticos, tanto en los alimentos como para protección personal (Benson et al., 2021). La creciente demanda de alimentos envasados ha aumentado el consumo de envases de un solo uso (Janairo, 2021). Por ello, diversas investigaciones se han enfocado en el desarrollo de envases biodegradables, biocompostables y amigables con el ambiente (Zhang & Sablani, 2021).
Las películas biopoliméricas representan una alternativa de envase ecológico. Estas películas están formadas por matrices de biopolímeros con diferentes funcionalidades, como propiedades de barrera frente a la humedad, acarreadoras de sustancias activas y biocompatibilidad para contener diversos alimentos. Entre las ventajas que presentan las películas elaboradas con biopolímeros se encuentra la rápida biodegradabilidad en el ambiente (Trajkovska-Petkoska et al., 2021).
La gelatina es uno de los biopolímeros más versátiles en la formación de películas. Este polipéptido, a través de sus propiedades de gelificación, se combina fácilmente con lípidos y carbohidratos para formar una red polimérica (Tyuftin & Kerry, 2021). Asimismo, se ha demostrado que las películas de gelatina permiten incorporar diferentes tipos de aditivos, esto con la finalidad de extender la vida de anaquel de productos alimenticios a través de la reducción del crecimiento microbiano (Roy & Rhim, 2020).
Los aceites esenciales, antioxidantes y extractos de residuos orgánicos, se han incorporado en matrices biopoliméricas para retrasar el deterioro causado por microorganismos, con beneficios adicionales en el proceso higiénico-sanitario de los alimentos (Mir et al., 2018). Los extractos naturales obtenidos de residuos de productos hortofrutícolas son fuentes de compuestos bioactivos, y se han estudiado como aditivos en la formación de películas, tal es el caso de los extractos de cáscara de mango (Chaiwarit et al., 2020), naranja (Terzioğlu et al., 2021), lima (Rodsamran & Sothornvit, 2019), piña (Kumar et al., 2021b), entre otros.
La cáscara de coco es un recurso natural que se utiliza comúnmente como insumo para la elaboración de filtros eliminadores de metales pesados (Sengupta & Basu, 2016); además, representa una alta fuente de fibra y de compuestos activos. No obstante, no se ha estudiado su efecto como aditivo en matrices biopoliméricas. En este sentido, el objetivo del presente estudio fue evaluar el efecto de un extracto de cáscara de coco (ECC) incorporado a películas biopoliméricas de gelatina-carboximetilcelulosa (G-CMC) sobre sus propiedades fisicoquímicas y antifúngicas, para determinar su uso potencial como material de envase de productos hortofrutícolas.
Materiales y métodos
Materiales y reactivos
Los reactivos utilizados para elaborar las películas fueron gelatina tipo B, carboximetilcelulosa (CMC) y glicerol (Merck, Alemania), además de agar papa dextrosa (PDA) y nitrato de potasio (Meyer, México). Todos los materiales fueron grado reactivo analítico.
Recolección y preparación de extracto de cáscara de coco
Se adquirieron frutos de coco (Cocos nucifera L.) en estado de madurez de consumo de un mercado local en Texcoco, Estado de México. La cosecha se realizó 24 h antes de la compra. Los frutos se trasladaron en contendedores de plástico al Laboratorio de Biomateriales del Centro de Investigación en Ciencia Aplicada y Tecnología Avanzada - Unidad Legaria, del Instituto Politécnico Nacional, donde se descartaron aquellos que presentaron daños mecánicos o infección por fitopatógenos.
Para obtener el extracto de la cáscara de coco, se seleccionaron aproximadamente 15 frutos, los cuales se desfibraron y se les retiró el endocarpio. Las muestras desfibradas se trituraron en un molino de discos (148-2, The Bauer Co., EUA) y se secaron en una estufa digital (Fe-294AD, Feligneo, México) a 60 ± 2 °C durante 24 h. La extracción se realizó considerando el método descrito por Nagarajan et al. (2015), con algunas modificaciones. Se mezclaron 15 g del material seco en 500 mL de etanol al 30 % (m/v). La mezcla se sonicó en un baño ultrasónico (TI-H-5, Elma, Alemania), se centrifugó (modelo K, International Equipment Co., EUA) a 1 750 rpm durante 30 min y se filtró con papel Whatman No. 1 (Whatman® International, Ltd., Inglaterra). Finalmente, la mezcla filtrada se concentró a 40 ± 2 °C en un rotavapor (RE-500, Yamato, Japón) y se liofilizó (FreeZone 4.5, Labconco™, EUA), obteniéndose así el extracto acuoso-etanólico de cáscara de coco (ECC). El ECC se almacenó en frascos ámbar herméticamente cerrados a 53 % de humedad relativa (HR).
Preparación de las películas activas
La gelatina (G), la CMC y el glicerol se disolvieron en agua destilada empleando una relación de 1:1:0.6, respectivamente. La solución se calentó a 90 °C en una parrilla eléctrica (SP1311325Q, Thermolyne™, EUA) con agitación constante (600 rpm) durante 1 h. La solución se dejó enfriar a temperatura ambiente (25 °C), y posteriormente se agregaron diferentes concentraciones de ECC: G-CMC (testigo, sin adición de extracto), 200/ECC (200 mg·L-1 de extracto), 300/ECC (300 mg·L-1 de extracto) y 400/ECC (400 mg·L-1 de extracto). Finalmente, se vertieron 25 mL de la solución en cajas Petri (1.5 x 12 cm) y se colocaron en una estufa digital a 60 °C durante 24 h. Las películas secas se retiraron de las placas y se almacenaron en bolsas herméticamente cerradas y sin exposición a la luz hasta su análisis. Antes de cada caracterización, las películas se acondicionaron en un desecador a 25 °C y 53 % HR.
Caracterización de las películas
Espesor y propiedades mecánicas
El espesor de las películas se midió con un micrómetro digital (H-2781, Mitutoyo, Japón), con una precisión de 0.01 mm. Las mediciones se tomaron en diez posiciones diferentes de cada película y se registró el promedio en µm.
Las propiedades mecánicas medidas fueron la fuerza a la punción (N) y la resistencia a la tensión (MPa) (American Society for Testing and Materials [ASTM], 1995a), ambas con un analizador de textura (TA-XT2i, Stable Micro Systems, Inglaterra) y celda de carga fija de 25 N. Para determinar la fuerza de punción se cortaron muestras circulares de 2.5 cm de diámetro de cada película. Las muestras se fijaron en celdas circulares adaptadas para el ensayo. Para la resistencia a la tensión, se cortaron muestras rectangulares de 2 x 4 cm2 y se colocaron en el equipo con celdas de agarre. La medición se realizó a una velocidad de 1 mm·s-1. Finalmente, este parámetro se calculó mediante la Ecuación 1.
Donde F max es la fuerza máxima que soporta la película (N) y A es el área transversal de la película (m2).
Permeabilidad al vapor de agua (PVA)
La permeabilidad al vapor de agua (PVA; g·m-1·s-1·Pa-1) se determinó de acuerdo con el método estándar modificado de ASTM (1995b). Se adaptaron frascos de 3 cm de diámetro con capacidad de 120 mL. Las películas cubrieron la parte superior de cada frasco y se cerraron herméticamente con parafina; posteriormente, se inyectaron 25 mL de una solución saturada de nitrato de potasio (40 %) en cada frasco y se almacenaron en una cámara controlada a 28 °C y 97 % HR. Los frascos se pesaron cada 8 h en una balanza (Ve-300, Velab™, México) con resolución de 0.01 mg. Para determinar la velocidad de transpiración, se realizó un análisis de regresión lineal (pendiente de pérdida de peso por tiempo), y con la Ecuación 2 se determinó la permeabilidad.
Donde r v es la velocidad de transpiración (g·m-2·s-1), P v* es la presión de vapor de saturación (Pa), HR 1 es la humedad relativa de la cámara (adimensional), HR 2 es la humedad relativa del contenedor (adimensional) y E es el espesor de la película (m).
Microscopia electrónica de barrido (MEB)
La morfología de las películas se observó en un microscopio electrónico de barrido (MEB) (JSM 6390 LV, JEOL, Japón), con un voltaje acelerador de 10 kV. Para ello, se cortaron muestras 4 mm2 de cada película y se fijaron en porta muestras cilíndricos con cinta de carbono adhesiva de doble cara. Las muestras se recubrieron con oro mediante pulverización catódica (Desk IV, Denton Vacuum, EUA) durante 120 s. Las imágenes obtenidas fueron de la sección transversal de las películas a magnificaciones de 1000x y 1500x.
Color
El color de las películas se analizó de acuerdo con lo descrito por Nallan-Chakravartula et al. (2020). Se utilizó un colorímetro de alta definición CIE Lab (NH300, 3NH, China), y el índice de blancura (IB) e índice de amarillez (IA) se calcularon a partir de los valores L* (luminosidad), a* (verde/rojo) y b* (azul/amarillo) con las Ecuaciones 3 y 4, respectivamente:
Para calibrar el equipo se utilizó un estándar blanco (L* = 94.512, a* = 0.417 y b* = 0.350).
Transmitancia de luz UV y opacidad
Para medir la transmitancia de luz UV, se cortaron trozos de 1 x 3 cm2 de cada película y se acondicionaron en una celda de medición con un espectrofotómetro (Lambda 35 UV-Vis, Perkin Elmer®, EUA) (Kchaou et al., 2020). El rango de medición se estableció de 200 a 800 nm. Por su parte, la opacidad (abs·mm-1) se determinó mediante la Ecuación 5.
Donde Abs 600 es la absorbancia a 600 nm y x es el espesor de las películas (mm).
Espectroscopia infrarroja por transformada de Fourier (FTIR)
Los espectros de las películas se obtuvieron en un espectrofotómetro FTIR (Cary 630, Agilent Technologies, EUA), con una resolución de 2 cm-1 y una velocidad de exploración de 32 escaneos·min-1. Las mediciones se realizaron de 4 000 a 650 cm-1.
Determinación de la actividad antifúngica in vitro del extracto de cáscara de coco
La actividad antifúngica del ECC se evaluó empleando concentraciones de 0, 200, 300 y 400 mg·L-1. Cada concentración se aplicó en un disco estéril de papel filtro (Whatman No. 1) de 25 mm de diámetro, el cual se fijó en la parte central de una caja de Petri con PDA. Las cajas se inocularon previamente con una suspensión de 106 esporas·mL-1 de Aspergillus niger y Rhizopus stolonifer en 20 mL de medio de cultivo, y se almacenaron en una incubadora digital (IC 403CW, Yamato, Japón) a 25 °C y 97 % HR por 48 h. Después del periodo de incubación, se determinó el halo de inhibición alrededor del disco (mm) utilizando un vernier (500-196-30, Mitutoyo, Japón). Los cultivos de hongos utilizados se obtuvieron en el Laboratorio de Microbiología de la Universidad Autónoma Chapingo con el método de Luksiene y Buchovec (2019).
Análisis estadístico
Se realizaron análisis de varianza de una sola vía para evaluar las propiedades fisicoquímicas y antifúngicas de las películas, y pruebas de comparación de medias de Tukey (P ≤ 0.05). Para los análisis se utilizó el programa estadístico MINITAB®. Todos los análisis se realizaron por triplicado y los datos se presentan como la media ± la desviación estándar.
Resultados y discusión
Espesor y propiedades mecánicas
El espesor de las películas varió significativamente (P ≤ 0.05) entre los tratamientos (Cuadro 1). Las películas con 200/ECC, 300/ECC y 400/ECC incrementaron 3.4, 11.9 y 14.3 µm con respecto al testigo, respectivamente. Estos resultados sugieren compatibilidad entre los péptidos de la gelatina y los componentes del extracto, lo cual dio lugar al desarrollo y formación de una matriz compacta de mayor espesor. Un efecto similar fue reportado por Ahmad et al. (2012) en películas de gelatina con extractos de bergamota y limoncillo. Inicialmente, dichos autores observaron una interrupción en las cadenas polipeptídicas de la gelatina por la presencia del extracto, después estos polipéptidos fueron capaces de interactuar y formar enlaces con los compuestos fenólicos de naturaleza hidrofílica del extracto, dando lugar a una estructura con mayor magnitud. Cabe señalar que el espesor de las películas tiende a incrementar al incorporar agentes externos afines a la solución biopolimérica, ya que de lo contrario el agente podría saturar la solución y, por consiguiente, desarrollar estructuras delgadas, frágiles, quebradizas y con restos no solubles (Xue et al., 2021). Asimismo, es determinante la obtención de un producto con mayor espesor como material de envase y posterior manipulación.
Cuadro 1 Espesor, resistencia a la punción, resistencia a la tensión, permeabilidad al vapor de agua (PVA) y opacidad de las películas de gelatina-carboximetilcelulosa (G-CMC) y las adicionadas con diferentes concentraciones de extracto de cáscara de coco (ECC).
| Tratamiento | Espesor (µm) | Fuerza de punción (N) | Resistencia a la tensión (MPa) | PVA (× 10-11, g·m-1·s-1·Pa-1) | Opacidad (abs·mm-1) |
|---|---|---|---|---|---|
| Testigo (G-CMC) | 23.4 ± 0.3 a | 24.5 ± 1.3 a | 14.8 ± 1.4 a | 3.3 ± 0.2 a | 2.76 ± 0.1 a |
| 200 mg·L-1 (200/ECC) | 26.8 ± 1.1 b | 34.5 ± 0.9 b | 16.7 ± 1.2 ab | 3.7 ± 0.1 a | 4.91 ± 0.1 b |
| 300 mg·L-1 (300/ECC) | 35.3 ± 0.6 c | 30.1 ± 0.7 c | 20.1 ± 1.9 b | 5.3 ± 0.1 b | 5.16 ± 0.1 c |
| 400 mg·L-1 (400/ECC) | 37.7 ± 0.8 d | 29.4 ± 0.7 c | 16.3 ± 1.0 a | 6.1 ± 0.1 c | 5.30 ± 0.2 c |
Medias con la misma letra dentro de cada columna no difieren estadísticamente (Tukey, P ≤ 0.05).
La fuerza de punción de la película de G-CMC fue de 24.5 N, con diferencia significativa (P < 0.05) comparada con los demás tratamientos (Cuadro 1). La mayor fuerza obtenida fue de 34.5 N con 200/ECC. La estabilidad de la matriz se pudo deber a las interacciones electroestáticas, y a los puentes de hidrógeno establecidos entre los grupos hidroxilo de los polifenoles del extracto y las moléculas hidrofílicas aceptoras de la gelatina en la matriz biopolimérica (Hoque et al., 2011). En consecuencia, el incremento en la fuerza de las películas con ECC podría estar relacionado con la formación de una red biopolimérica estable en función de la concentración del extracto. Por otro lado, la fuerza de punción disminuyó significativamente (P < 0.05) en los tratamientos 300/ECC y 400/ECC, en comparación con 200/ECC. Como se mencionó anteriormente, en concentraciones elevadas de agentes externos, la solución satura los enlaces disponibles y genera una estructura densa. Kan et al. (2019) obtuvieron resultados similares en películas de gelatina/quitosano con extracto de Crataegus pinnatifida.
De manera similar al análisis anterior, la resistencia a la tensión disminuyó significativamente al incorporar 400 mg·L-1 de ECC, con respecto al tratamiento con 300 mg·L-1. Dicha disminución se pudo deber a la elevada concentración de compuestos fenólicos, lo cual generó una estructura heterogénea con áreas discontinuas en la película. Estos resultados concuerdan con lo reportado por Kchaou et al. (2020). Asismismo, ellos señalan que las propiedades mecánicas disminuyen con la incorporación de extractos naturales en cantidades mayores a la saturación de la solución o al generar incompatibilidad con los biopolímeros de la matriz, ya que crea una disminución en la densidad de las interacciones intermoleculares y un aumento en el volumen libre entre las cadenas de gelatina, lo cual provoca fragilidad en las películas.
La mayor resistencia a la punción y a la tensión se alcanzaron cuando el extracto se aplicó en concentraciones bajas y medias (200 y 300 mg·L-1). Este fenómeno ocurre por la estabilidad de la red biopolimérica generada a través de interacciones electroestáticas y puentes de hidrógeno entre el extracto y la matriz biopolimérica. Por otro lado, la máxima concentración de extracto (400 mg·L-1) disminuyó las propiedades mecánicas, ya que los compuestos presentes en el extracto reducen la densidad de las interacciones intermoleculares, lo cual genera una red polimérica discontinua. Por lo tanto, la incorporación de ECC en la matriz biopolimérica modificó tanto las propiedades mecánicas como el espesor de las películas activas, sin comprometer su formación, manejo y desmolde. Valores mayores de resistencia y fuerza de punción son deseables en el desarrollo de películas biopoliméricas dirigidas al envasado de alimentos, debido a que reflejan la carga neta que pueden soportar durante su manejo.
PVA
El valor más bajo de PVA se obtuvo en las películas testigo (3.3 × 10-11 g·m-1·s-1·Pa-1), mientras que las películas con ECC incrementaron su valor en 0.4, 2 y 2.8 × 10-11 g·m-1·s-1·Pa-1, con 200/ECC, 300/ECC y 400/ECC, respectivamente (Cuadro 1). En general, la incorporación de ECC afectó significativamente (P < 0.05) los valores de PVA, ya que se registraron valores crecientes proporcionales a la concentración de extracto añadida a la solución filmógena. La alta permeabilidad se puede explicar mediante los procesos de sorción, difusión y desorción por los que transitan los polímeros de naturaleza hidrofílica y que están involucrados en el incremento de este parámetro (Xu et al., 2020). En primer lugar, el fenómeno consiste en la sorción y solubilización de los biopolímeros, seguido de la difusión de las moléculas de agua en la matriz y la desorción o evaporación (fase de secado) de las moléculas de agua en la superficie de la película.
En el presente estudio, la concentración de los biopolímeros, el plastificante y el agua fueron los mismos; por tanto, el incremento en la permeabilidad fue ocasionado por la concentración del extracto añadido. Dou et al. (2018) encontraron que la PVA en películas de gelatina se vio afectada por la incorporación de extractos vegetales, ya que entre los polímeros y el extracto se formó una estructura de red densa, y con ello disminuyó la permeabilidad. En otro estudio, Malherbi et al. (2019) encontraron que la PVA en películas de gelatina con extracto de pulpa de guabiroba tuvo resultados variables con respecto a la concentración del extracto añadido.
Los resultados del presente estudio confirman que la PVA en películas de gelatina está relacionada con la proporción del extracto añadido a la solución. Así, a medida que se incrementa la cantidad de extracto, aumentan las áreas heterogéneas generadas por las interacciones G-CMC-ECC, las cuales desencadenan la discontinuidad en la red polimérica y generan el incremento en la PVA. La medición de dicho parámetro es determinante en películas dirigidas a la conservación de alimentos, debido a la necesidad de protección y a una barrera frente a la concentración de vapor de agua del ambiente y del alimento.
MEB
En las micrografías de la película testigo, se observa una estructura lisa, uniforme y sin grietas visibles (Figura 1a), lo cual refleja una buena compatibilidad y homogeneidad entre los polímeros de la matriz. Esta homogeneidad se atribuye a la afinidad entre la gelatina, la CMC y el glicerol en el medio acuoso. El agua favorece la formación de interacciones moleculares como puentes de hidrógeno entre estos biopolímeros (Nazmi et al., 2017).
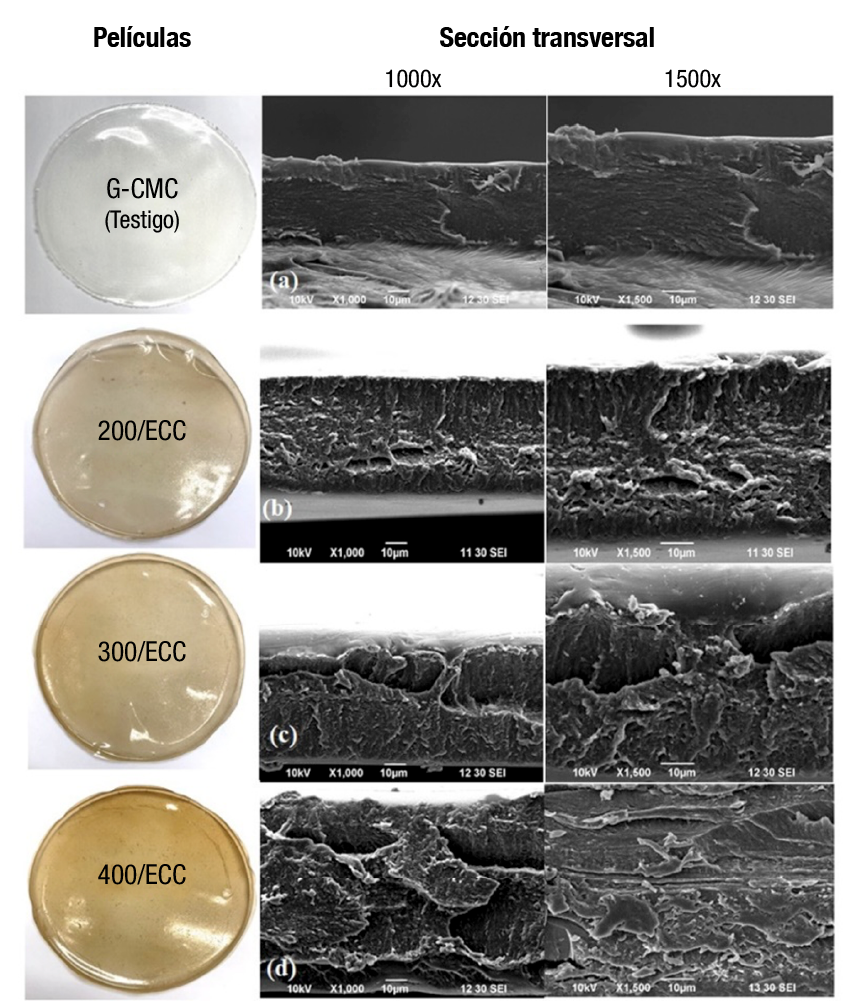
Figura 1 Imágenes de microscopia electrónica de barrido de la sección transversal de las películas de gelatina-carboximetilcelulosa (G-CMC) y las adicionadas con diferentes concentraciones de extracto de cáscara de coco (ECC) en magnificación de 1000x y 1500x.
La estructura homogénea de la película se afectó cuando se adicionaron 200 mg·L-1 de ECC (Figura 1b). Las rugosidades son evidencia de una dispersión del extracto en la matriz, donde intervienen interacciones hidrofóbicas del ECC y la formación de interacciones hidrofílicas con los compuestos fenólicos del extracto (Nor Adilah et al., 2020).
En la sección transversal de las películas 300/ECC y 400/ECC (Figuras 1c y 1d), se aprecia una intensificación de rugosidades y cráteres, con secciones irregulares y discontinuas. La superficie heterogénea es consistente con el incremento de la concentración de extracto. Resultados similares fueron reportados por Rasid et al. (2018) en películas de gelatina con extracto de Centella asiatica L. Por tanto, conforme aumentó la cantidad del extracto, se intensificaron las rugosidades y grietas observadas en las películas. Además, estos cambios se correlacionan con la formación de enlaces intermoleculares entre polímeros (sección de FTIR). Finalmente, a pesar de que la adición de extracto incrementó la complejidad en la matriz, las discontinuidades en la red biopolimérica causadas por la adición de ECC no comprometieron la formación de las películas.
Color
Los mayores valores de luminosidad (L*) y del parámetro a* (rojo/verde) se obtuvieron con el tratamiento testigo (Figura 2). En contraste, las películas con ECC mostraron una disminución significativa (P < 0.05) en los valores de L* y, por consiguiente, un incremento en los valores de a* y b* (amarillo/azul). Esto indica que las películas perdieron luminosidad y adquirieron un tono amarillento, lo cual concuerda con los resultados del IA, ya que a medida que aumentó la cantidad de ECC en la matriz de G-CMC, incrementó el nivel de pardez en la película.

Figura 2 Luminosidad (L*), parámetros de color a* y b*, índice de blancura (IB) e índice de amarillez (IA) de las películas de gelatina-carboximetilcelulosa (G-CMC) y las adicionadas con diferentes concentraciones de extracto de cáscara de coco (ECC).
Los resultados obtenidos fueron consistentes con el IB, donde también se observó un efecto significativo en función de la concentración del ECC. El valor más bajo de dicho parámetro se observó en el tratamiento con la mayor concentración de ECC (Figura 2). Esto indicó que el color de las películas testigo, al ser incoloras y translúcidas, pueden cambiar su tonalidad con un mínimo de concentración de aditivo. En este caso, los cambios observados en los parámetros de color se atribuyeron, principalmente, a la presencia de compuestos fenólicos del ECC, el cual presentó una coloración marrón al momento de su incorporación (Li et al., 2021). Por tanto, la incorporación del ECC en la matriz de G-CMC modificó significativamente los parámetros de color de las películas. El desarrollo de nuevos materiales con aporte de color puede reducir la exposición a la luz, y así evitar daños oxidativos a los productos alimenticios, lo cual sugiere una tecnología de envasado mejorada.
Transmitancia de luz y opacidad
La incorporación del ECC en la matriz de gelatina y carboximetilcelulosa provocó cambios significativos (P < 0.05) en los valores de transmitancia en función de la concentración de extracto agregada (Figura 3). La transmitancia en películas con ECC incrementó a partir de 350 nm, mientras que en la película testigo fue desde 200 nm; es decir, se obtuvo una película traslúcida en todo el espectro de luz estudiado. Aunque la película de G-CMC fue translúcida y brillosa, la incorporación del extracto cambió la transparencia de la película a un color amarillo pardo.

Figura 3 Transmitancia de luz UV-Vis de las películas de gelatina-carboximetilcelulosa (G-CMC) y las adicionadas con diferentes concentraciones de extracto de cáscara de coco (ECC).
El color aportado por el ECC se podría deber al alto contenido de lignina, la cual se caracteriza por absorber la luz UV, como se ha demostrado en diversas investigaciones (Shikinaka et al., 2020). En el envasado de alimentos, son deseables los materiales que crean una barrera a la luz UV-Vis para reducir la peroxidación de lípidos, la pérdida de nutrientes y, con ello, evitar la generación de olores y sabores desagradables (Ge et al., 2018). Por tanto, las películas con ECC obtenidas en el presente estudio poseen una ventaja como bloqueadoras de luz UV.
Los resultados obtenidos mediante UV-Vis indican una mayor opacidad a medida que aumenta la concentración del ECC (Cuadro 1). Tanto la transparencia como la opacidad de las películas son propiedades ópticas importantes en materiales dirigidos al envasado de alimentos. Una alta absorbancia indica mayor transparencia y, por tanto, menor opacidad (Khedri et al., 2021). Dado que se trata de un color ligero aportado por el ECC, las películas mantuvieron una opacidad relativamente baja (Figura 4). Un resultado similar fue reportado por Nor Adilah et al. (2020) en películas de gelatina con extracto de cáscara de mango, donde el tinte amarillento observado fue atribuido a los carotenoides contenidos en el fruto debido a su estado de madurez.

Figura 4 Opacidad de las películas de gelatina-carboximetilcelulosa (G-CMC) y las adicionadas con diferentes concentraciones de cáscara de coco (ECC).
Obtener una película con mayor opacidad para la industria de material de envasado podría parecer una desventaja, ya que es deseable un material translúcido; sin embargo, en alimentos con alto contenido de ácidos grasos, como el aguacate, el queso, la carne, entre otros, es indispensable la manipulación del alimento con un material que evite la oxidación frente a los rayos UV (Michelin et al., 2020). En este sentido, el ECC podría ser una alternativa de aditivo natural para disminuir la transmitancia de luz UV e incrementar la opacidad en películas de G-CMC y, con ello, crear un material de envasado con propiedades de barrera en longitudes de onda de 200 a 350 nm.
FTIR
En los espectros FTIR de la película de G-CMC y sus interacciones con el ECC en diferentes concentraciones, se detectaron bandas características de la gelatina como la amida A en 3 270 cm-1, amida B en 2 930 cm-1, amida I en 1 634 cm-1, amida II en 1 534 cm-1 y amida III en 1 240 cm-1 (Figura 5), las cuales representan los modos vibratorios del enlace peptídico de la gelatina. Estos hallazgos son consistentes con lo reportado por Rasid et al. (2018). Adicionalmente, todas las películas mostraron bandas similares en el rango de 3 200 a 3 500 cm-1, atribuidas a las interacciones de la amida A (vibraciones de estiramiento N−H) y a las interacciones intermoleculares e intramoleculares de los grupos −OH de los componentes poliméricos (gelatina, carboximetilcelulosa y glicerol). En las películas con ECC se muestra un incremento en el estiramiento de la banda −OH, lo cual se pudo deber a la cantidad de compuestos de naturaleza fenólica del extracto (Tanwar et al., 2021).
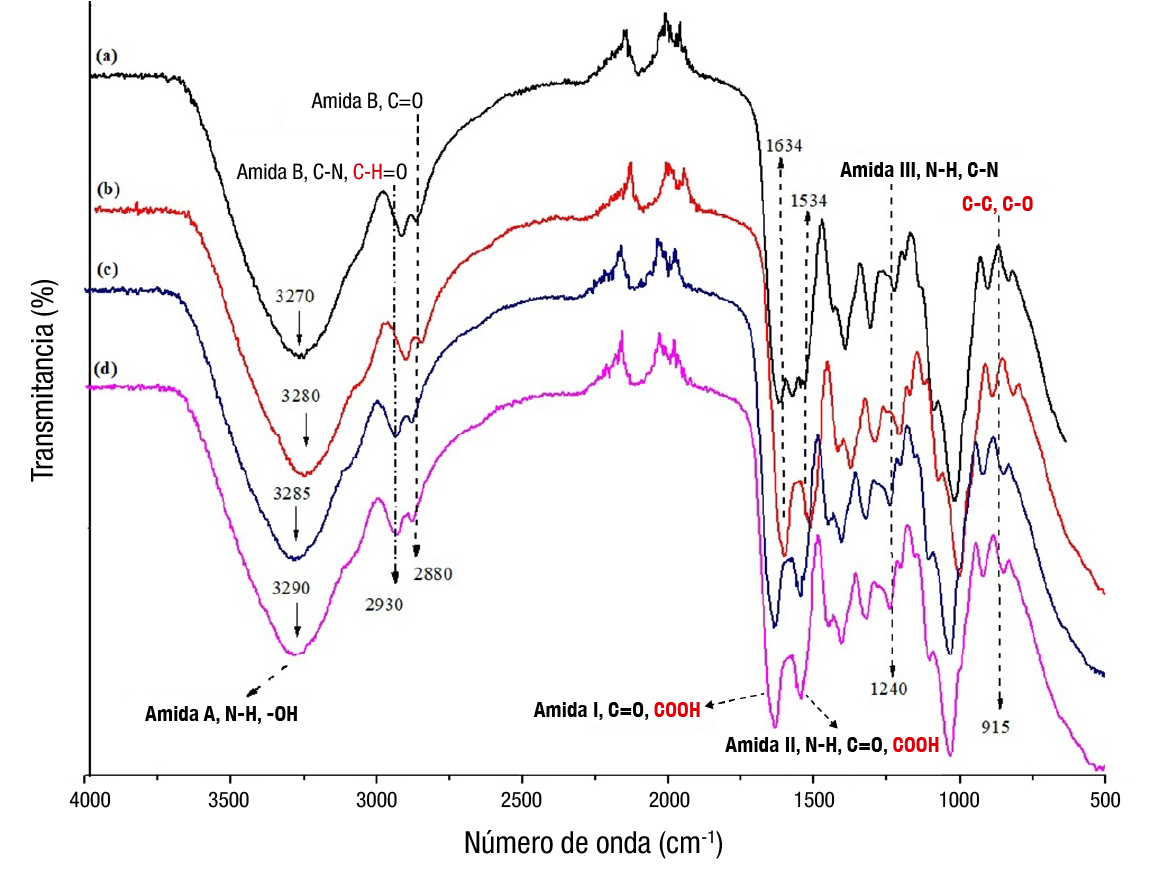
Figura 5 Espectros de espectroscopia infrarroja por transformada de Fourier de las películas de gelatina-carboximetilcelulosa (G-CMC) y las adicionadas con diferentes concentraciones de extracto de cáscara de coco (ECC): a) G-CMC (testigo, sin adición de ECC), b) 200 mg·L-1 de ECC (200/ECC), c) 300 mg·L-1 de ECC (300/ECC) y d) 400 mg·L-1 de ECC (400/ECC).
Los picos de 2 930 cm-1 y 2 880 cm-1 son característicos de la amida B (vibraciones de estiramiento C−N y vibraciones de estiramiento asimétrico C=O). La interacción C−H en la banda 2 930 cm-1 representa el anillo de metano de los átomos de hidrógeno del CMC, lo cual es consistente con lo reportado por Kowalczyk et al. (2020). La banda 1 634 cm-1 se atribuye a la amida I, que representa a los enlaces C=O de la gelatina, y al enlace de hidrógeno acoplado al COOH del CMC. La banda presente en 1 534 cm-1 hace referencia a la amida II de la gelatina (interacciones de N−H y C=O). De igual forma, la amida II podría estar interactuando con el grupo −COOH del CMC (Esteghlal et al., 2018). En 1 240 cm-1 se encuentra identificada la amida III con enlaces N−H y C−N, y en la banda 915 cm-1 se observan las interacciones de C−C y C−O del CMC (Kowalczyk et al., 2020).
El estudio de los espectros FTIR se realizó con la finalidad de evaluar y determinar las interacciones entre los compuestos involucrados en la solución polimérica. La incorporación de ECC en las películas de G-CMC favoreció las interacciones intermoleculares e intramoleculares a través de enlaces no covalentes entre los grupos −OH de los compuestos.
Actividad antifúngica in vitro
La película de G-CMC no inhibió el crecimiento de las cepas R. stolonifer y A. niger (Cuadro 2), lo cual indica que esta película no posee propiedades antifúngicas ante las cepas estudiadas. Estos resultados son consistentes con lo reportado por Sahraee et al. (2017) en películas de gelatina. Lo anterior demuestra que los biopolímeros no poseen actividad inhibitoria.
Cuadro 2 Actividad antifúngica de la película de gelatina-carboximetilcelulosa (G-CMC) y las adicionadas con diferentes concentraciones de extracto de cáscara de coco (ECC).
| Tratamientos | Halo de inhibición (mm)** | |
|---|---|---|
| Rhizopus stolonifer | Aspergillus niger | |
| Testigo (G-CMC) | 0.0 ± 0.0 a* | 0.0 ± 0.0 a* |
| 200 mg·L-1 (200/ECC) | 64.17 (± 0.2) b | 64.10 (± 0.3) b |
| 300 mg·L-1 (300/ECC) | 64.10 (± 0.1) b | 64.87 (± 0.1) c |
| 400 mg·L-1 (400/ECC) | 65.0 (± 0.0) c | 65.0 (± 0.0) d |
*No hubo zona de inhibición, incluso el patógeno fúngico creció encima del disco. **Diámetro del halo de inhibición, excluyendo el diámetro del disco de 25 mm. Medias con la misma letra dentro de cada columna no difieren estadísticamente (Tukey, P ≤ 0.05).
Los tratamientos 200/ECC y 300/ECC mostraron actividad antifúngica al presentar un halo de inhibición de 64.17 y 64.10 mm para R. stolonifer, y de 64.10 y 64.87 mm para A. niger, respectivamente. Asimismo, al aumentar la concentración de ECC a 400 mg·L-1 se obtuvo una mayor actividad inhibitoria contra ambas cepas fúngicas (Cuadro 2). La actividad antifúngica de la cáscara de coco está relacionada con la presencia de un alto contenido de catequinas. Además, varios estudios han reportado un alto contenido de lignina y taninos condensados en la cáscara de coco, a los cuales se les atribuyen acciones antibacterianas (Candida albicans, Escherichia coli y Staphylococcus aureus), antivirales y anticancerígenas (Prakash et al., 2018).
El mecanismo plausible de la actividad biocida del ECC, reportado como fuente rica de lignina, se centra en la membrana celular, ya que provoca daños y ruptura en las células bacterianas y, en consecuencia, la muerte del microorganismo (Yang et al., 2016). Adicionalmente, el efecto antimicrobiano es dependiente del tipo de extracción, condición climática, periodo de cosecha, entre otros factores (Kumar et al., 2021a). Otros estudios han confirmado el efecto antimicrobiano de la lignina extraída de diversas fuentes biológicas (de Sousa-Nascimento et al., 2021). Por ello, la incorporación del ECC en películas de G-CMC representa una alternativa de envase con acción fungicida para preservar la vida de anaquel de los alimentos, al controlar el deterioro causado por la proliferación de fitopatógenos.
Conclusiones
Este estudio reveló que la incorporación del ECC incrementó significativamente el espesor de las películas; además, modificó las propiedades mecánicas y de permeabilidad al vapor de las películas de G-CMC. El ECC aportó un color marrón a las películas translúcidas, incrementando la opacidad y ejerciendo un efecto protector frente a la luz UV. La microestructura se modificó por la incorporación del ECC; sin embargo, el extracto no afectó la formación y desmolde de las películas. Adicionalmente, los ECC mostraron alta capacidad inhibitoria contra cepas de R. stolonifer y A. niger. Considerando lo anterior, las películas obtenidas representan un material prometedor como sustituto de los envases convencionales, ya que además de sus características pueden reducir el deterioro de los alimentos ocasionado por hongos.
Agradecimientos
Los autores agradecen al Instituto Politécnico Nacional (Proyecto SIP: 20181062 y 20210011) por el financiamiento de este trabajo. Además, la primera autora agradece al Consejo Nacional de Ciencia y Tecnología (CONACYT) y a la Comisión de Operación y Fomento de Actividades Académicas del IPN (COFAA) por las becas otorgadas.
REFERENCIAS
American Society for Testing and Materials (ASTM). (1995a). Standard test methods for tensile properties of thin plastic sheet. ASTM International [ Links ]
American Society for Testing and Materials (ASTM). (1995b). Standard test methods for water vapor transmission of materials. ASTM International [ Links ]
Ahmad, M., Benjakul, S., Prodpran, T., & Agustini, T. W. (2012). Physico-mechanical and antimicrobial properties of gelatin film from the skin of unicorn leatherjacket incorporated with essential oils. Food Hydrocolloids, 28(1), 189-199. https://doi.org/https://doi.org/10.1016/j.foodhyd.2011.12.003 [ Links ]
Benson, N. U., Bassey, D. E., & Palanisami, T. (2021). COVID pollution: impact of COVID-19 pandemic on global plastic waste footprint. Heliyon, 7(2), e06343. https://doi.org/https://doi.org/10.1016/j.heliyon.2021.e06343 [ Links ]
Chaiwarit, T., Masavang, S., Mahe, J., Sommano, S., Ruksiriwanich, W., Brachais, C. H., Chambin, O., & Jantrawut, P. (2020). Mango (cv. Nam Dokmai) peel as a source of pectin and its potential use as a film-forming polymer. Food Hydrocolloids , 102, 105611. https://doi.org/https://doi.org/10.1016/j.foodhyd.2019.105611 [ Links ]
de Sousa-Nascimento, L., da Mata-Vieira, F. I., Horácio, V., Pereira-Marques, P., Freitas-Rosa, M., Araújo-Souza, S., Martins-de Freitas, R., Andrade-Uchoa, D. E., Mazzeto, S., Lomonaco, D., & Avelino, F. (2021). Tailored organosolv banana peels lignins: Improved thermal, antioxidant and antimicrobial performances by controlling process parameters. International Journal of Biological Macromolecules, 181, 241-252. ://doi.org/https://doi.org/10.1016/j.ijbiomac.2021.03.156 [ Links ]
Dou, L., Li, B., Zhang, K., Chu, X., & Hou, H. (2018). Physical properties and antioxidant activity of gelatin-sodium alginate edible films with tea polyphenols. International Journal of Biological Macromolecules , 118(B), 1377-1383. https://doi.org/https://doi.org/10.1016/j.ijbiomac.2018.06.121 [ Links ]
Esteghlal, S., Niakousari, M., & Hashem-Hosseini, S. M. (2018). Physical and mechanical properties of gelatin-CMC composite films under the influence of electrostatic interactions. International Journal of Biological Macromolecules , 114, 1-9. https://doi.org/https://doi.org/10.1016/j.ijbiomac.2018.03.079 [ Links ]
Ge, L., Zhu, M., Li, X., Xu, Y., Ma, X., Shi, R., Li, D., & Mu, C. (2018). Development of active rosmarinic acid-gelatin biodegradable films with antioxidant and long-term antibacterial activities. Food Hydrocolloids , 83, 308-316. https://doi.org/https://doi.org/10.1016/j.foodhyd.2018.04.052 [ Links ]
Hoque, M. S., Benjakul, S., & Prodpran, T. (2011). Properties of film from cuttlefish (Sepia pharaonis) skin gelatin incorporated with cinnamon, clove and star anise extracts. Food Hydrocolloids , 25(5), 1085-1097. https://doi.org/https://doi.org/10.1016/j.foodhyd.2010.10.005 [ Links ]
Janairo, J. I. (2021). Unsustainable plastic consumption associated with online food delivery services in the new normal. Cleaner and Responsible Consumption, 2, 100014. https://doi.org/https://doi.org/10.1016/j.clrc.2021.100014 [ Links ]
Kan, J., Liu, J., Yong, H., Liu, Y., Qin, Y., & Liu, J. (2019). Development of active packaging based on chitosan-gelatin blend films functionalized with Chinese hawthorn (Crataegus pinnatifida) fruit extract. International Journal of Biological Macromolecules , 140, 384-392. https://doi.org/https://doi.org/10.1016/j.ijbiomac.2019.08.155 [ Links ]
Kchaou, H., Jridi, M., Benbettaieb, N., Debeaufort, F., & Nasri, M. (2020). Bioactive films based on cuttlefish (Sepia officinalis) skin gelatin incorporated with cuttlefish protein hydrolysates: Physicochemical characterization and antioxidant properties. Food Packaging and Shelf Life, 24, 100477. https://doi.org/https://doi.org/10.1016/j.fpsl.2020.100477 [ Links ]
Khedri, S., Sadeghi, E., Rouhi, M., Delshadian, Z., Mortazavian, A. M., de Toledo-Guimarães, J., Fallah, M., & Mohammadi, R. (2021). Bioactive edible films: Development and characterization of gelatin edible films incorporated with casein phosphopeptides. LWT - Food Science and Technology, 138, 110649. https://doi.org/https://doi.org/10.1016/j.lwt.2020.110649 [ Links ]
Kowalczyk, D., Pytka, M., Szymanowska, U., Skrzypek, T., Łupina, K., & Biendl, M. (2020). Release kinetics and antibacterial activity of potassium salts of iso-α-acids loaded into the films based on gelatin, carboxymethyl cellulose and their blends. Food Hydrocolloids , 109, 106104. https://doi.org/https://doi.org/10.1016/j.foodhyd.2020.106104 [ Links ]
Kumar, K., Srivastav, S., & Sharanagat, V. S. (2021a). Ultrasound assisted extraction (UAE) of bioactive compounds from fruit and vegetable processing by-products: A review. Ultrasonics Sonochemistry, 70, 105325. https://doi.org/https://doi.org/10.1016/j.ultsonch.2020.105325 [ Links ]
Kumar, P., Tanwar, R., Gupta, V., Upadhyay, A., Kumar, A., & Gaikwad, K. K. (2021b). Pineapple peel extract incorporated poly (vinyl alcohol)-corn starch film for active food packaging: Preparation, characterization and antioxidant activity. International Journal of Biological Macromolecules , 187, 223-231. https://doi.org/https://doi.org/10.1016/j.ijbiomac.2021.07.136 [ Links ]
Li, N., Jiang, H., Yang, J., Wang, C., Wu, L., Hao, Y., & Liu, Y. (2021). Characterization of phenolic compounds and anti-acetylcholinase activity of coconut shells. Food Bioscience, 42, 101204. https://doi.org/https://doi.org/10.1016/j.fbio.2021.101204 [ Links ]
Luksiene, Z., & Buchovec, I. (2019). Impact of chlorophyllin-chitosan coating and visible light on the microbial contamination, shelf life, nutritional and visual quality of strawberries. Innovative Food Science & Emerging Technologies, 52, 463-472. https://doi.org/https://doi.org/10.1016/j.ifset.2019.02.003 [ Links ]
Malherbi, N. M., Schmitz, A. C., Grando, R. C., Bilck, A. P., Yamashita, F., Tormen, L., Fakhouri, F. M., Velasco, J. I., & Bertan, L. C. (2019). Corn starch and gelatin-based films added with guabiroba pulp for application in food packaging. Food Packaging and Shelf Life, 19, 140-146. https://doi.org/https://doi.org/10.1016/j.fpsl.2018.12.008 [ Links ]
Michelin, M., Marques, A. M., Pastrana, L. M., Teixeira, J. A., & Cerqueira, M. A. (2020). Carboxymethyl cellulose-based films: effect of organosolv lignin incorporation on physicochemical and antioxidant properties. Journal of Food Engineering, 285, 110107. https://doi.org/https://doi.org/10.1016/j.jfoodeng.2020.110107 [ Links ]
Mir, S. A., Dar, B. N., Wani, A. A., & Shah, M. A. (2018). Effect of plant extracts on the techno-functional properties of biodegradable packaging films. Trends in Food Science & Technology, 80, 141-154. https://doi.org/https://doi.org/10.1016/j.tifs.2018.08.004 [ Links ]
Nagarajan, M., Benjakul, S., Prodpran, T., & Songtipya, P. (2015). Properties and characteristics of nanocomposite films from tilapia skin gelatin incorporated with ethanolic extract from coconut husk. Journal of Food Science and Technology, 52, 7669-7682. https://doi.org/10.1007/s13197-015-1905-1 [ Links ]
Nallan-Chakravartula, S. S., Lourenço, R. V., Balestra, F., Quinta-Barbosa-Bittante, A. M., do Amaral-Sobral, P. J., & Dalla-Rosa, M. (2020). Influence of pitanga (Eugenia uniflora L.) leaf extract and/or natamycin on properties of cassava starch/chitosan active films. Food Packaging and Shelf Life , 24, 100498. https://doi.org/https://doi.org/10.1016/j.fpsl.2020.100498 [ Links ]
Nazmi, N. N., Isa, M. I., & Sarbon, N. M. (2017). Preparation and characterization of chicken skin gelatin/CMC composite film as compared to bovine gelatin film. Food Bioscience, 19, 149-155. https://doi.org/https://doi.org/10.1016/j.fbio.2017.07.002 [ Links ]
Nor Adilah, A., Noranizan, M. A., Jamilah, B., & Nur Hanani, Z. A. (2020). Development of polyethylene films coated with gelatin and mango peel extract and the effect on the quality of margarine. Food Packaging and Shelf Life , 26, 100577. https://doi.org/https://doi.org/10.1016/j.fpsl.2020.100577 [ Links ]
Prakash, A., Vadivel, V., Banu, S. F., Nithyanand, P., Lalitha, C., & Brindha, P. (2018). Evaluation of antioxidant and antimicrobial properties of solvent extracts of agro-food by-products (cashew nut shell, coconut shell and groundnut hull). Agriculture and Natural Resources, 52(5), 451-459. https://doi.org/https://doi.org/10.1016/j.anres.2018.10.018 [ Links ]
Rasid, N. A., Nazmi, N. N., Isa, M. I. N., & Sarbon, N. M. (2018). Rheological, functional and antioxidant properties of films forming solution and active gelatin films incorporated with Centella asiatica (L.) urban extract. Food Packaging and Shelf Life , 18, 115-124. https://doi.org/https://doi.org/10.1016/j.fpsl.2018.10.002 [ Links ]
Rodsamran, P., & Sothornvit, R. (2019). Lime peel pectin integrated with coconut water and lime peel extract as a new bioactive film sachet to retard soybean oil oxidation. Food Hydrocolloids , 97, 105173. https://doi.org/https://doi.org/10.1016/j.foodhyd.2019.105173 [ Links ]
Roy, S., & Rhim, J. W. (2020). Preparation of antimicrobial and antioxidant gelatin/curcumin composite films for active food packaging application. Colloids and Surfaces B: Biointerfaces, 188, 110761. https://doi.org/https://doi.org/10.1016/j.colsurfb.2019.110761 [ Links ]
Sahraee, S., Milani, J. M., Ghanbarzadeh, B., & Hamishehkar, H. (2017). Effect of corn oil on physical, thermal, and antifungal properties of gelatin-based nanocomposite films containing nano chitin. LWT - Food Science and Technology , 76(A), 33-39. https://doi.org/https://doi.org/10.1016/j.lwt.2016.10.028 [ Links ]
Sengupta, S., & Basu, G. (2016). Properties of coconut fiber. In: Hashmi, S., & Choudhury, I. A. (Eds), Encyclopedia of Renewable and Sustainable Materials (pp. 263-281). Elsevier B.V. https://doi.org/10.1016/B978-0-12-803581-8.04122-9 [ Links ]
Shikinaka, K., Nakamura, M., & Otsuka, Y. (2020). Strong UV absorption by nanoparticulated lignin in polymer films with reinforcement of mechanical properties. Polymer, 190, 122254. https://doi.org/https://doi.org/10.1016/j.polymer.2020.122254 [ Links ]
Tanwar, R., Gupta, V., Kumar, P., Kumar, A., Singh, S., & Gaikwad, K. K. (2021). Development and characterization of PVA-starch incorporated with coconut shell extract and sepiolite clay as an antioxidant film for active food packaging applications. International Journal of Biological Macromolecules , 185, 451-461. https://doi.org/https://doi.org/10.1016/j.ijbiomac.2021.06.179 [ Links ]
Terzioğlu, P., Güney, F., Parın, F. N., Şen, İ., & Tuna, S. (2021). Biowaste orange peel incorporated chitosan/polyvinyl alcohol composite films for food packaging applications. Food Packaging and Shelf Life , 30, 100742. https://doi.org/https://doi.org/10.1016/j.fpsl.2021.100742 [ Links ]
Trajkovska-Petkoska, A., Daniloski, D., D'Cunha, N. M., Naumovski, N., & Broach, A. T. (2021). Edible packaging: sustainable solutions and novel trends in food packaging. Food Research International, 140, 109981. https://doi.org/https://doi.org/10.1016/j.foodres.2020.109981 [ Links ]
Tyuftin, A. A., & Kerry, J. P. (2021). Gelatin films: Study review of barrier properties and implications for future studies employing biopolymer films. Food Packaging and Shelf Life , 29, 100688. https://doi.org/https://doi.org/10.1016/j.fpsl.2021.100688 [ Links ]
Xu, J., Wei, R., Jia, Z., & Song, R. (2020). Characteristics and bioactive functions of chitosan/gelatin-based film incorporated with ε-polylysine and astaxanthin extracts derived from by-products of shrimp (Litopenaeus vannamei). Food Hydrocolloids , 100, 105436. https://doi.org/https://doi.org/10.1016/j.foodhyd.2019.105436 [ Links ]
Xue, F., Zhao, M., Liu, X., Chu, R., Qiao, Z., Li, C., & Adhikari, B. (2021). Physicochemical properties of chitosan/zein/essential oil emulsion-based active films functionalized by polyphenols. Future Foods, 3, 100033. https://doi.org/https://doi.org/10.1016/j.fufo.2021.100033 [ Links ]
Yang, W., Fortunati, E., Dominici, F., Giovanale, G., Mazzaglia, A., Balestra, G. M., Kenny, J. M., & Puglia, D. (2016). Effect of cellulose and lignin on disintegration, antimicrobial and antioxidant properties of PLA active films. International Journal of Biological Macromolecules , 89, 360-368. https://doi.org/https://doi.org/10.1016/j.ijbiomac.2016.04.068 [ Links ]
Zhang, H., & Sablani, S. (2021). Biodegradable packaging reinforced with plant-based food waste and by-products. Current Opinion in Food Science, 42, 61-68. https://doi.org/https://doi.org/10.1016/j.cofs.2021.05.003 [ Links ]
Recibido: 29 de Septiembre de 2021; Aprobado: 25 de Marzo de 2022











 texto em
texto em 



