Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Ingeniería agrícola y biosistemas
versão On-line ISSN 2007-4026versão impressa ISSN 2007-3925
Ing. agric. biosist. vol.13 no.1 Chapingo Jan./Jun. 2021 Epub 13-Jun-2022
https://doi.org/10.5154/r.inagbi.2020.04.025
Artículo científico
Soluciones conservadoras en poscosecha en dos variedades de nardo (Polianthes tuberosa L.) nativas de México: ‘Mexicano’ y ‘Perla’
1Universidad Autónoma del Estado de Morelos, Facultad de Ciencias Agropecuarias. Av. Universidad, núm. 1001, Col. Chamilpa, Cuernavaca, Morelos, C. P. 62209. MÉXICO.
2Universidad Autónoma Metropolitana, Departamento de Ciencias de la Salud. Av. San Rafael Atlixco, núm. 186, Col. Vicentina, Iztapalapa, Ciudad de México, C. P. 09340, MÉXICO.
Introducción:
‘Perla’ y ‘Mexicano’ son variedades de nardo cultivadas de México que presentan potencial para su comercialización y exportación; sin embargo, no se han evaluado soluciones conservadoras que incrementen su vida útil.
Objetivo:
Determinar los cambios físicos, fisiológicos y químicos que ocurren en nardo en poscosecha cuando se aplican diferentes soluciones conservadoras.
Metodología:
Espigas de nardo ‘Mexicano’ y ‘Perla’, con dos flores basales abiertas, se colocaron en soluciones conservadoras (Crystal®, sacarosa [Sac] + ácido cítrico [AC] + hidroxiquinoleína citrato [HQC] y ácido ascórbico [AAsc]). Se mantuvo un grupo de espigas como testigo, y en todos los casos se evaluaron variables destructivas y no destructivas en poscosecha.
Resultados:
El peso fresco relativo y el consumo de agua aumentaron con las soluciones conservadoras en ambos cultivares. La apariencia en ‘Perla’ fue excelente por 5 días con Crystal®. En ‘Mexicano’ abrieron más flores con Crystal® y Sac + AC + HQC, mientras que en ‘Perla’ fue con AAsc y Crystal®. La respiración en ‘Mexicano’ fue alta con Sac + AC + HQC, y en ‘Perla’ fue baja con AAsc. En ‘Perla’, la mayor actividad específica de superóxido dismutasa se detectó con AAsc y Crystal®.
Limitaciones del estudio:
Los resultados son válidos sin realizar aplicaciones previas de soluciones pulso o hidratantes en las variedades de nardo evaluadas.
Originalidad:
Es el primer estudio donde se evalúa el comportamiento poscosecha de dos variedades de nardo mexicanas en soluciones conservadoras.
Conclusiones:
En ‘Mexicano’ y ‘Perla’ se pueden utilizar las soluciones Crystal® y AAsc para mantener la calidad por mayor tiempo en florero.
Palabras clave consumo de agua; peso fresco relativo; calidad; respiración; superóxido dismutasa
Introduction:
‘Perla’ and ‘Mexicano’ are varieties of tuberose grown in Mexico that have potential for commercialization and export; however, no preservative solutions have been evaluated to increase their shelf life.
Objective:
To determine physical, physiological, and chemical changes that occur in postharvest tuberose when different preservative solutions are applied.
Methodology:
Tuberose flower spikes of varieties ‘Mexicano’ and Perla, with two open basal flowers, were placed in preservative solutions (Crystal®, sucrose [Sac] + citric acid [CA] + hydroxyquinoline citrate [HQC] and ascorbic acid [AAsc]). A group of tuberose flower spikes was kept as control, and in all cases destructive and non-destructive variables were evaluated during postharvest.
Results:
Relative fresh weight and water consumption increased with preservative solutions in both varieties. The appearance of the ‘Perla’ variety was excellent for 5 days with Crystal®. The ‘Mexicano’ variety had more open flowers with Crystal® and Sac + AC + HQC, while the ‘Perla’ variety had the same result with AAsc and Crystal®. Respiration in the ‘Mexicano’ variety was high with Sac + AC + HQC, and in the case of ‘Perla’ variety, respiration was low with AAsc. The highest specific superoxide dismutase activity was detected with AAsc and Crystal® for ‘Perla’ variety.
Study limitations:
The results are valid without previous applications of pulse or hydrating solutions in tuberose varieties evaluated.
Originality:
This is the first study where the postharvest behavior of two Mexican tuberose varieties is evaluated in preservative solutions.
Conclusions:
‘Mexicano’ and ‘Perla’ varieties can use Crystal® and AAsc solutions to maintain the quality for longer time in vase.
Keywords water consumption; relative fresh weight; quality; respiration; superoxide dismutase
Introducción
El nardo (Polianthes tuberosa L.) es una planta tuberosa, herbácea y perenne conocida de forma común como nardo, amole, tuberosa blanca, amiga de noche, azucena y vara de San José (González-Vega, 2016). Es una planta ornamental originaria de México que se dispersó alrededor del mundo en el siglo XVI (Barba-González et al., 2012). El nardo es una especie que ocupa una posición importante entre las bulbosas ornamentales, ya que comercialmente se utiliza como flor de corte y ornamental de maceta, además de que se extraen aceites esenciales de las flores, los cuales son altamente valorados (Kameswari et al., 2014). En México, Cuba, India, Nueva Zelanda y Japón, el nardo se utiliza como flor de corte en eventos sociales y para arreglos florales debido a su apreciado aroma (Barba-González et al., 2012; González-Vega, 2016).
En México, particularmente en Morelos, Oaxaca, Guerrero, Veracruz y Puebla, se cultivan 306.1 ha de nardo como flor de corte, lo que genera 61.9 millones de pesos en ventas anuales (Servicio de Información Agroalimentaria y Pesquera [SIAP], 2020). En Morelos, el nardo se ubica entre los principales cultivos de flores de corte (SIAP, 2020), donde la variedad con flores sencillas es la ‘Mexicano’, y la de flores dobles es ‘Perla’, la cual se cultiva en mayor proporción (Vázquez-García, 2004). A nivel internacional, se tienen variedades de nardo como ‘Doble excelsior’, ‘Tall double’, ‘Florentiu’ y ‘Orange flower’ (González-Vega, 2016). En India, se reportan variedades como ‘Shiringar’, Vaibhav’, ‘Calcuta doble’ y ‘Prajwal’, en las cuales se ha evaluado su comportamiento en cultivo y en poscosecha (Pérez-Arias et al., 2019).
Las flores de corte, inmediatamente después de la cosecha y antes del almacenamiento, o después del almacenamiento y subsecuente transporte (pero antes de aplicar soluciones de florero o conservadoras), se colocan en: a) soluciones rehidratantes, que tienen como objetivo restaurar la turgencia (generalmente son con agua a temperatura ambiente, la cual contiene algún germicida, agente humectante y acidificante, sin azúcar); b) soluciones pulsos, que consiste en colocar, por un periodo corto (desde segundos hasta horas), las flores recién cosechadas en una solución que contenga sales de plata o acidificador, un germicida y altas cantidades de azúcar, y c) soluciones para apertura de botones flores, las cuales se utilizan cuando se cortan las flores en estadio de botón y contienen cantidades moderadas de azúcar y un germicida (Arief-Zargar, 2016; Reid, 2009).
El uso de soluciones conservadoras es el método más económico y práctico para extender la vida poscosecha de las flores de corte; además, ayudan a conservar una apariencia fresca por más tiempo, por lo que los vendedores detallistas o los consumidores las utilizan para mantener a las flores en condiciones de venta o vida en florero por un periodo más prolongado. Estas soluciones generalmente contienen un germicida, azúcares, regulador de pH y, en ocasiones, surfactantes y hormonas (Kumar et al., 2017; Nowak & Rudnicki, 1990; Salunkhe et al., 1990).
El nardo es una flor de corte con una vida poscosecha corta, la cual varía entre 4 y 13 días (Pérez-Arias et al., 2019). Una vez cosechada, la respiración y producción de etileno se incrementan, por lo que se requiere hidratación y suministro de azúcares para obtener una mayor apertura de las flores y para incrementar la vida útil (Kumari et al., 2018; Pérez-Arias et al., 2019). Wahitaka et al. (2001) indican que al cosechar las espigas de nardo con dos o tres flores basales abiertas, realizar un pretratamiento pulso con sacarosa al 20 % y almacenar a temperatura entre 0 y 5 °C se puede mantener por más tiempo la calidad de las espigas.
En el caso del nardo, diversos autores señalan que soluciones conservadoras con sacarosa (Sac) + ácido cítrico (AC) o AC solo incrementan la vida útil del nardo entre 1 y 10 días, si se compara con flores que sólo se colocaron en agua (Sao & Verma, 2020; Sigma et al., 2018). Anjum et al. (2001) reportan que el ácido ascórbico (AAsc) en dosis de 200 mg·L-1 incrementó en 1 día la vida poscosecha del nardo en comparación con las flores testigo. En forma comercial, se tiene un producto denominado Crystal® de FloraLife® (que contiene alimento para las flores cortadas), el cual precipita las partículas de polvo y suciedad, además mantiene el agua de florero limpia y sin olor durante la apertura y crecimiento floral, esto al aplicarse una dosis de 5 g·L-1 (FloraLife, 2020).
En soluciones conservadoras, el germicida 8-HQC es el más utilizado para controlar bacterias, levaduras y hongos (Kumar et al., 2017). La sacarosa al 1 o 2 % es la fuente de energía más empleada para proveer energía a las flores, y los ácidos o sales adicionados para ajustar el pH (entre 3.5 y 5.0) son necesarios para reducir el desarrollo de algunos microorganismos y para que el consumo de agua por los tallos florales sea más fácil (Kumar et al., 2017).
Por lo anterior, el objetivo del trabajo fue evaluar la aplicación de soluciones conservadoras (Crystal®, sacarosa [Sac] + ácido cítrico [AC] + hidroxiquinoleína citrato [HQC] o ácido ascórbico [AAsc]) sobre algunos cambios físicos, fisiológicos y químicos de espigas de nardo ‘Mexicano’ y ‘Perla’ durante poscosecha.
Materiales y métodos
Material vegetal
Se cosecharon espigas de nardo de las variedades ‘Mexicano’ y ‘Perla’ de huertas comerciales ubicados en Cuahuchichinola, Mazatepec, Morelos (18° 38’ 54’’ latitud norte y 99° 22’ 56’’ longitud oeste, a 996 msnm). La cosecha se realizó a las 8:00 a.m., y las espigas se trasladaron al Laboratorio de Producción Agrícola en la Facultad de Ciencias Agropecuarias de la Universidad Autónoma del Estado de Morelos, donde se seleccionaron aquellas que no presentaran daños de patógenos y que tuvieran al menos dos flores basales abiertas. Se recortaron aproximadamente 100 espigas de cada variedad a 40 cm, y en cada grupo se formaron dos lotes de 50 inflorescencias, los cuales se colocaron bajo cuatro soluciones conservadoras (Cuadro 1).
Cuadro 1 Soluciones conservadoras evaluadas sobre la vida poscosecha de nardo ‘Mexicano’ y ‘Perla’.
| Producto | Concentración | pH | Conductividad eléctrica (μS·cm-1) |
|---|---|---|---|
| Crystal® | 10 g·L-1 | 3.45 | 387 |
| Sac + AC + HQC | 2 % +100 mg·L-1 + 100 mg·L-1 | 3.63 | 183 |
| AAsc | 200 mg·L-1 | 3.54 | 133 |
| Agua | Testigo | 5.3 | 8 |
Sac = sacarosa; AC = ácido cítrico; HQC = hidroxiquínoleína citrato; AAsc = ácido ascórbico.
Diseño experimental
Se utilizó agua destilada para la preparación de las soluciones conservadoras (tratamientos), las cuales contenían Sac + AC + HQC, AAsc o Crystal®, y el testigo fue un grupo de espigas que se mantuvo sólo en agua destilada (Cuadro 1). A cada solución se le determinó pH y conductividad eléctrica (CE) con ayuda de unos sensores (LAQUAtwin pH-33 y CE-33, Horiba®, Japón). Las inflorescencias se colocaron bajo condiciones de laboratorio (22 ± 2 °C, 60 % HR y 120 mmol·m2·s-1 de intensidad luminosa). El diseño experimental fue completamente al azar, donde la fuente de variación fueron las soluciones conservadoras, la unidad experimental fue una espiga, y se tuvieron ocho repeticiones para medir las variables no destructivas y seis repeticiones para las variables destructivas. Los muestreos se realizaron cada 2 días.
Variables respuesta
Una de las variables no destructivas fue la apariencia, para la cual se utilizó una escala hedónica donde 5 fue excelente (espigas con flores turgentes), 4 fue buena (espigas con borde de las flores con signos iniciales de deshidratación), 3 fue regular (espigas con las primeras flores basales marchitas), 2 fue mala (espigas con 10 % de las flores marchitas) y 1 se consideró senescente (flores con más de 25 % de flores marchitas); cuando las flores alcanzaron la clasificación 2, se consideraron sin valor comercial. Otra variable evaluada fue el consumo de agua; para ello, se colocaron las inflorescencias en probetas de 1 L (con 500 mL de la solución conservadora) sin realizar cambio de agua y se registró el cambio de volumen cada 2 días hasta finalizar el experimento. El peso fresco relativo se midió en cada espiga con una balanza digital (Ohaus®, EUA), considerándose como 100 % el peso inicial; esta variable se determinó en forma paralela al consumo de agua. El número de flores abiertas acumuladas se obtuvo de cada espiga, de la parte basal hacia la aparte apical.
Las variables destructivas fueron la respiración o producción de CO2, los azúcares totales y la actividad específica de la superóxido dismutasa (SOD). La respiración se cuantificó mediante un sistema estático (Salveit, 2016), el cual consistió en colocar una espiga de nardo en un recipiente de plástico con capacidad de 4 300 mL cerrado herméticamente durante 3 h. Posteriormente, se tomó 1 mL de gas del espacio de cabeza a través de una septa del recipiente para inyectarlo en un cromatógrafo de gases (789A GC, Agilent Technologies, EUA), el cual tenía una columna tipo abierta, con empaques de capa porosa de sílica, conectada simultáneamente a un detector de conductividad térmica. Las condiciones del equipo fueron 150, 80 y 170 °C para el inyector, horno y detector, respectivamente. Se utilizó nitrógeno como gas de arrastre. La cuantificación del CO2 se realizó con un estándar de 460 mg·L-1 proporcionado por Infra S.A. de C.V. (México).
Los azúcares totales se determinaron a partir del método de Antrona (Whitam et al., 1971). Se tomó 1 g de pétalo de dos flores en la parte media de cada espiga y se picó finamente, se agregaron 20 mL de alcohol al 80 % y se sometió a ebullición durante 10 min. La mezcla se mantuvo en refrigeración por 15 días; posteriormente, se filtró, se tomó 1 mL de la solución, se evaporó y se hizo una dilución (1:20); de cual se tomó 1 mL, se ajustó el volumen a 3 mL con agua destilada, se agregaron 6 mL del reactivo de Antrona y se agitó la mezcla (Vortex-Genie 2, Scientific Industries, EUA). Al mismo tiempo, se preparó un blanco al que se le añadieron 3 mL de agua destilada y 6 mL del reactivo de Antrona (0.4 g·L-1); la reacción se llevó a cabo en agua fría. Los tubos se llevaron a ebullición en baño María y después se sumergieron en agua fría. Finalmente, se tomaron lecturas de absorbancia a 600 nm en un espectrofotómetro (Uv-vis GENESYS™ 10S, Thermo Fisher, EUA). La cuantificación de los azúcares se realizó mediante una curva de calibración con glucosa.
Para determinar la actividad específica de la SOD, se tomaron 10 flores de la parte media hacia el ápice de la espiga, y los pétalos de las flores se utilizaron para elaborar polvo de acetona (PAc) (Alia-Tejacal et al., 2005). Los PAc se obtuvieron a partir de 15 g de pétalos más 25 mL de acetona en congelación (-15 °C); la mezcla se homogeneizó (T 25 digital Ultra-turrax®, IKA, EUA) por 25 s y se filtró al vacío en un embudo Buchner. Después de homogeneizar y filtrar en tres ocasiones, el extracto se dejó secar en cajas de Petri a temperatura ambiente (22 ± 2 °C); pasadas 5 h, se pesó y se guardó en el congelador (-20 °C) en bolsas de plástico hasta su posterior análisis. El peso del PAc se determinó en función de la relación del peso fresco de flores maceradas entre el peso del polvo seco.
A partir del PAc se realizó la extracción y cuantificación de la actividad de la SOD (EC. 1.15.1.1). El procedimiento inició a partir de 0.1 g de polvo de acetona, al cual se le adicionaron 5 mL de buffer Tris-HCl (0.1 M, pH 7.8) y se homogeneizaron por 20 s; posteriormente, la mezcla se colocó en una centrífuga (Z 326 K, HERMLE, EUA) a 12 096 g durante 30 min a 4 °C y se reservó el sobrenadante. Para el ensayo enzimático, se empleó la metodología propuesta por Beyer y Fridovich (1987), en la cual se mezclaron 27 mL de buffer de fosfatos (0.1 mM y pH 7.8 + EDTA), 1.5 mL de L-metionina (30 mg·mL-1), 1 mL de nitroazul de tetrazolio (1.41 mg·mL-1) y 0.75 mL de Triton X-100 al 1 %. A 3 mL de esta mezcla se le adicionaron 0.5 mL del sobrenadante y 0.03 mL de riboflavina (4.4 mg·100 mL-1); la mezcla se agitó e iluminó por 7 min con luz fluorescente y, posteriormente, las lecturas se hicieron en absorbancia a 560 nm en un espectrofotómetro.
El incremento en absorbancia, debido a la formación de nitroazul de tetrazolio formazan (NBTF), por unidad de tiempo equivale a la velocidad de reacción, y la absorbancia en ausencia o en presencia de varias cantidades de sobrenadante con SOD se utilizó para determinar el número de unidades por mililitro de SOD en la solución. La actividad enzimática se reportó como actividad específica (U·mg prot-1), donde U es una unidad enzimática de SOD y es igual a la cantidad de sobrenadante que foto-inhibe el 50 % de la formación de NBTF (Giannopolities & Ries, 1977; Stauffer, 1989).
La proteína soluble se determinó por el método de Bradford (1976). Para ello, se preparó una mezcla con 0.05 g de PAc y 5 mL de Tris-HCl (0.1 M, pH 7.8), y se homogeneizó por 10 s. Después, la mezcla se centrifugó a 12 096 g durante 30 min a 4 °C. Del sobrenadante, se tomaron 0.1 mL y se mezclaron con 5 mL de una solución de azul de Coomassie. La mezcla se agitó y se midió su absorbancia a 595 nm después de 12 min en un espectrofotómetro. La cuantificación se hizo a partir de una curva de calibración con albúmina de bovino.
Análisis de datos
Los datos se sometieron a un análisis de varianza y una comparación de medias de Tukey (P ≤ 0.05). Se utilizó el paquete estadístico SAS (SAS Institute, 1999) para el análisis de datos, así como los comandos GLM y MEANS (Castillo-Márquez, 2011).
Resultados y discusión
La variedad ‘Mexicano’, con diferentes soluciones conservadoras, aumentó su peso fresco relativo al tercer día: 13 % con Crystal®, 9 % con Sac + AC + HQC y 5 % con AAsc. Posteriormente, el peso fresco relativo se mantuvo en las espigas tratadas con Crystal®, y con el resto de los tratamientos disminuyó más de 100 % (Figura 1A). En la variedad ‘Perla’ se tuvo un aumento significativo entre 11 y 18 % de peso fresco con Crystal® y AAsc, después de 3 y 5 días de evaluación, respectivamente, manteniéndose así aun después de 7 días (Figura 1B). Las espigas del testigo, tanto ‘Mexicano’ como ‘Perla’, mostraron el menor peso fresco a partir del tercer día (Figura 1 A y 1B). En poscosecha, el comportamiento del peso fresco relativo de las flores de corte refleja el balance entre el agua que absorben y el agua que pierden por transpiración a través de los estomas de las hojas y, en algunos casos, de las flores (van Doorn, 2012). En ambas variedades de nardo, la solución con Crystal® favoreció el consumo de agua y, probablemente, el cierre de estomas.
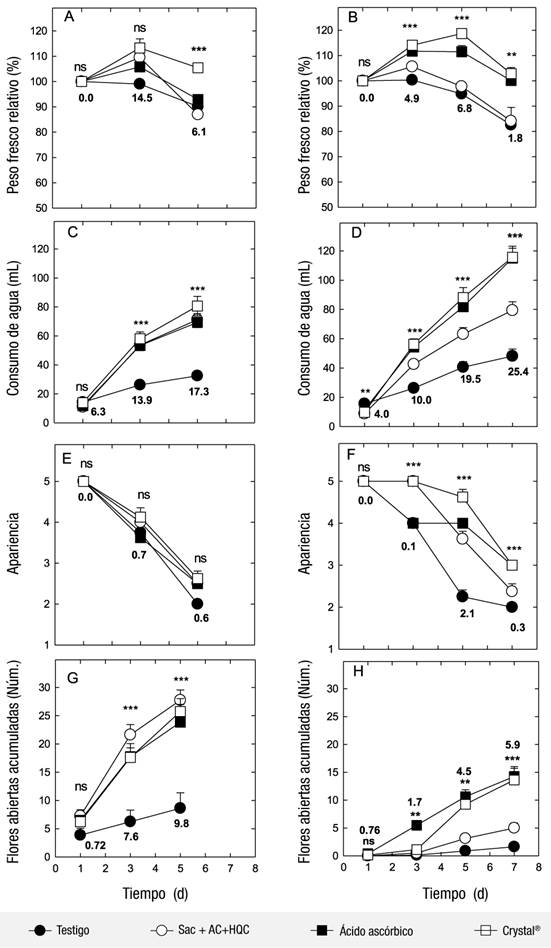
Figura 1 Cambios en el peso fresco relativo, consumo de agua, apariencia y flores abiertas en dos variedades nativas de nardo: ‘Mexicano’ (A, C, E y G) y ‘Perla’ (B, D, F y H), sometidas a diferentes soluciones conservadoras (Crystal®, sacarosa [Sac] + ácido cítrico [AC] + hidroxiquinoleína citrato [HQC] o ácido ascórbico). Cada punto representa la media de ocho observaciones ± su error estándar. Las notaciones ns, *, ** y *** indican significancia estadística con 0.05, 0.01 y <0.0001, respectivamente. Números en negro indican diferencia mínima significativa (Tukey, P ≤ 0.05).
En ‘Mexicano’, el consumo de agua fue entre 101 y 148 % mayor en las espigas tratadas con alguna solución nutritiva en comparación con las flores testigo (Figura 1C). En ‘Perla’, el consumo de agua fue entre 101.5 y 238.9 % mayor en las flores cuando se trataron con Crystal® o AAsc, mientras que las espigas tratadas con Sac + AC + HQC consumieron entre 54 y 64 % más que las espigas testigo (Figura 1D). En ambas variedades, las soluciones con Crystal® o AAsc mejoraron las relaciones hídricas (Figuras 1A -D).
Uno de los principales problemas del nardo en poscosecha es el taponamiento del xilema (Sao & Verma, 2020). Las soluciones conservadoras evaluadas favorecieron el consumo de agua debido a que el pH del agua disminuyó (Cuadro 1), lo que evitó el desarrollo de microorganismos en el medio y ayudó en la absorción del agua (Kumar et al., 2017). Mosqueda-Lazcares et al. (2011) evaluaron el uso de Crystal® en ocho variedades de rosa y observaron una mejora en la hidratación, ya que hubo un incremento de 69 % en el peso fresco relativo en comparación con tallos colocados en agua de la llave. Estos autores atribuyeron dicha respuesta, en parte, a que el pH de la solución de Crystal® fue de 5, el cual fue inferior al pH del agua de la llave, que estuvo entre 6.5 - 7, lo cual sugiere que se rompió la tensión superficial del agua y facilitó la absorción por los tejidos conductores del tallo de la rosa. Las soluciones conservadoras evaluadas mostraron mayor CE (Cuadro 1), esto sugiere que parte de los solutos se transportaron a las hojas y pétalos, lo que ocasionó un mayor consumo de agua (Sigma et al., 2018).
Al inicio, la apariencia de las espigas de nardo ‘Mexicano’ fue excelente, al tercer día fue buena y al quinto día regular, sin que se detectaran diferencias entre tratamientos (Figura 1E). En ‘Perla’, las espigas que se trataron con Crystal® mostraron una apariencia excelente, aun a los 5 días. A los 7 días de evaluación, las espigas con Crystal® o AAsc expusieron una apariencia regular. Por su parte, las flores testigo mostraron una apariencia mala desde los 5 días. La aplicación de Crystal® y AAsc generó un efecto positivo en ‘Perla’ (Figura 1F).
El producto Crystal® se ha evaluado en rosa y ha mejorado su vida en poscosecha, principalmente porque disminuye el pH y la acidez, además de aportar azúcares que son necesarios para la apertura floral (Mosqueda-Lazcares et al., 2011); un efecto similar se puede atribuir en nardo. El AAsc mejora la vida poscosecha en flores de corte, ya que se considera un bioregulador que en bajas concentraciones ejerce un efecto en la calidad y vida de florero, principalmente como promotor de los compuestos de las plantas (Budiarto, 2019).
En ‘Mexicano’ y ‘Perla’ no se detectaron diferencias significativas entre tratamientos en el número de flores abiertas al inicio del experimento (Figura 1G y 1H). Posteriormente, las espigas de la variedad ‘Mexicano’ colocadas en las soluciones conservadoras mostraron un mayor número de flores abiertas a los 5 días (entre 24 y 28 flores), en comparación con las espigas testigo (Figura 1G). Después de 7 días, abrieron entre 13 y 14 flores de ‘Perla’ con Crystal® y AAsc (Figura 1H). En ambas variedades, las espigas tratadas con Crystal® o AAsc mantuvieron la mayor apertura de flores (Figura 1H). Anjum et al. (2001) mencionan que dosis de AAsc entre 50 y 200 mg·L-1 incrementan la apertura floral hasta en un 41 % en comparación con el testigo (apertura de 14.21 %), lo que es similar a lo obtenido en el presente trabajo.
En rosa se ha reportado que el AAsc ayuda a mantener la apertura floral, aún después de un estrés hídrico (Jin et al., 2006). En algunas flores de corte, la aplicación de azúcares en solución favorece el comportamiento poscosecha y la apertura floral (Reid, 2009). En el presente trabajo, la solución conservadora compuesta con Sac + AC + HQC en ‘Mexicano’ también favoreció la apertura floral (Figura 1G). Lo anterior sugiere que las soluciones son importantes en nardo, esto debido a su efecto en la apertura floral.
La respiración en ‘Mexicano’ se mantuvo similar durante los tres primeros días de evaluación, y el quinto día incrementó en todos los tratamientos, a excepción de las espigas con Crystal® (Figura 2A). En ‘Perla’, la respiración aumentó a partir del tercer día en las espigas con Sac + AC + HQC y las testigo, en tanto que las espigas con Crystal® disminuyeron su respiración hasta el quinto día de evaluación, y el último día incrementó significativamente. Esta situación no ocurrió en las espigas con AAsc, las cuales mantuvieron constante su respiración (Figura 2B). Reid y Jiang (2012) indican que la vida poscosecha de flores de narciso es menor cuando la respiración incrementa, lo que ocurrió en las espigas testigo y con aplicación de Sac + AC + HQC.

Figura 2 Cambios en la respiración, azúcares totales y actividad específica de la superóxido dismutasa (SOD) en dos variedades nativas de nardo: ‘Mexicano’ (A, C, E y G) y ‘Perla’ (B, D, F y H), sometidas a diferentes soluciones conservadoras (Crystal®, sacarosa [Sac] + ácido cítrico [AC] + hidroxiquinoleína citrato [HQC] o ácido ascórbico). Cada punto representa la media de ocho observaciones ± su error estándar. Las notaciones ns, *, ** y *** indican significancia estadística con 0.05, 0.01 y <0.0001, respectivamente. Números en negro indican diferencia mínima significativa (Tukey, P ≤ 0.05).
En la concentración de azúcares totales no se detectaron diferencias significativas entre los tratamientos aplicados a nardo ‘Mexicano’ al inicio del experimento, pero a partir del tercer día las espigas tratadas con Sac + AC + HQC y AAsc tuvieron la mayor concentración de azúcares, y las tratadas con Crystal® mantuvieron la menor concentración (Figura 2C). En el quinto día, las espigas con AAsc y las testigo se mantuvieron con los valores mayores, y las espigas con Sac + AC + HQC y Crysal® con los valores menores (Figura 2C). En ‘Perla’, sólo se encontraron diferencias entre tratamientos al tercer día, donde las espigas tratadas con Sac + AC + HQC mostraron el menor contenido de azúcares. En los días posteriores, no se detectaron diferencias entre tratamientos, y la tendencia en todos los tratamientos fue decreciente.
Arief-Zargar (2016) señala que durante la senescencia de las flores el contenido de los azúcares en los pétalos disminuye, ya que son utilizados como sustratos de la respiración. No obstante, en el presente trabajo no se observó dicha asociación, ya que en ‘Mexicano’ las espigas que tuvieron la menor respiración también mostraron la menor concentración de azúcares, que fueron las tratadas con Sac + AC + HQC. En contraste, las espigas de ‘Perla’ no mostraron diferencias en el contenido de azúcares totales, mientras que en respiración se observaron claras diferencias entre tratamientos (Figura 2B). La falta de asociación entre los azúcares y la respiración se atribuye, probablemente, a que los azúcares se evaluaron en flores de la parte media de la espiga y la respiración fue de la espiga completa.
En ‘Mexicano’, la actividad específica de la SOD al inicio del experimento fue mayor en las espigas con Sac + AC + HQC, y la menor actividad fue en las espigas con AAsc. En los días posteriores, no se detectaron diferencias entre tratamientos, aunque se observó que las espigas con soluciones conservadoras incrementaron su actividad en menor proporción que las espigas testigo, lo cual fue más evidente el quinto día de evaluación (Figura 2 E). En ‘Perla’, se observaron diferencias entre tratamientos en cuanto a la actividad específica de la SOD, donde las espigas testigo mantuvieron su actividad constante durante 5 días, y el séptimo día presentaron una disminución drástica. Por su parte, las espigas con soluciones conservadoras iniciaron con baja actividad y alcanzaron su máximo al tercero, quinto y séptimo día cuando fueron tratadas con Crystal®, AAsc o Sac + AC + HQC, respectivamente. Al final del periodo, dicha actividad disminuyó drásticamente en todos los tratamientos, a excepción de las espigas tratadas con Sac + AC + HQC (Figura 2F).
Saeed et al. (2014) sugieren que una mayor actividad de la SOD en poscosecha de flores de corte se asocia con un retraso en la senescencia y, por lo tanto, mantiene una calidad adecuada por más tiempo, lo que genera una mayor vida poscosecha. Este comportamiento se observó principalmente en las espigas de ‘Perla’ tratadas con Crystal® y AAsc.
Conclusiones
Las soluciones conservadoras en las variedades de nardo ‘Mexicano’ y ‘Perla’ favorecen el consumo de agua, la apertura de flores y la actividad de la SOD; además, mantienen el peso fresco, la apariencia agradable por más tiempo y disminuyen la respiración. No se detectó efecto de las soluciones conservadoras en el contenido de azúcares. Las soluciones con Crystal® o AAsc mostraron un efecto benéfico en el comportamiento poscosecha de las espigas de nardo ‘Mexicano’ y ‘Perla’, que puede ser considerado para desarrollar tecnologías de manejo poscosecha.
Agradecimientos
El primer autor agradece al Consejo Nacional de Ciencia y Tecnología (CONACYT) por la beca de estudios de posgrado, del cual deriva el presente trabajo.
REFERENCIAS
Alia-Tejacal, I., Colinas-León, M. T., Martínez-Damián, M. T., & Soto-Hernández, R. M. (2005). Daños por frío en zapote mamey (Pouteria sapota (Jacq.) H.E. Moore and Stearn) II: Cambios en fenoles totales y actividad enzimática. Revista Fitotecnia Mexicana, 28(1), 25-32. https://www.revistafitotecniamexicana.org/documentos/28-1/4a.pdf [ Links ]
Anjum, M. A., Naveed, F., Shakeel, F., & Amin, S. (2001). Effect of some chemicals on keeping quality and vase life of tuberose (Polianthes tuberosa L.) cut flowers. Journal of Research Science, 12(1), 1-7. https://www.bzu.edu.pk/jrscience/vol12no1/1.php [ Links ]
Arief-Zargar, M. (2016). Postharvest physiology and handling of cut flowers. Scholar’s Press. [ Links ]
Barba-González, R., Rodríguez-Domínguez, J. M., Castañeda-Saucedo, M. C., Rodríguez, A., Van Tuyl J. M., & Tapia-Campos, E. (2012). Mexican geophytes I. The genus Polianthes. Floriculture and Ornamental Biothechnology, 6(1), 122-128. http://www.globalsciencebooks.info/Online/GSBOnline/images/2012/FOB_6(SI1)/FOB_6(SI1)122-128o.pdf [ Links ]
Beyer, F. W., & Fridovich, I. (1987). Assaying for superoxide activity: some large consequences of minor changes in conditions. Analytical Biochemistry, 161(2), 559-566. https://doi.org/10.1016/0003-2697(87)90489-1 [ Links ]
Bradford, M. M. (1976). A rapid and sensitive method for the quatitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry , 72(1-2), 248-254. https://doi.org/10.1016/0003-2697(76)90527-3 [ Links ]
Budiarto, K. (2019). Effects of acids on post-harvest longevity of chrysantemum cut flowers. Planta Tropika: Journal of Agro Science, 7(1), 33-40. https://doi.org/10.18196/pt.2019.091.33-40 [ Links ]
Castillo-Márquez, L. E. (2011). Introducción al SAS® para Windows. Universidad Autónoma Chapingo. [ Links ]
FloraLife. (2020). Floralife Crystal Clear®. http://www.floralife.com/cms_assets/File%20Library/FloralIfe/Spanish/14.%20FlowerFoodClear300_ProductSheet_spa.pdf [ Links ]
Giannopolities, C. N., & Ries, S. K. (1977). Superoxide dismutases: I. Ocurrence in higher plants. Plant Physiology, 59(2), 309-314. https://doi.org/10.1104/pp.59.2.309 [ Links ]
González-Vega, M. E. (2016). Polianthes tuberosa L.: Revisión de sus aspectos filogenéticos, morfológicos y de cultivo. Cultivos Tropicales, 37(3), 120-136. https://doi.org/10.13140/RG.2.1.2715.4161 [ Links ]
Jin, J., Shan, N., Ma, N., Bai, J., & Gao, J. (2006). Regulation of ascorbate peroxidase at the transcript level is involved in tolerance to postharvest water déficit stress in the cut rose (Rosa hybrida L.) cv. Samantha. Postharvest Biology and Technology, 40(3), 236-243. https://doi.org/10.1016/j.postharvbio.2006.01.014 [ Links ]
Kameswari, P. L., Girwani, A., & RadhaRani, K. (2014). Genetic diversity in tuberose (Polianthes tuberose L.) using morphological and ISSR markers. Electronic Journal of Plant Breeding, 5(1), 52-57. http://www.ejplantbreeding.org/index.php/EJPB/article/view/154 [ Links ]
Kumar, S., Barman, K., & Sharma, S. (2017). Postharvest management of comercial flowers. In: M. W. Siddiqui, & A. Ali (eds.), Postharvest management of horticutlural crops practices for quality preservation (pp: 91-150). CRC Press. [ Links ]
Kumari, S., Raghupati, B., Sarika, K., & Deb, P. (2018). Effect of different preservatives on vase-life of cut tuberose (Polianthes tuberosa L.) cv. Calcutta Single. International Journal of Current Microbiology and Applied Sciences, 7(1), 1651-1657. https://doi.org/10.20546/ijcmas.2018.701.200 [ Links ]
Mosqueda-Lazcares, G., Arévalo-Galarza, M. L., Valdovinos-Ponce, G., Rodríguez-Pérez, J. E., & Colinas-León, M. T. (2011). Época de corte y manejo poscosecha de ocho cultivares de rosa de corte. Revista Mexicana de Ciencias Agrícolas, 2(3), 591-602. http://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S2007-09342011000900015 [ Links ]
Nowak, J., & Rudnicki, R. M. (1990). Postharvest handling and storage of cut flowers, florist greens, and potted plants. Timber Press. [ Links ]
Pérez-Arias, G. A., Alia-Tejacal, I., Colinas-León, M. T., Valdez-Aguilar, L. A., & Pelayo-Zaldívar, C. (2019). Postharvest physiology and technology of the tuberose (Polianthes tuberosa L.): an ornamental flower native to Mexico. Horticulture, Environment and Biotechnology, 60, 281-293. https://doi.org/10.1007/s13580-018-00122-4 [ Links ]
Reid, M. S. (2009). Poscosecha de las flores cortadas. Manejo y recomendaciones. Hortitecnia. [ Links ]
Reid, M. S., & Jiang, C. Z. (2012). Postharvest Biology and Techno logy of cut flowers and potted plants. Horticultural Reviews, 40, 1- 54. https://doi.org/10.1002/9781118351871.ch1 [ Links ]
Saeed, T., Hassan, I., Akhtar, N., & Jilani, G. (2014). Effect of gibberellic acid on the vase life and oxidative activities in senescing cut gladiolus flowers. Plant Growth Regulation, 72, 89-95. https://doi.org/10.1007/s10725-013-9839-y [ Links ]
Salunkhe, D. K., Bhat, N. R., & Desai, B. B. (1990). Postharvest biotechnology of flowers and ornamentals plants. Springer-Verlag. [ Links ]
Salveit, M. E. (2016). Respiratory metabolism. In: S. Pareek (ed.), Postharvest Ripening Physiology of Crops (pp. 139-156). CRC Press - Taylor and Francis. [ Links ]
Sao, B., & Verma, L. S. (2020). Review on impact of different preservative solutions on vase-life of tuberose (Polianthes tuberosa L.) cut flowers. Journal of Pharmacognosy and Phytochemistry, 9(1), 1185-1188. https://www.phytojournal.com/archives/?year=2020&vol=9&issue=1&ArticleId=10617 [ Links ]
SAS Institute. (1991). SAS/STAT User´s guide version 8. SAS Institute. [ Links ]
Sigma, T. N., Hoque, M. A., & Hossain, M. M. (2018). Effect of different preservatives on vase life of tuberose. Journal of Crop Science and Technology, 7(3), 10-15. https://doi.org/10.13140/RG.2.2.33556.35204 [ Links ]
Servicio de Información Agroalimentaria y Pesquera (SIAP). (2020). Cierre de la producción agrícola por cultivo (1980 - 2018). https://nube.siap.gob.mx/cierreagricola/ [ Links ]
Stauffer, C. E. (1989). Enzyme assays for food scientists. Van Nostrand Reinhold. [ Links ]
van Doorn, W. G. (2012) Water relations of cut flowers: An update. Horticultural Reviews , 40, 55-106. https://doi.org/10.1002/9781118351871.ch2 [ Links ]
Vázquez-García, L. M. (2004). Nardo (Polianthes spp.) y amolli (Manfreda spp.). Recursos fitogenéticos ornamentales de México. Universidad Autónoma del Estado de México. [ Links ]
Wahitaka, K., Reid, M. S., & Dodge, L. L. (2001). Cold storage and flower keeping quality of cut tuberose (Polianthes tuberosa L.). Journal of Horticultural Science & Biotechnology, 76(3), 271-275. https://doi.org/10.1080/14620316.2001.11511362 [ Links ]
Whitam, F. F., Blaydes, D. F., & Devlin, R. M. (1971). Experiments in plant physiology. Van Nostrand Reinhold. [ Links ]
Recibido: 19 de Abril de 2020; Aprobado: 13 de Noviembre de 2020











 texto em
texto em 


