Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Ingeniería agrícola y biosistemas
versão On-line ISSN 2007-4026versão impressa ISSN 2007-3925
Ing. agric. biosist. vol.11 no.1 Chapingo Jan./Jun. 2019 Epub 24-Fev-2020
https://doi.org/10.5154/r.inagbi.2017.10.013
Artículo científico
Influencia de la zona geográfica y fracción del lirio acuático en su composición química
1Universidad Politécnica de Pachuca, Departamento de Biotecnología. Carretera Pachuca-Ciudad Sahagún km 20, Zempoala, Hidalgo, C. P. 43830, MÉXICO.
2Universidad Autónoma Metropolitana-Iztapalapa, Departamento de Biotecnología. Avenida San Rafael Atlixco núm. 186, Colonia Vicentina, Ciudad de México, C. P. 09340, MÉXICO.
3Universidad Juárez Autónoma de Tabasco, División Académica de Ciencias Biológicas. Carretera Villahermosa-Cárdenas km 0.5, Villahermosa, Tabasco, C. P. 86039, MÉXICO.
4Universidad de Guadalajara, Centro Universitario de Ciencias Exactas e Ingenierías. Blvd. Marcelino García Barragán núm. 1421, Guadalajara, Jalisco, C. P. 44430, MÉXICO.
Introducción:
El lirio acuático (Eichhornia crassipes) es una especie tropical que posee características con potencial biotecnológico; sin embargo, su composición química puede variar en función de la zona geográfica y las condiciones climáticas, lo cual influye en su uso final.
Objetivo:
Evaluar el efecto del lugar de colecta (Ciudad de México, Hidalgo, Jalisco y Tabasco) y la sección de la planta de Eichhornia crassipes sobre su composición química para aplicaciones biotecnológicas.
Metodología:
El lirio acuático se seccionó en tres partes y se analizó para establecer una relación de acuerdo con la zona geográfica de colecta.
Resultados:
Se observó un comportamiento heterogéneo; tanto la zona geográfica como la sección de la planta tienen un impacto fuerte en la composición de la planta. La mayor concentración de cenizas se observó en las muestras de Tabasco (25 % en tallos y 16 % en hojas), mientras que la concentración de lignina fue mayor en las muestras de Hidalgo (11 % en hojas y 6 % en tallos). Por su parte, los compuestos extraíbles en solventes fueron mayores en los tallos de todas las muestras, y los extraíbles en agua fueron superiores en las hojas. El contenido de holocelulosa fue el constituyente con menos variabilidad.
Limitaciones del estudio:
Se colectaron muestras de solo tres zonas geográficas de México, por lo que se hace necesario extender el estudio a más regiones.
Originalidad:
Es el primer estudio que se realiza en México que compara tanto el efecto de la zona de colecta como la fracción del lirio acuático sobre su composición química.
Conclusiones:
Para el procesamiento del lirio acuático es importante tomar en cuenta la zona geográfica y la fracción de la planta.
Palabras clave Eichhornia crassipes; holocelulosa; lignina; extraíbles en solventes; extraíbles en agua
Introduction:
The water hyacinth (Eichhornia crassipes) is a tropical species that has characteristics with biotechnological potential; however, its chemical composition may vary depending on the geographical area and climatic conditions, which influences its end use.
Objective:
To evaluate the effect of the collection site (Mexico City, Hidalgo, Jalisco and Tabasco) and morphological part of the Eichhornia crassipes plant on its chemical composition for biotechnological applications.
Methodology:
The water hyacinth was sectioned into three parts and analyzed to establish a relationship according to the geographical collection area.
Results:
Heterogeneous behavior was observed; both the geographical area and the plant section have a strong impact on the plant’s chemical composition. The highest ash concentration was observed in the Tabasco samples (25 % in stalks and 16 % in leaves), while the lignin concentration was the highest in the Hidalgo samples (11 % in leaves and 6 % in stalks). On the other hand, solvent-extractable compounds were highest in the stalks of all samples, and water-extractable compounds were highest in the leaves. Holocellulose content was the constituent with the least variability.
Study limitations:
Samples were collected from only three geographical areas of Mexico, so it is necessary to extend the study to more regions.
Originality:
This is the first study carried out in Mexico that compares both the effect of the collection area and the section of the water hyacinth on its chemical composition.
Conclusions:
For the processing of the water hyacinth, it is important to take into account the geographical area and the plant part.
Keywords Eichhornia crassipes; holocellulose; lignin; solvent extractives; water extractives
Introducción
El lirio acuático (Eichhornia crassipes) es una especie tropical flotante originaria de Brasil y, posiblemente, de algunos países centroamericanos. Presenta un crecimiento rápido y se ha reportado su distribución en varias partes del mundo, principalmente entre los 40° de latitud norte y sur, incluyendo Sudáfrica y algunos países como India y Estados Unidos (Center, 1994; Hellmann, Byers, Bierwagen, & Dukes, 2008). En su hábitat natural, el lirio acuático juega un rol de gran importancia debido a que provee refugio y zonas de alimentación a los peces, fitoplancton y zooplacton (Villamagna & Murphy, 2010), además, posee características con potencial biotecnológico. Sin embargo, en grandes cantidades, esta especie presenta efectos negativos para el ambiente, la salud humana y la economía, ya que afecta directamente la vida acuática de los cuerpos de agua dulce (Epstein, 1998) y no existe un control biológico que evite su proliferación desmedida (Humphrey & Dube, 2018).
Esta planta es capaz de desarrollarse en aguas con alto contenido de nutrientes, ya que tolera grandes variaciones de nutrientes, pH y temperatura (entre 1 y 40 °C); aunque su pH óptimo es entre 6 y 8 (Wilson, Holst, & Rees, 2005). La velocidad de crecimiento del lirio acuático incrementa cuando hay niveles altos de nitrógeno disuelto en el agua (Heard & Winterton, 2000), y se ha observado que niveles de salinidad de 6 a 8 % resultan letales para la planta (Olivares & Colonnello, 2000).
Uno de los principales problemas que genera el lirio acuático es que, debido a su alta velocidad de crecimiento, cubre rápidamente las superficies de los cuerpos de agua, lo que evita el paso de la luz y, por consiguiente, bloquea los procesos fotosintéticos de la flora acuática, reduciendo el oxígeno disuelto en el agua. Además, se ha descrito su papel antagónico en el crecimiento de otros organismos acuáticos, lo cual reduce la diversidad biológica (Brendonck et al., 2003). Esta especie es capaz de duplicar su población en solo cinco días, y se han llegado a contabilizar hasta dos millones de plantas por hectárea, con un peso de 200 a 400 t, por lo que además genera graves problemas de navegación, recreación, irrigación y generación de electricidad (Epstein, 1998).
Para el control del lirio acuático, se han desarrollado modelos matemáticos de crecimiento, y se ha observado que en condiciones controladas su crecimiento sigue un comportamiento logístico (Wilson et al., 2005); no obstante, esto no ha sido suficiente para evitar todos los problemas que causa en zonas donde se le considera como especie invasiva. Actualmente se utilizan métodos químicos (herbicidas), agentes de control biológico y remoción física para controlar su crecimiento (Harley, Julien, & Wright, 1996). Es un hecho que un solo método es poco eficiente, por lo que se hace necesario el uso simultáneo de varias técnicas de eliminación (Gutiérrez, Ruiz, Uribe, & Martínez, 2000); de aquí la importancia de generar alternativas de procesamiento.
El lirio acuático contiene entre 92.8 y 95 % de agua, de 4.2 a 6.1 % de compuestos volátiles, de 18.2 a 19 % de celulosa, de 48.7 a 50 % de hemicelulosa, de 3.5 a 3.8 % de lignina y de 13 a 13.5 % de proteína cruda (Nigam, 2002), por lo que puede ser utilizado en una amplia variedad de procesos (Malik, 2007); sin embargo, es importante considerar que estas concentraciones pueden variar en función de la zona geográfica y las condiciones climáticas (Boyd & Vickers, 1971).
Los usos más comunes del lirio acuático son la producción de etanol (Aswathy et al., 2010; Guragain, Coninck, Husson, Durand, & Rakshit, 2011; Nigam, 2002), la producción de enzimas fúngicas (Deshpande, Nair, & Khedkar, 2009; Pramanik, 2010; Wang, Liu, Ning, Liao, & Jia, 2017), la remoción de metales pesados en agua (Mahamadi & Nharingo, 2010; Mishra & Tripathi, 2009; Muramoto & Oki, 1983; Saraswat & Rai, 2010), la fitorremediación (Jayaweera & Kasturiarachchi, 2004), la producción de biogás (Kivaisi & Mtila, 1997) y como fertilizante orgánico (Khaket, Singh, Dhanda, Singh, & Singh, 2012).
Diversos investigadores han analizado los componentes del lirio acuático de diferentes zonas geográficas. Lara-Serrano et al. (2016) estudiaron muestras de dos zonas geográficas de México (Durango y Guanajuato), y encontraron diferencias en cenizas, holocelulosa y extraíbles totales, mientras que Lakshminarayana, Rao, Pantulu, y Thyagarajan (1984) observaron diferencias en la composición de lípidos en raíces, tallos, hojas y flores. Por ello, para generar estrategias de aprovechamiento de esta especie, es fundamental conocer la influencia que tiene la zona geográfica y las partes de la planta sobre su composición. En este sentido, el objetivo del presente trabajo fue evaluar el efecto de la zona de colecta y la sección de la planta de Eichhornia crassipes sobre su composición química en cuatro zonas geográficas de México (Ciudad de México, Hidalgo, Jalisco y Tabasco), con el fin de determinar la presencia de los principales componentes de esta especie para posibles aplicaciones biotecnológicas.
Materiales y métodos
Obtención de las muestras
Las muestras se colectaron en cuatro zonas de junio a agosto de 2016: presa San Antonio (Huasca de Ocampo, Hidalgo: 20° 13’ 40” latitud norte y 98° 33’ 45” longitud oeste), embarcadero de Cuemanco (Ciudad de México: 19° 16’ 06” latitud norte y 99° 06’ 15” longitud oeste), lago de Chapala (Jalisco: 19° 16’ 32” latitud norte y 99° 06’ 05” longitud oeste) y Villahermosa (Tabasco: 18° 10’ 99” latitud norte y 93° 10’ 92” longitud oeste).
Preparación de las muestras
Se tomaron 50 especímenes por zona de colecta, dentro de los cuales había plantas maduras, medianas y jóvenes; esto se hizo en la misma época del año para que el efecto de la edad de la planta sobre la composición química fuera mínima. Las plantas se lavaron con agua fría, se seccionaron y se clasificaron: hoja chica (HC) y tallo chico (TC), hoja mediana (HM) y tallo mediano (TM), hoja grande (HG) y tallo grande (TG), para las partes superior, media e inferior de la planta, respectivamente (Figura 1). Las muestras se secaron a 60 °C durante 36 h con un horno de convección (DHG-9000J, MTI Corporation, EUA), posteriormente se molieron, se cribaron en una malla 40 (0.425 mm), se colocaron en bolsas oscuras y se almacenaron en un lugar fresco y seco para su análisis.
Análisis químicos
Material extraíble en solventes orgánicos. Se utilizó la norma TAPPI T-204 om-88 mediante un sistema Soxhlet y hexano como solvente. Para el análisis se usaron 10 g de cada muestra.
Material extraíble en agua. Se empleó la norma TAPPI T-207 om-93 en el residuo resultante de la extracción con solventes.
Contenido de cenizas. Se determinó de acuerdo con la norma TAPPI T-211 om-93, para lo cual se utilizó 1 g de muestra.
Lignina insoluble en ácido. A partir de 1 g de muestra se determinó el porcentaje de lignina presente por diferencia de peso de acuerdo con la norma TAPPI T-222 om-88.
Contenido de holocelulosa. A 2 g de muestra se le adicionaron 100 mL de clorito de sodio al 1.5 % y ácido acético glacial. La reacción se llevó a cabo a 75 °C durante 5 h. Posteriormente, la mezcla se filtró en un crisol Gooch, se lavó con acetona y se secó a 105 °C por 1 h. El porcentaje de holocelulosa se determinó por diferencia de peso entre el inicial y el final.
Todas las muestras se analizaron por triplicado y los resultados se expresaron como porcentaje en base seca.
Resultados y discusión
Para identificar diferencias significativas entre las fracciones, se realizó un análisis estadístico multivariado (Cuadro 1), el cual indicó que tanto las fracciones (hojas y tallos) como las zonas de colecta (los cuatro estados de México) presentaron un efecto significativo sobre las variables evaluadas. Mientras que en los resultados del análisis de DMS, se observa que el porcentaje de cenizas, extraíbles en solvente y en agua (Figura 2) presentaron una mayor diferencia estadística (α ≤ 0.05) en las muestras provenientes de Jalisco.
Cuadro 1 Prueba multivariada de significancia para las fracciones analizadas (hojas y tallos) y estados de México (Ciudad de México, Hidalgo, Jalisco y Tabasco).
| Value | F | Efecto | Error | P | |
|---|---|---|---|---|---|
| Intercepto | 0.000051 | 171652.4 | 5 | 44.0000 | 0.00 |
| Estado | 0.000011 | 494.6 | 15 | 121.8660 | 0.00 |
| Fracción | 0.000446 | 46.0 | 25 | 164.9547 | 0.00 |
| Estado x fracción | 0.000051 | 19.7 | 75 | 214.9682 | 0.00 |

Figura 2 Gráficas del análisis de diferencia mínima significativa (DMS) de las muestras de lirio acuático. HC = hoja chica; TC = tallo chico; HM = hoja mediana; TM = tallo mediano; HG = hoja grande; TG = tallo grande.
En cuanto a la composición se observaron grandes diferencias, tanto en las fracciones analizadas como en la zona de colecta, siendo el contenido de holocelulosa (celulosa + hemicelulosa) el que tuvo menor variación (Figura 3C). En cuando al contenido de cenizas, las muestras provenientes de la Ciudad de México, Hidalgo y Tabasco presentaron, en promedio, 16.16, 17.56 y 19.8 %, respectivamente (Figura 3), y no mostraron diferencias estadísticas significativas entre sí (Figura 2). Las muestras que tuvieron la menor concentración fueron las procedentes de Jalisco, y las de Tabasco fueron las mayores (Figura 3A). Gao, Chen, Yuan, Huang, y Yan (2013) reportan un contenido de cenizas de 45 % y Ma et al. (2010) de 2.8 %, ambos de lirio colectado en China, pero de diferentes zonas, lo que podría evidenciar el efecto de la zona geográfica sobre la composición química de la planta.
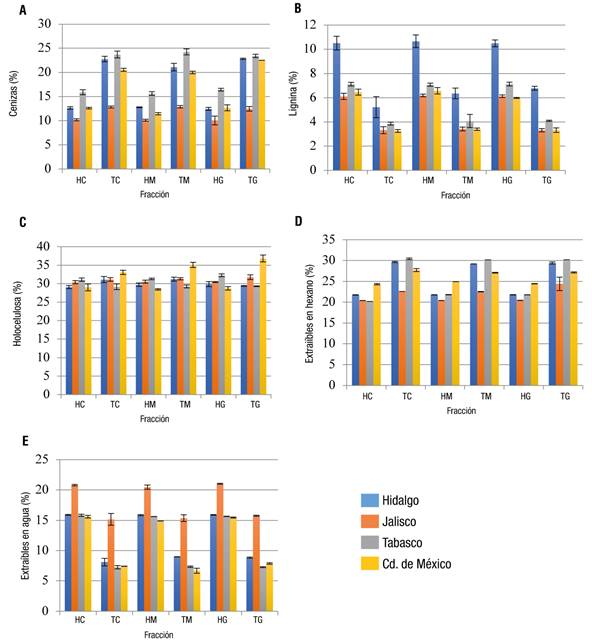
Figura 3 Concentración de los principales componentes del lirio acuático. HC = hoja chica; TC = tallo chico; HM = hoja mediana; TM = tallo mediano; HG = hoja grande; TG = tallo grande.
Atehortua y Gartner (2013) mencionan que es posible que el incremento en el contenido de cenizas se deba a una mayor adsorción de metales presente en el agua, los cuales permanecen estables durante la calcinación; en este sentido, dicho incremento podría ser un indicativo de contaminación de los cuerpos acuíferos del lugar de colecta del lirio. Lara-Serrano et al. (2016) encontraron grandes diferencias en el contenido de cenizas de lirio acuático de dos zonas geográficas de México (Durango y Guanajuato), siendo mayor en las muestras de Durango (26 %) que en las de Guanajuato (14.6 %), debido, probablemente, a las diferentes concentraciones de elementos como silicio, magnesio, cloruros, potasio, calcio y hierro. En general, en la Figura 3A se observa que el tallo presenta mayor cantidad de cenizas, esto debido a que funciona como un sistema vascular que permite el flujo de nutrientes hacia las hojas y viceversa; además, es probable que los metales presentes en el agua sean absorbidos con mayor facilidad por este sistema.
Por otro lado, el mayor porcentaje de lignina se observó en las muestras colectadas en el estado de Hidalgo, en promedio 8 % (Figura 3B), y en todas las zonas de colecta el mayor porcentaje lo presentaron las hojas. Esto coincide con Balasubramanian, Arunachalam, Da, y Arunachalam (2012), quienes encontraron mayor contenido de lignina en hojas que en raíces de lirio acuático colectado en tres zonas geográficas de la India. La lignina juega un papel de suma importancia, ya que además de proteger a la planta contra el ataque de diversos organismos, forma parte de los sistemas vasculares y de soporte de la planta; por ello, al ser el lirio una planta de superficie donde las hojas son las responsables de su flotabilidad, es de suponerse que la lignina se presente en mayor cantidad en esta parte de la planta.
Neiff, Casco, y de Neiff (2008) determinaron que la cantidad de lignina en E. crassipes está en función de los niveles de agua de los lagos donde crece, y que periodos largos de confinamiento de la planta provocan incremento en la concentración de lignina. Es probable que en el estado de Hidalgo se tenga poco intercambio de agua y con bajos niveles, lo que explicaría, en parte, los altos porcentajes de lignina encontrados en el lirio colectado en este estado. Por su parte, el lirio proveniente de Jalisco y de la Ciudad de México presentaron las menores concentraciones de lignina, en promedio 4.6 y 4.7 %, respectivamente (Figura 3); valores muy similares a los descritos por Nigam (2002), y Sornvoraweat y Kongkiattikajorn (2010), y por debajo de los reportados por Gao et al. (2013) (17 % de lignina en lirio del río Liuxi, en China) y Ma et al. (2010) (29.3 % de lignina en lirio colectado en China).
En general, la mayor cantidad de extraíbles en solventes se presentó en los tallos de todas las muestras (Figura 3D); en donde las muestras de Jalisco presentaron la mayor diferencia estadística significativa (Figura 2). Los resultados obtenidos concuerdan con lo descrito por Silva, de Melo, Silvestre, y Silva (2015), quienes reportaron en E. crassipes una concentración de extraíbles en solventes de 31.49 y 24.23 % para tallo y hojas, respectivamente; aunque son inferiores a los reportados por Lakshminarayana et al. (1984) (64.4 % de extraíbles en solventes en hojas y tallos). Los principales compuestos extraíbles pueden ser ceras, resinas, ácidos grasos y sus ésteres, sustancias insaponificables y clorofila ( Sluiter et al., 2005). Se ha descrito que este tipo de compuestos pueden actuar como catalizadores en la oxidación de lignocelulosa, específicamente de la hemicelulosa y la lignina (Burgois, Bartholin, & Gutonnet, 1989), y que la edad de la planta tiene un efecto importante en su concentración.
Para el caso de los compuestos extraíbles en agua, se pudo observar que la mayor cantidad se presentó en las hojas (Figura 3E). En el proceso de extracción en agua se obtienen carbohidratos no estructurales, sales y algunas sustancias nitrogenadas. Las muestras colectadas en Jalisco presentaron el mayor porcentaje de extraíbles acuosos, con un valor promedio de 20 % en hojas y 15 % en tallos, lo que concuerda con lo reportado por Tan et al. (2008). Estos resultados sugieren que hay un efecto tanto de la zona de colecta como de la fracción de la planta.
Finalmente, el contenido de holocelulosa fue muy parecido en todas las fracciones, aunque fue ligeramente mayor en las muestras colectadas en la Ciudad de México (Figura 3C). Los carbohidratos presentes en la holocelulosa son de gran interés, ya que se pueden emplear en una gran variedad de procesos biotecnológicos, como la producción de bioetanol (Guragain et al., 2011). La concentración de holocelulosa encontrada (alrededor de 32 %) difiere con lo descrito por otros autores, lo que puede deberse a las diferencias climáticas, edad de la planta, altitud, zona geográfica, entre otras cosas.
Balasubramanian et al. (2012) observaron que la cantidad de holocelulosa en lirio acuático colectado en tres diferentes cuerpos de agua en India no era consistente, debido a que varió de 68.8 a 78. 6 %; además, encontraron que dicho porcentaje se veía afectado por la parte de la planta (raíces, peciolos u hojas). Los contenidos de holocelulosa reportados por otros autores en muestras de E. crassipes, provenientes de zonas geográficas diferentes, fueron: 53.3 % (Abraham & Kurup, 1996), 66.9 % (Nigam, 2002), 52.9 % (Gunnarsson & Petersen, 2007), 67.6 % (Kumar, Singh, & Ghosh, 2009), 51.7 % (Sornvoraweat & Kongkiattikajorn, 2010), 47.5 % (Ma et al., 2010) y 41.6 % (Gao et al., 2013).
Por otra parte, el Cuadro 2 presenta los resultados del análisis de contraste (comparación entre medias), y se puede observar que la relación Estado-Fracción no presentó diferencia significativa; es decir, que tanto los tallos como las hojas (fracciones) de las plantas colectadas en un mismo estado no presentan diferencias significativas. El resto de las comparaciones mostraron diferencias entre sí. A manera de ejemplo, la relación Estado-Cenizas implica que el contenido de cenizas de las plantas es diferente en cada uno de los estados. En general, el análisis de contraste indicó que tanto las fracciones (hoja y tallo), como los componentes (cenizas, extraíbles en agua, en solvente y contenido de holocelulosa) y el estado (Ciudad de México, Hidalgo, Jalisco y Tabasco) presentan diferencias estadísticas cuando se comparan entre sí.
Cuadro 2 Análisis de contraste entre las diferentes fracciones estudiadas (α ≤ 0.05).
| Contraste | Significancia | Diferencia | +/- Límites |
|---|---|---|---|
| Estado - Fracción | - | -1.0 | 1.06071 |
| Estado - Cenizas | * | -13.8471 | 1.06071 |
| Estado - Lignina | * | -3.37039 | 1.06071 |
| Estado - Holocelulosa | * | -28.3097 | 1.06071 |
| Estado - ES1 | * | -22.2604 | 1.06071 |
| Estado - EA | * | -10.792 | 1.06071 |
| Fracción - Cenizas | * | -12.8471 | 1.06071 |
| Fracción - Lignina | * | -2.37039 | 1.06071 |
| Fracción - Holocelulosa | * | -27.3097 | 1.06071 |
| Fracción - ES | * | -21.2604 | 1.06071 |
| Fracción - EA | * | -9.79203 | 1.06071 |
| Cenizas - Lignina | * | 10.4767 | 1.06071 |
| Cenizas - Holocelulosa | * | -14.4626 | 1.06071 |
| Cenizas - ES | * | -8.41326 | 1.06071 |
| Cenizas - EA | * | 3.05508 | 1.06071 |
| Lignina - Holocelulosa | * | -24.9393 | 1.06071 |
| Lignina - ES | * | -18.89 | 1.06071 |
| Lignina - EA | * | -7.42164 | 1.06071 |
| Holocelulosa - ES | * | 6.04934 | 1.06071 |
| Holocelulosa - EA | * | 17.5177 | 1.06071 |
| ES - EA | * | 11.4683 | 1.06071 |
1ES = compuestos extraíbles en solventes; EA = compuestos extraíbles en agua.
Debido a la variabilidad observada entre las muestras y para determinar si la zona de colecta influye en la composición de la planta, a partir del análisis de DMS se formaron grupos homogéneos (Cuadro 3). Se puede observar que en el contenido de cenizas, las muestras provenientes de Jalisco, que fueron las que presentaron menor cantidad de este compuesto, no mostraron diferencias con respecto a las muestras de la Ciudad de México en la fracción de HM. Para el caso de la lignina, la mayor cantidad se detectó en las muestras de Hidalgo, estado que no formó grupos en ninguna fracción, mientras que la lignina presente en TC, TM y TG no difiere estadísticamente entre sí, ya que se forman los mismos grupos.
Cuadro 3 Formación de grupos homogéneos a partir del análisis de la diferencia mínima significativa (DMS) de las muestras provenientes de cuatro zonas de México.
| Compuesto químico | Grupos homogéneos (α ≤ 0.05) | |||||
|---|---|---|---|---|---|---|
| HC1 | TC | HM | TM | HG | TG | |
| Cenizas | Tab Hgo-Mx Jal | Tab-Hgo Mx Jal | Tab Hgo Mx-Jal | Tab Hgo-Mx Jal | Tab Hgo-Mx Jal | Tab-Hgo-Mx Jal |
| Lignina | Hgo Tab-Mx Mx-Jal | Hgo Tab-Jal-Mx | Hgo Tab-Mx Mx-Jal | Hgo Tab-Jal-Mx | Hgo Tab Jal-Mx | Hgo Tab-Jal-Mx |
| Holocelulosa | Tab-Jal-Hgo Hgo-Mx | Mx Hgo-Jal Tab | Tab-Jal-Hgo Mx | Mx Hgo-Jal Tab | Tab Jal-Hgo Hgo-Mx | Mx Jal Hgo-Tab |
| Extraíbles en solventes | Mx Hgo Jal-Tab | Tab-Hgo Mx Jal | Mx Hgo-Tab Jal | Tab-Hgo Mx Jal | Mx Hgo-Tab Jal | Tab-Hog Mx Jal |
| Extraíbles en agua | Jal Hgo-Tab-Mx | Jal Hgo-Mx-Tab | Jal Hgo-Tab Tab-Mx | Jal Hgo Tab-Mx | Jal Hgo-Tab-Mx | Jal Hgo Mx-Tab |
1HC = hoja chica; TC = tallo chico; HM = hoja mediana; TM = tallo mediano; HG = hoja grande; TG = tallo grande; Mx = Ciudad de México; Hgo = Hidalgo; Jal = Jalisco; Tab = Tabasco.
La concentración de holocelulosa mostró mayor heterogeneidad tanto en tallos como en hojas, en donde las muestras de TC, TM y TG de la Ciudad de México se agruparon de manera independiente. Lo mismo ocurrió con los compuestos extraíbles en solventes; de los cuales, las muestras de la Ciudad de México fueron independientes a los otros estados, esto para el caso de HC, HM y HG, y las muestras de Jalisco fueron las que mostraron las mayores diferencias, a excepción de HC (Cuadro 3). Finalmente, en los compuestos extraíbles en agua se observó que las muestras de Jalisco tuvieron la mayor concentración de estos compuestos, y no mostraron similitud con las muestras de los otros estados.
De manera general, los resultados obtenidos pueden facilitar la toma de decisiones en cuanto al procesamiento del lirio acuático para diversos procesos biotecnológicos, como la obtención de carbohidratos, o como posible indicativo de contaminación de cuerpos de agua.
Conclusiones
Los resultados proporcionan información sobre la composición química del lirio acuático (E. crassipes) de cuatro zonas de México (Ciudad de México, Hidalgo, Jalisco y Tabasco), las cuales presentaron gran heterogeneidad. Tanto las hojas como los tallos mostraron diferencias estadísticas significativas en su composición química. Las muestras provenientes de Tabasco tuvieron la mayor concentración de cenizas, las de Hidalgo la mayor concentración de lignina y las de Jalisco los mayores porcentajes de compuestos extraíbles en agua. Por otro lado, la holocelulosa fue la que mostró la mayor variabilidad con diferencias mínimas significativas, tanto a nivel de zona de colecta como de fracción de planta. Lo anterior sugiere que para el procesamiento de la planta es importante tomar en cuenta la zona geográfica y la fracción de la misma.
Agradecimientos
Los autores agradecen al Consejo Nacional de Ciencia y Tecnología (CONACYT) por el financiamiento otorgado a través del Proyecto 24711, dentro del marco de la convocatoria de atención a Problemas Nacionales.
REFERENCIAS
Abraham, M., & Kurup, M. (1996). Bioconversion of tapioca (Manihot esculenta) waste and water hyacinth (Eichhornia crassipes) - Influence of various physico-chemical factors. Journal of Fermentation and Bioengineering, 82(3), 259-263. doi: 10.1016/0922-338X(96)88817-9 [ Links ]
Aswathy, U. S., Sukumaran, R. K., Devi, G. L., Rajasree, K. P., Singhania, R. R., & Pandey, A. (2010). Bio-ethanol from water hyacinth biomass: An evaluation of enzymatic saccharification strategy. Bioresource Technology, 101(3), 925-930. doi: 10.101 6/j.biortech.2009.08.019 [ Links ]
Atehortua, E., & Gartner, C. (2013). Preliminry studies of Eichhornia crassipes dry biomass for lead and chromium removal from waters. Revista Colombiana de Materiales, 43, 81-92 [ Links ]
Balasubramanian, D., Arunachalam, K., Da, A. K., & Arunachalam, A. (2012). Decomposition and nutrient release of Eichhornia crassipes (Mart.) Solms. under different trophic conditions in wetlands of eastern Himalayan foothills. Ecological Engineering, 44, 111-122. doi: 10. 101 6/j.ecoleng.2012.03.002 [ Links ]
Boyd, C. E., & Vickers, D. H. (1971). Variation in the elemental content of Eichhornia crassipes. Hydrobiologia, 38(3-4), 409-414. doi: 10.1007/BF00036546 [ Links ]
Brendonck, L., Maes, J., Rommens, W., Dekeza, N., Nhiwatiwa, T., & Barson, M. (2003). The impact of water hyacinth (Eichhornia crassipes) in a eutrophic subtropical impoundment (Lake Chivero, Zimbabwe). II. Species diversity. Archives of Hydrobiology, 158(3), 389-405. doi: 10.1127/0003-9136/2003/0158-0389 [ Links ]
Burgois, J., Bartholin, M. C., & Gutonnet, R. (1989). Thermal treatment of wood: analysis of the obtained product. Wood Science Technology, 23(4), 303-310. doi: 10.1007/BF00353246 [ Links ]
Center, T. D. (1994). Biological control of weeds: water hyacinth and water lettuce. In: Rosen, D., Bennet, F. D., & Capinera, J. L. (Eds), Pest management in the subtropics, biological control a Florida perspective (pp. 481-521), U. K.: Intercep Ltd. [ Links ]
Deshpande, P., Nair, S., & Khedkar, S. (2009). Water hyacinth as carbon source for the production of cellulase by Trichoderma reesei. Applied Biochemistry and Biotechnology, 158(3), 552-560. doi: 10.1007/s12010-008-8476-9 [ Links ]
Epstein, P. (1998). Weeds bring disease to the east African waterways. Lancet, 351(9102), 351-577. doi: 10.101 6/S0140-6736(05)78570-6 [ Links ]
Gao, J., Chen, K., Yuan, K., Huang, H., & Yan, Z. (2013). Ionic liquid pretreatment to enhance the anaerobic digestion of lignocellulosic biomass. Bioresource Technology , 150, 352-358. doi: 10.101 6/j.biortech.2013.10.026 [ Links ]
Gunnarsson, C. C., & Petersen, C. M. (2007). Water hyacinth as a resource in agriculture and energy production: a literature review. Waste Management, 27(1), 117-129. doi: 10.101 6/j.wasman.2005.12.011 [ Links ]
Guragain, Y. N., Coninck, J. D., Husson, F., Durand, A., & Rakshit, S. K. (2011). Comparison of some new pretreatment methods for second generation bioethanol production from wheat straw and water hyacinth. Bioresource Technology , 102, 4416-4424. doi: 10. 101 6/j.biortech.2010.11.125 [ Links ]
Gutiérrez, E. L., Ruiz, E. F., Uribe, E. G., & Martínez, J. M. (2000). Biomass and productivity of water hyacinth and their application in control programs. Proceedings of the second IOBC global working group on the biological and integrated control of water hyacinth, 102, 109-119. Retrieved from http://ageconsearch.umn.edu/bitstream/135372/2/PR102.pdf [ Links ]
Harley, K. L. S., Julien, M. H., & Wright, A. D. (1996). Water hyacinth: a tropical worldwide problem and methods for its control. Proceedings of the 2 nd international weed control congress, 2, 639-644. [ Links ]
Heard, T. A., & Winterton, S. L. (2000). Interactions between nutrient status and weevil herbivory in the biological control of water hyacinth. Journal of Applied Ecology, 37(1), 117-21. doi: 10.1046/j.1365-2664.2000.00480.x [ Links ]
Hellmann, J. J., Byers, J. E., Bierwagen, B. G., & Dukes, J. S. (2008). Five potential consequences of climate change for invasive species. Conservation Biology, 22(3), 534-543. doi: 10.1111/j.1523-1739.2008.00951.x [ Links ]
Humphrey, T. K., & Dube, T. (2018). Remote sensing of invasive water hyacinth (Eichhornia crassipes): A review on applications and challenges. Remote Sensing Applications: Society and Environment, 10, 36-46. doi: 10.101 6/j.rase2018.02.005 [ Links ]
Jayaweera, M. W., & Kasturiarachchi, J. C. (2004). Removal of nitrogen and phosphorus from industrial wastewater using water hyacinth (Eichhornia crassipes (Mart) Solms). Water Science and Technology, 50(6), 217-225. doi: 10.2166/wst.2004.0379 [ Links ]
Khaket, T. P., Singh, M., Dhanda, S., Singh, T., & Singh, J. (2012). Biochemical characterization of consortium compost of toxic weeds Parthenium hysterophorus and Eichhornia crassipes. Bioresources Technology, 123, 260-265. doi: 10.101 6/j.biortech.2012.07.107 [ Links ]
Kivaisi, A. K., & Mtila, M. (1997). Production of biogas from water hyacinth (Eichhornia crassipes) (Mart) (Solms) in a two-stage bioreactor. World Journal of Microbiology and Biotechnology, 14(1), 125-131. doi: 10.1023/A:100884500 [ Links ]
Kumar, A., Singh, L. K., & Ghosh, S. (2009). Bioconversion of lignocellulosic fraction of water hyacinth (Eichhornia crassipes) hemicellulose acid hydrolysate to ethanol by Pichia stipitis. Bioresource Technology , 100(13), 3293-3297. doi: 10.101 6/j.biortech.2009.02.023 [ Links ]
Lakshminarayana, G., Rao, K. S., Pantulu, A. J., & Thyagarajan, G. (1984). Composition of lipids in roots, stalks, leaves and flowers of Eichhornia crassipes (Mart.) Solms. Aquatic Botany, 20(3-4), 219-227. doi: 10.101 6/0304-3770(84)90088-3 [ Links ]
Lara-Serrano, J. S., Rutiaga-Quiñones, O. M., López-Miranda, J., Fileto-Pérez, H. A., Pedraza-Bucio, F. E., Rico-Cerda, J. L., & Rutiaga-Quiñones, J. G. (2016). Physicochemical characterization of water hyacinth (Eichhornia crassipes (Mart.) Solms). Bioresources, 11(3), 7214-7223. Retrieved from https://bioresources.cnr.ncsu.edu/resources/physicochemical-characterization-of-water-hyacinth-eichhornia-crassipes-mart-solms/ [ Links ]
Ma, F., Yang, N., Xu, C., Yu, H., Wu, J., & Zhang, X. (2010). Combination of biological pretreatment with mild acid pretreatment for enzymatic hydrolysis and ethanol production from water hyacinth. Bioresource Technology , 101 (24), 9600-9604. doi: 10.101 6/j.biortech.2010.07.084 [ Links ]
Mahamadi, C., & Nharingo, T. (2010). Competitive adsorption of Pb+2, Cd+2 and Zn+2 ions onto Eichhornia crassipes in binary and ternary systems. Bioresource Technology , 101 (3), 859-864. doi: 10.101 6/j.biortech.2009.08.097 [ Links ]
Malik, A. (2007). Environmental challenge vis a vis opportunity: The case of water hyacinth. Environmental International, 33(1), 122-138. doi: 10.101 6/j.envint.2006.08.004 [ Links ]
Mishra, V. K., & Tripathi, B. D. (2009). Accumulation of chromium and zinc from aqueous solutions using water hyacinth (Eichhornia crassipes). Journal of Hazardous Materials, 164(2-3), 1059-1063. doi: 10.101 6/j.hazmat.2008.09.020 [ Links ]
Muramoto, S., & Oki, Y. (1983). Removal of some heavy metals from polluted water by water hyacinth (Eichhornia crassipes). Bulletin Environmental Contamination Toxicology, 30(2), 170-177. doi: 10.1007/BF01610117 [ Links ]
Neiff, J. J., Casco, S. L., & de Neiff, A. P. (2008). Response of Eichhornia crassipes to water level fluctuations in two lakes with different connectivity in the Paraná River floodplain. Revista de Biología Tropical, 56(2), 613-623. doi: 10.15517/rbt.v56i2.5612 [ Links ]
Nigam, J. N. (2002). Bioconversion of water-hyacinth (Eichhornia crassipes) hemicellulose acid hydrolysate to motor fuel ethanol by xylose-fermenting yeast. Journal of Biotechnology, 97(2), 107-116. doi: 10.1016/S0168-1656(02)00013-5 [ Links ]
Olivares, E., & Colonnello, G. (2000). Salinity gradient in the Mánamo River, a dammed distributary of the Orinoco Delta, and its influence on the presence of Eichhornia crassipes and Paspalum rapens. Interciencia, 25(5), 242-248. Retrieved from http://www.redalyc.org/articulo.oa?id=33904704 [ Links ]
Pramanik, P. (2010). Changes in enzymatic activities and microbial properties in vermicompost of water hyacinth as affected by pre-composting and fungal inoculation: A comparative study of ergosterol and chitin for estimating fungal biomass. Waste Management , 30(8-9), 1472-1476. doi: 10.101 6/j.wasman.2010.02.026 [ Links ]
Saraswat, S., & Rai, J. P. N. (2010). Heavy metal adsorption from aqueous solution using Eichhornia crassipes dead biomass. International Journal of Mineral Processing, 94(3-4), 203-206. doi: 10. 1016/j.minpro.2010.02.006 [ Links ]
Silva, R. P., de Melo, M. W. R., Silvestre, A. J. D., & Silva, C. M. (2015). Polar and lipophilic extracts characterization of roots, stalks, leaves and flowers of water hyacinth (Eichhornia crassipes), and insights for its future valorization. Industrial Crops and Products, 76, 1033-1038. doi: 10.1016/j.indcrop.2015.07.055 [ Links ]
Sluiter, A., Hames, B., Ruiz, R., Scarlata, C., Sluiter, J., & Templeton, D. (2005). Determination of ash in biomass. Laboratory Analytical Procedure. U.S.A.: National Renewable Energy Laboratory. [ Links ]
Sornvoraweat, B. & Kongkiattikajorn, J. (2010). Separated hydrolysis and fermentation of water hyacinth leaves for ethanol production. KKU Research Journal, 15(9), 794-802. [ Links ]
Tan, L., Zhu, D., Zhou, Z., Mi, W., Ma, L., & He, W. (2008). Preferring cellulose of Eichhornia crassipes to prepare xanthogenate to other plant materials and its adsorption properties on copper. Bioresource Technology , 99(10), 4460-466. doi: 10.1016/j.biortech.2007.08.022 [ Links ]
Technical Association of the Pulp and Paper Industry (TAPPI), Official Test Methods: T204 om-84 (Solvent extractives of wood and pulp); T207 om-93 (Water solubility of wood and pulp); T211 om-93 (Ash in wood, pulp, paper and paperboard: combustion at 525 ºC) and T222 om-88 (Acid insoluble lignin in wood and pulp). [ Links ]
Villamagna, A. M., & Murphy, B. R. (2010). Ecological and socio-economic impacts of invasive water hyacinth (Eichhornia crassipes): a review. Freshwater Biology, 55(2), 282-289. doi: 10.1111/j.1365-2427.2009.02294.x [ Links ]
Wang, Z., Liu, J., Ning, Y., Liao, X., & Jia, Y. (2017). Echhornia crassipes: Agro-waster for a novel thermostable laccase production by Pycnoporus sanguineus SYBC-L1. Journal of Bioscience and Bioengineering, 123(2), 163-169. doi: 10.1016/j.jbiosc.2016.09.005 [ Links ]
Wilson, J. R., Holst, N., & Rees, M. (2005). Determinants and patterns of population growth in water hyacinth. Aquatic Botanic, 81(1), 51-67. doi: 10.1016/j.aquabot.2004.11.002 [ Links ]
Recibido: 20 de Octubre de 2017; Aprobado: 15 de Noviembre de 2018











 texto em
texto em 



