Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Chapingo serie ciencias forestales y del ambiente
versión On-line ISSN 2007-4018versión impresa ISSN 2007-3828
Rev. Chapingo ser. cienc. for. ambient vol.29 no.2 Chapingo may./ago. 2023 Epub 05-Abr-2024
https://doi.org/10.5154/r.rchscfa.2022.09.067
Artículos científicos
Biología de la generación sexual de Loxaulus hyalinus (Hymenoptera: Cynipidae) en encinares de Quercus laeta Liebm. de la Ciudad de México
1Colegio de Postgraduados, Campus Montecillo, Postgrado en Fitosanidad-Entomología y Acarología. Carretera México-Texcoco km 36.5. C. P. 56230. Texcoco, Estado de México, México.
2Universidad Autónoma Chapingo, División de Ciencias Forestales. Carretera México-Texcoco km 38.5. C. P. 56230. Texcoco, Estado de México, México.
3Universitat de Barcelona, Facultat de Biologia, Departament de Biologia Animal. Av. Diagonal 643. C. P. 08028. Barcelona, Cataluña, España.
Introducción:
Loxaulus hyalinus es un cinípido (Hymenoptera) que ataca encinares (Quercus laeta Liebm.) de la Ciudad de México. La biología y el potencial de daño del insecto se desconoce.
Objetivos:
Describir la biología de la fase sexual de L. hyalinus y sus efectos en Q. laeta, así como enlistar los inquilinos y parasitoides asociados.
Materiales y métodos:
Para determinar el periodo de cada estado de L. hyalinus se recolectaron agallas de ramillas infestadas que se disecaron periódicamente, para describir su desarrollo y la presencia de inquilinos y parasitoides en el periodo 2019- 2022.
Resultados y discusión:
La generación sexual inició a partir de octubre cuando se observaron los primeros síntomas del desarrollo de las agallas en ramillas, y concluyó en mayo del siguiente año, cuando los adultos emergieron. La presencia de una gran cantidad de agallas altera el patrón de crecimiento de la copa de los árboles. Se encontraron dos especies de Synergus como inquilinos y nueve géneros de parasitoides calcidoideos asociados a L. hyalinus.
Conclusiones:
La generación sexual de L. hyalinus se desarrolla en las agallas de ramilla y su único hospedante confirmado es Q. laeta. Dicha plaga no ocasiona la muerte de su hospedante, pero sí afecta severamente la forma de la copa.
Palabras clave: avispa agalladora; ciclo biológico; cinípidos; parasitoides; plaga forestal
Introduction:
Loxaulus hyalinus is a cynipid (Hymenoptera) that attacks oak groves (Quercus laeta Liebm.) in Mexico City. The insect's biology and damage potential are unknown.
Objectives:
Describe the biology of the sexual phase of L. hyalinus and its effects on Q. laeta, and list the associated inquilines and parasitoids.
Materials and methods:
To determine the period of each stage of L. hyalinus, galls were collected from infested twigs and periodically dissected to describe their development and the presence of inquilines and parasitoids in the period 2019- 2022.
Results and discussion:
Sexual generation began in October when the first symptoms of galls development were observed on twigs, and concluded in May of the following year, when adults emerged. The presence of many galls alters the growth pattern of the tree crown. Two Synergus species were found as inquilines and nine genera of chalcidoid parasitoids were associated with L. hyalinus.
Conclusions:
Sexual generation of L. hyalinus develops in twig galls and its only host confirmed is Q. laeta. This pest causes no death of its host but severely affects the shape of the crown.
Keywords: gall wasp; life cycle; cynipids; parasitoids; forest pest
Ideas destacadas:
La generación sexual de Loxaulus hyalinus dura al menos ocho meses.
Las agallas de L. hyalinus alteran el crecimiento y la forma de la copa de Quercus laeta.
Los principales enemigos naturales de L. hyalinus son especies de Eurytomidae y de Synergus.
El único hospedante confirmado de L. hyalinus es Q. laeta
Introducción
Loxaulus es un género neártico de avispas agalladoras que se desarrollan en Quercus (Melika & Abrahamson, 2000); 15 especies han sido reportadas en EUA (Melika et al., 2021), dos en Panamá (Medianero et al., 2011) y dos en México (Pujade-Villar et al., 2014).
Los estudios de biología son indispensables para entender las relaciones entre fitófagos, sus hospedantes y especies asociadas. De 13 especies de Loxaulus solo se reporta la generación asexual, 10 de las cuales inducen sus agallas en ramillas (Loxaulus atrior [Kinsey] Dailey 1977, Loxaulus boharti Dailey y Sprenger 1983, Loxaulus brunneus [Ashmead 1896], Loxaulus championiMedianero y Nieves-Aldrey 2011, Loxaulus maculipennis [Ashmead 1896], Loxaulus tenuis [Weld 1952], Loxaulus vaccini [Ashmead] Weld 1951, Loxaulus panamensis Medianero & Nieves-Aldrey 2011, L. laetaPujade-Villar 2014, Loxaulus virginianaeMelika & Buss 2021), una en hojas (Loxaulus beutenmuelleri Weld 1957), una en raíces (Loxaulus pattersoni [Kinsey 1922]) y una en tallos subterráneos (Loxaulus illinoisensis [Weld 1921]) (Medianero et al., 2011; Melika & Abrahamson, 2000; Melika et al., 2021; Pujade-Villar et al., 2014). De Loxaulus quercusmammula (Bassett 1881) se reporta solo la generación sexual induciendo agallas en ramillas, al igual que de Loxaulus hyalinus Pujade-Villar y Melika 2014 (en este estudio) y tres especies (Loxaulus ferrugineus [Gillette 1891], Loxaulus huberi Melika y Abrahamson 2000, y Loxaulus masneri Melika y Abrahamson 2000) se conocen las hembras, pero se desconocen las agallas y a qué generación corresponden (Melika & Abrahamson, 2000). Solo de Loxaulus trizonalis Weld 1926 se conocen las generaciones asexual y sexual, la primera induciendo agallas en bellotas y la segunda en ramillas de Quercus chrysolepis Liebm. 1854 (Melika & Abrahamson, 2000).
En 2014 se reportó a Loxaulus laetaPujade-Villar 2014 en Quercus laeta Liebm. 1854 (sección Quercus) en Santa Fe, Cuajimalpa, Ciudad de México y a L. hyalinus en Quercus dysophylla Benth. 1840 (sección Lobatae) en Huasca de Ocampo, Hidalgo (Pujade-Villar et al., 2014). Recientemente, para L. hyalinus, Cuesta-Porta et al. (2022) corrigieron la identificación del huésped como Q. laeta, por lo que las dos especies conocidas de México atacan a Q. laeta. Se ha observado que las agallas de L. hyalinus causan alteraciones en el crecimiento de las ramas infestadas, así como en la estructura y apariencia de la copa del hospedante, por lo que esta especie se considera plaga en áreas verdes de fraccionamientos de la Ciudad de México.
Las agallas de encinos producidas por fitófagos son explotadas por diversos organismos, entre ellos, inquilinos y parasitoides que compiten por el hospedante o lo atacan (Todorov et al., 2019). En las agallas producidas por cinípidos, los parasitoides calcidoideos son, en general, los enemigos naturales más importantes, mientras que las especies de la tribu Synergini (Cynipidae), letales o no letales (facultativos), son el principal grupo de inquilinos (Sanver & Hawkins, 2000).
El objetivo de este trabajo fue describir los estados de desarrollo de la generación sexual de L. hyalinus, sus agallas, el tipo del daño en el hospedante e identificar las especies de inquilinos y géneros de parasitoides asociados.
Materiales y métodos
El área de estudio se ubicó en la Barranca ‘Los Helechos’ (Figura 1a), localidad de Santa Fe, San Mateo Tlaltenango, Alcaldía de Cuajimalpa, Ciudad de México (entre 19° 21’ 16.7” - 19° 20’ 52.1” N y 99° 16’ 38.7” - 99° 15’ 40.1” O), a 2 547-2 623 m de elevación. Quercus laeta se distribuye en una franja de bosque natural, a la orilla de vialidades, alrededor de edificios y diversas áreas comunes (Figura 1b).
Otro sitio de estudio fue el municipio de Huasca de Ocampo, Hidalgo (20” 12’ 12.34” - 20° 12’ 14.51” N y 98° 34’ 14.64” - 98” 34’ 06.76” O (Figura 1c). El 8 y 29 de mayo del 2021 se recolectaron agallas de ramilla similares a las de L. hyalinus y muestras de los hospedantes (marcas verdes, Figura 1d), en las cercanías del lugar reportado por Pujade-Villar et al. (2014) (marca amarilla, Figura 1d). Las agallas se colocaron en recipientes individuales y las muestras de los hospedantes se prensaron, secaron e identificaron. Los adultos emergidos de las agallas se colocaron en microtubos Axygen® de 2 mL con alcohol etílico 96 %.
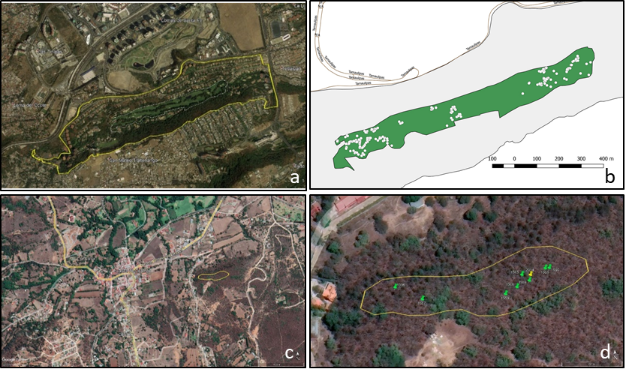
Figura 1 Sitios de estudio para la recolecta de Loxaulus hyalinus en encinares de Quercus laeta: a) Santa Fe, Cuajimalpa, Ciudad de México; b) árboles bajo observación señalados con puntos blancos dentro del polígono verde; c) Huasca de Ocampo, Hidalgo; d) polígono examinado, hospedantes estudiados (marca verde) y punto de referenciación del sitio (marca amarilla).
En las agallas recolectadas de octubre de 2019 a junio de 2021 en Santa Fe, se estudió el desarrollo de los inmaduros y el momento de emergencia de los adultos. Los recorridos en campo se efectuaron al menos una vez al mes y se recolectaron ramillas para buscar oviposturas o agallas jóvenes. Las recolectas se realizaron al menos una vez por semana cuando se empezaron a observar las pupas en marzo de cada año y hasta que concluyó la emergencia de adultos en laboratorio.
Loxaulus hyalinus y sus agallas se observaron en el laboratorio de Fisiología de Insectos del Posgrado en Fitosanidad, Entomología y Acarología del Campus Montecillo, Colegio de Postgraduados. En cada fecha de recolecta se seleccionaron tres agallas en cada uno de cinco árboles. Con una navaja se retiró la corteza y el parénquima hasta encontrar las cámaras larvales; el contenido de cada cámara larval se extrajo y se registró el tipo de organismo y su estado de desarrollo. Las larvas y pupas se almacenaron en alcohol etílico (96 %). Un grupo de larvas de todos los tamaños se asoció con las fechas de recolecta y se describieron sus características morfológicas, de igual forma que en el estado de pupa, en el que se registraron también los cambios durante su desarrollo, la longitud del cuerpo y su presencia en relación con las fechas de recolecta. La medición de los huevos, larvas, pupas y cámaras larvales se hizo en Adobe Photoshop® CS3.
El inicio del periodo de emergencia de los adultos se registró a partir de la detección de las primeras pupas en las agallas diseccionadas y hasta la primera semana de junio de 2019 a 2021. De cada fecha de recolecta se colocaron, individualmente, al menos 20 agallas en recipientes de plástico transparente de 1.0 L, que se consideraron cámaras de emergencia, y se les asignó un número de identificación. Estos se conservaron bajo condiciones de temperatura ambiente y luz natural. A partir de que se encontraron los primeros adultos de L. hyalinus en las agallas diseccionadas, se hicieron revisiones diarias de las cámaras para recolectar uno por día con un aspirador y transferirlos a un frasco transparente de 1.0 L con tapa con ventilación, para observar su comportamiento. Los adultos de parasitoides e inquilinos detectados se capturaron y conservaron en microtubos con alcohol etílico (96 %), un microtubo/cámara/día. En el 2020 y 2021, se colocó una tapa con agua y gotas de miel como alimento en los frascos, así como hojas de Q. laeta para refugio. Los recipientes se inspeccionaron hasta que ya no se registró emergencia de adultos.
La longevidad de los adultos se determinó en 49 individuos emergidos entre el 9 y el 15 de mayo del 2020 en condiciones de laboratorio. Los frascos se revisaron diariamente a las 10:00 y 15:00 h, para registrar el comportamiento alimenticio y sexual. Los recipientes permanecieron cerrados hasta la muerte de todos ellos, momento en el que se colocaron en alcohol etílico al 96 %. Se registró el número de hembras y machos de L. hyalinus, parasitoides y cinípidos inquilinos adultos capturados por cámara/fecha de recolecta de 2019, 2020 y 2021. Las hembras de L. hyalinus se identificaron con base en la descripción de Pujade-Villar et al. (2014) y los machos con los datos de Cuesta-Porta et al. (2022).
Con base en la metodología modificada de Hood y Ott (2011), el número de huevos desarrollados se contabilizó en 14 hembras con el abdomen dilatado. El abdomen se desprendió del cuerpo, se retiró el integumento del segundo y tercer segmento y se colocó en una placa de reacción con una solución 1:1:13 de ácido acético, glicerol y agua, respectivamente, por un periodo de al menos 2 h para aflojar el tejido folicular del ovario. Los huevos se separaron de las ovariolas y se contaron usando luz UV (395 nm) bajo un microscopio. De cada hembra se tomaron 10 huevos al azar que se colocaron en un portaobjetos con una solución de glicerol al 70 %, se fotografiaron y se midió la longitud y ancho del cuerpo y la longitud del pedúnculo, de acuerdo con Vårdal et al. (2003).
La longitud, diámetro mínimo y máximo, los diámetros de la ramilla antes y al final de la agalla, así como la distancia de esta última a la yema terminal de la ramilla se midieron con un calibrador iGaging® OriginCal® (resolución = 0.01 mm) en 70 agallas recolectadas en febrero del 2022 y se contó el número de cámaras larvales. La matriz de correlación (P = 0.05) de las variables medidas y la regresión lineal múltiple (α = 0.05) de la longitud de las agallas - número de cámaras larvales se calcularon en el programa STATISTICA® versión 8.0 (StatSoft Inc., 2007).
La estructura de dos ramillas con y sin agallas típicas de L. hyalinus, recolectadas en febrero del 2022, se describió a partir de cortes micrométricos longitudinales y transversales de 25 µm a 30 µm de espesor fijados en formaldehído-alcohol-ácido acético y obtenidos con un microtomo de deslizamiento Leica® SM2000R. Los cortes se tiñeron con Pardo de Bismarck, el cual denota la celulosa de la pared de las células vegetales (Garrido-Fariña et al., 2021) de diversos tejidos, como el del floema (Blaydes, 1939).
Los efectos de la infestación por L. hyalinus en ramillas de Q. laeta se registraron en árboles situados en lugares con alta perturbación y con infestación evidente entre 2018 y 2021. Se incluyeron observaciones sobre la supervivencia de las ramas, presencia de follaje y dominancia apical. Los parasitoides se identificaron a nivel de género con las claves de Gibson et al. (1997) y la especie de los cinípidos inquilinos se identificó con base en la información de Lobato-Vila y Pujade-Villar (2017, 2018) y Lobato-Vila et al. (2019, 2020).
Las fotografías en campo se tomaron con una cámara digital Sony® A7R3 y un lente Vario-Tessar® T* FE 24-70 mm F4 ZA OSS, así como en el laboratorio con la misma cámara y objetivos planares 4x, 10x y 20x en el programa Remote (Sony®). Para la medición se usó como referencia una escala con divisiones a 0.01 mm de un portaobjetos de calibración de micrómetro. Las fotografías se procesaron con los programas Helicon Focus 7 (Heliconsoft®), Capture One® 20 y 22 y Adobe Photoshop® CS3. Las pruebas estadísticas, matrices de correlación, regresión lineal múltiple y el cálculo de estadísticos descriptivos se hicieron en STATISTICA® 8 (StatSoft®).
Resultados y discusión
En el 2019 emergieron hembras y machos de L. hyalinus de las agallas de ramillas de Q. laeta recolectadas en Santa Fe. Previamente, Pujade-Villar et al. (2014) reportaron L. hyalinus de agallas de ramilla de Q. dysophylla, recolectadas en Huasca de Ocampo, Hidalgo, pero solo describieron a las hembras y señalaron que pertenecían a la generación asexual; sin embargo, en 2021 realizaron otra recolecta en Huasca y encontraron agallas en ramillas de Q. laeta de las que emergieron hembras y machos de L. hyalinus, pero no en Q. dysophylla. Es importante mencionar que las dos especies de Quercus pertenecen a secciones distintas y que Q. dysophylla no presentó agallas de ramilla en dicha localidad, lo que permite suponer que hubo un error en la identificación de esta especie como hospedante. En el 2014, los mismos autores mencionaron que, en Santa Fe, L. laeta generaba agallas en ramillas y que era la principal especie de agallador de ramas de Q. laeta; en cambio, en todas las recolectas realizadas en este trabajo, entre 2019 y el primer trimestre de 2022, solo se obtuvieron hembras y machos de L. hyalinus. De acuerdo con los autores mencionados, la morfología de las alas diferencia muy fácilmente a L. hyalinus (alas completamente hialinas) de L. laeta (con una mancha alar característica).
Estados de desarrollo de Loxaulus hyalinus
La forma asexual se presenta entre dos generaciones sexuales consecutivas. En los periodos de muestreo de junio a octubre, se examinaron ramillas en busca de las oviposturas de la forma asexual que dan lugar a las agallas de la generación sexual, pero no se encontraron. Por tanto, aún se desconoce en qué órgano del hospedante se encuentran las agallas de la generación asexual, su apariencia y cuándo ovipositan las hembras agámicas, de tal modo que, en este estudio, solo se describen los estadios de desarrollo de la forma sexual.
Larva
De octubre a diciembre, los cortes longitudinales de agallas en desarrollo mostraron, en vista cenital, que las cámaras estaban rellenas de tejido nutricio. En este periodo, el instar L1 es una esfera translúcida sin segmentación externa situada en el centro.
En las observaciones de enero, 57.1 % de las larvas del inductor de agallas correspondió a L1 con actividad reducida y se les podía encontrar en sitios diferentes dentro de la cámara, mientras que el tejido nutricio ya no cubría todo el interior y 42.9 % correspondía a L2.
Las larvas de L. hyalinus a partir del instar L2 son himenopteriformes con el cuerpo fusiforme, curvado ventralmente, con la parte anterior ligeramente más ancha que el resto, sin proyecciones, blanquecino, liso y brillante, con la segmentación poco evidente en los primeros instares y 12 segmentos visibles de tamaño similar en los estadios más desarrollados (Figura 2a), semejante a otras especies de Cynipoidea, de acuerdo con lo descrito por Nieves-Aldrey et al. (2005). La cabeza es pequeña sobre todo en los primeros instares, con mandíbulas diminutas de un solo diente con punta aguda (Figura 2b); Nieves-Aldrey et al. (2005) indican que el número de dientes en Cynipoidea varía de uno a cinco entre la mandíbula izquierda y derecha.
Pupa
En abril, en las agallas se encontraron larvas de último instar y pupas de L. hyalinus con diversos niveles de desarrollo (Figura 3a). La pupa es exarada y a medida que avanzaba su desarrollo fue posible diferenciar los tagmas del cuerpo, las patas y antenas (Figura 3b). Para mediados de abril completaron su desarrollo. La pigmentación inicia por los ojos y continúa en el resto del cuerpo (Figura 3c); las alas fueron las últimas en formarse.
Preimago, adulto y huevo
Los preimagos con paquetes alares en formación podían caminar de manera constante cuando se extraían de las cámaras. Los adultos no emergidos cuando se les extraía de las cámaras o cuando emergieron de manera natural comenzaron a desplegar las alas como primera actividad.
Loxaulus hyalinus es de color negro con la cabeza masiva (1.9 veces más ancha que larga en vista dorsal en las hembras y 1.7 a 1.8 en los machos) con espacio malar 0.2 veces la altura del ojo compuesto. Las hembras (Figura 3d) tienen 13 flagelómeros antenales con sensilas placoideas visibles desde el segmento F3; mientras que los machos (Figura 3e) tienen 15 flagelómeros; F1 0.8 veces F2 y ligeramente curvado; el ocelo lateral posterior con una impresión transversal; el mesosoma es 1.4 a 1.5 veces más largo que ancho en vista lateral; notauli incompleto, fosetas escutelares longitudinalmente carinadas, alas anteriores translúcidas con setas en el margen, celda radial 3.0 veces más larga que ancha y espina ventral del hipopigio corta y tan larga como ancha (Cuesta-Porta et al., 2022; Pujade-Villar et al., 2014).
La supervivencia de los adultos fue de uno a dos días cuando carecieron de refugio, agua y carbohidratos, mientras que los que sí contaban con dichos recursos vivieron cuatro a seis días.
En campo, el apareamiento se observó el 18 de mayo del 2021, alrededor del mediodía, en condiciones climáticas de cielo despejado. Los adultos permanecían en el follaje y fuste de los individuos de Q. laeta cercanos y a nivel de suelo; se encontraron adultos activos principalmente en el envés de las hojas, pero no se registró la oviposición o intentos de esta por parte de las hembras. En laboratorio no ocurrió el apareamiento, debido a las condiciones de baja intensidad de luz.
En las 14 hembras de la generación sexual, el abdomen se encontraba ocupado casi en su totalidad por la masa de huevos ováricos (Figura 3f) y contenían en promedio 57.78 ± 5.50 huevos por hembra. Estos se observaron translúcidos a blanquecinos bajo luz blanca (Figura 3g) y verde fluorescente bajo luz UV (Figura 3h); en ellos se distinguen el cuerpo y el pedúnculo. El cuerpo es más largo que ancho en una relación de 3.7:1.0, con el extremo distal redondeado que se estrecha gradualmente hacia el pedúnculo, el cual es aproximadamente 1.6 veces más largo que el cuerpo (Cuadro 1) y presenta un ensanchamiento gradual hacia el extremo distal (Figuras 3g y 3h). Las características generales del huevo ovárico coinciden con la descripción de los huevos de otras especies de cinípidos agalladores, de acuerdo con Vårdal et al. (2003).
Cuadro 1 Dimensiones de los huevos ováricos de Loxaulus hyalinus (n = 14).
| Variable (mm) | Promedio | Mínimo | Máximo | DE | IC-Límite inferior | IC-Límite superior |
|---|---|---|---|---|---|---|
| Longitud del cuerpo | 0.2355 | 0.1313 | 0.2849 | 0.0203 | 0.0181 | 0.023 |
| Ancho del cuerpo | 0.063 | 0.0318 | 0.0822 | 0.0082 | 0.0074 | 0.0093 |
| Longitud del pedúnculo | 0.3746 | 0.177 | 0.6377 | 0.0714 | 0.0639 | 0.0809 |
| Longitud total del huevo | 0.6101 | 0.401 | 0.8721 | 0.0736 | 0.0659 | 0.0834 |
DE: desviación estándar; IC: intervalo de confianza.

Figura 3 Características de los estados de desarrollo de Loxaulus hyalinus: a) agalla con larvas y pupas; b y c) pupas con grado diferente de desarrollo; d y e) hembra y macho, respectivamente; f) metasoma ovipleno de hembra; g y h) huevos ováricos bajo luz blanca y luz UV (395 nm), respectivamente.
Características y desarrollo de la agalla de ramilla
Debido a que no se encontraron oviposturas antes de septiembre, no se determinó el momento en que las hembras de la forma asexual de L. hyalinus (aún desconocidas) ovipositan en las ramillas para iniciar la fase sexual del ciclo ni las características de las agallas en etapas tempranas del crecimiento. En octubre, las agallas se observaron como hinchazones alargadas y poco evidentes. Para enero del año siguiente, las agallas adquirieron una forma alargada con corteza ligeramente rugosa a rugosa, café a gris verdosa, similar a la porción basal y distal de la ramilla no infestada (Figura 4f). En junio, después de la emergencia de los adultos, la agalla madura adquiere un color café grisáceo (Figura 4g). De acuerdo con Stone y Schönrogge (2003) y Hernández-Soto et al. (2015), en las agallas se pueden distinguir dos regiones, la interna compuesta por las cámaras larvales y la externa por tejido cortical. Las agallas de L. hyalinus presentan cámaras contiguas solo interrumpidas por áreas menos desarrolladas en las que no hay cámaras o estas son individuales y aisladas con el tejido de la agalla externa, poco desarrollado, que da una apariencia de abultamientos adyacentes (Figura 4f).
En 70 agallas medidas en enero del 2022 se observó una longitud promedio de 40.91 mm (mínimo = 9.75 mm, máximo = 108 mm). El diámetro promedio de la agalla fue 4.94 mm (mínimo = 4.42, máximo = 5.46 mm) y el de la ramilla antes de iniciar la agalla fue 3.42 mm y después de finalizar en la parte distal fue 2.82 mm. Las agallas terminan en promedio a 16.3 mm de la yema terminal de la ramilla. Cuarenta agallas tenían hojas verdes y el resto hojas color café (10) o sin ellas (20). El promedio de cámaras por agalla fue 36.4 con un intervalo de 7 a 104 y correlación positiva significativa de 0.80 (P < 0.05, n = 70) entre longitud y número de cámaras, aunque existieron agallas largas con un número bajo de cámaras y viceversa. La regresión lineal múltiple proporcionó R2 = 0.6408 que corroboró la relación.
En L. hyalinus, la agalla interna es la cámara larval, cuya estructura está integrada de adentro hacia afuera por una capa de tejido nutricio y una de parénquima que cubren total o parcialmente el interior, y una capa de esclerénquima que las delimita y a la que se unen haces vasculares en la región basal. La agalla externa presenta una estructura similar a la rama sin agalla (Figura 4b), pero cuyo parénquima es de mayor grosor, en particular alrededor de las cámaras larvales (Figuras 4c, 4d y 4e). Las cámaras están alineadas longitudinalmente al eje de la ramilla, en grupos contiguos de dos a seis, en cuatro a cinco hileras semirrectas y en ocasiones helicoidales, aunque existen variaciones atribuibles a la cantidad de huevos depositados inicialmente (Figura 4a).
Una cámara típica tiene forma ovalada en vista cenital, con valores promedio de 2.8 mm de largo y 1.4 mm de ancho (n = 30), con la parte más alargada paralela a la dirección de crecimiento de la ramilla (Figura 4f y 4g). Otras formas menos frecuentes son la semicircular, más pequeña que la ovalada (largo: 1.25 ± 0.17 mm; ancho: 1.49 ± 0.16 mm; n = 8), y la irregular, en la que se observa una deformación en alguno de los lados, pero se conserva la estructura de los tejidos (Figura 4a). En la parte basal del centro de la cámara se aprecia una cavidad cónica que conecta con el duramen de la ramilla. La periferia de la cámara está formada por una capa coriácea de esclerénquima que hacia adentro conecta con el parénquima, el cual, por efecto de la alimentación de la larva, se convierte en tejido nutricio, como sugiere Melika (2006). En posición transversal, la agalla presenta las cámaras con forma de gota (largo: 1.91 ± 0.05 mm; ancho: 1.23 ± 0.19 mm; n= 42), con la parte angosta insertada profundamente en el xilema (Figura 4c y 4d), la cual, cuando no hay tejido nutricio, en vista cenital se percibe como una cavidad cónica prolongada hacia el centro de la ramilla (Figura 4h y 4i). El inductor está involucrado activamente en el desarrollo y diferenciación de la agalla (Stone & Schönrogge, 2003). Al igual que otros cinípidos, las agallas de L. hyalinus están formadas por tejido del hospedante cuya función y estructura es modificada (Harris & Pitzschke, 2020), tal como se observó en los cortes perpendiculares de las ramas con y sin agallas (Figura 4b y 4c).

Figura 4 Agallas de Loxaulus hyalinus: a) agalla sin corteza con las cámaras expuestas (flecha); b) sección transversal de ramilla sin agallas; c, d y e) sección transversal de una ramilla con agallas y cámaras larvales maduras; f) agalla en desarrollo; g) agalla madura con orificios de emergencia; h) cámara larval en vista transversal; i) cámaras larvales en vista cenital. Las flechas indican la cavidad cónica que penetra en el xilema.
Ciclo biológico de la generación sexual
Debido a que en los Cynipini es muy raro un ciclo biológico con solo la generación sexual, se hipotetiza que la generación conocida de L. hyalinus proviene de oviposturas de hembras de origen asexual, las cuales no fueron encontradas en el presente estudio.
En octubre y noviembre, cuando se detectaron agallas pequeñas, el estado de desarrollo presente fue de L1 que, en los cortes longitudinales y en vista cenital, se observa como una esfera translúcida. En la primera mitad de enero, las cámaras completaron su desarrollo y las larvas empezaron a desarrollarse. El estadio larval se prolongó hasta mediados de abril. Las pupas se detectaron con mayor frecuencia en las primeras dos semanas de abril, mientras que los preimagos se observaron hasta la última semana del mismo mes.
En los años donde se registró la emergencia de adultos se encontraron variaciones de pocos días para su inicio y de semanas para su final. La emergencia de hembras y machos adultos inició durante la última semana de abril y se prolongó hasta la última semana de mayo de 2019, 2020 y 2021 y, excepcionalmente, hasta la segunda semana de junio de 2020. La mayor emergencia de machos ocurrió entre el 1 y el 7 de mayo, mientras que la de las hembras fue entre el 26 de abril y el 3 de mayo.
El apareamiento se observó solo en campo, el 18 de mayo de 2021 alrededor del mediodía y en condiciones de cielo despejado. En el sitio de estudio se encontraron adultos activos principalmente en el envés de las hojas, aunque no se observó la oviposición.
La generación sexual de L. hyalinus requiere de al menos ocho meses y se presenta de octubre a mayo del siguiente año. Al no conocer donde se desarrolla la fase asexual, se mantiene la incertidumbre sobre la duración total del ciclo biológico en sus dos fases.
Consecuencias del impacto de Loxaulus hyalinus
En el sitio de estudio, la distribución de Q. laeta es fragmentada con mayor número de individuos en un bosque residual, en vialidades, parques y en un campo de golf. La distribución y daños de L. hyalinus es mayor en sitios perturbados donde el encino sufre estrés de varios tipos, ya sea por impactos de construcción o por estar en suelos expuestos a erosión y lavado de nutrientes, así como falta de agua. Los árboles afectados son de varios tamaños y tienen copa compacta, deformada y con ramas ‘zigzagueantes’, consecuencia de infestaciones crónicas de varios años.
La presencia de las agallas en Q. laeta puede provocar, además de la pérdida de follaje (Figura 5a), un menor tamaño de la rama (Figura 5b) y afectación a la conducción de agua y nutrientes, por lo que solo pocas ramillas pueden continuar con un desarrollo normal. La muerte de la ramilla durante el desarrollo de la agalla o después de la emergencia de los adultos, y la pérdida de dominancia apical con la brotación subsecuente de yemas laterales en la base de la rama infestada, generan un patrón ondulado del crecimiento y una apariencia tortuosa de la copa (Figura 5c y 5d). Los agalladores, como indican Tooker et al. (2008), consumen recursos que los hospedantes podrían emplear en su crecimiento y reproducción, suprimen o manipulan sus defensas, alteran sus características físicas, impactan su fenotipo al cambiar los patrones de la tasa fotosintética y acumulación de biomasa, y estimulan tejidos especiales para la protección del inductor, lo que puede causar efectos profundos en sus hospedantes. Una alta presencia de L. hyalinus tiene un efecto visual importante en los sitios donde los encinos son elementos importantes del paisaje, ya que se pierde el patrón arquetípico que los Q. laeta no atacados presentan.
Inquilinos y parasitoides de Loxaulus hyalinus
Los cinípidos inquilinos en las agallas de L. hyalinus tienen al menos dos periodos de emergencia: uno de finales de enero a marzo y otro que coincide con la emergencia del inductor de la agalla. En febrero del 2022, durante el estado larval de L. hyalinus, se observó la emergencia de Synergus pseudofilicornisLobato-Vila y Pujade-Villar 2018 (previamente denominada Synergus filicornis Cameron, 1883), y de abril a mayo (periodo de emergencia de L. hyalinus) del 2020 y 2021, de Synergus grahami Lobato-Vila y Pujade-Villar, 2019. También se ha reportado a Synergus macrackenae Lobato-Vila & Pujade-Villar, 2021 (Lobato-Vila & Pujade-Villar, 2021) y a S. filicornis en agallas de rama de Loxaulus (Lobato-Vila et al., 2020). Debido a que solo se evaluó de manera detallada el periodo de emergencia de L. hyalinus, se puede esperar que el efecto en la mortalidad sea mayor al observado, ya que se trata de inquilinos letales.
En una recolecta del 26 de abril del 2019, en dos agallas se obtuvieron 279 adultos de especies distintas. La emergencia se registró del 28 de abril al 12 de mayo. Los individuos correspondieron a Eurytoma (135 adultos, 48.49 %), L. hyalinus (117 adultos, 41.93 %), Synergus (12 adultos, 4.30 %), Sycophila (nueve adultos, 3.22 %), Ormyrus (un adulto, 0.36 %), Pteromalidae (tres adultos, 1.07 %) y Eulophidae (dos adultos, 0.72 %).
Del 8 de abril al 18 de junio del 2020, en 30 agallas emergieron 652 adultos de especies diferentes, el mayor número de estos entre el 10 y 27 de mayo. El grupo más numeroso fue Eurytomidae (337 adultos, 51.69 %), seguido de Pteromalidae y Eulophidae (147 adultos en conjunto, 22.55 %), L. hyalinus (90 adultos, 13.80 %), Synergini (66 adultos, 10.12 %), Ormyridae (10 adultos, 1.53 %) y Eupelmidae (dos adultos, 0.31 %).
Entre el 20 de abril y el 17 de mayo del 2021, de 27 agallas emergieron 488 adultos; de estos, el grupo de insectos más numeroso fue Eurytomidae (224 adultos, 45.90 %), seguido de L. hyalinus (190 adultos, 38.93 %), Synergini (15 adultos, 3.07 %), Eulophidae (33 adultos, 6.76 %), Pteromalidae (12 adultos, 2.46 %), Ormyridae (nueve adultos, 1.84 %), Torymidae (cuatro adultos, 0.82 %) y Eupelmidae (un adulto, 0.20 %).
Los géneros de parasitoides calcidoideos presentes en las agallas de rama de L. hyalinus fueron: Eurytoma y Sycophila (Eurytomidae), Ormyrus (Ormyridae), Torymus (Torymidae), Eupelmus (Eupelmidae), Pteromalus (Pteromalidae) y Eulophidae. También se registró la emergencia de Encyrtidae y Platygastridae, los cuales pueden no estar asociados a L. hyalinus y a sus enemigos naturales. Los parasitoides más diversos son Eurytoma y las familias Pteromalidae y Eulophidae, los cuales cuentan con múltiples morfoespecies. Los géneros restantes tienen menor diversidad, contando con al menos una morfoespecie.
En los años estudiados se pudo reconocer gran diversidad de enemigos naturales, cuyo efecto de control natural sobre L. hyalinus podría ser significativo, como lo sugiere la disminución en la cantidad de agallas, aunque no se cuenta con información concluyente sobre la causa de dicha reducción.
En 2019 y 2020, en las ramas jóvenes de algunos individuos de Q. laeta se registró presencia alta de agallas de L. hyalinus. En 2021 se observó reducción de agallas de rama, presumiblemente por el efecto de los enemigos naturales u otros impactos del ambiente en años anteriores, aunque la mayor presencia de L. hyalinus en ese año podría indicar que las poblaciones del inductor, de inquilinos y de parasitoides interactúan irregularmente.
En la disección de las agallas colectadas desde enero hasta la segunda semana de abril de 2020 y 2021 se encontraron estados inmaduros del inductor, inquilinos y parasitoides. En enero del 2022, además de las larvas L1 de L. hyalinus en cámaras con características similares a las del inductor, se encontraron larvas de cinípido de último instar con mandíbulas con tres dientes (el apical de mayor tamaño), similares a la larva de S. filicornis descrita por Tormos et al. (2014).
Conclusiones
Este trabajo permitió conocer las características de las agallas de Loxaulus hyalinus y su papel como inductor de agallas de ramilla que afectan el crecimiento, estructura y apariencia de Quercus laeta, aunque sin causar su muerte. Hay gran diversidad y cantidad de parasitoides calcidoideos y cinípidos inquilinos asociados a L. hyalinus, siendo Eurytoma y Sinergus los más numerosos, aunque se desconoce la magnitud de su efecto en la población de este agallador. Aun cuando no se encontró la generación asexual de L. hyalinus es posible que sí esté presente.
Agradecimientos
Se agradece al Consejo Nacional de Ciencia y Tecnología (CONACYT) por la beca de manutención otorgada a Uriel M. Barrera Ruiz; al Colegio de Postgraduados por el financiamiento a la tesis de doctorado de la cual se deriva el presente trabajo; y al personal del Departamento de Áreas Verdes y Forestales de la Asociación de Colonos del Fraccionamiento Habitacional Bosques de Santa Fe por el apoyo y las facilidades para la realización de los trabajos en campo.
REFERENCIAS
Blaydes, G. W. (1939). The use of Bismarck Brown Y in some new stain schedules. Stain Technology, 14(3), 105‒110. https://doi.org/10.3109/10520293909110309 [ Links ]
Cuesta-Porta, V., Barrera-Ruiz, U. M., Cibrián-Tovar, D., & Pujade-Villar, J. (2022). Discovery of the male of Loxaulus hyalinus, and implications for the sympatric species Loxaulus laeta (Hymenoptera: Cynipidae: Cynipini): an integrative taxonomical case of species delimitation. Journal of Natural History, 56(5-8), 397‒413. https://doi.org/10.1080/00222933.2022.2077150 [ Links ]
Garrido-Fariña, G. I., Cornejo-Cortés, M. Á., & López-Pérez, V. M. (2021). Colorantes para laboratorios de ciencias básicas. Ediciones Cuautitlán. [ Links ]
Gibson, G. A. P., Huber, J. T., & Woolley, J. B. (1997). Annotated key to the genera of Neartic Chalcidoidea (Hymenoptera). NRC-CNRC. [ Links ]
Harris, M. O., & Pitzschke, A. (2020). Plants make galls to accommodate foreigners: some are friends, most are foes. New Phytologist, 225(5), 1852‒1872. https://doi.org/10.1111/nph.16340 [ Links ]
Hernández-Soto, P., Lara-Flores, M., Agredano-Moreno, L., Jiménez-García, L. F., Cuevas-Reyes, P., & Oyama, K. (2015). Developmental morphology of bud galls induced on the vegetative meristems of Quercus castanea by Amphibolips michoacaensis (Hymenoptera: Cynipidae). Botanical Sciences, 93(4), 685‒693. https://doi.org/10.17129/botsci.607 [ Links ]
Hood, G. R., & Ott, J. R. (2011). Generational shape shifting: changes in egg shape and size between sexual and asexual generations of a cyclically parthenogenic gall former. Entomologia Experimentalis et Applicata, 141(1), 88‒96. https://doi.org/10.1111/j.1570-7458.2011.01169.x [ Links ]
Lobato-Vila, I., Cibrián-Tovar, D., Barrera-Ruíz, U. M., Equihua-Martínez, A., Estrada-Venegas, E. G., Buffington, M. L., & Pujade-Villar, J. (2019). Review of the Synergus Hartig species (Hymenoptera: Cynipidae: Synergini) associated with tuberous and other tumor-like galls on oaks from the New World with the description of three new species from Mexico. Proceedings of the Entomological Society of Washington, 121(2), 193‒255. https://doi.org/10.4289/0013-8797.121.2.193 [ Links ]
Lobato-Vila, I., Cibrián-Tovar, D., Barrera-Ruíz, U. M., Equihua-Martínez, A., Estrada-Venegas, E. G., Tovar-Sánchez, E., Castillo-Mendoza, E., Buffington, M. L., & Pujade-Villar, J. (2020). Review of the Synergus Hartig species (Hymenoptera: Cynipidae: Synergini) associated with wolly galls on oaks from the New World, with the description of a new species from Mexico. Proceedings of the Entomological Society of Washington, 122(3), 678‒715. https://doi.org/10.4289/0013-8797.122.3.678 [ Links ]
Lobato-Vila, I., & Pujade-Villar, J. (2017). Description of five new species of inquiline oak gall wasps of the genus Synergus Hartig (Hymenoptera, Cynipidae: Synergini) with partially smooth mesopleurae from Mexico. Zoological Studies, 56, e36. https://doi.org/10.6620/ZS.2017.56-36 [ Links ]
Lobato-Vila, I., & Pujade-Villar, J. (2018). Estado actual del conocimiento de la diversidad de inquilinos de agallas de cinípidos en encinos de México (Hymenoptera: Cynipidae). Entomología Forestal, 5, 435‒443. https://www.researchgate.net/profile/Irene-Lobato-Vila/publication/325903717_Current_knowledge_on_inquiline_oak_gall_wasp_diversity_from_Mexico_Hymenoptera_Cynipidae/links/5b2babe90f7e9b0df5b47453/Current-knowledge-on-inquiline-oak-gall-wasp-diversity-from-Mexico-Hymenoptera-Cynipidae.pdf [ Links ]
Lobato-Vila, I., & Pujade-Villar, J. (2021). The genus Synergus Hartig (Hymenoptera: Cynipidae: Synergini) in the New World: a complete taxonomic revision with a key to species. Zootaxa, 4906(1), 1‒121. https://doi.org/10.11646/zootaxa.4906.1.1 [ Links ]
Medianero, E., Nieves-Aldrey, J.-L., & Melika, G. (2011). Two new Neotropical species of oak gall wasps of the genus Loxaulus Mayr (Hymenoptera: Cynipidae: Cynipini) from Panama. Zootaxa, 2811(1), 37‒46. https://doi.org/10.11646/zootaxa.2811.1.3 [ Links ]
Melika, G., & Abrahamson, W. G. (2000). Review of the cynipid gall wasps of the genus Loxaulus Mayr (Hymenoptera: Cynipidae) with descriptions of new species. Proceedings of the Entomological Society of Washington, 102(1), 198‒211. https://doi.org/10.5281/zenodo.27206 [ Links ]
Melika, G. (2006). Gall wasp of Ukraine: Cynipidae. Vestnik Zoologï, 1(21), 492. http://mail.izan.kiev.ua/vz-pdf/suppl/Supplement%202006-21-1.pdf [ Links ]
Melika, G., Nicholls, J. A., Abrahamson, W. G., Buss, E. A., & Stone, G. N. (2021). New species of Nearctic oak gall wasps (Hymenoptera: Cynipidae, Cynipini). Zootaxa, 5084(1), 23. https://doi.org/10.11646/zootaxa.5084.1.1 [ Links ]
Nieves-Aldrey, J.-L., Vårdal, H., & Ronquist, F. (2005). Comparative morphology of terminal-instar larvae of Cynipoidea: phylogenetic implications. Zoologica Scripta, 34(1), 15‒36. https://doi.org/10.1111/j.1463-6409.2005.00175.x [ Links ]
Pujade-Villar, J., Cibrián-Tovar, D., Equihua-Martínez, A., Estrada-Venegas, E. G., Barrera-Ruiz, U. M., & Melika, G. (2014). First record of Loxaulus Mayr from Mexico, with descriptions of two new species (Hymenoptera: Cynipidae, Cynipini). Southwestern Entomologist, 39(2), 343‒354. http://doi.org/10.3958/059.039.0212 [ Links ]
Sanver, D., & Hawkins, B. A. (2000). Galls as habitats: the inquiline communities of insect galls. Basic and Applied Ecology, 1(1), 3‒11. https://doi.org/10.1078/1439-1791-00001 [ Links ]
StatSoft, Inc. (2007). STATISTICA (data analysis software system) (version 8.0). https://www.tibco.com/data-science-and-streaming [ Links ]
Stone, G. N., & Schönrogge, K. (2003). The adaptive significance of insect gall morphology. Trends in Ecoloy and Evolution, 18(10), 512‒522. https://doi.org/10.1016/S0169-5347(03)00247-7 [ Links ]
Todorov, I., Stojanova, A., Zlatkov, B., Hristov, G., & Melika, G. (2019). New data on the parasitoid-inquiline community of Andricus quercustozae (Bosc, 1792) (Hymenoptera: Cynipidae) in Bulgaria. Acta Zoologica Bulgarica, 71(2), 301‒303. https://www.researchgate.net/publication/335828247_New_Data_on_the_Parasitoid-Inquiline_Community_of_Andricus_quercustozae_Bosc_1792_Hymenoptera_Cynipidae_in_Bulgaria [ Links ]
Tooker, J. F., Rohr, J. R., Abrahamson, W. G., & De Morales, C. M. (2008). Gall insects can avoid and alter indirect plant defenses. New Phytologist, 178(3), 657‒671. https://doi.org/10.1111/j.1469-8137.2008.02392.x [ Links ]
Tormos, J., Asís, J. D., Cibrián-Tovar, D., Cibrián-Llanderal, V. D., Barrera-Ruiz, U. M., Melika, G., & Pujade-Villar, J. (2014). Description of the inmature larva of Synergus filicornis (Hymenoptera: Cynipidae: Synergini), with notes on the inmature larvae. Florida Entomologist, 97(2), 540‒548. https://doi.org/10.1653/024.097.0227 [ Links ]
Vårdal, H., Sahlén, G., & Ronquist, F. (2003). Morphology and evolution of the cynipoid egg (Hymenoptera). Zoological Journal of the Linnean Society, 139(2), 247‒260. https://doi.org/10.1046/j.1096-3642.2003.00071.x [ Links ]
Recibido: 08 de Septiembre de 2022; Aprobado: 05 de Abril de 2023











 texto en
texto en 





