Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Chapingo serie ciencias forestales y del ambiente
versión On-line ISSN 2007-4018versión impresa ISSN 2007-3828
Rev. Chapingo ser. cienc. for. ambient vol.29 no.2 Chapingo may./ago. 2023 Epub 05-Abr-2024
https://doi.org/10.5154/r.rchscfa.2022.08.053
Artículos científicos
Crecimiento de plantas de Pinus arizonica Engelm. inoculadas con Pisolithus tinctorius y Astraeus hygrometricus en invernadero
1Universidad Autónoma de Ciudad Juárez. Av. Benjamín Franklin núm. 4650, zona PRONAF. C. P. 32310. Ciudad Juárez, Chihuahua, México.
2Universidad Autónoma de Nuevo León, Facultad de Ciencias Forestales. Carretera Nacional km 145. Linares, Nuevo León, México.
Introducción:
Las asociaciones ectomicorrícicas son un componente esencial para el ciclo de nutrientes y la salud del bosque.
Objetivo:
Evaluar los efectos de la inoculación de esporas de los hongos ectomicorrícicos Pisolithus tinctorius (Pers.) Coker & Couch y Astraeus hygrometricus (Pers.) Morgan sobre el crecimiento de Pinus arizonica Engelm.
Materiales y métodos:
Se aplicaron tres tratamientos de inoculación fúngica (A. hygrometricus, P. tinctorius y Ectorrize®) con tres volúmenes (10, 25 y 50 mL: 106 esporas∙mL-1) y un grupo control sin inóculo. Las variables medidas fueron supervivencia y colonización micorrícica; altura de la planta; longitud y diámetro del follaje; longitud de la raíz y biomasa. Las ectomicorrizas se caracterizaron y se hizo un análisis mineral de elementos nutricionales en el sistema aéreo y radicular. Los efectos de las especies fúngicas y el volumen del inóculo se determinaron mediante un ANOVA aleatorizado (α = 0.05).
Resultados y discusión:
El volumen de inoculante no tuvo efecto significativo (P > 0.05) sobre las variables, pero sí hubo diferencias entre la especie fúngica y el control (P ≤ 0.05); siendo P. tinctorius el de mayor efecto significativo. Las plantas inoculadas tuvieron mayor tasa de supervivencia y mayor cantidad de minerales en la composición en comparación con las no inoculadas (P ≤ 0.05). Las ectomicorrizas mostraron claras diferencias morfológicas; se observó la red de Hartig como indicador.
Conclusión:
La inoculación con los hongos ectomicorrícicos causó mejoras en el desarrollo morfológico de P. arizonica. Se recomienda la dosis más pequeña de inóculo (10 mL: 106 esporas∙mL-1), principalmente del hongo P. tinctorius.
Palabras clave: ectomicorrizas; análisis mineral; simbiosis; Ectorrize; sistema micorrícico
Introduction:
Ectomycorrhizal associations are an essential component of nutrient cycling and forest health.
Objective:
To evaluate the effects of spore inoculation of Pisolithus tinctorius (Pers.) Coker & Couch and Astraeus hygrometricus (Pers.) Morgan on Pinus arizonica Engelm. growth.
Materials and methods:
Three mycorrhizal inoculation treatments (A. hygrometricus, P. tinctorius and Ectorrize®) were applied with three volumes (10, 25 and 50 mL: 106 spores∙mL-1) and a control group with no inoculum. The variables measured were mycorrhizal survival and colonization; plant height; shoot length and diameter; root length and biomass. The ectomycorrhizas were characterized and a mineral analysis of nutritional elements in the shoot and root was performed. The effects of fungal species and inoculum volume were determined by randomized ANOVA (α = 0.05).
Results and discussion:
The volume of this inoculum had no significant effect (P > 0.05) on the variables, but there were differences between the fungal species and the control (P ≤ 0.05); with P. tinctorius having the greatest significant effect. Inoculated plants had higher survival rate and higher amount of minerals in the composition compared to non-inoculated plants (P ≤ 0.05). The ectomycorrhizas showed clear morphological differences; the Hartig net was observed as an indicator.
Conclusion:
Inoculation with the ectomycorrhizal fungi improved the morphological development of P. arizonica. The smallest inoculum dose (10 mL: 106 spores∙mL-1) is recommended, mainly of the fungus P. tinctorius.
Keywords: ectomycorrhizae; mineral analysis; symbiosis; Ectorrize; mycorrhizal system
Ideas destacadas:
La inoculación con hongos ectomicorrícicos (HEM) mejoró el crecimiento de P. arizonica.
Las plantas inoculadas con HEM tuvieron mayor supervivencia y cantidad de minerales.
Los HEM puede establecer simbiosis con P. arizonica a bajos volúmenes de inoculación.
Se recomienda la dosis más pequeña de HEM (10 mL: 106 esporas∙mL-1) en P. arizonica.
Introducción
La mayoría de los árboles de bosques templados forman asociaciones mutualistas simbióticas con diversos hongos ectomicorrícicos (HEM) (Marqués-Gálvez et al., 2022). La planta suministra carbono y energía al socio fúngico; al mismo tiempo, este aporta nutrientes minerales que son difíciles de asimilar por la planta, especialmente nitrógeno y fósforo (Ortega, 2015). Asimismo, el hongo asociado proporciona otros beneficios, como una mayor tolerancia al estrés ambiental, mejora en la tasa fotosintética, resistencia osmótica a plagas y estimulación de sustancias reguladoras del crecimiento (Frank & García, 2021).
La reducción y manejo inadecuado de los bosques disminuye o elimina el inóculo micorrícico que se encuentra naturalmente en el suelo, lo que se traduce en un menor porcentaje de supervivencia para las especies de hongos y árboles (Prado-Tarango et al., 2021). Como alternativa a la preservación del inóculo fúngico se han tomado medidas para asegurar la presencia del micelio de HEM en las raíces de las plantas. Una de ellas es transportar cantidades grandes de suelo forestal al lugar donde las plántulas se cultivan, pero esta práctica resulta insostenible (Sáenz-Romero, 2014). Otra opción es cultivar HEM in vitro y realizar síntesis de micorrizas en el laboratorio, invernaderos o campo utilizando plantas germinadas asépticamente; sin embargo, es necesario determinar las condiciones adecuadas de crecimiento, las especies de hongos a utilizar, así como las técnicas de cultivo y la cantidad óptima de inóculo (Pérez-López et al., 2021; Walker & Jones, 2013).
Pinus arizonica Engelm. es uno de los pinos comercialmente más importantes del estado de Chihuahua, debido a la calidad de la madera, la cual ha sido afectada por las actividades de la industria maderera, incendios forestales y desmonte agrícola (Morales-Nieto et al., 2021; Silva-Flores et al., 2014). A pesar de su importancia, no se han realizado estudios para investigar los asociados fúngicos nativos de P. arizonica en la Sierra Madre Occidental en Chihuahua; además, ningún estudio ha informado los efectos que los HEM pueden tener en el crecimiento de la especie cuando se inoculan in vitro o como suspensión de esporas en condiciones de invernadero. Por tanto, el objetivo de este estudio fue evaluar la respuesta morfométrica de plantas de P. arizonica inoculadas con preparaciones esporales de Pisolithus tinctorius (Pers.) Coker & Couch y Astraeus hygrometricus (Pers.) Morgan. Estos HEM pueden vivir en suelos pobres con acidez alta y soportar periodos de estrés por sequía (Sebastiana et al., 2020). Los resultados de esta investigación pueden ser de utilidad para mejorar el éxito de las plantas de P. arizonica cuando se establecen en el campo durante los programas de reforestación.
Materiales y métodos
Preparación de semillas
Las semillas de P. arizonica fueron proporcionadas por la Unidad de Manejo Forestal (UMAFOR) del poblado de San Juanito en el municipio de Bocoyna, Chihuahua. Las semillas se colocaron en un recipiente con agua del grifo durante 24 h para desechar las semillas flotantes que se consideraron inviables (Monroy-Vazquez et al., 2017). Las semillas restantes en el fondo del recipiente se colocaron en papel secante húmedo en una bolsa de plástico resellable hasta la germinación. En el invernadero se utilizaron semilleros (con 77 cavidades) que se llenaron con un sustrato estéril de musgo de turba. Las semillas se colocaron a 0.5 cm de profundidad en el sustrato y se humedecieron con agua desionizada cada tercer día. Las plantas se mantuvieron en el invernadero de la Universidad Autónoma de Ciudad Juárez (UACJ) a una temperatura promedio de 26.3 ± 1.06 °C y se fertilizaron con Trifol 60 Plus® 20-20-20 una vez al mes durante nueve meses, para garantizar el crecimiento.
Muestreo de campo de esporomas
Los esporomas de P. tinctorius y A. hygrometricus (Figura 1) se cosecharon en agosto del 2018 durante la temporada de lluvias en bosques templados ubicados en El Huérfano y en San Juanito, Bocoyna, Chihuahua. Las muestras se llevaron al Laboratorio de Biodiversidad de la UACJ para la extracción de esporas.
Preparación de inóculo fúngico
Los esporomas de A. hygrometricus y P. tinctorius se remojaron con agua destilada (para evitar posible contaminación por bacterias u hongos) en una proporción de 1:50 durante 2 h (Aguilar-Ulloa et al., 2016). Después, los esporomas se colocaron por separado en una licuadora convencional y se licuaron hasta obtener una mezcla homogénea, que posteriormente se tamizó (abertura de malla de 1 mm) y se colocó en frascos de vidrio. El inóculo se mantuvo a 4 °C en la oscuridad hasta su uso en el invernadero. El número de esporas por especie se determinó mediante una cámara Neubauer y la concentración se ajustó a 106 esporas∙mL-1 (Konopická et al., 2021).
Inoculación de plantas
Cuando las plantas de pino alcanzaron una altura promedio de 5 cm, el inóculo fúngico se aplicó al sistema radicular utilizando volúmenes de 10, 25 y 50 mL con jeringas de 10 mL; el inóculo de esporas (106 esporas∙mL-1) se aplicó dos veces en un mes (modificado de Yin et al., 2018). Asimismo, se utilizó el producto comercial Ectorrize® como control positivo, el cual tiene esporas de P. tinctorius y bacterias del suelo; del mismo modo, el número de esporas se ajustó a 106 esporas∙mL-1. El control negativo consistió solo en plantas sin inoculación. El número de plantas inoculadas en cada tratamiento se muestra en el Cuadro 1. La variabilidad entre la cantidad de plantas se debe a que del número inicial (n = 40), existieron elementos que no alcanzaron los 5 cm de altura para iniciar el experimento.
Cuadro 1 Volumen de inóculo (106 esporas∙mL-1) de Astraeus hygrometricus y Pisolithus tinctorius utilizado en plantas de Pinus arizonica.
| Especie | Volumen de inóculo (mL) | Plantas por tratamiento |
|---|---|---|
| A. hygrometricus | 10 | 29 |
| A. hygrometricus | 25 | 28 |
| A. hygrometricus | 50 | 23 |
| P. tinctorius | 10 | 30 |
| P. tinctorius | 25 | 33 |
| P. tinctorius | 50 | 33 |
| Ectorrize® | 10 | 31 |
| Ectorrize® | 25 | 32 |
| Ectorrize® | 50 | 24 |
| Control negativo | - | 29 |
Evaluación de la eficiencia micorrícica
El crecimiento aéreo de las plantas (altura, diámetro del tallo y del follaje) se midió mensualmente a partir del inicio de la inoculación, durante nueve meses, con un vernier digital Neiko 01407A. La biomasa se obtuvo en peso fresco (g) para la parte aérea (hojas y tallo) y sistema radicular; la biomasa en peso seco se obtuvo a través de secado en mufla.
Las medidas de altura, el diámetro del sistema radicular y la biomasa de la parte aérea y el sistema radicular (peso fresco y seco) se determinaron a partir de un método de muestreo no reemplazable utilizando cinco plantas por tratamiento; el sistema radicular se lavó con agua abundante del grifo para eliminar el sustrato restante. La colonización micorrícica se determinó con la ecuación utilizada por Garza-Ocañas et al. (2018): colonización (%) = (número de raíces micorrizadas/ número raíces observadas) * 100.
Caracterización de la ectomicorriza
Los sistemas radiculares de tres plantas seleccionadas al azar, por especie de hongo, se caracterizaron morfológicamente a los nueve meses de la inoculación. Las características externas de las micorrizas frescas se observaron con ayuda de un microscopio estereoscópico y se describieron en términos de tipo de ramificación, morfología de las puntas de las raíces, presencia de rizomorfos, color y grosor del manto, y diámetro de las micorrizas (Agerer, 1991).
La caracterización histológica de las micorrizas comenzó con una técnica de fijación de las muestras con 1:1:1 de formol, alcohol y ácido acético; posteriormente, se filtraron con ayuda de una bomba de vacío seguido de una inclusión en parafina. Después se realizaron cortes longitudinales y transversales de la micorriza de 2 µm en un microtomo de rotación. Por último, los cortes se desparafinaron y se tiñeron con azul de metileno de Loeffler (1 %) y verde brillante para observar y caracterizar la morfología del manto fúngico y red Hartig (Prophet et al., 1995) con ayuda de un microscopio óptico en un aumento de 100x.
Contenido mineral de la planta
Se enviaron muestras del sistema aéreo y radicular de las plantas con cada tratamiento al Laboratorio de Análisis de Suelos, Plantas y Aguas de la Facultad de Ciencias Agrotecnológicas de la Universidad Autónoma de Chihuahua, donde se realizó un análisis de composición mineral para conocer los porcentajes del nitrógeno total (Nt), fósforo (P), potasio (K), calcio (Ca), magnesio (Mg) y sodio (Na), así como la cantidad en partes por millón (ppm) de cobre (Cu), hierro (Fe), manganeso (Mn) y zinc (Zn).
La técnica micro-Kjeldahl se utilizó para determinar la cantidad de N, y la mezcla digestora triazida y la técnica de vanadato colorimétrico para el porcentaje de P. La mezcla digestora se basa en la extracción del P con la metodología de Tiessen y Moir (1993), y la prueba colorimétrica de vanadato es la sugerida por Murphy y Riley (1962). La cuantificación de K, Ca, Mg, Na, Cu, Fe, Mn y Zn también se hizo con una mezcla de digestores triazidos y espectrofotometría de absorción atómica (GBC Avanta-Sigma) (Association of Official Analytical Chemists [AOAC], 1990).
Análisis estadístico
Se realizaron pruebas de normalidad de Shapiro-Wilk (n ≤ 30) y Kolmogórov-Smirnov (n > 30) para determinar si los datos se ajustaron a una distribución normal, también se utilizó una prueba de homogeneidad de varianzas de Levene (P ≥ 0.05).
Los efectos de las especies de hongos (factor A) y el volumen de inóculo de esporas utilizado (factor B) sobre las variables morfométricas (variables de respuesta: altura de la planta, diámetro del follaje y altura del tallo) se determinaron mediante un ANOVA completamente aleatorizado. Se utilizó una disposición factorial de 4 x 3, correspondiente al inóculo de esporas de las dos especies de hongos, el inóculo comercial de Ectorrize®, el control negativo y los tres volúmenes de inóculo. Asimismo, se realizó un ANOVA con un diseño aleatorio para evaluar el efecto de las especies de hongos sobre las variables morfométricas de altura y diámetro del sistema radicular y la biomasa de la parte aérea y el sistema radicular (peso fresco y seco). Los datos que mostraron heterogeneidad de las varianzas se analizaron con una comparación múltiple de medias T3 por Dunnett. El análisis estadístico se realizó en el programa estadístico SPSS versión 20 (IBM Corporation, 2011) y se utilizó el programa GraphPad Prism versión 8.0 (GraphPad Software, Inc., 2018).
Resultados
Eficiencia y colonización
El Cuadro 2 indica que, al final del experimento, las plantas inoculadas tuvieron mayor supervivencia (93.5 a 100 %) que las no inoculadas (74.3 %).
Las Figuras 2, 3 y 4 muestran que la inoculación con P. tinctorius y A. hygrometricus tuvo efecto positivo (P ≤ 0.05) en todas las variables morfométricas de P. arizonica. La altura promedio de las plantas (Figura 2), así como el diámetro y longitud del follaje (Figura 4), fue mayor en los tratamientos inoculados en comparación con el control no inoculado, independientemente del volumen de inóculo que no tuvo efecto estadísticamente significativo (P > 0.05). Lo anterior indica que los HEM puede establecer simbiosis con las plantas de P. arizonica a bajos volúmenes de inoculación, generando efectividad.
Cuadro 2 Supervivencia de las plantas de Pinus arizonica a los nueve meses de inoculación con Astraeus hygrometricus y Pisolithus tinctorius a una concentración de 106 esporas∙mL-1 en condiciones de invernadero.
| Tratamiento | Volumen de inóculo (mL) | Supervivencia (%) |
|---|---|---|
| P. tinctorius | 10 | 100.0 |
| P. tinctorius | 25 | 96.9 |
| P. tinctorius | 50 | 100.0 |
| Ectorrize® | 10 | 93.5 |
| Ectorrize® | 25 | 90.6 |
| Ectorrize® | 50 | 100.0 |
| A. hygrometricus | 10 | 100.0 |
| A. hygrometricus | 25 | 100.0 |
| A. hygrometricus | 50 | 95.6 |
| Control | - | 74.3 |

Figura 2 Altura de las plantas de Pinus arizonica bajo efecto de los tratamientos de inoculación con Pisolithus tinctorius (PT), Ectorrize® (ECT), Astraeus hygrometricus (AH) y un tratamiento control sin inoculación (C). Letras diferentes indican diferencias significativas entre tratamientos de acuerdo con la comparación múltiple de medias de Dunnett (P ≤ 0.05). Las barras de variación representan la desviación estándar de la media (n = 5).
El análisis estadístico determinó que el volumen de inoculante no tuvo efecto significativo (P > 0.05) sobre el crecimiento de la altura de las plantas (Figura 2), el diámetro del tallo (Figura 3) y la longitud y diámetro del follaje (Figura 4); sin embargo, la interacción o combinación de los HEM y el volumen inoculado sí mostró efecto sobre las variables (Cuadro 3). En el caso de la altura, longitud del follaje y diámetro del follaje de la planta se observa que P. tinctorius genera el mayor crecimiento a dosis de 10 y 50 mL, siendo similar con Ectorrize® a 10 mL; para el diámetro del tallo, la mejor respuesta se generó con P. tinctorius a dosis de 10 mL.
Cuadro 3 Efecto de interacción de los hongos ectomicorrícicos y volumen de inóculo sobre las variables de crecimiento de Pinus arizonica.
| Volumen de inóculo (mL) | Pisolithus tinctorius | Ectorrize® | Astraeus hygrometricus | Control (sin inóculo) |
|---|---|---|---|---|
| Altura de la plántula | ||||
| 10 | 28.6 ± 2.4 f | 28.5 ± 3.4 f | 24.4 ± 2.9 de | 16.9 ± 3.4 a |
| 25 | 24.7 ± 2.3 e | 22.4 ± 3.4 bcd | 23.5 ± 3.4 cde | |
| 50 | 27.1 ± 4.2 f | 22.0 ± 2.4 bc | 25.0 ± 3.6 de | |
| Longitud del follaje | ||||
| 10 | 26.1 ± 2.4 f | 25.7 ± 3.3 f | 21.3 ± 2.9 de | 14.8 ± 3.1 a |
| 25 | 22.3 ± 2.5 e | 19.7 ± 3.2 cd | 20.8 ± 3.2 cde | |
| 50 | 24.5 ± 4.1 f | 18.7 ± 2.3 bc | 21.4 ± 3.7 de | |
| Diámetro del follaje | ||||
| 10 | 21.7 ± 2.4 g | 21.5 ± 3.8 g | 17.6 ± 2.7 bcde | 12.9 ± 4.1 a |
| 25 | 16.5 ± 3.1 b | 18.6 ± 2.9 cdef | 18.1 ± 3.8 cdef | |
| 50 | 20.6 ± 4.0 g | 17.9 ± 3 bcdef | 17.6 ± 4.6 bcdef | |
| Diámetro del tallo | ||||
| 10 | 5.7 ± 0.09 f | 5.3 ± 0.6 e | 4.3 ± 0.06 c | 3.2 ± 0.08 a |
| 25 | 5.3 ± 0.19 e | 4.6 ± 0.08 d | 4.1 ± 0.07 bc | |
| 50 | 5.1 ± 0.06 de | 4.6 ± 0.1 d | 3.9 ± 0.06 b | |
± desviación estándar de la media. En cada variable, letras distintas indican diferencias significativas entre medias de acuerdo con la prueba de Dunnett (P ≤ 0.05).
En cuanto al diámetro del tallo (Figura 3), las plantas inoculadas con esporas de P. tinctorius y Ectorrize® mostraron mayor crecimiento, seguidas de A. hygrometricus, en comparación con el control (3.36 cm).

Figura 3 Diámetro del tallo de Pinus arizonica bajo tratamientos de inoculación con Pisolithus tinctorius (PT), Ectorrize® (ECT), Astraeus hygrometricus (AH) y un tratamiento control sin inoculación (C). Letras distintas indican diferencias significativas entre tratamientos de acuerdo con la comparación múltiple de medias de Dunnett (P ≤ 0.05). Las barras de variación representan la desviación estándar de la media (n = 5).
La longitud y diámetro del sistema aéreo en los tratamientos inoculados fueron mayores que en el control no inoculado (Figura 4A). Con respecto al sistema de las raíces, los tratamientos inoculantes tuvieron efecto estadísticamente similar sobre la longitud (P > 0.05) en comparación con el control (Figura 4B); esta varió entre 14.04 y 15.26 cm. Por el contrario, los resultados para el diámetro del sistema radicular (Figura 4B) indicaron diferencias entre los tratamientos (P < 0.05), siendo menor el control (3.72 cm); los valores más altos se obtuvieron con los tratamientos Ectorrize® y A. hygrometricus, con 4.60 y 4.62 cm, respectivamente.
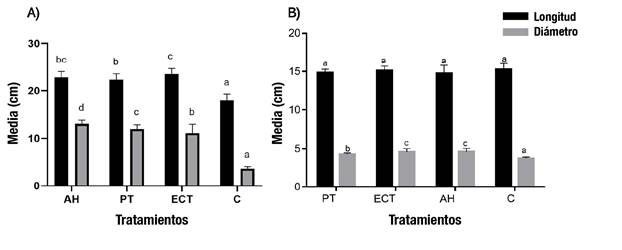
Figura 4 A) Longitud y diámetro promedio del sistema aéreo (A) y radicular (B) de Pinus arizonica bajo tratamientos de inoculación con Pisolithus tinctorius (PT), Ectorrize® (ECT), Astraeus hygrometricus (AH) y un tratamiento control sin inoculación (C). Letras distintas indican diferencias significativas entre tratamientos de acuerdo con la comparación múltiple de medias de Dunnett (P ≤ 0.05). Las barras de variación representan la desviación estándar de la media (n = 5).
Se ha informado que, en las primeras etapas del desarrollo de las plantas, la presencia de inóculos reduce la incidencia de patógenos de raíz (Sharma et al., 2014) porque se produce competencia natural por el espacio entre estos y los HEM (Jung et al., 2012). En este estudio no se detectaron enfermedades causadas por especies fúngicas patógenas en las plantas inoculadas de P. arizonica ni en el control.
En cuanto a la producción de biomasa, tanto de la parte aérea como del sistema radicular (Figura 5), se observaron efectos positivos en plantas de P. arizonica en comparación con el control. El tratamiento con esporas de P. tinctorius estimuló un mayor crecimiento aéreo de las plantas (8.08 g) que difirió significativamente (P < 0.05) con el tratamiento control no inoculado (2.40 g). La mayor biomasa en peso fresco para el sistema radicular fue inducida por tratamientos de esporas de P. tinctorius y Ectorrize® con valores de 7.92 y 7.80 g, respectivamente, y estos difirieron significativamente con los obtenidos en el control. Los tratamientos de esporas de P. tinctorius y el producto comercial Ectorrize® generaron también mayor biomasa en peso seco en el sistema radicular con 3.12 y 3.22 g, respectivamente.

Figura 5 Producción de biomasa del sistema aéreo (A) y sistema radicular (B) de Pinus arizonica bajo tratamientos de inoculación con Pisolithus tinctorius (PT), Ectorrize® (ECT), Astraeus hygrometricus (AH) y un tratamiento control sin inoculación (C). Letras distintas indican diferencias significativas entre tratamientos de acuerdo con la comparación múltiple de medias de Dunnett (P ≤ 0.05). Las barras de variación representan la desviación estándar de la media (n = 5).
Colonización ectomicorrícica de raíces de Pinus arizonica
El Cuadro 4 indica que las esporas de P. tinctorius produjeron el mayor porcentaje de colonización ectomicorrícica en las plantas de P. arizonica, seguidas por las de A. hygrometricus y Ectorrize®. El grado de formación de micorrizas se clasificó de acuerdo con Tateishi et al. (2003); en función del número de raíces micorrícicas, las plantas inoculadas tuvieron un nivel medio a alto (nivel IV).
Cuadro 4 Colonización ectomicorrícica por tratamiento de inoculación en plantas de Pinus arizonica.
| Especie | Colonización (%) |
|---|---|
| Pisolithus tinctorius | 67.6 ± 1.1 d |
| Ectorrize® | 56.8 ± 27 b |
| Astraeus hygrometricus | 63.4 ± 2.6 c |
| Control | 0.0 a |
± desviación estándar de la media. Letras distintas indican diferencias significativas entre especies de acuerdo con la prueba de Dunnett (P ≤ 0.05).
Caracterización morfológica de ectomicorrizas
Las características micorrícicas, como el color del manto y el tipo de ramificación, ayudaron a distinguir las dos especies de hongos, y las secciones transversales de los cortes histológicos fueron útiles para identificar la red de Hartig y el grosor del manto. Las micorrizas dicotómicas fueron las más abundantes.
La Figura 6 muestra las ectomicorrizas de P. tinctorius de color marrón claro, con oscurecimiento en la base de tipo principalmente dicotómicas. Se observaron algunas formaciones coraloides, pero no fueron frecuentes, también se identificaron rizomorfos. La longitud del sistema micorrícico varió de 1.3 a 2.5 mm y el diámetro de 0.4 a 0.7 mm. Las puntas de las raíces midieron 0.7 mm de longitud y 0.3 mm de diámetro. La textura del manto fúngico varió de granular a liso, y la coloración fue marrón claro a hialino. Las secciones longitudinales de las micorrizas mostraron que el manto es de tipo plectenquimático H (Agerer, 1991); estas se caracterizan por hifas de forma irregular de 15 a 20 μm de diámetro. No se observaron conexiones de abrazadera. La red Hartig estuvo compuesta por células ovoides de 2 a 3 μm de diámetro.
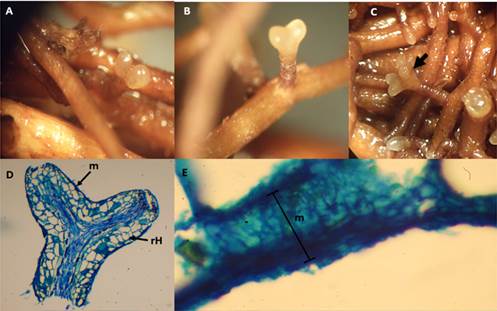
Figura 6 Ectomicorrizas de Pisolithus tinctorius en plantas de Pinus arizonica: A) formación inicial, B) morfotipo dicotómico, C) morfotipo coraloide, D) corte longitudinal de ectomicorriza indicando el manto (m) y la red de Hartig (rH), E) manto de 20 μm de espesor.
La variabilidad morfológica de las ectomicorrizas producidas por el tratamiento con Ectorrize® se observa en la Figura 7. El sistema micorrícico es denso con ramificaciones principales de tipo dicotómica y puntas rectas en las etapas iniciales, aunque ligeramente sinuosas en estado maduro. No se observó la presencia de rizomorfos. El color de las micorrizas varió del marrón oscuro al dorado y las puntas tenían un color más claro que el resto. El sistema micorrícico registró, en promedio, 3.1 a 5.4 mm de longitud y 1.5 mm de diámetro, y las puntas tuvieron 0.9 a 2.3 mm de longitud y 0.2 a 0.5 mm de diámetro. La textura del manto varió de liso a granular con una coloración marrón claro a hialina. Las secciones transversales mostraron un manto plectenquimático tipo N (Agerer, 1991), caracterizado por hifas irregulares. El manto midió de 10 a 15 μm de grosor y la red Hartig tuvo células de forma semicircular.
La morfología y el color de las micorrizas formadas por el tratamiento Ectorrize® fueron similares a P. tinctorius, pero solo en las etapas iniciales; mientras que la longitud del sistema micorrícico si fue mayor con el control positivo. Las variaciones en ambos tratamientos pueden deberse a la adición de diversas cepas bacterianas utilizadas en el producto Ectorrize®.
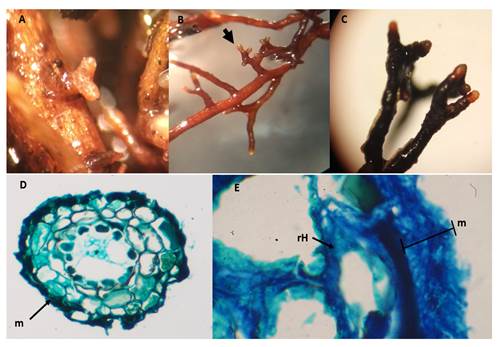
Figura 7 Ectomicorrizas en plantas de Pinus arizonica con el tratamiento de inoculación Ectorrize®. A) Etapa inicial, B) morfotipo dicotómico, C) ectomicorrizas maduras, D) sección transversal de ectomicorriza indicado en el manto (m), E) manto plectenquimático (m) de 15 μm de espesor tipo N (Agerer, 1991) y red de Hartig (rH), aumento de 100x.
La Figura 8 muestra la morfología de las micorrizas de A. hygrometricus. Es importante mencionar que el estudio presenta por vez primera la descripción morfológica de la asociación micorrícica de A. hygrometricus con Pinus arizonica. Las formas fueron de tipo dicotómicas y coraloides, siendo estas últimas las dominantes en las etapas maduras. Se observó la presencia de rizomorfos densos, pero restringidos a un punto. Las micorrizas presentaron coloraciones blancas y algunas tenían puntas de raíces ligeramente hialinas; las micorrizas más viejas tenían un color grisáceo. El sistema micorrícico de tipo dicotómico midió 2.1 mm de largo por 1.4 mm de diámetro y las puntas tuvieron una longitud promedio de 1.1 mm por 0.4 mm de diámetro. El morfotipo coraloide varió de 2 a 2.5 mm de largo por 2 mm de diámetro y las puntas midieron 1.3 µm de largo por 0.5 µm de diámetro. La textura del manto fue granulosa a lisa en las puntas. El corte histológico transversal mostró que la morfología del manto es plectenquimático de tipo B que se caracteriza por hifas irregulares sobre la superficie del manto, dispuestas principalmente de forma longitudinal (Agerer, 1991). El grosor del manto fue de 70 µm. La red de Hartig presentó células con forma semicircular y alargadas de 3 a 5 µm de longitud.

Figura 8 Ectomicorrizas de Astraeus hygrometricus en plantas de Pinus arizonica: A) etapa inicial, B) micorrizas dicotómicas, C) ectomicorrizas maduras con ramificación coraloide, D) rizomorfos (R) y ectomicorrizas coraloides, E) sección transversal de ectomicorrizas mostrando el manto (m) y la red de Hartig (rH).
Análisis mineral en plantas de Pinus arizonica
En general, se observó contenido alto de macronutrientes tanto en las partes aéreas como radiculares de las plantas de Pinus arizonica inoculadas con el producto comercial Ectorrize® y con los hongos A. hygrometricus y P. tinctorius (Cuadro 5). Para el control negativo, los análisis del sistema radicular no pudieron realizarse, ya que la cantidad de biomasa fue insuficiente.
Los resultados apoyan lo señalado por Ortega (2015), Smits y Wallander (2017) y Chen et al. (2018), quienes mencionan que las micorrizas absorben azúcares de las raíces de las plantas e introducen nutrientes como P, N, K, Ca, S y Zn, entre otros, en sus sistemas vasculares.
Cuadro 5 Composición mineral de plantas de Pinus arizonica inoculadas con hongos ectomicorrícicos.
| Variables | Astraeus hygrometricus | Pisolithus tinctorius | Ectorrize® | Control | ||||
|---|---|---|---|---|---|---|---|---|
| Parte aérea | Sistema radicular | Parte aérea | Sistema radicular | Parte aérea | Sistema radicular | Parte aérea | Sistema radicular | |
| Peso fresco (g) | 5.94 | 8.00 | 8.74 | 6.69 | 7.45 | 7.10 | 2.64 | 2.86 |
| Peso seco (g) | 2.58 | 1.67 | 3.34 | 1.45 | 3.32 | 1.85 | 1.53 | 0.39 |
| Nt (%) | 1.26 | 1.26 | 1.20 | 1.20 | 1.26 | 1.13 | 1.32 | 1.13 |
| P (%) | 0.19 | 0.27 | 0.16 | 0.14 | 0.16 | 0.15 | 0.11 | NS |
| K (%) | 1.04 | 0.63 | 0.56 | 0.43 | 0.45 | 0.49 | 0.30 | NS |
| Ca (%) | 4.14 | 2.32 | 1.97 | 2.83 | 2.32 | 1.72 | 2.68 | NS |
| Mg (%) | 0.19 | 0.22 | 0.17 | 0.19 | 0.17 | 0.16 | 0.15 | NS |
| Na (%) | 0.12 | 0.13 | 0.11 | 0.12 | 0.12 | 0.12 | 0.13 | NS |
| Cu (ppm) | 4.00 | 6.00 | 4.00 | 4.50 | 4.00 | 8.00 | 3.50 | NS |
| Fe (ppm) | 78.00 | 165.00 | 48.00 | 107.50 | 50.50 | 88.00 | 37.50 | NS |
| Mn (ppm) | 86.50 | 32.50 | 88.50 | 34.00 | 81.00 | 39.00 | 40.00 | NS |
| Zn (ppm) | 43.00 | 68.50 | 41.50 | 63.00 | 32.50 | 45.00 | 30.00 | NS |
NS = No suficiente para el análisis.
Discusión
Se registró un efecto favorable en el crecimiento de la especie P. arizonica con cualquiera de los HEM inoculados, así como con el producto comercial Ectorrize®. Estos resultados muestran el gran potencial micorrícico que tienen los inóculos de esporas de P. tinctorius o A. hygrometricus.
Wang (2017) sugirió que el uso de plantas inoculadas con hongos micorrícicos juega un papel importante en la reforestación de áreas fuertemente alteradas. En el presente estudio, la inoculación de plantas de P. arizonica con hongos micorrícicos causó aumento sustancial en las variables de crecimiento y supervivencia. Se ha informado que P. tinctorius y A. hygrometricus tienen capacidad alta para formar asociaciones con una gama amplia de angiospermas y gimnospermas (Kayama & Yamanaka, 2014). Dicho potencial puede atribuirse a la capacidad de las esporas para germinar en un intervalo amplio de pH (4 a 6.5) en comparación con otros HEM de bosques templados, que se limitan a pH 5 aproximadamente; además, podrían soportar temperaturas más altas que otras especies como Rhizopogon roseolus (Corda) Th. Fr. (Maltz et al., 2019).
Sebastiana et al. (2018) señalaron que la inoculación con P. tinctorius tuvo efecto positivo sobre la altura de la planta, la biomasa de los brotes, el diámetro basal del brote y el crecimiento radicular de Quercus suber en condiciones de campo, también aumentó la concentración de nitrógeno y la tolerancia a la sequía en comparación con las plantas no inoculadas.
En cuanto a los aspectos morfológicos, Kayama y Yamanaka (2014) encontraron que el desarrollo de hojas, tallos, ramas y raíces de Quercus glauca Thunb., Q. salicina Blume y Castanopsis cuspidata Thunb. inoculados con A. hygrometricus fue mayor que cuando no se inocularon HEM. Adeleke et al. (2015) inocularon plantas de Pinus patula Schl. et Cham. con P. tinctorius, Paxillus involutus (Batsch ex Fr.) Fr., Laccaria bicolor (Maire) P. D. Orton y Suillus tomentosus (Kauffman) Singer bajo condiciones in vitro. Estos hongos indujeron mayor producción de biomasa de raíces y brotes, y mejoraron el estado fisiológico de las plantas en comparación con las no inoculadas.
Wen et al. (2017) inocularon plantas de pino rojo chino (Pinus tabuliformis Carr.) con P. tinctorius y Cenococcum geophilum Fr. y demostraron que el nivel de micorrización dependía de las especies fúngicas utilizadas. El inóculo de P. tinctorius dio los mejores resultados en la acumulación de nutrientes y crecimiento de brotes de pino; los autores concluyeron que estos hongos pueden beneficiar el establecimiento de plantas en áreas contaminadas. Por último, Gómez et al. (2013) evaluaron el establecimiento de Pinus pseudostrobus Lindl. en campo con plantas inoculadas y no inoculadas con P. tinctorius; la tasa de supervivencia de los pinos inoculados fue mayor (86 %) en comparación con aquellos sin inóculo (62 %).
En cuanto a la colonización, los resultados del presente estudio fueron consistentes con los reportados por Garza-Ocañas et al. (2018) y Garza et al. (2022) con valores entre 60 y 80 % en raíces de especies forestales en condiciones de invernadero.
El diámetro del tallo es uno de los atributos morfológicos utilizados ampliamente para caracterizar la calidad de las plantas de vivero y se cree que está relacionado con la transferencia de agua y nutrientes, la resistencia mecánica y la robustez. También es una medida representativa de la resistencia a factores climáticos y biológicos (Sánchez-Costa et al., 2015). En el presente estudio, el diámetro del tallo se desarrolló apropiadamente en todos los tratamientos, excepto en el control.
La longitud del sistema radicular está relacionada con la capacidad de las plantas para explorar el suelo en busca de nutrientes y agua; el contenido de este elemento en el sustrato influirá en el desarrollo de las raíces. Si el agua es abundante, el crecimiento de las raíces no se estimula, pero si el agua es escasa, será necesario un sistema radicular amplio para sobrevivir (Yang et al., 2017). Otro aspecto importante es la capacidad que el sistema hifal tiene para explorar el sustrato y establecer conexiones con las raíces de los árboles; de acuerdo con Agerer (2001), P. tinctorius y A. hygrometricus cuentan con capacidad exploratoria de larga distancia, la cual les permite extender sus hifas algunos decímetros y generar ectomicorrizas con mayor facilidad. Por otra parte, la biomasa del sistema radicular de las plantas inoculadas está relacionada con aumento en la superficie de absorción, y con un mayor volumen del suelo utilizado por las plantas micorrícicas (Halifu et al., 2019). Aunque la longitud de las raíces fue similar en todos los tratamientos, las plantas inoculadas tuvieron mejor producción de biomasa radicular que el control. Wang et al. (2021) reportaron mayor producción de biomasa tanto de la parte aérea como del sistema radicular de P. tabuliformis cuando se inoculó con Suillus variegatus (Sw.) Kuntze. Según Arteaga-León et al. (2018), la biomasa aérea está relacionada con una mayor actividad fotosintética y de transpiración, lo que implica buena salud y, en consecuencia, un sistema radicular fuerte. Una vez más, los valores más altos en la producción de biomasa aérea y radical de las plantas de Pinus arizonica se encontraron en las inoculadas con HEM.
La relación entre el peso seco de la parte aérea y el sistema radicular refleja el grado de desarrollo de la planta en el invernadero. De acuerdo con las mediciones, las plantas inoculadas con HEM tuvieron valores superiores a 1, lo que indica que la biomasa aérea fue mayor que en el sistema radicular; estos valores están dentro del intervalo óptimo (1.5 a 2.5) (Subira et al., 2016). Por el contrario, en las plantas control no inoculadas se obtuvo una proporción de 3.44, lo que indicó una desproporción entre ambas partes. Esto revela un sistema radicular insuficiente para proporcionar los nutrientes que la planta necesita.
En la identificación de hongos simbiontes, la morfología de las micorrizas se considera valiosa, ya que esta es característica para cada huésped; el tipo de ramificación dominante en la ectomicorriza de pino suele ser bifurcada, dicotómica, coraloide o tuberculada. En otros estudios, la identificación se hace con métodos moleculares (Agerer, 1991; Sulzbacher et al., 2016); no obstante, debido a que en el invernadero no se habían hecho experimentos de HEM y los tratamientos fueron separados entre sí, no se produjeron contaminaciones cruzadas con otras especies y, por tanto, no fue necesario el análisis molecular de las ectomicorrizas formadas.
La morfología y el color de las micorrizas de P. tinctorius concuerdan con lo reportado por García et al. (2006) en plantas de Pinus greggii Engelm. ex Parl.; sin embargo, la morfología del manto reportada por estos autores era del tipo prosenquimatoso. Por otra parte, la coloración fue diferente a la reportada por Valdés et al. (2010), quienes mencionaron un color blanquecino a ligeramente amarillento en plantas de P. devoniana. Al respecto, los mismos autores señalan que las micorrizas de P. tinctorius presentan un color blanquecino cuando son jóvenes y que luego cambian de color beige a marrón amarillento a medida que maduran. Se infiere que después de nueve meses de inoculación, las plantas de P. arizonica tendrían micorrizas en fase madura, lo cual también puede afectar la organización del manto y micelio.
El inóculo comercial ha sido utilizado por autores como Gómez et al. (2013) para la restauración de plantaciones de P. pseudostrobus. Estos autores no caracterizaron las micorrizas, pero observaron cambios significativos en las variables morfométricas de las plantas en comparación con el control. Varios inoculantes comerciales basados en HEM y utilizados en combinación con bacterias son beneficiosos para las plantas; sin embargo, los estudios de inoculación se han llevado a cabo principalmente con hongos silvestres (Gómez et al., 2013).
La morfología y el color de las ectomicorrizas formadas por A. hygrometricus fueron similares a las reportadas por Fangfuk et al. (2010) en Pinus densiflora Siebold & Zucc.; pero son diferentes de los reportados por Kaewgrajang et al. (2013) usando Astraeus odoratus Phosri, Watling, M. P. Martín & Whalley en plantas de Dipterocarpus alatus Roxb. ex G. Don. Cabe mencionar que este árbol es de climas tropicales, por lo que las necesidades nutricionales y ambientales son diferentes a las de los bosques templados.
En el presente trabajo se observó un efecto favorable sobre el crecimiento y contenido nutricional de P. arizonica. Es posible confirmar la asimilación de N, P, K, Ca, Mg, Na, Cu, Fe, Mn y Zn en el sistema radicular y la parte aérea. Las plantas cultivadas con inoculación fúngica tuvieron, en general, mayor biomasa aérea y radical, así como mayor contenido de macro y micronutrientes en comparación con las plantas cultivadas sin la adición de micorrizas. Esto concuerda con lo reportado por Rentería-Chávez et al. (2017), quienes encontraron mayor absorción, crecimiento y biomasa mineral en plantas de P. greggi inoculadas con HEM.
Conclusiones
Las plantas de Pinus arizonica inoculadas con esporas de Astraeus hygrometricus y Pisolithus tinctorius a varias concentraciones formaron micorrizas exitosamente, por lo que ambos hongos ectomicorrícicos (HEM) son efectivos para establecer simbiosis con el pino. Las plantas inoculadas con estos hongos tuvieron altura, diámetro del tallo y biomasa aérea y radical mayores en comparación con las plantas no inoculadas. Una tendencia similar se observó en la absorción e incorporación de minerales, principalmente para N, Zn, Mn y Fe. El uso de dosis altas de esporas para la inoculación de las plantas de P. arizonica no es necesario para obtener una buena colonización micorrícica. Por lo anterior, se sugiere el uso de una dosis pequeña de inóculo de esporas (10 mL; 106 esporas∙mL-1), para la producción de plantas de P. arizonica en invernaderos; en particular, se recomienda el HEM P. tinctorius por tener la mejor respuesta en las variables evaluadas.
Agradecimientos
Los autores agradecen al Consejo Nacional de Ciencia y Tecnología (CONACYT) por el apoyo en beca de manutención (núm. 452136) asignada a la M. C. Liliana de Jesús Gómez Flores para sus estudios de posgrado.
REFERENCIAS
Adeleke, R., Cloete, T. E., Bertrand, A., & Khasa, D. P. (2015). Relationship between plant growth and organic acid exudates from ectomycorrhizal and non-ectomycorrhizal Pinus patula. South African Journal of Plant and Soil, 32(4), 183‒188. https://doi.org/10.1080/02571862.2015.1019376 [ Links ]
Agerer, R. (1991). Characterization of ectomycorrhizae. In J. R. Norris, D. J. Read, & A. K. Varma (Eds.), Methods in microbiology: techniques for the study of mycorrhiza (pp. 25‒73). Academic Press. [ Links ]
Agerer, R. (2001). Exploration types of ectomycorrhizae. Mycorrhiza, 11(2), 107‒114. https://doi.org/10.1007/s005720100108 [ Links ]
Aguilar-Ulloa, W., Arce-Acuña, P., Galiano-Murillo, F., & Torres-Cruz, T. J. (2016). Aislamiento de esporas y evaluación de métodos de inoculación en la producción de micorrizas en cultivos trampa. Revista Tecnología en Marcha, 29, 5‒14. https://doi.org/10.18845/tm.v29i7.2700 [ Links ]
Arteaga-León, C., Pérez-Moreno, J., Espinosa-Victoria, D., Almaraz-Suárez, J. J., Silva-Rojas, H., & Delgado-Alvarado, A. (2018). Ectomycorrhizal inoculation with edible fungi increases plant growth and nutrient contents of Pinus ayacahuite. Revista Mexicana de Biodiversidad, 89(4), 1089‒1099. https://doi.org/10.22201/ib.20078706e.2018.4.2235 [ Links ]
Association of Official Analytical Chemists (AOAC). (1990). Official methods of analysis (15th ed.). Association Official Analytical Chemists. [ Links ]
Chen, A., Gu, M., Wang, S., Chen, J., & Xu, G. (2018). Transport properties and regulatory roles of nitrogen in arbuscular mycorrhizal symbiosis. Seminars in Cell & Developmental Biology, 74, 80‒88. https://doi.org/10.1016/j.semcdb.2017.06.015 [ Links ]
Fangfuk, W., Okada, K., Fukuda, M., Yamada, A., Petchang, R., & To-anun, C. (2010). In vitro mycorrhization of edible Astraeus mushrooms and their morphological characterization. Mycosciense, 51(3), 234‒241. https://doi.org/10.1007/S10267-009-0031-1 [ Links ]
Frank, H. E. R., & Garcia, K. (2021). Benefits provided by four ectomycorrhizal fungi to Pinus taeda under different external potassium availabilities. Mycorrhiza, 31, 755-766. https://doi.org/10.1007/s00572-021-01048-z [ Links ]
García, L., Pérez, J., Aldrete, A., Cetina-Alcala, V., & Vaquera-Huerta, H. (2006). Characterization of the wild ectomycorrhizal fungus Pisolithus tinctorius (Pers.) Coker et Couch In culture in symbiosis with eucalypt and pine. Agrociencia, 40(5), 665‒676. https://www.researchgate.net/publication/287563410_Characterization_of_the_wild_ectomycorrhizal_fungus_Pisolithus_tinctorius_Pers_Coker_et_couch_in_culture_and_in_symbiosis_with_eucalypt_and_pine [ Links ]
Garza, O. F., Quiñonez, M. M., Guevara, G. G., Carrillo-Parra, A., De La Fuente, J. I., & García, J. J. (2022). Growth responses of Quercus fusiformis (Fagaceae) to ectomycorrhizal inoculation with Boletus luridellus. Österr. Z. f. Pilzkunde, 29, 193-202. https://www.myk.univie.ac.at/wp-content/uploads/2022/04/OZP29_Fortunato_Boletus_luridellus.pdf [ Links ]
Garza-Ocañas, F., García-Jiménez, J., Quiñonez-Martínez, M., Guevara-Guerrero, G., Valenzuela-Garza, R., Carrillo-Parra, A., Sánchez-Castillo, L. R. M., Villalón-Mendoza, H., & García Aranda, M. A. (2018). Boletus luridellus (Murr.) Murrill y Quercus fusiformis Small: cultivo, síntesis de micorrizas y producción de esporomas en invernadero. Revista Mexicana de Ciencias Forestales, 9(50), 361‒378. https://doi.org/10.29298/rmcf.v9i50.238 [ Links ]
Gómez, M., Villegas, J., Sáenz-Romero, C., & Lindig-Cisneros, R. (2013). Effect of mycorrhyzation in the establishment of Pinus pseudostrobus in gullies. Madera y Bosques, 19(3), 51‒63. http://www.scielo.org.mx/scielo.php?script=sci_abstract&pid=S1405-04712013000300005&lng=es&nrm=iso&tlng=en [ Links ]
GraphPad Software, Inc. (2018). GraphPad Prism version 8.0. https://www.graphpad.com/guides/prism/8/user-guide/index.htm [ Links ]
Halifu, S., Deng, X., Song, X., & Song, R. (2019). Effects of two Trichoderma strains on plant growth, rhizosphere soil nutrients, and fungal community of Pinus sylvestris var. mongolica annual seedlings. Forests, 10(9), 758. https://doi.org/10.3390/f10090758 [ Links ]
IBM Corporation (2011). IBM SPSS Statistics for Windows, version 20.0. IBM Corp. [ Links ]
Jung, S. C., Martínez-Medina, A., López-Ráez, J., & Pozo, M. (2012). Mycorrhiza-induced resistance and priming of plant defenses. Journal of Chemical Ecology, 38, 651‒64. https://doi.org/10.1007/s10886-012-0134-6 [ Links ]
Kaewgrajang, T., Sangwanit, U., Iwase, K., Kodama, M., & Yamato, M. (2013). Effect of ectomycorrhizal fungus Astraeus odoratus on Dipterocarpus alatus seedlings. Journal of Tropical Forest Science, 25(2), 200‒205. https://www.frim.gov.my/v1/JTFSOnline/jtfs/v25n2/200-205.pdf [ Links ]
Kayama, M., & Yamanaka, T. (2014). Growth characteristics of ectomycorrhizal seedlings of Quercus glauca, Quercus salicina, and Castanopsis cuspidata planted on acidic soil. Trees, 28(2), 569‒583. https://doi.org/10.1007/s00468-013-0973-y [ Links ]
Konopická, J., Bohatá, A., Nermuť, J., Jozová, E., Mráček, Z., Palevsky, E., & Zemek, R. (2021). Efficacy of soil isolates of entomopathogenic fungi against the bulb mite, Rhizoglyphus robini (Acari: Acaridae). Systematic and Applied Acarology, 26(6), 1149‒1167. https://doi.org/10.11158/saa.26.6.11 [ Links ]
Maltz, M. R., Chen, Z., Cao, J., Arogyaswamy, K., Shulman, H., & Aronson, E. L. (2019). Inoculation with Pisolithus tinctorius may ameliorate acid rain impacts on soil microbial communities associated with Pinus massoniana seedlings. Fungal Ecology, 40, 50‒61. https://doi.org/10.1016/j.funeco.2018.11.011 [ Links ]
Marqués-Gálvez, J. E., Veneault-Fourrey, C., & Kohler, A. (2022). Ectomycorrhizal symbiosis: from genomics to trans-kingdom molecular communication and signaling. In B. A. Horwitz, & P. K. Mukherjee (Eds.), Microbial cross-talk in the rhizosphere (pp. 273‒296). Springer. https://doi.org/10.1007/978-981-16-9507-0_11 [ Links ]
Monroy-Vázquez, M. E., Peña-Valdivia, C. B., García-Nava, J. R., Solano-Camacho, E., Campos, H., & García-Villanueva, E. (2017). Imbibición, viabilidad y vigor de semillas de cuatro especies de Opuntia con grado distinto de domesticación. Agrociencia, 51(1), 27‒42. https://www.scielo.org.mx/pdf/agro/v51n1/1405-3195-agro-51-01-00027.pdf [ Links ]
Murphy, J., & Riley, J. P. (1962). A modified single solution method for the determination of phosphate in natural waters. Analytica Chimica Acta, 27, 31‒36. https://doi.org/10.1016/S0003-2670(00)88444-5 [ Links ]
Morales-Nieto, C. R., Siqueiros-Candia, M., Álvarez-Holguín, A., Gil-Vega, K. D. C., Corrales-Lerma, R., & Martínez-Salvador, M. (2021). Diversidad, estructura genética e hibridación en poblaciones de Pinus arizonica y P. durangensis. Madera y Bosques, 27(2), e2722170. https://doi.org/10.21829/myb.2021.2722170 [ Links ]
Ortega, P. (2015). El suelo: hábitat de interacciones maravillosas. CONABIO Biodiversitas, 122, 10‒13. https://studylib.es/doc/5005310/el-suelo--h%C3%A1bitat-de-interacciones-maravillosas http://www.telematica.ccadet.unam.mx/antologias/medio/presentacion/pdf/ANTOLOGIAS%20REALCIONES%20biodiv122art3.pdf [ Links ]
Pérez-López, R. I., González-Espinosa, M., Ramírez-Marcial, N., Pérez-Moreno, J., & Toledo-Aceves, T. (2021). Forest management effects on the ectomycorrhizal macromycete community in tropical montane forests in Mexico. Forest Ecology and Management, 501, 119670. https://doi.org/10.1016/j.foreco.2021.119670 [ Links ]
Prado-Tarango, D. E., Mata-González, R., Hovland, M., & Schreiner, R. P. (2021). Assessing commercial and early-seral arbuscular mycorrhizal fungi inoculation to aid in restoring sagebrush steppe shrubs. Rangeland Ecology & Management, 79, 87‒90. https://doi.org/10.1016/j.rama.2021.08.001 [ Links ]
Prophet, E., Mills, B., Arrington, J., & Sobin, L. H. (1995). Métodos histotecnológicos. Instituto de Patología de las Fuerzas Armadas de los Estados Unidos de América. [ Links ]
Rentería-Chávez, M. C., Pérez-Moreno, J., Cetina-Alcalá, V. M., Ferrera-Cerrato, R., & Xoconostle-Cázares, B. (2017). Transferencia de nutrientes y crecimiento de Pinus greggii Engelm. inoculado con hongos comestibles ectomicorrícicos en dos sustratos. Revista Argentina de Microbiología, 49(1), 93‒104. https://doi.org/10.1016/j.ram.2016.06.004 [ Links ]
Sáenz-Romero, C. (2014). Guía técnica para la planeación de la reforestación adaptada al cambio climático. Comisión Nacional Forestal. http://www.conafor.gob.mx:8080/documentos/docs/19/6688Guía%20Técnica%20para%20la%20Planeación%20de%20la%20Reforestación.pdf [ Links ]
Sánchez-Costa, E., Poyatos, R., & Sabaté, S. (2015). Contrasting growth and water use strategies in four co-occurring Mediterranean tree species revealed by concurrent measurements of sap flow and stem diameter variations. Agricultural and Forest Meteorology, 207, 24‒37. https://doi.org/10.1016/j.agrformet.2015.03.012 [ Links ]
Sebastiana, M., Corrêa, A., Castro, P., & Ramos, M. (2020). Pisolithus. In N. Amaresan, M. Senthil-Kumar, K. Annapurna, K. Kumar, & A. Sankaranarayanan (Eds.), Beneficial microbes in agro-ecology (pp. 707‒726). Academic Press. https://doi.org/10.1016/C2020-0-00594-3 [ Links ]
Sebastiana, M., da Silva, A. B., Matos, A. R., Alcântara, A., Silvestre, S., & Malhó, R. (2018). Ectomycorrhizal inoculation with Pisolithus tinctorius reduces stress induced by drought in cork oak. Mycorrhiza, 28(3), 247‒258. https://doi.org/10.1007/s00572-018-0823-2 [ Links ]
Sharma, Y. P., Watpade, S., & Thakur, J. S. (2014). Role of mycorrhizae: A component of integrated disease management strategies. Journal of Mycology and Plant Pathology, 44(1), 12‒20. https://www.researchgate.net/publication/261008072_Role_of_Mycorrhizae_A_Component_of_Integrated_Disease_Management_Strategies [ Links ]
Silva-Flores, R., Pérez-Verdín, G., & Wehenkel, C. (2014). Patterns of tree species diversity in relation to climatic factors on the Sierra Madre Occidental, Mexico. PloS ONE, 9(8), e105034. https://doi.org/10.1371/journal.pone.0105034 [ Links ]
Smits, M. M., & Wallander, H. (2017). Role of mycorrhizal symbiosis in mineral weathering and nutrient mining from soil parent material. In N. Collins-Johnson, C. Gehring, & J. Jansa (Eds.), Mycorrhizal mediation of soil (pp. 35‒46). Elsevier. https://doi.org/10.1016/B978-0-12-804312-7.00003-6 [ Links ]
Subira, J., Ammar, K., Álvaro, F., García del Moral, L. F., Dreisigacker, S., & Royo, C. (2016). Changes in durum wheat root and aerial biomass caused by the introduction of the Rht-B1b dwarfing allele and their effects on yield formation. Plant and Soil, 403(1), 291‒304. https://doi.org/10.1007/s11104-015-2781-1 [ Links ]
Sulzbacher, M. A., Grebenc, T., García, M. Á., Silva, B. D., Silveira, A., Antoniolli, Z. I., Marinho, P., Münzenberger, B., Telleria, M. T., Baseia, L. G., & Martín, M. P. (2016). Molecular and morphological analyses confirm Rhizopogon verii as a widely distributed ectomycorrhizal false truffle in Europe, and its presence in South America. Mycorrhiza, 26(5), 377‒388. https://doi.org/10.1007/s00572-015-0678-8 [ Links ]
Tateishi, T., Yokoyama, K., Kohno, N., Okabe, H., & Marumoto, T. (2003). Estimation of mycorrhizal colonization of the roots of oak seedlings inoculated with an ectomycorrhizal fungus, Laccaria amethystea. Soil Science and Plant Nutrition, 49(4), 641‒645. https://doi.org/10.1080/00380768.2003.10410054 [ Links ]
Tiessen, H., & Moir, J. O. (1993). Characterization of available P by sequential extraction. In M. R. Carter (Ed.), Soil sampling and methods of analysis. Taylor & Francis Group. [ Links ]
Valdés, M., Ambriz, E., Camacho, A., & Fierros, A.M. (2010). Pine seedling inoculation with different fungi and visual identification of ectomycorrhizae. Revista Mexicana de Ciencias Forestales, 2(1), 53‒64. https://doi.org/10.29298/rmcf.v1i2.637 [ Links ]
Walker, J. K. M., & Jones, M. D. (2013). Little evidence for niche partitioning among ectomycorrhizal fungi on spruce seedlings planted in decayed wood versus mineral soil microsites. Oecologia, 173, 1499‒1511. https://doi.org/10.1007/s00442-013-2713-9 [ Links ]
Wang, F. (2017). Occurrence of arbuscular mycorrhizal fungi in mining-impacted sites and their contribution to ecological restoration: Mechanisms and applications. Critical Reviews in Environmental Science and Technology, 47(20), 1901‒1957. https://doi.org/10.1080/10643389.2017.1400853 [ Links ]
Wang, J., Zhang, H., Gao, J., Zhang, Y., Liu, Y., & Tang, M. (2021). Effects of ectomycorrhizal fungi (Suillus variegatus) on the growth, hydraulic function, and non-structural carbohydrates of Pinus tabulaeformis under drought stress. BMC Plant Biology, 21(1), 1‒13. doi: 10.1186/s12870-021-02945-3 [ Links ]
Wen, Z., Shi, L., Tang, Y., Shen, Z., Xia, Y., & Chen, Y. (2017). Effects of Pisolithus tinctorius and Cenococcum geophilum inoculation on pine in copper-contaminated soil to enhance phytoremediation. International Journal of Phytoremediation, 19(4), 387‒394. https://doi.org/10.1080/15226514.2016.1244155 [ Links ]
Yang, M., Défossez, P., Danjon, F., Dupont, S., & Fourcaud, T. (2017). Which root architectural elements contribute the best to anchorage of Pinus species? Insights from in silico experiments. Plant and Soil, 411(1), 275‒291. https://doi.org/10.1007/s11104-016-2992-0 [ Links ]
Yin, D., Song, R., Qi, J., & Deng, X. (2018). Ectomycorrhizal fungus enhances drought tolerance of Pinus sylvestris var. mongolica seedlings and improves soil condition. Journal of Forestry Research, 29(6), 1775‒1788. doi: 10.1007/s11676-017-0583-4 [ Links ]
Recibido: 09 de Agosto de 2022; Aprobado: 15 de Marzo de 2023











 texto en
texto en 




