Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Chapingo serie ciencias forestales y del ambiente
versión On-line ISSN 2007-4018versión impresa ISSN 2007-3828
Rev. Chapingo ser. cienc. for. ambient vol.28 no.3 Chapingo sep./dic. 2022 Epub 08-Mar-2024
https://doi.org/10.5154/r.rchscfa.2022.01.003
Artículo científico
Variación fitoquímica entre procedencias de oyamel (Abies religiosa [Kunth] Schltdl. & Cham.) en un gradiente altitudinal
1Universidad Michoacana de San Nicolás de Hidalgo (UMSNH), Instituto de Investigaciones Agropecuarias y Forestales. Av. San Juanito Itzícuaro s/n, col. Nueva Esperanza. C. P. 58337. Morelia, Michoacán, México.
2Universidad Nacional Autónoma de México (UNAM), Instituto de Investigaciones en Ecosistemas y Sustentabilidad. Antigua Carretera Pátzcuaro núm. 8701. C. P. 58190. Morelia, Michoacán, México.
3Tecnológico Nacional de México, Campus Morelia, Departamento de Ingeniería Bioquímica. Av. Tecnológico, núm. 1500, col. Lomas de Santiaguito. C. P. 58120. Morelia, Michoacán, México.
4Colegio de Postgraduados, Campus Puebla. km 125.5 carretera federal México-Puebla (bulevar Forjadores de Puebla). C. P. 72760. San Pedro Cholula, Puebla, México.
5Universidad Michoacana de San Nicolás de Hidalgo (UMSNH), Instituto de Investigaciones sobre los Recursos Naturales. Av. San Juanito Itzícuaro s/n, col. Nueva Esperanza. C. P. 58337. Morelia, Michoacán, México.
Introducción:
Las poblaciones de una especie son diferentes a lo largo de su distribución por la presión de selección del gradiente climático.
Objetivo:
Describir la variación fitoquímica entre 14 procedencias en un gradiente altitudinal de Abies religiosa (Kunth) Schltdl. & Cham., para determinar si existen asociaciones de perfiles químicos entre poblaciones, expresados bajo un solo ambiente.
Materiales y métodos:
Se recolectaron semillas de 165 árboles de un transecto altitudinal de 2 850 a 3 540 m en el cerro de San Andrés, Municipio Libre de Hidalgo, Michoacán, México. La planta se produjo en ensayo de jardín común; a los 28 meses se recolectaron acículas maduras por individuo y se analizaron por cromatografía de gases-masas. Los datos se analizaron con índices de diversidad, análisis de varianza y multivariados (componentes principales, correspondencias y conglomerados).
Resultados y discusión:
Se identificaron 32 compuestos, la mayoría terpenos. Las poblaciones presentaron diferencias en presencia/ausencia de terpenos y en su concentración; arriba de 3 350 m, la diversidad fue más baja, pero con mayor concentración. Se encontraron tres grupos de altitud con base en el perfil químico de las poblaciones: baja = 2 850 a 3 300 m y 3 400 m; intermedia = 3 350, 3 450 y 3 500 m; y elevada = 3 540 m.
Conclusiones:
La diversidad y concentración de los terpenos en A. religiosa variaron en función de la altitud de las poblaciones. Existen tres perfiles químicos que deben considerarse en el establecimiento de programas de recolecta de germoplasma para reforestación y restauración.
Palabras clave: terpenos; metabolitos secundarios; perfil químico; índices de diversidad; análisis multivariados
Introduction:
A species' populations differ across its distribution due to selection pressure from the climate gradient.
Objective:
To describe the phytochemical variation among 14 tree provenances in an altitudinal gradient of Abies religiosa (Kunth) Schltdl. & Cham. to determine if there are associations of chemical profiles among populations, expressed under a single environment.
Materials and methods:
Seeds were collected from 165 trees from an altitudinal transect from 2 850 to 3 540 m in Cerro San Andrés, Municipio Libre de Hidalgo, Michoacán, Mexico. The plant was grown in a common garden trial; at 28 months, mature needles were collected per tree and analyzed by gas-mass chromatography. Data were analyzed with diversity indices, ANOVA and multivariate analysis (principal components, correspondences and cluster).
Results and discussion:
Thirty-two compounds were identified, most of them terpenes. The populations showed differences in presence/absence of terpenes and in their concentration; above 3 350 m, diversity was lower, but with higher concentration. Three altitude groups were found based on the chemical profile of the populations: low = 2 850 to 3 300 m and 3 400 m; moderate = 3 350, 3 450 and 3 500 m; and high = 3 540 m.
Conclusions:
The diversity and concentration of terpenes in A. religiosa varied depending on the altitude of populations. There are three chemical profiles that should be considered in the implementation of germplasm collection programs for reforestation and restoration.
Keywords: terpenes; secondary metabolites; chemical profile; diversity indices; multivariate analysis
Ideas destacadas:
Las procedencias de oyamel corresponden a un transecto altitudinal de 2 850 a 3 540 m.
La diversidad y concentración de terpenos en poblaciones de oyamel varían altitudinalmente.
La diversidad de terpenos disminuye conforme la elevación aumenta, pero la concentración incrementa.
Se identificaron tres grupos de altitud de acuerdo con el perfil químico de las poblaciones.
Las procedencias a baja altitud mostraron similitud de perfiles químicos.
Introducción
Los bosques de oyamel (Abies religiosa [Kunth] Schltdl. & Cham.) se distribuyen en zonas altas dominadas por coníferas, principalmente entre 2 400 y 3 600 m de elevación, entre 19° y 20° de latitud norte, a lo largo de la Faja Volcánica Transmexicana (Sáenz-Romero, Rehfeldt, Duval, & Lindig-Cisneros, 2012). Estos bosques son de gran importancia ecológica debido a los servicios ecosistémicos que proporcionan como la captura de carbono, captación de agua y protección contra la erosión (Hernández-Álvarez, Reyes-Ortiz, Villanueva-Díaz, & Sánchez-González, 2021); además, son sitio de hibernación de la mariposa monarca Danaus plexippus L. (Oberhauser, Nail, & Altizer, 2015).
El oyamel es un árbol monoico siempre verde de hasta 40 m de altura, de corteza gruesa con placas escamosas en árboles adultos y lisa en árboles jóvenes. Sus hojas son alternas, lineares, sésiles, rectas, algo coriáceas de 19 a 70 mm de longitud, con ápice agudo o redondeado y yemas oblongas protegidas con resina (Rodríguez Trejo, Aparicio Lechuga, Lara Bueno, Uribe Gómez, & Ramírez Castell, 2021).
Una de las principales amenazas para los bosques de oyamel es el cambio climático, ya que inducirá un desacoplamiento entre sus poblaciones y el clima propicio para ellas (Gómez‐Pineda et al., 2020; Sáenz-Romero et al., 2012), lo que a su vez provocará incidencia cada vez mayor de descortezadores, pues las temperaturas altas proveen condiciones favorables para el desarrollo de estos insectos (Gómez-Pineda et al., 2022; López-Gómez, Arriola Padilla, & Pérez Miranda, 2015; Rubin-Aguirre et al., 2015; Sosa Díaz et al., 2018).
Las poblaciones de una misma especie con un rango amplio de distribución se encuentran en una vasta gama de condiciones ambientales que se pueden reflejar en la variación fenotípica (Premoli, Acosta, Mathiasen, & Donoso, 2012). Esta puede explicarse como resultado de la selección diferencial de los genotipos bajo las diversas condiciones ambientales en un gradiente ambiental (Ignazi, Mathiasen, & Premoli, 2019). La comprensión de los patrones altitudinales de diferenciación genética entre poblaciones es fundamental para el diseño de medidas de manejo forestal que faciliten la adaptación de las poblaciones forestales a los climas proyectados (Sáenz-Romero et al., 2016). En las regiones montañosas, el gradiente altitudinal es de particular importancia para entender los patrones de riqueza tanto a nivel comunidades como poblaciones (Muenchow, Dieker, Kluge, Kessler, & von Wehrden, 2018).
Los ensayos de procedencias o jardín común en condiciones de campo permiten la expresión de las diferencias genéticas, mediante el cultivo de plantas de diversos orígenes geográficos (procedencias) bajo las mismas condiciones ambientales. En este tipo de estudios se espera que la procedencia mejor acoplada al clima del sitio de ensayo tenga el mejor desempeño y las demás muestren diferencias, en parte, relacionadas con la magnitud de la diferencia climática entre el sitio de origen y el de ensayo (Cruzado-Vargas et al., 2021; Sáenz‐Romero et al., 2017). Una variante de lo anterior son los ensayos de jardín común donde se proveen condiciones óptimas (en la medida de lo posible) al conjunto de procedencias con la finalidad de favorecer la expresión de su potencial de crecimiento, y con ello, cuantificar si existe o no diferenciación genética entre ellas. Esto se puede lograr estableciendo los ensayos en sitios de campo ubicados dentro del espacio climático óptimo de la especie, o bien, como es el caso de este trabajo, proporcionando de condiciones favorables artificialmente, a través del uso de malla-sombra y riego en temporada de estiaje (Ortiz-Bibian et al., 2017).
Los mecanismos de defensa y resistencia en las coníferas dependen de factores genéticos, bióticos, abióticos, así como de sus interacciones. Estos mecanismos incluyen caracteres de defensa físicos y compuestos químicos (Zas Arregui & Sampedro Pérez, 2015). Las defensas químicas a menudo se presentan como conjuntos de sustancias que defienden a las plantas contra herbívoros (incluidos los escarabajos de la corteza) (Taft, Najar, Godbout, Bousquet, & Erbilgin, 2015), patógenos (Kopaczyk, Warguła, & Jelonek, 2020) y ciertos tipos de estrés abiótico como las temperaturas altas (Materić et al., 2015).
Las plantas sintetizan gran cantidad de compuestos, entre ellos están los metabolitos secundarios que son compuestos volátiles variantes en composición y concentración entre especies y de un individuo a otro dentro de una misma especie (García-Rodríguez, Bravo-Monzón, Martínez-Díaz, Torres-Gurrola, & Espinosa-García, 2012). Dicha variación también depende de la parte la planta que se analice, la estación del año, origen geográfico y otros factores medioambientales (Kopaczyk et al., 2020). Los metabolitos secundarios se sintetizan en cantidades pequeñas y no de forma generalizada (algunos son producidos solo por una especie, género o familia) (Pichersky & Raguso, 2018); cumplen funciones de defensa, atracción o competencia, y su efectividad depende de la concentración (López-Goldar et al., 2018) y del metabolismo del consumidor: herbívoro o patógeno (García-Rodríguez et al., 2012).
Los terpenos constituyen el grupo más grande y diverso de metabolitos secundarios en las plantas (Kopaczyk et al., 2020) abarcando más de 40 000 compuestos individuales (Abbas et al., 2017) y, junto con los compuestos fenólicos, son las principales defensas químicas de las coníferas (Lundborg, Fedderwitz, Björklund, Nordlander, & Borg-Karlson, 2016). Los terpenos más abundantes en la familia de pinos son: α-pineno, β-pineno, mirceno, limoneno, canfeno y 3-careno (Kopaczyk et al., 2020; Pokorska et al., 2012; Taft et al., 2015).
El objetivo del presente trabajo fue determinar si la diversidad fitoquímica de A. religiosa varía entre 14 poblaciones provenientes de un gradiente altitudinal (2 850 a los 3 550 m) establecidas en un ensayo de jardín común. La hipótesis es que la diversidad de terpenos será mayor a menor altitud, donde hay mayor herbivoría y, por lo tanto, una mayor presión de selección que eventualmente favorecería la diversidad de terpenos como una respuesta adaptativa de las poblaciones forestales (Pellissier et al., 2016).
Materiales y métodos
Recolecta de semilla y producción de planta
Se recolectaron conos maduros de A. religiosa en 14 sitios: 11 árboles en cada uno de los sitios separados entre sí por 50 m de diferencia altitudinal en un transecto de los 2 850 a los 3 550 m (Cuadro 1) en el cerro de San Andrés, Municipio Libre de Hidalgo, Michoacán, México. Los sitios de recolecta fueron rodales bien conservados, dominados principalmente por A. religiosa (89 % de área basal) en la parte alta de la montaña, combinado con Pinus hartwegii Lindl. (pino de las alturas) y Cupressus lindleyi Klotzsch ex Endl. (cedro). En la parte intermedia del transecto altitudinal, A. religiosa representa 60 % del área basal del arbolado en combinación principalmente con Pinus pseudostrobus Lindl. (pino liso), C. lindleyi y Salix paradoxa Kunth (borreguito). En la parte más baja, A. religiosa representa 45 % en combinación con P. pseudostrobus, Pinus montezumae Lamb. (pino blanco), Quercus obtusata Bonpl. (encino blanco) y demás especies de hojosas como Arbutus xalapensis Kunth (madroño) y S. paradoxa. La descripción detallada de los sitios se puede consultar en el estudio de Ortiz-Bibian et al. (2017).
Los conos se secaron al sol durante 15 días para extraer las semillas y, posteriormente, germinarlas en almácigo de turba de musgo. Las plántulas se trasplantaron en tubetes de 380 cm3, donde se desarrollaron durante nueve meses. En marzo de 2014 se montó un ensayo de procedencias o jardín común (Figura 1) en el Instituto de Investigaciones sobre los Recursos Naturales de la Universidad Michoacana de San Nicolás de Hidalgo (INIRENA-UMSNH) ubicado en Morelia, Michoacán. El experimento tuvo un diseño de seis bloques completos al azar con seis plántulas por procedencia (Ortiz-Bibian et al., 2017).
Cuadro 1 Localización geográfica de los sitios de recolección de conos de 14 procedencias de Abies religiosa en el cerro de San Andrés, Municipio Libre de Hidalgo, Michoacán, México.
| Altitud (m) | Latitud (N) | Longitud (O) |
|---|---|---|
| 3 540 | 19° 48’ 01.0” | 100° 36’ 04.7” |
| 3 500 | 19° 48’ 03.6” | 100° 36’ 06.8” |
| 3 450 | 19° 48’ 06.3” | 100° 36’10.3” |
| 3 400 | 19° 48’ 19.0” | 100° 36’ 13.5” |
| 3 350 | 19° 48’ 20.2” | 100° 36’ 13.8” |
| 3 300 | 19° 48’ 23.8” | 100° 36’ 18.6” |
| 3 250 | 19° 48’ 36.1” | 100° 36’ 16.3” |
| 3 200 | 19° 48’ 38.0” | 100° 36’ 20.6” |
| 3 150 | 19° 48’ 40.9” | 100° 36’ 26.4” |
| 3 100 | 19° 48’ 49.0” | 100° 36’ 31.2” |
| 3 050 | 19° 48’ 58.7” | 100° 36’ 30.6” |
| 3 000 | 19° 49’ 10.1” | 100° 36’ 28.4” |
| 2 950 | 19° 49’ 15.0” | 100° 36’ 05.8” |
| 2 850 | 19° 49’ 38.6” | 100° 35’ 35.0” |
Fuente: Ortiz-Bibian et al. (2017).
Extracción de muestras
A los 28 meses de edad de las plántulas, se recolectaron muestras de 2 g de acículas maduras de 10 árboles seleccionados al azar en cada una de las 14 procedencias de A. religiosa presentes en el ensayo de jardín común, para evaluar el perfil químico. Doce horas antes de la recolección, el ensayo se regó a capacidad de campo. Las muestras se tomaron ente las 8 y 10 h de la mañana en octubre del 2016 con exposición norte y sin señales de daño. Las ramas se tomaron de la parte media del tallo principal.
De cada muestra, 1 g de acículas se introdujo en una bolsa de papel, se mantuvo en el horno de secado a 80 °C durante 24 h y se pesó. El otro gramo se colocó en un frasco de vidrio ámbar que contenía 10 mL de n-hexano grado reactivo, el cual permaneció a 5 °C en un refrigerador. Posteriormente, la muestra en n-hexano se molió en un mortero de porcelana con 0.5 g de arena inerte y 1 mL de tetradecano (C14H30) a una concentración de 1 mg∙mL-1 como estándar interno. El extracto se filtró a través de un embudo con papel filtro de apertura de poro de 11 μm, que contenía 0.5 g de sulfato de sodio anhidro (Na2SO4) grado reactivo y se guardó en un vial ámbar a 5 °C hasta su análisis químico.
Análisis químico
Las muestras se analizaron inyectando 1 µL en un cromatógrafo de gases equipado con un detector de masas (Agilent 6890, MSD 5973), con división de flujo (split 60.3:1) a 250 °C en una columna capilar no polar HP-5MS (30 m x 20 mm x 20 µm), usando helio como gas acarreador con un flujo de 1 mL∙min-1. El programa de temperatura del horno fue: rampa inicial de 50-200 °C a 20 °C∙min-1, seguida de otra rampa de 200-280 °C a 15 °C∙min-1 y una última de 280-300 °C a 20 °C∙min-1. El espectrómetro de masas se operó en modo de ionización eléctrica, flujo de 1 mL∙min-1, voltaje de ionización a 70 eV, temperatura de la interfase a 280 °C y modo SCAN con un rango de masas de 50 a 550 m/z (García‐Rodríguez, Torres‐Gurrola, Meléndez‐González, & Espinosa‐García, 2016).
La concentración de compuestos se calculó por el método de estándar interno, relacionando el área de cada compuesto con el área del tetradecano, cuya concentración es conocida. Posteriormente, la concentración se relacionó con el peso seco de la muestra (mg∙g-1). Estos datos se utilizaron para calcular la diversidad química de las procedencias.
Los espectros obtenidos en MSD ChemStation (Agilent Technologies Inc., 2004) se compararon con los de la biblioteca de Espectros de Masas NIST/EPA/NIH, versión 2.0 (Stein, Mirokhin, Tchekhovskoi, & Mallard, 2012). La identidad de los compuestos se validó con los índices de retención experimentales, inyectando 1 µL de dos series de alcanos (C8-C20 y C21-C40, Sigma Aldrich) con el mismo método cromatográfico. Los tiempos de retención de los alcanos se relacionaron con los de los compuestos y se compararon con los índices de retención reportados en la literatura (Adams, 2007; Zenkevich, 2010).
Se obtuvieron cromatogramas para cada individuo muestreado que, de acuerdo con los análisis estadísticos, se dividieron en tres grupos con intervalo altitudinal de 200 m, por lo que se seleccionó un cromatograma de cada sección altitudinal para ejemplificar su diversidad fitoquímica (Figura 2).
Índices de diversidad
La diversidad alfa, expresada a través de varios índices de diversidad de las 14 procedencias de A. religiosa, se estimó con el programa de análisis estadístico PAST 4.03 (Hammer, Harper, & Ryan, 2001). Se obtuvieron 11 índices de diversidad, de los cuales se seleccionaron los más informativos (significativos) mediante un análisis de varianza en la interfaz gráfica del software libre R Rcmdr 4.0.2 (R Development Core Team, 2020). Estos fueron el índice alfa de Fisher y el índice de Menhinick que resultó robusto dado que permite la comparación de muestras de tamaños diferentes.
La diversidad total medida con el índice de Menhinick se basó en la relación entre el número total de terpenos y el número total de individuos (muestras). El índice alfa de Fisher se utilizó para los terpenos más comunes en la mayoría de las coníferas (α-pineno, canfeno, β-pineno, β-mirceno, 3-careno, limoneno), el cual permite la comparación del nivel de riqueza entre procedencias, que varían en el nivel de abundancia y depende del número de individuos muestreados. En ambos índices se consideró a cada terpeno como una ‘especie’ y a las procedencias como las ‘comunidades’.
Análisis estadístico
Se realizaron análisis de varianza y multivariados con el paquete estadístico SAS 9.4 TS 1 M3 (SAS Institute Inc., 2015). Para el análisis de varianza se usó el PROC GLM y para el análisis stepwise el PROC STEPDISC con el fin de seleccionar las variables estadísticamente significativas (P < 0.05) e informativas. También se hizo un análisis de correlaciones con PROC CORR, para eliminar las variables altamente correlacionadas y evitar problemas de colinealidad, a excepción de los terpenos encontrados comúnmente en las coníferas como α-pineno, canfeno, β-pineno, β-mirceno, 3-careno, limoneno (Kopaczyk et al., 2020; Pokorska et al., 2012; Taft et al., 2015). Posteriormente, se obtuvo una matriz de promedios para los análisis multivariados componentes principales, correspondencias y conglomerados realizados con los procedimientos PRINCOMP, CORRESP y CLUSTER, respectivamente.
Resultados
El Cuadro 2 presenta los 32 compuestos y sus índices de retención (IR) encontrados en las acículas de las 14 procedencias de A. religiosa: 17 monoterpenos (IR 932-1 132), 10 sesquiterpenos (IR 1 345, 1 375-1 700), un fenil propanoide (IR 1 196), un alcatetraeno (IR 1 237) y tres ésteres (IR 1 223, 1 287, 1 379).
Cuadro 2 Metabolitos secundarios identificados en 14 procedencias de Abies religiosa del cerro de San Andrés, Municipio Libre de Hidalgo, Michoacán, México, ordenados por tiempo de retención e índice de retención.
| TR | IR | IRexp | MS | TR | IR | IRexp | MS |
|---|---|---|---|---|---|---|---|
| 3.45 | 932 | 942 | α-Pineno* | 5.79 | 1 237 | 1 254 | Pulegona |
| 3.57 | 946 | 959 | Canfeno* | 6.1 | 1 287 | 1 298 | Acetato de bornilo |
| 3.74 | 969 | 981 | Sabineno | 6.64 | 1 345 | 1 376 | α-Cubebeno |
| 3.78 | 974 | 987 | β-Pineno* | 6.7 | 1 379 | 1 381 | Acetato de geranilo |
| 3.82 | 988 | 992 | β-Mirceno* | 6.78 | 1 375 | 1 397 | Copaeno |
| 4.02 | 1 002 | 1 019 | α-Felandreno | 7.1 | 1 417 | 1 446 | Cariofileno |
| 4.09 | 1 008 | 1 027 | 3-Careno* | 7.33 | 1 452 | 1 482 | α-Humuleno |
| 4.13 | 1 020 | 1 032 | o-Cimeno | 7.49 | 1 458 | 1 506 | Aloaromadendreno |
| 4.16 | 1 024 | 1 036 | Limoneno* | 7.56 | 1 484 | 1 518 | Germacreno D |
| 4.24 | 1 025 | 1 047 | β-Felandreno | 7.57 | 1 500 | 1 519 | α-Muroleno |
| 4.26 | 1 044 | 1 050 | β-Z-Ocimeno | 7.69 | 1 522 | 1 539 | δ-Cadinol |
| 4.39 | 1 054 | 1 096 | γ-Terpineno | 7.77 | 1 574 | 1 552 | Germacreno D-4-ol |
| 4.62 | 1 086 | 1 096 | Terpinoleno | 8.18 | 1 582 | 1 619 | Óxido de cariofileno |
| 4.93 | 1 132 | 1 137 | (E,E)-Cosmeno | 8.41 | 1 645 | 1 656 | Cubenol |
| 5.46 | 1 196 | 1 209 | Estragol | 8.48 | 1 652 | 1 667 | α-Cadinol |
| 5.63 | 1 223 | 1 232 | Acetato de fenchilo | 8.65 | 1 700 | 1 695 | Eudesm-7(11)-en-4-ol |
TR: tiempo de retención, IR: índice de retención, IRexp: índice de retención experimental, MS: metabolito secundario. *MS más comunes en coníferas.
Índices de diversidad
La Figura 3 muestra que las procedencias fueron significativamente diferentes entre sí (P ≤ 0.0174, α = 0.05), de acuerdo con la riqueza específica calculada con el índice de Menhinick. La regresión lineal simple indica una asociación negativa entre la diversidad de terpenos y la altitud de origen (P = 0.0016, R2 = 0.5788); es decir, el número de terpenoides disminuye cuando la altitud aumenta. La prueba de comparación de medias de Tukey indicó tres agrupaciones de acuerdo con el número de terpenos en cada procedencia: 1) la procedencia de 2 850 m, diferente del resto y en la cual se encuentra la mayor diversidad de terpenos; 2) las procedencias entre 2 950 y 3 300 m, incluyendo la de mayor altitud (3 540 m), que en conjunto presentan diversidad intermedia; y 3) las procedencias de 3 350 a 3 500 m, donde se encuentra la menor diversidad de terpenos con respecto al rango de distribución estudiado.

Figura 3 Variación de la diversidad de terpenos calculada con el índice de Menhinick para 14 procedencias de Abies religiosa del cerro de San Andrés, Municipio Libre de Hidalgo, Michoacán, México. Un mismo color indica pertenencia a un agrupamiento de medias de Tukey (P = 0.05).
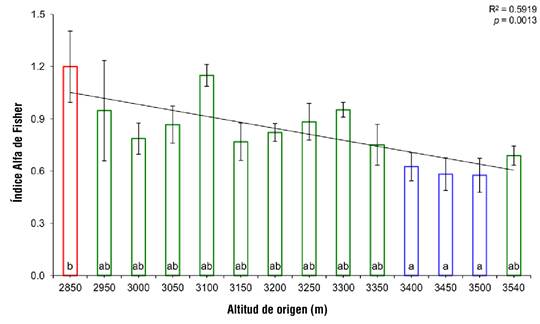
Por otra parte, de acuerdo con la Figura 4, las procedencias también mostraron diferencias significativas entre sí (P ≤ 0.0083), de acuerdo con el índice de alfa de Fisher. Similar al índice de Menhinick, se demostró mediante una regresión lineal simple que la diversidad de terpenoides disminuye conforme la elevación aumenta (P = 0.0013, R2 = 0.5919). Asimismo, la comparación de medias de Tukey estableció tres conjuntos de acuerdo con la diversidad de los terpenos analizados: 1) la procedencia a 2 850 m que es la de mayor diversidad, 2) las procedencias entre los 2 950 a los 3 350 m, incluyendo la procedencia de mayor altitud (3 540 m) con diversidad intermedia y 3) las procedencias entre los 3 400 a los 3 500 m con menor diversidad de terpenos.
Análisis multivariados
Mediante análisis de varianza se encontraron diferencias significativas entre procedencias para sabineno, o-cimeno, terpinoleno y α-cubebeno (P < 0.05) y diferencias altamente significativas para (E,E)-cosmeno y eudesm-7(11)-en-4-ol (P < 0.0001). El análisis stepwise identificó a germacreno D, α-cubebeno, germacreno D-4-ol y δ-cadinol (P < 0.05) y a terpinoleno (P < 0.0001) como variables más informativas.
Además de los terpenos seleccionados con los análisis de varianza y stepwise, se hizo un análisis de correlaciones, eliminando los terpenos altamente correlacionados entre sí, a excepción de los que son comúnmente encontrados en coníferas. De esta forma, de los 32 compuestos identificados, se seleccionaron 22 y con ellos se realizaron análisis de componentes principales, de correspondencias y de conglomerados. De acuerdo con los análisis de componentes principales y de correspondencias, se detectaron tres grupos discretos que corresponden a rangos altitudinales de 200 m: 2 850 a 3 050 m, 3 100 a 3 300 m y 3 350 a 3 540 m.
Análisis de componentes principales
Los cinco primeros componentes principales tuvieron valores propios mayores de 1.0 y explican 90 % de la varianza total. El primer componente tuvo un valor propio de 7.4 que explica 33.7 % de la varianza total. Terpenos como α-pineno, β-pineno, δ-cadinol y cubenol contribuyeron fuertemente a la variación de este componente, con autovectores superiores a 0.3. El segundo componente tuvo un valor propio de 4.13 que explica 18.8 % del total de la variación. Los terpenos que contribuyeron de manera importante a la variación fueron o-cimeno, (E,E)-cosmeno, pulegona y eudesm-7(11)-en-4-ol. El tercer componente tuvo un valor propio de 3.6 que contribuye con 16.3 % de la varianza total; los terpenos que tuvieron autovectores superiores a 0.3 fueron limoneno, β-felandreno y eudesm-7(11)-en-4-ol. El cuarto componente tuvo un valor propio de 2.85 que contribuyó con 12.9 % de la varianza; los terpenos que tuvieron autovectores mayores de 0.3 fueron canfeno, sabineno y terpinoleno. Para finalizar, el quinto componente tuvo valor propio de 1.88 que contribuyó con 8.5 % de la varianza total; los terpenos α-felandreno, germacreno D y cubenol contribuyeron a dicha variación.
La Figura 5 muestra la distribución de las 14 procedencias de A. religiosa en función de los tres primeros componentes principales (se presentan con el prefijo CP), los cuales representan 68.6 % de la varianza total explicada. Las poblaciones por debajo de los 3 300 m (cuadrados verdes y triángulos rojos) presentan mayor relación entre sí que con las poblaciones por encima de esa altitud (círculos azules), de acuerdo con los terpenos que definen a los tres primeros componentes.
Análisis de correspondencias
Por medio del estadístico Ӽ2 se obtuvo que el análisis de correspondencias presenta un valor P significativo (<0.0001), donde la suma de las dos primeras dimensiones es de 61.4 % de la varianza total explicada. La Figura 6 presenta la distribución de las procedencias con colores de acuerdo con el grupo altitudinal al que fueron asignados contra las dos primeras dimensiones que arroja el análisis. En el gráfico se observa que las procedencias de las altitudes baja e intermedia se concentran en el primer cuadrante (cuarto superior derecho) y solo dos altitudes en el segundo (cuarto inferior derecho), las cuales se asocian a cuatro de los compuestos encontrados frecuentemente en coníferas: β-pineno, limoneno, canfeno y 3-careno; terpenos que sirven en mayor parte para la protección contra patógenos. Las procedencias de las altitudes más altas se distribuyen en el segundo, tercero (inferior izquierda) y cuarto cuadrantes (superior izquierda) del gráfico.

Figura 6 Distribución de las procedencias de Abies religiosa de acuerdo con el análisis de correspondencias. Triángulos rojos corresponden a las altitudes bajas (2 850 a 3 050 m), cuadrados verdes se asignaron a las altitudes intermedias (3 100 a 3 300 m) y los círculos azules representan altitudes elevadas (3 350 a 3 540 m).
Análisis de conglomerados
La Figura 7 muestra el dendrograma generado con análisis de conglomerados de acuerdo con el método de agrupamiento de Ward, que estadísticamente marca un corte en 0.1592 de R2 semiparcial con base en el estadístico pseudo t2. El dendrograma refleja un patrón clinal altitudinal; es decir, la diversidad y concentración de los terpenos disminuyen conforme la altitud aumenta. Los grupos formados son tres: i) procedencias de altitudes elevadas (3 500, 3 450 y 3 350 m), ii) procedencia de mayor altitud (3 540 m) y iii) procedencias de altitudes bajas a intermedias (2 850 a 3 300 y 3 400 m).
Discusión
Las acículas de las 14 procedencias de A. religiosa tuvieron 32 compuestos en su mayoría terpenos, específicamente monoterpenos. En sitios donde predominan las coníferas, los monoterpenos son los compuestos mayoritarios en la emisión de orgánicos volátiles biogenéticos (Iñíguez et al., 2014; Trowbridge et al., 2021). Dichos metabolitos juegan un rol importante en las interacciones árbol-insecto, ya que son un elemento central de las defensas constitutivas e inducibles de las coníferas y son un componente esencial de las resinas defensivas al ser tóxicos para muchos herbívoros (Pezet et al., 2013; Whitehill et al., 2019); la secreción de oleorresina es la principal forma de defensa química y mecánica (Heredia-Bobadilla et al., 2014).
Diversos estudios han demostrado que la variación altitudinal y la diversidad química de los compuestos químicos están muy relacionados. Mullin et al. (2021) determinaron que las concentraciones de monoterpenos (limoneno y 3-careno) y diterpenos incrementan a medida que la elevación aumenta en poblaciones de Pinus contorta Douglas ex Loudon (pino Lodgepole) (oeste de Alberta, Canadá). En contraste, Večeřová et al. (2021) encontraron que, en Picea abies (L.) Karsten (abeto rojo), el contenido de β-pineno, α-pineno, sabineno y α-terpineol se redujo sustancialmente a mayor altitud, y que el único monoterpeno asociado positivamente fue 3-careno.
En el presente estudio, los índices indican que existe mayor diversidad de terpenos en la procedencia originada a menor altitud (2 850 m) y que conforme la elevación incrementa, la diversidad disminuye. Esto se debe probablemente a que en la parte baja de la distribución de la especie, las plantas son más susceptibles al ataque de patógenos (Rasmann, Pellissier, Defossez, Jactel, & Kunstler, 2014; Rodríguez‐Castañeda et al., 2010); Moreira et al. (2014) indican que la altitud es un impulsor biótico de la evolución de la defensa de las plantas. Al respecto, diversos estudios han mostrado que la incidencia de daño por herbívoros, en particular descortezadores en coníferas, es mayor en altitudes menores cuando se compara tanto la variabilidad intraespecífica como la interespecífica. Por ejemplo, en la intraespecífica se encuentra el caso del descortezador Ips confusus Wood & Bright. que ataca a Pinus edulis Engelm. (piñón colorado) (Santos & Whitham, 2010); en la interespecífica, P. contorta se encuentra en las partes bajas de laderas y Pinus albicaulis Engelm (pino de corteza blanca) en las altas, ambas expuestas continuamente al complejo formado por escarabajos descortezadores y hongos, aunque en el pasado P. albicaulis estaba expuesta de forma intermitente. En este ecosistema, los síndromes de defensa química asociados a los monoterpenos de los pinos están relacionados con la historia de exposición y, por lo tanto, con la elevación (Raffa et al., 2017).
De forma congruente a los índices de diversidad, los análisis de componentes principales y el de correspondencias demostraron que la diversidad de terpenos es mayor en las procedencias menores de 3 350 m y que están asociadas mayormente al limoneno o 3-careno que funcionan como repelentes para el ataque de herbívoros (Phillips & Croteau, 1999). En particular el terpinoleno, identificado como parte de un genotipo de Picea sitchensis (Bong.) Carr. (abeto de Sitka), confiere resistencia al ataque del gorgojo blanco (Pissodes strobi Peck) (Robert et al., 2010) y β-pineno encontrado en Pinus ponderosa Douglas ex Lawson se sintetiza en respuesta a la actividad por herbivoría (Litvak & Monson, 1998).
Por otra parte, el análisis de conglomerados sugiere asociación entre las procedencias, a excepción del grupo dos, formado por la procedencia de mayor altitud (3 550 m), que podría tener mayor similitud con las poblaciones de la parte baja. Este comportamiento aparentemente atípico de la procedencia cercana a la cumbre se debe posiblemente a que recibe polen de la vertiente de Michoacán del lado oeste del cerro de San Andrés y también del lado este (Estado de México). Esto es compatible con los patrones observados para especies del género Betula, donde los terpenos tienen un componente de heredabilidad materna dominante, pero con influencia de la fuente de polen (Isidorov Stocki, & Vetchinikova, 2019). Además, este comportamiento atípico de procedencias de mayor altitud se ha observado en Pinus hartwegii Lindl. en la cumbre del Pico de Tancítaro, por la composición de frecuencias alélicas de isoenzimas (Viveros-Viveros et al., 2010). El patrón clinal altitudinal para la diversidad y concentración de los terpenos encontrados es similar al de Pinus patula Schiede ex Schltdl. & Cham. y sus monoterpenos α-pineno, Δ-3-careno, β-felandreno y limoneno (Lockhart, 1990). Asimismo, en Pinus yunnanensis Franch. (pino de Yunnan, China), la concentración de sesquiterpenos como el acetato de geranilo y δ-cadinol disminuyeron a medida que la altitud aumentó (Hengxiao et al., 1999).
Es importante considerar que los resultados del presente estudio provienen de un ensayo de jardín común en condiciones propicias para el crecimiento de las plantas. Por ello, es posible que la abundancia de terpenos pudiera variar si el ensayo se hubiera realizado en condiciones de campo en el área de distribución de A. religiosa, como resultado de una interacción entre el genotipo y el medio ambiente; sin embargo, debido a que todas las procedencias crecieron bajo las mismas condiciones, es razonable suponer que la diversidad de terpenos varió entre poblaciones como consecuencia de diferencias genéticas. Patrones clinales se han detectado para la altura, diámetro y supervivencia de esta especie (Castellanos-Acuña, Lindig-Cisneros, Silva-Farias, & Sáenz-Romero, 2014; Ortiz-Bibian et al., 2017; Ortiz-Bibian et al., 2019), lo cual implica que la variación altitudinal debe considerarse en el manejo y conservación de las poblaciones de especies forestales.
Conclusiones
La diversidad y concentración de los terpenos en Abies religiosa variaron en función de la altitud de las poblaciones; arriba de 3 350 m, la diversidad fue más baja, pero con mayor concentración. La mayor diversidad de terpenos a menor altitud, de acuerdo con diversos estudios es consecuencia de presiones evolutivas causadas por la herbivoría. Tanto los índices de diversidad como el análisis de conglomerados demuestran la existencia de tres grupos definidos; es decir, tres perfiles químicos diferenciados que deben considerarse en el establecimiento de programas de recolecta de germoplasma para reforestación y restauración, en particular para adaptarse a los efectos esperados del cambio climático.
Agradecimientos
Este documento es iniciativa del Grupo de Trabajo sobre Recursos Genéticos Forestales de la Comisión Forestal de América del Norte (FGRWG-NAFC, por sus siglas en inglés), Organización de las Naciones Unidas para la Agricultura y la Alimentación. Se agradece el financiamiento al Dr. Cuauhtémoc Sáenz-Romero del Monarch Butterfly Fund (Madison, Wisconsin, EUA), del FGRWG-NAFC y de la Coordinación de la Investigación Científica de la UMSNH; al Dr. Arnulfo Blanco-García del Consejo Nacional de Ciencia y Tecnología (CONACYT, Fondo Ciencia Básica-2014-242985) y al Dr. Roberto Lindig-Cisneros del PAPIIT-UNAM (AG 200221). A Gabriel Muñoz-Montoya (Queréndaro, Michoacán) y a Miguel Ángel Silva-Farías (Servi-Ambiental El Bosque) por las facilidades de acceso y ayuda en la colecta de semillas. A Nancy Izquierdo-Calderón por el apoyo en la extracción de muestras y procesamiento de base de datos. A Mariela Gómez-Romero, Leonel López-Toledo y Erick de la Barrera Montppellier por las observaciones al manuscrito. A CONACyT por otorgar beca de estudios de posgrado (413133) y beca mixta a la primera autora.
REFERENCIAS
Abbas, F., Ke, Y., Yu, R., Yue, Y., Amanullah, S., Jahangir, M. M., & Fan, Y. (2017). Volatile terpenoids: multiple functions, biosynthesis, modulation and manipulation by genetic engineering. Planta, 246(5), 803‒816. doi: 10.1007/s00425-017-2749-x [ Links ]
Adams, R. P. (2007). Identification of essential oil components by gas chromatography/mass spectrometry (4th ed.). Carol Stream, Illinois: Allured Publishing Corporation. [ Links ]
Agilent Technologies Inc. (2004). MSD ChemStation D.01.02.16. Germany: Author. [ Links ]
Castellanos-Acuña, D., Lindig-Cisneros, R. A., Silva-Farias, M. Á., & Sáenz-Romero, C. (2014). Provisional altitudinal zoning of Abies religiosa in an area near the Monarch Butterfly Biosphere Reserve, Michoacán. Revista Chapingo Serie Ciencias Forestales y del Ambiente, 20(2), 215‒225. doi: 10.5154/r.rchscfa.2013.11.041 [ Links ]
Cruzado-Vargas, A. L., Blanco-García, A., Lindig-Cisneros, R., Gómez-Romero, M., Lopez-Toledo, L., de la Barrera, E., & Sáenz-Romero, C. (2021). Reciprocal common garden altitudinal transplants reveal potential negative impacts of climate change on Abies religiosa populations in the Monarch Butterfly Biosphere Reserve overwintering sites. Forests, 12(1), 69. doi: 10.3390/f12010069 [ Links ]
García-Rodríguez, Y. M., Bravo-Monzón, Á., Martínez-Díaz, Y., Torres-Gurrola, G., & Espinosa-García, F. J. (2012). Variación fitoquímica defensiva en ecosistemas terrestres. In J. C. Rojas & E. A. Malo (Eds.), Temas selectos en ecología química de insectos (pp. 217‒252). México: El Colegio de la Frontera Sur. [ Links ]
García‐Rodríguez, Y. M., Torres‐Gurrola, G., Meléndez‐González, C., & Espinosa‐García, F. J. (2016). Phenotypic variations in the foliar chemical profile of Persea americana Mill. cv. Hass. Chemistry & Biodiversity, 13(12), 1767‒1775. doi: 10.1002/cbdv.201600169 [ Links ]
Gómez-Pineda, E., Hammond, W. M., Trejo-Ramirez, O., Gil-Fernández, M., Allen, C. D., Blanco-García, A., & Sáenz-Romero, C. (2022). Drought years promote bark beetle outbreaks in Mexican forests of Abies religiosa and Pinus pseudostrobus. Forest Ecology and Management, 505, 119944. doi: 10.1016/j.foreco.2021.119944 [ Links ]
Gómez‐Pineda, E., Sáenz‐Romero, C., Ortega‐Rodríguez, J. M., Blanco‐García, A., Madrigal‐Sánchez, X., Lindig‐Cisneros, R., …Rehfeldt, G. E. (2020). Suitable climatic habitat changes for Mexican conifers along altitudinal gradients under climatic change scenarios. Ecological Applications, 30(2), e02041. doi: 10.1002/eap.2041 [ Links ]
Hammer, Ø., Harper, D. A., & Ryan, P. D. (2001). PAST: Paleontological Statistics Software Package for education and data analysis. Retrieved from http://palaeo-electronica.org/2001_1/past/issue1_01.htm [ Links ]
Hengxiao, G., McMillin, J. D., Wagner, M. R., Zhou, J., Zhou, Z., & Xu, X. (1999). Altitudinal variation in foliar chemistry and anatomy of yunnan pine, Pinus yunnanensis, and pine sawfly (Hym., Diprionidae) performance. Journal of Applied Entomology, 123(8), 465‒471. doi: 10.1046/j.1439-0418.1999.00395.x [ Links ]
Heredia-Bobadilla, R. L., Arzate-Fernández, A. M., Gutiérrez-González, G., Santillán-Benítez, J. G., Cibrián-Tovar, D., & Endara-Agramont, A. R. (2014). Genes de defensa en Abies religiosa. Botanical Sciences, 92(4), 623‒628. Retrieved from http://www.scielo.org.mx/pdf/bs/v92n4/v92n4a14.pdf [ Links ]
Hernández-Álvarez, A. G., Reyes-Ortiz, J. L., Villanueva-Díaz, J., & Sánchez-González, A. (2021). Variation in the Abies religiosa (Pinaceae) forest structure, at different management and disturbance conditions. Acta Botánica Mexicana , ( 128), e1752. doi: 10.21829/abm128.2021.1752 [ Links ]
Ignazi, G., Mathiasen, P., & Premoli, A. C. (2019). Climatic gradients model genetic diversity in widespread woody trees: the case of Nothofagus pumilio in the southern Andes. Revista Ecosistemas, 28(1), 35‒47. doi: 10.7818/ECOS.1547 [ Links ]
Iñíguez Guillén, R. M., Esqueda Reyes, H. C., Escoto García, T., Guillermo Ochoa, H., Rodríguez Rivas, A., & Contreras Quiñonez, H. J. (2014). Chemical characterization of essential oils and wood extracts from two pine species of La Primavera forest. Revista Mexicana de Ciencias Forestales, 6(28), 42‒57. Retrieved from http://www.scielo.org.mx/pdf/remcf/v6n28/v6n28a4.pdf [ Links ]
Isidorov, V. A., Stocki, M., & Vetchinikova, L. (2019). Inheritance of specific secondary volatile metabolites in buds of white birch Betula pendula and Betula pubescens hybrids. Trees, 33(5), 1329‒1344. doi: 10.1007/s00468-019-01861-2 [ Links ]
Kopaczyk, J. M., Warguła, J., & Jelonek, T. (2020). The variability of terpenes in conifers under developmental and environmental stimuli. Environmental and Experimental Botany, 104197. doi: 10.1016/j.envexpbot.2020.104197 [ Links ]
Litvak, M. E., & Monson, R. K. (1998). Patterns of induced and constitutive monoterpene production in conifer needles in relation to insect herbivory. Oecologia, 114(4), 531‒540. doi: 10.1007/s004420050477 [ Links ]
Lockhart, L. A. (1990). Chemotaxonomic relationships within the Central American closed-cone pines. Silvae Genetica, 39(5-6), 173‒184. Retrieved from https://eurekamag.com/research/007/108/007108216.php [ Links ]
López-Goldar, X., Villari, C., Bonello, P., Borg-Karlson, A. K., Grivet, D., Zas, R., & Sampedro, L. (2018). Inducibility of plant secondary metabolites in the stem predicts genetic variation in resistance against a key insect herbivore in maritime pine. Frontiers in Plant Science, 9, 1651. doi: 10.3389/fpls.2018.01651 [ Links ]
López-Gómez, V., Arriola Padilla, V. J., & Pérez Miranda, R. (2015). Damages from abiotic and biotic factors in fir (Abies religiosa (Kunth) Schltdl. et Cham.) forests of the Monarch Butterfly Biosphere Reserve. Revista Mexicana de Ciencias Forestales, 6(29), 56‒73. Retrieved from http://www.scielo.org.mx/pdf/remcf/v6n29/v6n29a5.pdf [ Links ]
Lundborg, L., Fedderwitz, F., Björklund, N., Nordlander, G., & Borg-Karlson, A. -K. (2016). Induced defenses change the chemical composition of pine seedlings and influence meal properties of the pine weevil Hylobius abietis. Phytochemistry, 130, 99‒105. doi: 10.1016/j.phytochem.2016.06.002 [ Links ]
Materić, D., Bruhn, D., Turner, C., Morgan, G., Mason, N., & Gauci, V. (2015). Methods in plant foliar volatile organic compounds research. Applications in Plant Sciences, 3(12), 1500044. doi: 10.3732/apps.1500044 [ Links ]
Moreira, X., Mooney, K. A., Rasmann, S., Petry, W. K., Carrillo‐Gavilán, A., Zas, R., & Sampedro, L. (2014). Trade‐offs between constitutive and induced defences drive geographical and climatic clines in pine chemical defences. Ecology Letters, 17(5), 537‒546. doi: 10.1111/ele.12253 [ Links ]
Muenchow, J., Dieker, P., Kluge, J., Kessler, M., & von Wehrden, H. (2018). A review of ecological gradient research in the Tropics: identifying research gaps, future directions, and conservation priorities. Biodiversity and Conservation, 27(2), 273‒285. doi: 10.1007/s10531-017-1465-y [ Links ]
Mullin, M., Klutsch, J., Cale, J., Hussain, A., Zhao, S., Whitehouse, C., & Erbilgin, N. (2021). Primary and secondary metabolite profiles of lodgepole pine trees change with elevation, but not with latitude. Journal of Chemical Ecology, 47(3), 280‒293. doi: 10.1007/s10886-021-01249-y [ Links ]
Oberhauser, K. S., Nail, K. R., & Altizer, S. (2015). Monarchs in a changing world: biology and conservation of an iconic butterfly. USA: Cornell University Press. [ Links ]
Ortiz-Bibian, M. A., Blanco-García, A., Lindig-Cisneros, R. A., Gómez-Romero, M., Castellanos-Acuña, D., Herrerías-Diego, Y., …Sáenz-Romero, C. (2017). Genetic variation in Abies religiosa for quantitative traits and delineation of elevational and climatic zoning for maintaining Monarch Butterfly overwintering sites in Mexico, considering climatic change. Silvae Genetica, 66(1), 14‒23. doi: 10.1515/sg-2017-0003 [ Links ]
Ortiz-Bibian, M. A., Castellanos-Acuña, D., Gómez-Romero, M., Lindig-Cisneros, R., Silva-Farías, M. Á., & Sáenz-Romero, C. (2019). Variación entre poblaciones de Abies religiosa (HBK) Schl. et Cham a lo largo de un gradiente altitudinal. I. Capacidad germinativa de la semilla. Revista Fitotecnia Mexicana, 42(3), 301‒308. Retrieved from http://www.scielo.org.mx/pdf/rfm/v42n3/0187-7380-rfm-42-03-00301.pdf [ Links ]
Pellissier, L., Moreira, X., Danner, H., Serrano, M., Salamin, N., van Dam, N. M., & Rasmann, S. (2016). The simultaneous inducibility of phytochemicals related to plant direct and indirect defences against herbivores is stronger at low elevation. Journal of Ecology, 104(4), 1116‒1125. doi: 10.1111/1365-2745.12580 [ Links ]
Pezet, J., Elkinton, J., Gomez, S., Mckenzie, E. A., Lavine, M., & Preisser, E. (2013). Hemlock woolly adelgid and elongate hemlock scale induce changes in foliar and twig volatiles of eastern hemlock. Journal of Chemical Ecology, 39(8), 1090‒1100. doi: 10.1007/s10886-013-0300-5 [ Links ]
Phillips, M. A., & Croteau, R. B. (1999). Resin-based defenses in conifers. Trends in Plant Science, 4(5), 184‒190. doi: 10.1016/S1360-1385(99)01401-6 [ Links ]
Pichersky, E., & Raguso, R. A. (2018). Why do plants produce so many terpenoid compounds? New Phytologist, 220(3), 692‒702. doi: 10.1111/nph.14178 [ Links ]
Pokorska, O., Dewulf, J., Amelynck, C., Schoon, N., Šimpraga, M., Steppe, K., & Van Langenhove, H. (2012). Isoprene and terpenoid emissions from Abies alba: Identification and emission rates under ambient conditions. Atmospheric Environment, 59, 501‒508. doi: 10.1016/j.atmosenv.2012.04.061 [ Links ]
Premoli, A. C., Acosta, M. C., Mathiasen, P., & Donoso, C. (2012). Genetic variation in Nothofagus (subgenus Nothofagus). Bosque (Valdivia), 33(2), 115‒125. doi: 10.4067/S0717-92002012000200001 [ Links ]
R Development Core Team. (2020). R: A language and environment for statistical computing. Viena, Austria: R Foundation for Statistical Computing. Retrieved from R-project.org/ [ Links ]
Raffa, K. F., Mason, C. J., Bonello, P., Cook, S., Erbilgin, N., Keefover‐Ring, K., …Townsend, P. A. (2017). Defence syndromes in lodgepole-whitebark pine ecosystems relate to degree of historical exposure to mountain pine beetles. Plant, Cell & Environment, 40(9), 1791‒1806. doi: 10.1111/pce.12985 [ Links ]
Rasmann, S., Pellissier, L., Defossez, E., Jactel, H., & Kunstler, G. (2014). Climate‐driven change in plant-insect interactions along elevation gradients. Functional Ecology, 28(1), 46‒54. doi: 10.1111/1365-2435.12135 [ Links ]
Robert, J. A., Madilao, L. L., White, R., Yanchuk, A., King, J., & Bohlmann, J. (2010). Terpenoid metabolite profiling in Sitka spruce identifies association of dehydroabietic acid,(+)-3-carene, and terpinolene with resistance against white pine weevil. Botany, 88(9), 810‒820. doi: 10.1139/B10-049 [ Links ]
Rodríguez‐Castañeda, G., Dyer, L. A., Brehm, G., Connahs, H., Forkner, R. E., & Walla, T. R. (2010). Tropical forests are not flat: how mountains affect herbivore diversity. Ecology Letters, 13(11), 1348‒1357. doi: 10.1111/j.1461-0248.2010.01525.x [ Links ]
Rodríguez Trejo, D. A., Aparicio Lechuga, M., Lara Bueno, A., Uribe Gómez, M., & Ramírez Castell, P. (2021). Abies Mill. (Pinaceae). In D. A. Rodríguez Trejo (Ed.), Semillas de especies forestales (pp. 3‒14). Estado de México, México: División de Ciencias Forestales, Universidad Autónoma Chapingo. [ Links ]
Rubin-Aguirre, A., Saenz-Romero, C., Lindig-Cisneros, R., del-Rio-Mora, A., Tena-Morelos, C., Campos-Bolaños, R., & Del-Val, E. (2015). Bark beetle pests in an altitudinal gradient of a Mexican managed forest. Forest Ecology and Management, 343, 73‒79. doi: 10.1016/j.foreco.2015.01.028 [ Links ]
Sáenz‐Romero, C., Lamy, J. B., Ducousso, A., Musch, B., Ehrenmann, F., Delzon, S., …Hansen, J. K. (2017). Adaptive and plastic responses of Quercus petraea populations to climate across Europe. Global Change Biology, 23(7), 2831‒2847. doi: 10.1111/gcb.13576 [ Links ]
Sáenz-Romero, C., Lindig-Cisneros, R. A., Joyce, D. G., Beaulieu, J., St Clair, J. B., & Jaquish, B. C. (2016). Assisted migration of forest populations for adapting trees to climate change. Revista Chapingo Serie Ciencias Forestales y del Ambiente, 22(3), 303‒323. doi: 10.5154/r.rchscfa.2014.10.052 [ Links ]
Sáenz-Romero, C., Rehfeldt, G. E., Duval, P., & Lindig-Cisneros, R. A. (2012). Abies religiosa habitat prediction in climatic change scenarios and implications for monarch butterfly conservation in Mexico. Forest Ecology and Management, 275, 98‒106. doi: 10.1016/j.foreco.2012.03.004 [ Links ]
Santos, M. J., & Whitham, T. G. (2010). Predictors of Ips confusus outbreaks during a record drought in southwestern USA: implications for monitoring and management. Environmental Management, 45(2), 239‒249. doi: 10.1007/s00267-009-9413-6 [ Links ]
SAS Institute Inc. (2015). SAS Institute (version 9.4.TS Level 1 M3). Cary, North Carolina, USA: Author. [ Links ]
Sosa Díaz, L., Méndez González, J., García Aranda, M. A., Cambrón Sandoval, V. H., Villarreal Quintanilla, J. Á., Ruiz González, C. G., & Montoya Jiménez, J. C. (2018). Distribución potencial de barrenadores, defoliadores, descortezadores y muérdagos en bosques de coníferas de México. Revista Mexicana de Ciencias Forestales, 9(47), 187‒208. doi: 10.29298/rmcf.v9i47.159 [ Links ]
Stein, S. E., Mirokhin, Y., Tchekhovskoi, D., & Mallard, G. (2012). NIST/EPA/NIH Mass Spectral Library (Version 2.0). Gaithersburg, USA: National Institute of Standards and Technology. Retrieved from https://chemdata.nist.gov/ [ Links ]
Taft, S., Najar, A., Godbout, J., Bousquet, J., & Erbilgin, N. (2015). Variations in foliar monoterpenes across the range of jack pine reveal three widespread chemotypes: implications to host expansion of invasive mountain pine beetle. Frontiers in Plant Science, 6, 342. doi: 10.3389/fpls.2015.00342 [ Links ]
Trowbridge, A. M., Adams, H. D., Collins, A., Dickman, L. T., Grossiord, C., Hofland, M., …Stoy, P. C. (2021). Hotter droughts alter resource allocation to chemical defenses in piñon pine. Oecologia, 197(4), 921‒938. doi:10.1007/s00442-021-05058-8 [ Links ]
Večeřová, K., Klem, K., Veselá, B., Holub, P., Grace, J., & Urban, O. (2021). Combined effect of altitude, season and light on the accumulation of extractable terpenes in Norway spruce needles. Forests, 12(12), 1737. doi: 10.3390/f12121737 [ Links ]
Viveros-Viveros, H., Tapia-Olivares, B. L., Sáenz-Romero, C., Vargas-Hernández, J. J., López-Upton, J., Santacruz-Varela, A., & Ramírez-Valverde, G. (2010). Isoenzymatic variation of Pinus hartwegii Lindl. along an altitudinal gradient in Michoacán, México. Agrociencia, 44(6), 723‒733. Retrieved from http://www.scielo.org.mx/pdf/agro/v44n6/v44n6a11.pdf [ Links ]
Whitehill, J. G., Yuen, M. M., Henderson, H., Madilao, L., Kshatriya, K., Bryan, J., … Bohlmann, J. (2019). Functions of stone cells and oleoresin terpenes in the conifer defense syndrome. New Phytologist, 221(3), 1503‒1517. doi: 10.1111/nph.15477 [ Links ]
Zas Arregui, R., & Sampedro Pérez, L. (2015). Resistencia de los pinos a plagas y enfermedades: nuevas oportunidades de control fitosanitario. Cuadernos de la Sociedad Española de Ciencias Forestales, 39, 259‒273. doi: 10.31167/csef.v0i39.17466 [ Links ]
Zenkevich, I. G. (2010). Kovats´ retention index system. In J. Cazes (Ed.), Encyclopedia of chromatography (3rd. ed., pp. 1304‒1310). Boca Raton, Florida, USA: CRC Press. [ Links ]
Recibido: 08 de Enero de 2022; Aprobado: 26 de Julio de 2022











 texto en
texto en