Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Chapingo serie ciencias forestales y del ambiente
versión On-line ISSN 2007-4018versión impresa ISSN 2007-3828
Rev. Chapingo ser. cienc. for. ambient vol.28 no.3 Chapingo sep./dic. 2022 Epub 08-Mar-2024
https://doi.org/10.5154/r.rchscfa.2021.10.061
Artículo científico
Nueva especie de mosca sierra del género Zadiprion Rohwer (Hymenoptera: Diprionidae) atacando Pinus cembroides (Zucc.) en Tamaulipas, México
1Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias (INIFAP), Campo Experimental Pabellón. km 32.5 carretera Aguascalientes-Zacatecas. C. P. 20660. Pabellón de Arteaga, Aguascalientes, México.
2Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias (INIFAP), Centro Nacional de Investigación Disciplinaria en Conservación y Mejoramiento de Ecosistemas Forestales. Av. Progreso núm. 5, Barrio Santa Catarina. C. P 04010. Coyoacán, Ciudad de México, México.
Introducción:
Zadiprion Rohwer es un género de mosca sierra que incluye siete especies causantes de defoliaciones en bosques de coníferas.
Objetivo:
Determinar la especie de la mosca sierra del género Zadiprion que está defoliando Pinus cembroides (Zucc.) en Miquihuana, Tamaulipas.
Materiales y métodos:
Se recolectó material biológico de larvas de mosca sierra. Una porción se conservó en alcohol al 70 % para la descripción morfológica, otra en alcohol anhidro al 96 % para la identificación molecular y otra porción se colocó en una cámara Binder 720 KBW E5.1 para completar el ciclo biológico y obtener adultos. Se describió el ovipositor de la hembra y la fenología durante cinco años.
Resultados y discusión:
A nivel larvario, la mosca sierra tiene cabeza café-anaranjado con oculario pequeño y circular, una mancha longitudinal café en el dorso, dos líneas blancas a los costados y una franja oscura a nivel subdorsal. La hembra es amarillo claro con suturas oscuras en el tórax. La lanceta del ovipositor tiene nueve anillos; el primero con forma de “U” invertida. Los machos son preponderantemente negros con patas amarillentas y una mancha café amarillenta en el área postocelar; no tiene pronoto o tégula café-amarillentos y las harpes son redondeadas y claras en el ápice. La población es diferente de Z. rohweri (Middleton) y Z. jeffreyi (Smith), reportadas en el GenBank; sin embargo, están relacionadas.
Conclusión:
La mosca sierra en estudio es una especie nueva y se registró como Zadiprion borjai sp. nov. (GenBank: ON181557).
Palabras clave: Zadiprion borjai; Zadiprion rohweri; pino piñonero; plaga forestal; fenología
Introduction:
Zadiprion Rohwer is a genus of sawflies including seven species that cause defoliations in coniferous forests.
Objective:
To determine the species of Zadiprion sawflies infesting Pinus cembroides (Zucc.) in Miquihuana, Tamaulipas.
Materials and methods:
Biological material was collected from sawfly larvae. Part of the material was preserved in 70 % alcohol for morphological description, another in 96 % anhydrous alcohol for molecular identification and another portion was placed in a Binder 720 KBW E5.1 to complete the biological cycle and obtain adults. The ovipositor of the female and phenology during five years were described.
Results and discussion:
The sawfly larva has an orange-brown head with a small circular eyestalk, a longitudinal brown spot on the dorsum, two white lines on the sides and a dark subdorsal stripe. The female is light yellow with dark sutures on the thorax. The lancet of the ovipositor has nine rings; the first is inverted “U” shaped. Males are mainly black with yellowish legs and a yellowish-brown spot in the postocellar area; there is no yellowish-brown pronotum or tegula and the harpes are rounded and pale at the apex. The population is different from Z. rohweri (Middleton) and Z. jeffreyi (Smith), reported in GenBank; however, they are related.
Conclusion:
The sawfly under study is a new species and was recorded as Zadiprion borjai sp. nov. (GenBank: ON181557).
Keywords: Zadiprion borjai; Zadiprion rohweri; pinyon pine; forest pest; phenology
Ideas destacadas:
La plaga del género Zadiprion, que afecta al pino piñonero, se identificó a nivel de especie.
La lanceta del ovipositor tiene nueve anillos; el primero con forma de “U” invertida.
La mosca sierra en estudio se registró como Zadiprion borjai sp. nov. (GenBank: ON181557).
Z. borjai sp. nov. presenta diferencias morfológicas con Z. jeffreyi y Z. rohweri.
Z. borjai sp. nov. no ataca a Pinus nelsonii en Miquihuana, Tamaulipas.
Introducción
Las moscas sierra (Hymenoptera: Diprionidae) afectan árboles de los géneros Pinus, Picea, Pseudotsuga y Abies en bosques de coníferas de clima templado en Estados Unidos de América, México y Guatemala (Smith, 1988); se consideran plagas de importancia forestal, debido a que causan defoliaciones. En ocasiones alcanzan niveles epidémicos y después de repetidas defoliaciones provocan la muerte de los árboles en cientos o miles de hectáreas de bosques. En México se reportan los géneros Zadiprion, Neodiprion y Monoctenus siendo el género Zadiprion el más numeroso en especies y con mayor distribución en el país.
Zadiprion Rohwer (Hymenoptera: Diprionidae: Diprioninae) es un grupo que comprendía originalmente cinco especies, aunque se mencionaba que la fauna de México no se conocía con precisión. En 2012 se incorporó Zadiprion ojedae (Smith and Sánchez-Martínez) atacando Pinus durangensis (Martínez) en Chihuahua, México (Smith, Sánchez-Martínez, & Ojeda-Aguilera, 2012). En 2019 se describió a Zadiprion jeffreyi (Smith) como una nueva especie atacando Pinus jeffreyi Balf. en el Parque Nacional San Pedro Mártir en Baja California, México (Aguilera-Molina, Munguía-Ortega, López-Reyes, Martínez-Aquino, & Ceccarelli, 2019; Smith, 2019). Esta última está muy relacionada con Zadiprion rohweri (Middleton) considerada una plaga de pinos piñoneros que se caracteriza por presentar una “U” invertida en el primer anillo de la lanceta del ovipositor de la hembra, cerca del dorso. No obstante, las larvas difieren en la maculación y en el hospedero (Aguilera-Molina et al., 2019; Smith, 2019).
En la sierra de Miquihuana, Tamaulipas, México se detectaron ataques de moscas sierra sobre Pinus cembroides (Zucc.) y la especie causante se ubicó inicialmente como Z. rohweri, debido a las características de la lanceta del ovipositor; sin embargo, al revisar las larvas detenidamente se observaron diferencias muy notorias tanto de Z. rohweri de Coahuila (Smith, Monjarás-Barrera, Aguilar-Hernández, & Quiñones-Dena, 2016) como de Z. jeffreyi de Baja California (Aguilera-Molina et al., 2019).
Por lo anterior, es necesario corroborar si la especie que está atacando a P. cembroides en Tamaulipas se trata de una nueva especie o es una especie ya reportada. En el presente escrito se presenta información sobre la descripción morfológica de larvas, adultos y ovipositor de la hembra de la mosca sierra que ataca al pino piñonero.
Materiales y métodos
Área de estudio
El estudio se realizó en el paraje “Mesa del Jarrillo”, ejido Servando Canales en Miquihuana, Tamaulipas (23° 38’ 39.2” LN, 99° 50’ 37.2” LO; 2 210 m). El clima predominante es Aw1, cálido subhúmedo con lluvia en verano, temperatura media anual mayor de 22 °C y temperatura del mes más frío mayor de 18 °C; la vegetación es compuesta de matorral espinoso predominando las especies como sotol liso (Dasylirion miquihuanensis Bogler), sotol chino (D. berlandieri Watson), cenizo (Leucophyllum frutescens [Berland] I. M. Johnston), piñón duro (Pinus nelsonii Shaw) y encinos rastreros (Quercus spp.); la topografía es montañosa y lomerío y predominan los suelos Litosol y Xerosol (Gobierno de Tamaulipas, 2011).
El 22 de noviembre de 2017 se recolectaron larvas de tercer estadio. Estas se trasladaron en hieleras, con follaje del pino hospedero (P. cembroides), al laboratorio de Sanidad Forestal y Agrícola del Campo Experimental Pabellón (CEPAB) en Aguascalientes. Un grupo de larvas se utilizó para completar el ciclo biológico y así obtener adultos, otro grupo se empleó para la identificación morfológica y un tercer grupo para la identificación molecular.
Del grupo de larvas utilizadas para completar el ciclo biológico se obtuvieron cocones. Estos se colocaron en recipientes de plástico de 250 mL con tapa de organza y se colocaron en una cámara Binder 720 KBW E5.1 con temperatura controlada de 26 ± 2 °C con un fotoperiodo de 14:10 luz y oscuridad, respectivamente. Los frascos con las pupas se monitorearon tres veces por semana para consignar la emergencia de los adultos.
Identificación morfológica de larvas de Zadiprion sp.
Las larvas se mataron al sumergirlas en agua caliente a 70 °C por 3 min y después se transfirieron a alcohol al 70 % (v/v) (González et al., 2014). La larva se describió con base en los escritos de Ross (1955), Yuasa (1922), Wong y Szlabey (1986), y González et al. (2014) con la ayuda de fotografías tomadas con una cámara de celular a través del objetivo de un microscopio de disección Motic a una amplificación de 40X.
Identificación morfológica de adultos de Zadiprion sp.
Los adultos obtenidos de los cocones mantenidos en el laboratorio se identificaron con base en las descripciones de Smith et al. (2012), Smith (2019) y con la terminología de Goulet (1992).
La lanceta del ovipositor de las hembras y la genitalia del macho se extrajeron después de un proceso de maceración en frío. El abdomen se separó del cuerpo y se introdujo a un tubo Eppendorf de 4 mL con KOH al 10 % por 24 h. Al término de la maceración, el abdomen se enjuagó con agua destilada y se deshidrató en alcohol. Se realizaron montajes temporales en glicerina y con un microscopio compuesto (Motic BA 200) se tomaron fotografías de las estructuras; de manera complementaria se fotografió la lanceta de la hembra con un microscopio electrónico de barrido (ZEISS EVO® MA 15).
Identificación molecular de Zadiprion sp.
El ADN se extrajo de un grupo de ocho larvas en alcohol anhidro al 96 %. Estas se lavaron tres veces con agua destilada estéril y se colocaron en tubos Eppendorf de 1.5 mL, a los cuales se agregó nitrógeno líquido para su maceración y se adicionaron 500 μL de buffer de lisis. El tubo reposó a temperatura ambiente durante 30 min y posteriormente se centrifugó por un minuto a 12 000 rpm. El sobrenadante se recuperó en un tubo nuevo, al cual se adicionaron 300 μL de fenol: cloroformo (1:1), se colocó en el vórtex durante 1 min, se centrifugó a 12 000 rpm durante 3 min. El nuevo sobrenadante se transfirió a otro tubo y se agregaron 200 μL de fenol: cloroformo (1:1), luego se pasó a un tubo nuevo y se adicionaron 300 μL de isopropanol y 30 μL de acetato de amonio. La mezcla se centrifugó durante 5 min a 12 000 rpm; el sobrenadante se decantó y la pastilla se lavó con 50 μL de etanol al 70 %. El precipitado se secó a temperatura ambiente y la pastilla se resuspendió en 50 μL de agua libre de nucleasas. La calidad del ADN se midió en un NanoDrop™ 2000 (Thermo Scientific). El producto se conservó a 4 °C.
Los iniciadores universales LCO1490 (5-GGTCAACAAATCATAAAGATATTGG-3´) y HCO2198 (5´TAAACTTCAGGGTGACCAAAAAATCA-3´) (Folmer, Nilges, Folkers, Konings, & Hilbers, 1994) se utilizaron para la amplificación de regiones del ADN ribosomal, los cuales reconocen al gen Citocromo Oxidasa, Subunidad I (COI). Las reacciones de PCR se realizaron por medio de la adición de los reactivos: buffer PCR (5X: 5.0 µL, concentración:cantidad respectivamente), MgCl2 (25 nM: 0.75 µL), dNTP´s (10 nM: 0.25 µL), primer 1 (10 nmol: 1.0 µL), primer 2 (10 nmol: 1.0 µL), DNA Taq polimerasa (5U∙µL-1: 0.5 µL), DNA blanco (20 ng∙µL-1: 3.0 µL) y 13.5 µL de agua grado PCR.
La amplificación se realizó en un termociclador (T100TM Thermal Cycler, Bio-Rad) con el programa siguiente: 1) desnaturalización inicial 1 ciclo de 3 min a 95 °C; 2) desnaturalización 1 min a 95 °C; 3) alineamiento cinco ciclos de 30 s a 51 °C; 4) extensión 1 min a 70 °C, 5) desnaturalización 1 min a 94 °C, 6) alineamiento 35 ciclos de 30 s a 51 °C, 7) extensión 1 min a 72 °C, 8) extensión final un ciclo de 5 min a 72 °C y 9) conservación a 4.0 °C. Los fragmentos amplificados se corrieron en geles de agarosa al 1 % con 0.4 μL de bromuro de etidio y se visualizaron en un fotodocumentador (Infinity-ST5 VILBER Lourmat). La banda de interés se cortó para su purificación con el kit Wizard® SV Gel and PCR Clean-Up System siguiendo el protocolo del proveedor (Promega Corporation, 1999). Se adicionaron 50 µL de la solución 1 al gel de agarosa conservado en tubos Eppendorf y se disolvió a 65 °C. El mix del gel diluido se transfirió a una minicolumna insertada en un tubo colector, se incubó a temperatura ambiente por 1 min, se centrifugó a 14 000 rpm durante 1 min y se decantó el sobrenadante. Posteriormente, se realizaron dos lavados con 700 µL de la solución 2, se centrifugó a 14 000 rpm por 3 min y se decantó el sobrenadante del tubo colector. La minicolumna se transfirió a un tubo Eppendorf estéril y se dejó secar a temperatura ambiente. Se adicionaron 50 µL de agua libre de nucleasas, se incubó a temperatura ambiente por 5 min y se centrifugó a 14 000 rpm por 1 min; la minicolumna se desechó y el producto se conservó ± 4 °C. Los productos PCR purificados se enviaron a secuenciar a Macrogen Korea en Seúl, República de Korea.
Las secuencias se ensamblaron en el módulo SeqMan Pro del programa DNASTAR Lasergene Molecular Biology 16. Cada ensamble se sometió a un análisis de homología BLAST (Basic Local Alignment Search Tool) en la base de datos de nucleótidos del NCBI (National Center of Biotechnology Information, 2021) y también se analizaron en la base BOLDSYSTEMS (2021).
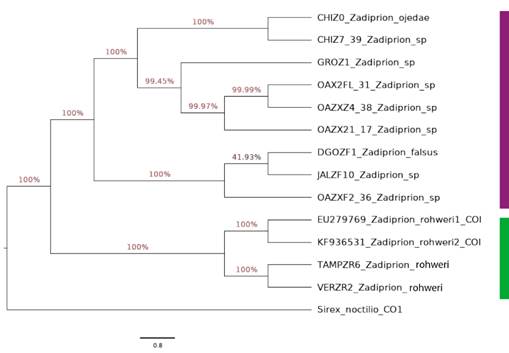
Se realizó un análisis filogenético para el género Zadiprion donde se incluyeron los ensambles de la secuenciación de los ejemplares recolectados y las bases de datos de referencia resultado de la búsqueda en el Gen Bank. Las secuencias se alinearon con el método clustal con el programa CLUSTAL OMEGA 1.2.2 (Sievers & Higgins, 2014) y se buscó el mejor modelo de sustitución de nucleótidos con el programa ModelTest-NG (Darriba et al., 2019). La reconstrucción filogenética se realizó con inferencia bayesiana mediante Markov Chains Monte Carlo (MCMC), implementado en el programa BEAST v1.10.4 (Suchard et al., 2018) con 1 000 000 de generaciones. Cabe mencionar que la secuencia HM114320 del GenBank, correspondiente a Sirex noctilio Fabricius 1793, se utilizó como testigo fuera de grupo (Hymenoptera: Siricidae).
Resultados y discusión
Zadiprion borjai González et al., 2021 sp. nov.
Hembra
La hembra mide 9.3 mm de longitud, es de color amarillo claro con las suturas oscuras en el tórax, posee cabeza amarilla con manchas oscuras triangulares alrededor de los ocelos, dos líneas oscuras longitudinales posteriores a los ocelos laterales que continúan hasta el occipucio y presenta una gran profusión de pelos largos amarillos en la cabeza. En la vista frontal, la cabeza tiene un aspecto amarillento con los agujeros tentoriales; los márgenes y ápice del clípeo son oscuros y las mandíbulas son cafés. Las antenas son serradas con 20 antenómeros de color café claro y los apicales son café oscuro. El tórax es amarillento, el lóbulo medio del mesoescutum tiene una mancha tenue café claro en la porción anterior y la quilla central es café oscuro. Presenta lóbulos laterales, cada uno con dos manchas oscuras en líneas longitudinales paralelas con los costados rectos, pero de forma irregular. El mesoescutellum es blanco amarillento que resalta por las suturas oscuras del tórax. El mesopleuron es amarillo con una mancha triangular café claro en la parte mesial; los márgenes y ápice son oscuros. Las alas son café amarillento con estigma café con dos áreas hialinas. El abdomen, en vista dorsal, es amarillento con la unión de los tergitos ligeramente café; los segmentos basales presentan mayor área café. Las patas son amarillentas con fina pubescencia, los fémures tienen la porción interna café, las tibias tienen el tercio basal amarillento y el resto es café igual que los tarsos (Figura 1).

Figura 1 Hembra de Zadiprion borjai n. sp. que ataca Pinus cembroides en Miquihuana Tamaulipas, México. Posada en hospedero (a), vista dorsal (b) y vista lateral (c).
La lanceta del ovipositor (Figura 2) presenta nueve anillos; el primer anillo con forma de una “U” invertida. Los dientes del primer anillo completo son más grandes en la base, las tres primeras serrulas son cóncavas en la parte mesial y el resto de los anillos son rectos.
Machos
Los machos miden 6.0 mm de longitud y son de apariencia negro oscuro con una mancha amarilla en el área postocular cerca del margen superior de cada ojo. Tienen antenas bipectinadas con excepción de los tres segmentos terminales. La base de los antenómeros es café claro con ramis negros. La cara es negra casi en su totalidad con pelos amarillentos. El labrum es amarillo claro; las mandíbulas son cafés y los palpos amarillentos. Las coxas y trocánter de las patas son negros, los fémures negros con el tercio apical amarillo y las tibias y tarsos amarillentos. La genitalia muestra las harpes redondeadas y claras en la punta con la parte interior ligeramente curveada y cóncava en el centro (Figura 3b). La válvula del pene presenta el ápice recto en la porción delantera y convexa redondeada en el resto con dos proyecciones triangulares en la parte media (Figura 3c).
En las moscas de menor talla, la mancha oscura que rodea a los ocelos es más ancha sin porciones claras entre los ocelos y las manchas de los lóbulos laterales del mesoescutum se unen y forman una línea oscura continua longitudinal.
Material tipo
Holotipo hembra montada en seco etiquetada como Miquihuana, Tamaulipas, México. “Mesa del Jarrillo” 23° 38’ 39.2” N - 99° 50’ 37.2” O y altitud de 2 210 m. Colector Ernesto González Gaona del 16 de marzo de 2019. Macho montado en seco con los mismos datos que el anterior. Estos especímenes se depositaron con número de registro INIT-1495 en la colección de insectos forestales del Centro Nacional de Investigación Disciplinaria en Conservación y Mejoramiento de Ecosistemas Forestales del Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias (CENID-COMEF-INIFAP), Viveros de Coyoacán, Ciudad de México.
Paratipo
Tres hembras y tres machos con los mismos datos de recolecta con número de registro 245 y 246, respectivamente, depositados en la colección de insectos forestales del CEPAB-INIFAP, km 32.5 carretera Aguascalientes-Zacatecas, Pabellón de Arteaga, Aguascalientes, México.
Etimología
El nombre Zadiprion borjai se ha asignado en honor a Hugo Enrique Borja Nava (enlace de Sanidad de la Comisión Nacional Forestal [CONAFOR]), quien en el 2013 detectó el brote epidémico que ataca P. cembroides en el ejido Servando Canales, Miquihuana, Tamaulipas, México, y ha dado seguimiento al estudio y fenología de la plaga.
Material examinado
Miquihuana, Tamaulipas, México. “Mesa del Jarrillo” del ejido Servando Canales (23° 38’ 39.2” LN, 99° 50’ 37.2” LO y 2 210 m). Infestación en lote de producción comercial de P. cembroides de 12 años. Este tipo de plantaciones se realizan con el objetivo de tener una fuente de ingreso económico en zonas de bajos recursos, por lo que la CONAFOR ha fomentado la plantación, ya que la semilla de P. cembroides se comercializa preferentemente con respecto a P. nelsonii Shaw que es considerado un piñón duro. En la zona, P. nelsonii se encuentra de forma natural en el cual no se ha registrado algún ataque.
Observaciones
En general, las hembras del género Zadiprion son muy parecidas, ya que son de color amarillo. La especie en estudio está muy relacionada con Z. jeffreyi y Z. rohweri, ya que la lanceta del ovipositor también presenta el primer anillo de U invertida (Smith et al., 2012). Lo anterior sugiere que Z. rohweri no es la única especie que presenta dicha característica, como lo mencionan Smith et al. (2012), considerando a las tres especies como un grupo. En este caso, una diferencia notoria se observa en los lóbulos laterales del mesonoto: Zadiprion borjai sp. nov. presenta dos líneas de manchas oscuras longitudinales paralelas con los costados rectos, pero de forma irregular, mientras que Z. jeffreyi tiene una mancha negra (Aguilera-Molina et al., 2019; Smith, 2019) y Z. rohweri es completamente amarillo sin mancha alguna (Smith et al., 2012). La lanceta se asemeja más a la de Z. jeffreyi (Smith, 2019) por ser corta y robusta, pero Z. borjai presenta nueve anillos y los anillos dos, tres y cuatro están ligeramente curveados; el primero de estos tres con los dientes de la base más grandes. Los machos de Z. borjai son preponderantemente negros con las patas amarillentas y muestran una mancha café amarillenta en el área postocelar cerca de la órbita superior del ojo compuesto, pero no tiene el pronoto o la tégula café-amarillentos como en Z. rohweri. Asimismo, Z. borjai difiere en la genitalia, ya que tiene las harpes redondeadas y claras en el ápice y en los otros es algo picuda; la válvula del pene también difiere de las otras dos especies en el ápice.
A nivel larvario, este grupo de insectos presenta una maculación muy distintiva y pueden ser separados desde esta etapa. Las larvas que afectan al pino piñonero P. cembroides en Miquihuana, Tamaulipas (Figura 4c) son diferentes a las que atacan a P. jeffreyi en Baja California, México, identificada como Z. jeffreyi (Figura 4b) (Aguilera-Molina et al., 2019), y a Z. rohweri que ataca a P. cembroides en Coahuila, México (Figura 4a) (Smith et al., 2016).
Las larvas Z. borjai son claras con franjas longitudinales oscuras sin glandubas en grupos. En vista dorsal presentan una mancha longitudinal café con dos líneas blancas delgadas a los costados y una franja longitudinal ancha oscura a nivel subdorsal. La cabeza es café anaranjado con oculario pequeño y circular. En vista lateral, y solo en los segmentos abdominales, muestran una mancha ancha oscura abarcando desde abajo del espiráculo hasta la base de las falsas patas, dejando claras solo las áreas de los lóbulos del prepipleurito (Figura 4c).

Figura 4 Larvas de Zadiprion del grupo Z. rohweri que afectan pinos en México: Z. rohweri en Pinus cembroides en Coahuila (a), Z. jeffreyi en P. jeffreyi en Baja California (b), Z. borjai sp. nov. en P. cembroides en Tamaulipas (c), Zadiprion sp. en P. chiapensis (d).
Respecto a la identificación molecular, en las bases de datos de taxonomía del NCBI, el género Zadiprion presenta solo cuatro secuencias registradas que corresponden a COI, y de estas solo dos fueron identificadas a especie como Z. rohweri.
Se obtuvo un árbol filogenético (Figura 5) con varios clados. El análisis de homología con BLAST y con BOLDSYSTEMS ubican a las muestras de Miquihuana, Tamaulipas (TAMPZR6) como especies diferentes a las poblaciones de los especímenes registrados en el GenBank (ID KF936531) con 92.23 % y 93.72 % de similitud, respectivamente, que corresponden a Z. rohweri.
La secuencia de la nueva especie de Zadiprion se registró en el GenBank con el número de depósito ON181557 con fecha del 12 de abril de 2022.
Conclusiones
La plaga que está afectando pino piñonero (Pinus cembroides) es diferente de Z. rohweri y Z. jeffreyi. La especie se registró como Zadiprion borjai sp. nov. (depositada en GenBank núm. ON181557) con distribución conocida solo en Miquihuana, Tamaulipas. En esta región, P. cembroides tiene mejor precio que P. nelsonii; por lo que la identificación de la plaga es importante si se considera que la plantación de pino piñonero se está promoviendo para incrementar los recursos de los productores.
Agradecimientos
Se agradece el apoyo económico del fondo Sectorial CONACYT-CONAFOR, proyecto CONAFOR 2017 CO2 núm. 291304.
REFERENCIAS
Aguilera-Molina, V. M., Munguía-Ortega, K. K., López-Reyes, E., Martínez-Aquino, A., & Ceccarelli, F. S. (2019). Climate change and forest plagues: assessing current and future impacts of diprionid sawflies on the pine forests of North-Western Mexico. Peer J, 7(5), e7220. doi: 10.7717/peerj.7220 [ Links ]
BOLDSYSTEMS. (2021). Barcode of life data system. Advancing biodiversity science through DNA-based species identification. Retrieved from https://www.boldsystems.org/ [ Links ]
Darriba, D., Posada D., Kozlov A. M., Stamatakis A., Morel B., & Flouri, T. (2019). ModelTest-NG: A new and scalable tool for the selection of DNA and protein evolutionary models. Molecular Biology and Evolution, 37(1), 291‒294. doi: 10.1093/molbev/msz189 [ Links ]
Folmer, R. H. A., Nilges, M., Folkers, P. J. M., Konings, R. N. H., & Hilbers, C. W. (1994). A model of the complex between single-stranded DNA and the single-stranded DNA binding protein encoded by gene V of filamentous bacteriophage M13. Journal of Molecular Biology, 240(4), 341‒357. doi: 10.1006/jmbi.1994.1449 [ Links ]
González, G. E., Bonilla, T. F., Quiñonez, B. S., Sánchez, M. G., Tafoya, R. F., España, L. M. P., & Robles, U. S. (2014). Guía para la identificación de moscas sierra de la familia Diprionidae presentes en el centro norte de México. México: INIFAP. Retrieved from https://docplayer.es/46918897-Guia-guia-para-la-identificacion-la-identificacion-moscas-sierra-la-familia-diprionidae-de-presentes-moscas-en-el-centro-norte-sierra.html [ Links ]
Gobierno de Tamaulipas. (2011). Atlas de riesgos del estado de Tamaulipas. Retrieved from https://www.tamaulipas.gob.mx/proteccioncivil/wp-content/uploads/sites/36/2011/12/CAPITULO-VI-PARTE-2.pdf [ Links ]
Goulet, H. (1992). The genera and subgenera of the sawflies of Canada and Alaska. Hymenoptera: Symphyta. Canada: Research Branch Agriculture Canada. Retrieved from https://publications.gc.ca/collections/collection_2016/aac-aafc/agrhist/A42-42-1992-20-eng.pdf [ Links ]
National Center of Biotechnology Information (NCBI). (2021). National Library of Medicine. Nucleotid BLAST. Retrieved from https://blast.ncbi.nlm.nih.gov/Blast.cgi [ Links ]
Promega Corporation. (1999). Wizard® SV Gel and PCR Clean-Up System. Retrieved from https://worldwide.promega.com/products/nucleic-acid-extraction/clean-up-and-concentration/wizard-sv-gel-and-pcr-clean-up-system/ [ Links ]
Ross, H. H. (1955). The taxonomy and evolution of the sawfly genus Neodiprion. Forest Science, 1(3), 196‒209. Retrieved from https://www.cabi.org/ISC/abstract/19580500510 [ Links ]
Sievers, F., & Higgins, D. G. (2014). Clustal omega, accurate alignment of very large numbers of sequences. In D. Russell (Ed.), Multiple sequence alignment methods. Methods in molecular biology (vol. 1079, pp. 105‒116). Totowa, NJ, USA: Humana Press. doi: 10.1007/978-1-62703-646-7_6 [ Links ]
Smith, D. R. (1988). A synopsis of the sawflies (Hymenoptera: Symphyta) of America south of the United States: Introduction Xyelidae, Pamphiliidae, Cimbicidae, Diprionidae, Xyphydriidae, Siricidae, Orussidae, Cephidae. Systematic Entomology, 13(2), 205‒261. doi: 10.1111/j.1365-3113.1988.tb00242.x [ Links ]
Smith, D. R. (2019). A new Zadiprion (Hymenoptera: Diprionidae) de Baja California, México on Pinus jeffreyi. Proceedings of the Entomological Society of Washington, 121(4), 700‒703. doi: 10.4289/0013-8797.121.4.700 [ Links ]
Smith, D. R., Sánchez-Martínez, G., & Ojeda-Aguilera, A. (2012). A new species of Zadiprion (Hymenoptera: Diprionidae) on Pinus durangensis from Chihuahua, Mexico, and a review of other species of the genus. Proceedings of the Entomological Society of Washington, 114(2), 224‒237. doi: 10.4289/0013-8797.114.2.224 [ Links ]
Smith, D. R., Monjarás-Barrera, J. I., Aguilar-Hernández, J. C. & Quiñones-Dena, H. (2016). New host and distribution records for Zadiprion rohweri (Middleton) (Hymenoptera: Diprionidae) a pinyon pine sawfly. Proceedings of the Entomological Society of Washington, 118(2), 300‒301. doi: 10.4289/0013-8797.118.2.300 [ Links ]
Suchard, M. A., Lemey, P., Baele, G., Ayres, D. L., Drummond, A. J., & Rambaut, A. (2018). Bayesian phylogenetic and phylodynamic data integration using BEAST 1.10. Virus Evolution, 4(1), 1‒5. doi: 10.1093/ve/vey016 [ Links ]
Yuasa, H. (1922). A classification of the larvae of the Tenthredinoidea. Thesis Doctor in Philosophy in Entomology, University of Illinois, USA. doi: 10.5962/bhl.title.16767 [ Links ]
Wong, H. R., & Szlabey, D. L. (1986). Larvae of the North American genera of Diprionidae (Hymenoptera: Symphyta). The Canadian Entomologist, 118(6), 577‒587. doi: 10.4039/Ent118577-6 [ Links ]
Recibido: 12 de Octubre de 2021; Aprobado: 29 de Junio de 2022











 texto en
texto en